神经外科手术机器人辅助原发性丘脑出血穿刺引流治疗的效果分析
2023-04-29倪升远钱中润张旺鲍得俊
倪升远 钱中润 张旺 鲍得俊

【摘要】 目的 探讨神经外科手术机器人辅助穿刺引流治疗原发性丘脑出血的可行性和安全性。方法 本研究共纳入53例确诊为原发性丘脑出血的患者。分为神经外科手术机器人(RS)组和脑室外引流(EVD)组。比较分析两组患者的血肿清除率、术后第1天和第14天GCS评分、术后再出血发生率、颅内感染发生率、癫痫、脑梗死和住院时间。术后6个月对患者进行随访评估预后,行头颅CT或MRI检查,以确定是否有脑积水或其他相关并发症。结果 RS组(34例)患者在血肿清除率、术后第14天的GCS评分、术后颅内感染发生率均明显优于EVD组(19例)(P<0.05)。随访6个月后,RS组的死亡率和脑积水发生率较EVD组降低,预后明显优于EVD组(P<0.05)。结论 与传统EVD相比,RS治疗丘脑出血的血肿清除率更高,颅内感染和脑积水患者更少,改善了临床预后,因此具有较高的临床应用价值。
【关键词】 机器人辅助;丘脑出血;穿刺引流;脑室外引流
【中图分类号】 R651 【文献标志码】 A 【文章编号】 1672-7770(2023)02-0130-05
Abstract: Objective To explore the feasibility and safety of robot assisted puncture and drainage for primary thalamic hemorrhage in neurosurgery. Methods A total of 53 patients with primary thalamic hemorrhage were enrolled in this study. They were divided into robot-assisted minimally invasive surgery(RS) group and external ventricular drainage(EVD) group. The hematoma clearance rate, GCS score on the first day and the 14th day after operation, incidence of postoperative rebleeding, incidence of intracranial infection, epilepsy, cerebral infarction and hospital stay of the two groups were compared and analyzed. Six months after surgery, patients were followed up to assess their prognosis, and skull CT or MRI examinations were performed to determine whether there was hydrocephalus or other related complications. Results RS group(34 cases) was superior to EVD group(19 cases) in hematoma clearance rate, GCS score on the 14th day after operation, and incidence of postoperative intracranial infection(P<0.05). After 6 months of follow-up, the mortality rate and incidence of hydrocephalus in the RS group were lower than those in the EVD group, and the prognosis was significantly better than that in the EVD group(P<0.05). Conclusions Compared with traditional EVD, RS has a higher hematoma clearance rate, fewer patients with intracranial infection and hydrocephalus, and improves the clinical prognosis. Therefore, it is recommended to perform RS in clinical practice.
Key words: robot-assisted; thalamic hemorrhage; puncture and drainage; external ventricular drainage
基金项目:安徽省卫生健康委科研项目重点项目(AHWJ2021a004)
作者单位:230001 合肥,中国科学技术大学附属第一医院(安徽省立医院)神经外科
通信作者:鲍得俊
丘脑出血(thalamic hemorrhage,TH)占脑出血的10%~20%,并且出血常破入脑室[1]。丘脑出血发病急,病情进展快,死亡率和致残率高,尤其是严重的丘脑出血合并脑室侵犯者[2]。丘脑出血临床表现和预后各不相同,在众多外科治疗方法中,各有优缺点,因此,临床治疗存在争议。目前,严重TH的治疗总体疗效较差,脑室外引流(external ventricular drainage, EVD)是一种常见的治疗方法,但疗效不佳,并伴有许多并发症[3]。因此,需要寻求提高临床疗效的更好治疗方法。随着近年来神经外科手术机器人的发展,神经外科手术机器人在丘脑出血治疗中的价值越来越被重视[4]。立体定向微创手术具有手术时间短、并发症少等优点,机器人立体定向辅助系统可进一步增加手术的精确性,可为每个患者制定个性化的手术计划。与传统立体定向手术相比,机器人辅助手术可避免对重要脑功能区的损伤,缩短手术时间,提高血肿清除率。结合CT血管造影,还可以减少血管损伤的发生率。这对于丘脑出血的手术治疗尤为重要。然而,机器人辅助手术治疗丘脑出血的疗效报道仍然较少。本研究回顾分析2020年7月—2022年7月中国科学技术大学附属第一医院神经外科收治的53例丘脑出血患者,分为神经外科手术机器人(robot-assisted minimally invasive surgery,RS)组和EVD组。比较兩组的临床数据,探索神经外科手术机器人治疗丘脑出血的临床疗效,以期为丘脑出血治疗提供了一种新的、安全可靠的治疗方法。
1 资料与方法
1.1 一般资料 共纳入53例确诊为原发性丘脑出血的患者,其中RS组34例,EVD组19例。RS组中,男18例,女16例;年龄55~64岁,平均年龄(58.7±1.9)岁,术前GCS平均得分为(8.15±0.15),Graeb平均分(6.22±0.53)。EVD组中,男11例,女8例;年龄56~88岁,平均年龄(60.1±2.3)岁;术前GCS平均分为(8.25±0.12);平均Graeb分(6.36±0.36)。所有患者或家属均签署知情同意书。纳入标准:(1)丘脑出血量 15~40 mL、或(和)合并脑室血肿;(2)年龄<75岁;(3)麻醉师可以在全麻下进行插管。排除标准:(1)深昏迷患者,一侧或双侧瞳孔散大;(2)肝肾功能衰竭者;(3)脑动静脉畸形、动脉瘤等原因导致的脑出血;(4)脑肿瘤卒中;(5)血液病等所致脑出血。
1.2 方法
1.2.1 EVD組 Kocher点是脑室外引流穿刺点。根据脑室出血情况,选择单侧或双侧EVD。
1.2.2 RS组 手术当天贴体表MARK,扫描头部CT,层厚0.625 mm,扫描完成后刻盘。手术机器人计算机规划手术靶点和路径后。头部三钉头架固定,机械臂连操作车、三钉头架。患者注册、机械臂注册。点击[手术定位]-[机械臂定位],选择“验证靶点”路径,依次点击[锁靶]-[靶点注册]-[手术模拟]-[实施定位],机械臂自动运动至验证点位置,观察定位精度为1 mm 以内。头部标记手术切口后,手术区域使用碘酊-酒精消毒,铺无菌巾。机械臂套装无菌袋,安装无菌导向器及适配器。切开头皮2 cm,颅骨钻一孔,切开硬膜,机械臂自动运动到指定位置,将引流管沿通道缓慢置入血肿靶点位置(图1)。
1.3 观察指标与术后随访
1.3.1 观察指标 (1)评估血肿清除程度和是否有再出血,血肿量计算方法为使用3D Slicer软件重建血肿后计算体积:血肿清除率 = (术前血肿量-拔管前血肿量)/术前血肿量×100%;(2)术后第1天和第14天分别对患者GCS评分、是否发生颅内感染、术后癫痫和脑梗死情况进行评估。
1.3.2 随访 术后随访6个月。通过头颅CT检查以评估是否发生脑积水,Barthel指数(BI)评估患者日常生活活动,BI≥90%表示预后良好。
1.4 统计学处理 采用 SPSS 25.0 软件进行统计分析。计数资料以例(%)表示,组间比较采用χ2 检验。计量资料在分析前,先进行K-S检验,判断资料是否符合正态分布,符合正态分布或近似符合正态分布的计量资料采用t检验,符合偏态分布的计量资料采用秩和检验。以P<0.05认为差异有统计学意义。
2 结 果
2.1 一般资料比较 两组间年龄、性别、术前GCS平均评分及Graeb平均分比较分析发现,差异不具有统计学意义(P>0.05)。见表1。
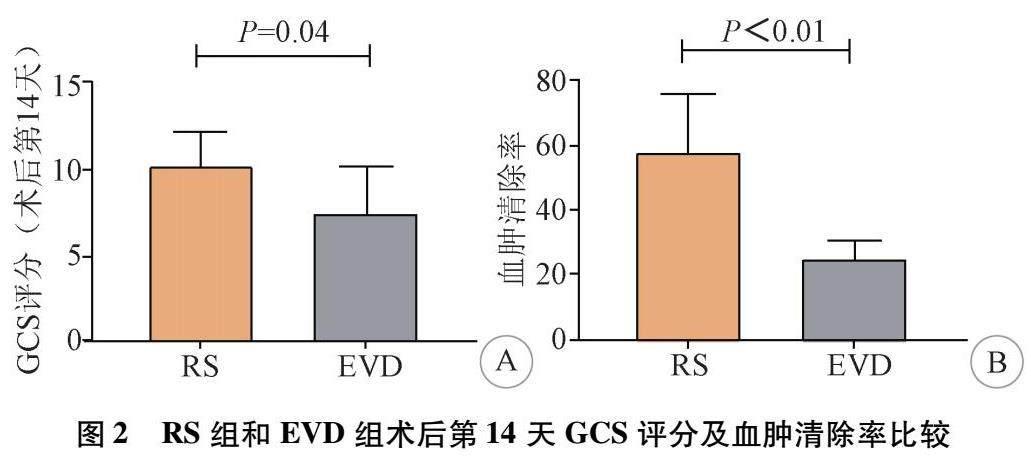
2.2 术后血肿清除和意识改善 术后24 h内行头部CT扫描,RS组的平均血肿清除率为(64.5±5.08)%,2例患者(5.88%)再次出血。EVD组血肿清除率为(24.6±1.05)%,1例患者(5.26%)再次出血。统计分析结果提示,RS组的血肿清除率显著高于EVD组(P<0.05),再出血发生率无显著性差异(P>0.05)。见图2。两组患者术后意识评估均有所改善。RS组第1天的GCS评分为(8.56±0.21),第14天为(10.83±0.36)。EVD组术后第1天的GCS评分为(7.83±0.25),第14天为(8.51±0.32)。RS组的意识改善明显优于EVD组(P<0.05)。见表1。
2.3 住院时间和颅内感染发生率 RS组和EVD组患者术后平均住院时间(不包括康复住院时间)分别为(17.42±1.53)d和(23.86±2.86)d;RS组和EVD组分别有6例(17.64%)和10例(52.63%)术后出现颅内感染;统计分析两组患者在住院时间和颅内感染发生率结果均提示差异具有统计学意义(P<0.05)。见表1。
2.4 术后6个月临床随访 RS组中,23例患者(67.64%)预后良好,2例患者(5.88%)死亡,脑积水患者4例(11.76%),癫痫患者1例(2.94%),脑梗死患者2例(5.88%)。EVD组中,7例患者(36.84%)预后良好,5例患者(26.31%)死亡,脑积水12例(63.16%),癫痫1例(5.26%),脑梗死1例(5.26%)。随访结果显示,RS组的死亡率和脑积水发生率较EVD组降低,预后明显优于EVD组(P<0.05)。RS组和EVD组患者在脑梗死和癫痫发病率方面的差异无统计学意义(P>0.05)。见表1。
3 讨 论
TH的特征是急性发作、丘脑功能受损、严重临床症状,出血进入脑室、脑脊液循环受阻、脑积水形成[5-6]。丘脑、穹窿、基底神经节、脑干和其他重要的神经结构位于脑室周围,急性脑室内出血容易引起周围神经结构的损伤和挤压效应,导致继发性损伤[7]。大多数患者合并有意识障碍,严重者可出现瞳孔散大和呼吸循环衰竭。丘脑位置很深,周围的结构重要。若不及时清除丘脑和脑室的积血,缓解脑室系统梗阻,并及时恢复脑脊液循环,将会降低患者临床疗效、增加致残率和死亡率[8-9]。Neisewander等的研究表明,严重TH的死亡率可高达60%~75%[6],因此,选择有效的外科治疗方法及时清除丘脑和脑室积血,恢复脑脊液循环,对改善患者的预后具有重要意义。
TH临床治疗的关键是尽快清除丘脑和脑室的积血,改善颅内高压状态,恢复脑脊液循环,减少重要周围神经结构的继发损伤[10-11]。Ullman等[7]总结了500例丘脑出血破入脑室患者的临床研究,认为早期有效清除血肿和畅通脑脊液循环对恢复神经功能非常重要。传统的手术治疗通常是EVD,这种手术程序快速简单,已被大多数医疗单位掌握和采用,已成为治疗严重丘脑出血的常用方法[10]。虽然持续引流血性脑脊液和中晚期腰大池引流对治疗丘脑出血破入脑室有一定的疗效[12];然而有研究表明,对于合并严重脑室内出血的患者预后仍较差[13]。这可能是由于脑室系统的梗阻和血肿压迫未能尽快缓解所致;而且,脑室引流管的保留时间过长,将会增加颅内感染发生的可能性[14]。Johnson等[15]分析了39例Graeb评分超过6分的脑室内出血患者发现,EVD很难在短时间内有效清除脑室内及丘脑血肿,需要晚期分流手术的脑积水发生率显著增加。Shimizu 等[16]的研究发现,快速清除脑室内及丘脑的血肿,需要晚期行分流手术的脑积水发生概率显著降低。以上研究结果进一步提示,寻求新的、精准的外科治疗方法具有重要的临床必要性。因此,机器人辅助神经外科手术在丘脑出血的治疗中具有重要临床价值。
本研究中,34例严重丘脑出血患者通过机器人辅助穿刺引流丘脑血肿和脑室外引流治疗,术后24 h内血肿清除率达64.5%。接受EVD治疗的19例患者,术后24 h的清除率为24.6%。统计分析结果提示,在血肿清除率方面RS组患者较EVD组患者更获益(P<0.05)。及时清除丘脑和脑室中的积血,不仅可以缓解血肿对周围脑组织的压迫作用,而且能促进脑脊液循环的早期建立,减少继发性损伤[17]。RS组丘脑和脑室中的血被清除后,脑脊液循环比EVD组恢复得更好,术后保留脑室引流管时间缩短,脑积水和颅内感染的发生率显著降低。根据该组数据,术后脑积水和术后颅内感染的发生率分别为11.7%和17.6%。EVD组保留引流管的时间较长,血肿难以在短时间内清除,一些患者需要尿激酶灌洗,导致术后脑积水和颅内感染的发生率升高,術后颅内感染发生率为52.6%,术后有63.1%的患者出现脑积水,两组之间存在显著差异。
RS手术组死亡2例,1例死于再出血,1例死于肺炎。EVD手术组5例死于心功能衰竭和肺炎。统计分析两组患者死亡率,结果提示无显著差异。颅内血肿引流手术已被多项临床指南推荐为脑血肿引流手术的常规手术,但对于丘脑血肿,目前尚无明确的指南;本研究的病例数据可以为神经外科医生提供信息,作为临床实践的指导。无手术或穿刺路径相关出血,这表明机器人辅助丘脑血肿引流手术安全可靠。
机器人辅助穿刺,可以针对患者进行个体化的穿刺路径规划,可以避免对重要功能区域和可见血管的损伤。清除血肿可缓解其局部占位效应,改善局部血流,减少脑组织损伤后血肿分解产物和血管活性物质释放,防止脑水肿的发展。所有这些作用都为神经功能的恢复提供了有利条件[18-20]。此外,手术组中患者的运动和语言恢复较好;这可能与血肿(延伸到内囊)的解剖结构有关。当内囊被压缩或损伤时,运动传导通路中断,导致对侧肢体运动功能障碍。当血肿压迫语言区或破坏丘脑腹侧核、前运动区和Broca区之间的连接时,很容易导致失语。
目前,关于小体积丘脑出血手术时机的选择目前尚无统一观点,许多前瞻性研究显示手术时机在出血后4~96 h。一般认为,血肿越早清除,功能恢复越好[21-22]。然而,超早(小于6 h)手术虽然可保护患者的神经功能,但术后发生颅内再出血的概率较高。本研究中心建议,在出血发生72 h后进行血肿穿刺引流。因为在临床工作中发现,部分患者从外院转入本中心后选择神经外科手术机器人辅助丘脑出血穿刺引流手术,这部分患者发病至手术时间16~270 h,平均(88.0±55.1)h,术后再出血率低、术后恢复满意。这可能是由于丘脑血肿已基本完全液化,更便于安全引流。但小体积丘脑出血的最佳手术时间,仍需随机对照试验结果以提供更有力的临床证据[23]。
作为一项回顾性研究,本研究存在诊断时间、病例数量等客观因素,限制了研究的开展。对于丘脑出血,还需要在血肿体积、手术时机、手术方法等方面进行多中心前瞻性随机对照试验,以获得更高水平的临床证据,指导丘脑出血的临床手术治疗。
本研究中,随着术后GCS评分和6个月随访,RS组术后GCS和预后评分的改善明显优于EVD组,且RS组住院时间缩短。因此,神经外科机器人治疗丘脑出血患者,可以明显改善其预后和生活质量,降低死亡率和并发症,值得临床推广应用。
[参 考 文 献]
[1]Kase CS,Hanley DF.Intracerebral hemorrhage:advances in emergency care[J].Neurol Clin,2021,39(2):405-418.
[2]Ruiz-Sandoval JL,Chiquete E,Parra-Romero G,et al.Hypertensive thalamic hemorrhage:analysis of short-term outcome[J].Int J Neurosci,2019,129(2):189-194.
[3]Schrag M,Kirshner H.Management of intracerebral hemorrhage:JACC focus seminar[J].J Am Coll Cardiol,2020,75(15):1819-1831.
[4]孙霄,陶英群,金海,等.ROSA与立体定向框架辅助手术治疗高血压脑出血的对比研究[J].中华神经外科杂志,2018,34(7):674-677.
[5]Deng LJ,Chen K,Yang L,et al.Different effects of hematoma expansion on short-term functional outcome in basal ganglia and thalamic hemorrhages[J].Biomed Res Int,2021,2021(10):9233559.
[6]Neisewander BL,Hu K,Tan Z,et al.Location of thalamic hemorrhage impacts prognosis[J].World Neurosurg,2018,116(5):e525-e533.
[7]Ullman NL,Tahsili-Fahadan P,Thompson CB,et al.Third ventricle obstruction by thalamic intracerebral hemorrhage predicts poor functional outcome among patients treated with alteplase in the CLEAR III trial[J].Neurocrit Care,2019,30(2):380-386.
[8]Hessington A,Tsitsopoulos PP,Fahlstrm A,et al.Favorable clinical outcome following surgical evacuation of deep-seated and lobar supratentorial intracerebral hemorrhage:a retrospective single-center analysis of 123 cases[J].Acta Neurochir (Wien),2018,160(9):1737-1747.
[9]Nam TM,Jang JH,Kim SH,et al.Comparative analysis of the patients with spontaneous thalamic hemorrhage with concurrent intraventricular hemorrhage and those without intraventricular hemorrhage[J].J Korean Med Sci,2021,36(1):e4.
[10]Fu CH,Wang N,Chen HY,et al.Endoscopic surgery for thalamic hemorrhage breaking into ventricles:comparison of endoscopic surgery,minimally invasive hematoma puncture,and external ventricular drainage[J].Chin J Traumatol,2019,22(6):333-339.
[11]倪海波,孫晓峰,钱晓波,等.神经内镜下微创手术治疗丘脑出血破入脑室的疗效分析[J].临床神经外科杂志,2022,19(4):433-436.
[12]Li Q,Li R,Zhao LB,et al.Intraventricular hemorrhage growth:definition,prevalence and association with hematoma expansion and prognosis[J].Neurocrit Care,2020,33(3):732-739.
[13]Trifan G,Arshi B,Testai FD.Intraventricular hemorrhage severity as a predictor of outcome in intracerebral hemorrhage[J].Front Neurol,2019,10(3):217.
[14]Moullaali TJ,Sato S,Wang X,et al.Prognostic significance of delayed intraventricular haemorrhage in the INTERACT studies[J].J Neurol Neurosurg Psychiatry,2017,88(1):19-24.
[15]Johnson JR,Idris Z,Abdullah JM,et al.Prevalence of shunt dependency and clinical outcome in patients with massive intraventricular haemorrhage treated with endoscopic washout and external ventricular drainage[J].Malays J Med Sci,2017,24(1):40-46.
[16]Shimizu Y,Tsuchiya K,Fujisawa H.Endoscopic surgery for thalamic hemorrhage with intraventricular hemorrhage:effects of combining evacuation of a thalamic hematoma to external ventricular drainage[J].Asian J Neurosurg,2019,14(4):1112-1115.
[17]陈俊杰,董军.丘脑出血并发脑室铸型的神经内镜微创手术治疗[J].临床神经外科杂志,2016(2):89-92.
[18]Xu SH,Du B,Shan AJ,et al.The risk factors for the postoperative pulmonary infection in patients with hypertensive cerebral hemorrhage:a retrospective analysis[J].Medicine(Baltimore),2020,99(51):e23544.
[19]Wu TY,Sharma G,Strbian D,et al.Natural history of perihematomal edema and impact on outcome after intracerebral hemorrhage[J].Stroke,2017,48(4):873-879.
[20]Qiu ZD,Yang J,Deng G,et al.Angiopoietin-like 4 attenuates brain edema and neurological deficits in a mouse model of experimental intracerebral hemorrhage[J].Med Sci Monit,2018,24(2):880-890.
[21]Hemphill JC 3rd,Greenberg SM,Anderson CS,et al.Guidelines for the management of spontaneous intracerebral hemorrhage:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J].Stroke,2015,46(7):2032-2060.
[22]Li YQ,Wang JC,Li ZH,et al.Computed tomography angiography spot sign as an indicator for ultra-early stereotactic aspiration of intracerebral hemorrhage[J].World Neurosurg,2018,109(1):e136-e143.
[23]Scaggiante J,Zhang XN,Mocco J,et al.Minimally invasive surgery for intracerebral hemorrhage[J].Stroke,2018,49(11):2612-2620.
(收稿2022-11-17 修回2022-12-30)
