长链非编码RNA Linc00645在脑胶质瘤中的表达及其功能研究
2023-04-29王宇杰李晨龙郑宏山刘清艾思奇王英杰肖旭苏天崎付天娇梁鹏
王宇杰 李晨龙 郑宏山 刘清 艾思奇 王英杰 肖旭 苏天崎 付天娇 梁鹏
【摘要】 目的 研究长链非编码RNA Linc00645在脑胶质瘤组织中的表达水平及其对胶质瘤细胞增殖、侵袭和迁移能力的影响,并探究其可能的作用机制。方法 分析癌症基因组图谱(TCGA-GBM)数据库和中国脑胶质瘤基因組计划(CGGA)数据库中,Linc00645在正常脑组织和胶质瘤组织中的表达情况,并采用实时荧光定量PCR(qRT-PCR)在人正常星形胶质细胞株和5种胶质瘤细胞株中检测Linc00645的表达水平。敲低Linc00645表达后,应用细胞增殖实验(MTT)检测胶质瘤细胞的增殖能力,应用划痕实验和Transwell侵袭实验检测细胞的迁移和侵袭能力。应用Western Blot实验在蛋白水平上验证敲低Linc00645的表达对胶质瘤细胞侵袭和迁移相关蛋白的影响。结果 Linc00645在脑胶质瘤中的表达水平明显高于正常脑(P<0.05),并且Linc00645的表达水平随着胶质瘤病理等级的升高而升高(P<0.05)。Linc00645高表达组的患者,总体生存期明显缩短,预后较差(P<0.05)。抑制Linc00645的表达后胶质瘤细胞的增殖、侵袭以及迁移能力均明显下降。基因表达相关性(Pearson)分析显示上皮-间质样转化(EMT-like)相关标志物N-钙黏蛋白(N-cadherin),波形蛋白(Vimentin)和锌指E-盒结合同源异形盒因子(ZEB1)与Linc00645表达呈正相关性,而E-钙黏蛋白(E-cadherin)与Linc00645表达呈负相关性(P<0.05)。敲低Linc00645的表达后细胞中的E-cadherin表达水平升高,而N-cadherin、Vimentin和ZEB1表达水平明显降低。结论 长链非编码RNA Linc00645在胶质瘤组织中高表达,并且其表达水平与肿瘤的恶性程度密切相关。Linc00645可能通过升高N-cadherin、Vimentin和ZEB1的表达水平从而提高胶质瘤细胞的侵袭和迁移能力。Linc00645可能作为胶质瘤早期诊断和治疗的新靶点。
【关键词】 神经胶质瘤;长链非编码RNA;侵袭;上皮-间质样转化
【中图分类号】 R739.41 【文献标志码】 A 【文章编号】 1672-7770(2023)02-0146-07
Abstract: Objective To investigate the expression of long non-coding RNA Linc00645 in glioma tissues and its effect on the proliferation, invasion and migration of glioma cells, and to explore its possible mechanisms. Methods The expression of Linc00645 in normal brain tissues and glioma tissues in The Cancer Genome Atlas(TCGA-GBM) database and the Chinese Glioma Genome Atlas(CGGA) database were analyzed, and quantitative Real-Time Polymerase Chain Reaction(qRT-PCR) was used to verify the expression in Normal Human Astrocyte and 5 glioma cell lines. After knocking down the expression of Linc00645, MTT assay was used to detect the proliferation capacity of the glioma cells, and the wound healing assay and the Transwell assay were conducted to evaluate the migration and invasion ability of the cells. Western Blot was performed to verify the effect of Linc00645 knockdown on the invasion and migration-related proteins of glioma cells at the protein level. Results The expression of Linc00645 in glioma tissues was significantly higher than that in normal brain tissues(P<0.05), and the expression of Linc00645 increased along with the advance of the pathological grade of glioma(P<0.05). In the Linc00645 high expression group, the overall survival period was significantly shorter and the prognosis was worse(P<0.05). After inhibiting the expression of Linc00645, the proliferation, invasion and migration ability of glioma cells were significantly reduced. The Pearson correlation analysis showed that EMT-like related markers N-cadherin, Vimentin and zinc finger E-box binding homeobox 1(ZEB1) were positively correlated with Linc00645, while E-cadherin was negatively correlated with Linc00645(P<0.05). The expression of E-cadherin increased, while the expression of N-cadherin, Vimentin and ZEB1 significantly decreased after knocking down the expression Linc00645. ConclusionsLong non-coding RNA Linc00645 is highly expressed in glioma tissues, and its expression is closely related to the malignancy of the tumor. Linc00645 could increase the expression of N-cadherin, Vimentin and ZEB1 to enhance the invasion and migration ability of glioma cells. Therefore, Linc00645 may serve as a new target for early diagnosis and treatment of glioma.
Key words: glioma; long non-coding RNA; invasion; epithelial-mesenchymal transition-like
基金项目:黑龙江省自然科学基金资助项目(LH2021H080)
作者单位:150001 哈尔滨,哈尔滨医科大学附属肿瘤医院神经外科
通信作者:梁鹏
在过去的几十年中,神经胶质瘤已成为中国乃至全球中枢神经系统恶性肿瘤相关死亡的主要原因[1]。尽管在诊断和治疗方面取得了很多进展,但神经胶质瘤患者的预后仍然很差,中位总生存期为12~14个月。胶质瘤的发病率不断上升且病死率很高,因此迫切需要阐明其发展的病理机制。众所周知,胶质瘤发生的过程很复杂,涉及很多基因突变和生物过程的多个步骤[2-4]。上皮间质转化 (epithelial-mesenchymal transition,EMT)是促进肿瘤侵袭和迁移过程的重要机制[5]。长链非编码RNA(long non-coding RNA,LncRNA)是一类 RNA 转录物,长度大于200个核苷酸,没有编码蛋白质的功能[6]。LncRNAs以前被认为是转录噪声,然而现已发现它们在一系列生物学过程中起着关键作用,如表观遗传调控,组蛋白修饰,转录控制和RNA代谢等过程[7]。长链非编码RNA 00645(Linc00645)位于人类14号染色体上,已在子宫内膜癌中被证实有表达异常并发挥重要作用[8],然而Linc00645在胶质瘤中的作用尚不清楚。本研究检测了Linc00645在脑胶质瘤组织中的表达水平,随后检测敲低Linc00645的表达对胶质瘤细胞的增殖、侵袭和迁移能力及相关标志物的影响,明确Linc00645在胶质瘤发生发展中的作用,为神经胶质瘤的治疗提供一种新的策略。
1 资料与方法
1.1 数据库样本数据收集 自癌症基因组图谱数据库(The Cancer Genome Atlas,TCGA)(http://cancergenome.nih.gov)下载164例样本数据,其中包含159例Ⅳ级胶质母细胞瘤(glioblastoma,GBM)组织样本和5例正常脑组织样本。自中国脑胶质瘤基因图谱数据库(Chinese Glioma Genome Atlas,CGGA)(www.cgga.org)下载262例胶质瘤患者样本,其中包含世界卫生组织(WHO)Ⅰ-Ⅱ级96例,Ⅲ级52例,Ⅳ级114例。样本数据用于正常脑组织和胶质瘤组织中Linc00645表达情况的分析。
1.2 生存分析方法 从TCGA和CGGA数据库中下载GBM患者的生存期数据,对Linc00645和GBM患者生存期进行相关性分析,通过Graphpad软件采用Kaplan-Meier 法绘制患者生存期曲线,并进行Log-rank检验,以P<0.05认为差异具有统计学意义。
1.3 与Linc00645相关的功能分析 使用基因本体论(gene ontology,GO)分析对Linc00645的生物学功能进行预测。通过Starbase V2.0数据库对Linc00645进行靶基因预测并根据相关性选取前50个基因作为靶基因,后通过功能注释生物信息数据库(The Database for Annotation, Visualization and Integrated Discovery,DAVID)(https://david.ncifcrf.gov/)对Linc00645进行基因功能注释,探索与Linc00645相关性最高的生物学功能注释,收集差异倍数为Fold change>2且错误发现率False discovery rate<0.01为有意义注释。
1.4 主要材料和试剂 所有细胞株均采用含10%胎牛血清、0.2%双抗(50 U/mL青霉素和链霉素)的DMEM高糖培养基培养,细胞均培养在37 ℃、CO2浓度为5%的培養箱中。胎牛血清和DMEM高糖培养基均购自美国Hyclone公司,青霉素-链霉素溶液(100×)购自上海碧云天生物技术有限公司。RNA提取试剂盒,逆转录试剂盒和实时定量PCR试剂盒均购自瑞士Roche公司。Transwell小室(预铺基质胶)购自美国Corning公司。苏木素-伊红试剂盒和MTT细胞增殖检测试剂盒均购自上海碧云天生物技术有限公司。载Linc00645的siRNA所用商品化质粒购自上海吉凯基因化学技术有限公司。
1.5 实时荧光定量PCR(qRT-PCR)方法 按照Trizol说明书提取胶质瘤细胞系中的总RNA,应用NanoDrop检测RNA浓度。Linc00645的正向引物序列为5′- CAGAGGTGGTGCCTTGACA-3′,反向引物序列为5′- ATATCCTCTGTGGCCCATGC -3′,GAPDH作为内参基因,其正向引物序列为5′- CACCCACTCCTCCACCTTTG -3′,反向引物序列为5′- CCACCACCCTGTTGCTGTAG -3′。以总RNA为模板,逆转录得到cDNA,然后加入引物使用SYBR Green qPCR分析法进行qRT-PCR实验,反应结束后使用ABI Prism7900HT PCR仪自带分析软件,导入原始数据,获得相应的CT值、ΔCt值,并以2-ΔΔCt值(Ct:循环阈值)算法分析qRT-PCR结果,得到目的基因的相对表达量。
1.6 细胞培养方法 所有细胞株均采用含10%胎牛血清、0.2%双抗(50 U/mL 青霉素和链霉素)的DMEM高糖培养基培养。细胞均培养在37 ℃、CO2浓度为5%的培养箱中。在光学显微镜下观察并记录细胞贴壁情况,2~3 d更换完全培养基一次,换液时弃掉培养皿中培养基,加入预染的PBS液(pH=7.4)3 mL漂洗1次,随后加入5 mL预热完全培养基,于培养箱中继续培养。
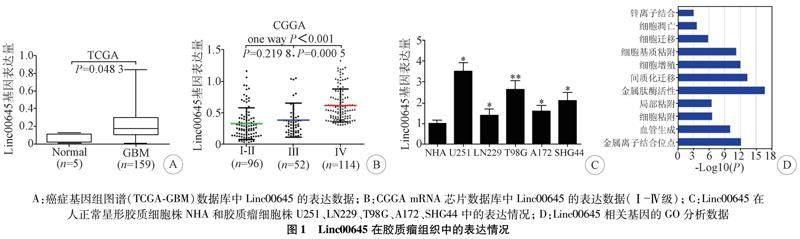
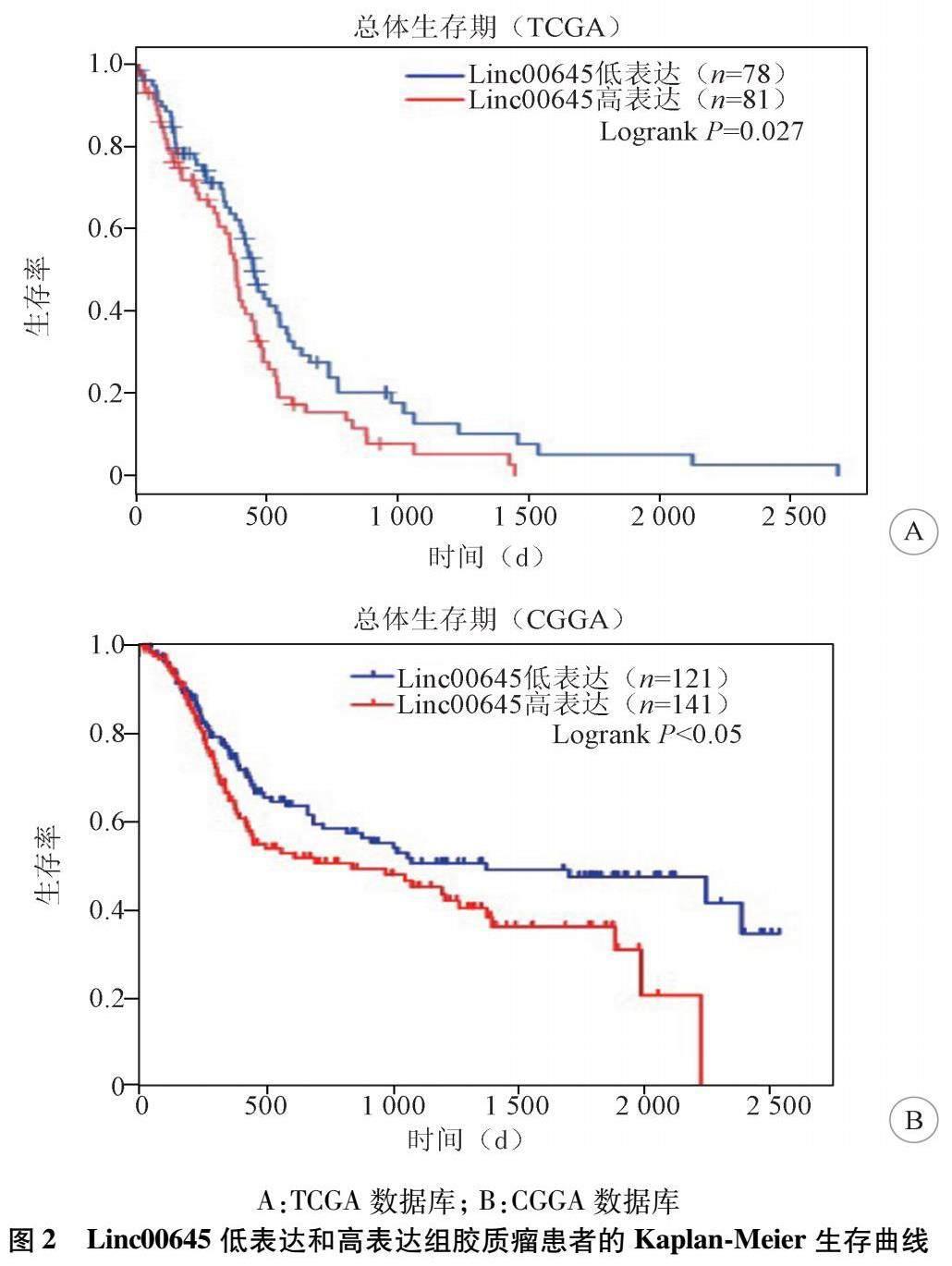
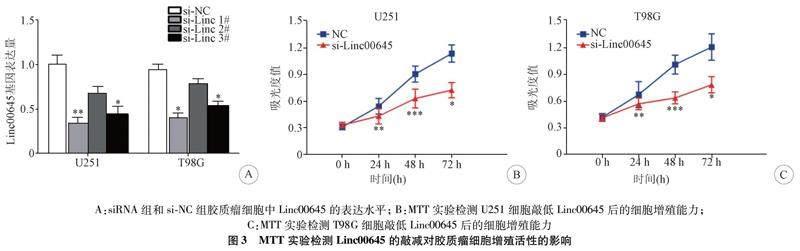
1.7 实验分组 结果1分组:(1)正常组和GBM组(图1A);(2)Ⅰ-Ⅱ级组,Ⅲ级组和Ⅳ级组(图1B);(3)人正常星形胶质细胞株(NHA)组和胶质瘤细胞株(U251、LN229、T98G、A172、SHG44)组(图1C)。结果2分组:(1)TCGA中Linc00645低表达组(n=78)和高表达组(n=81)(图2A);(2)CGGA中Linc00645低表达组(n=121)和高表达组(n=141)(图2B)。结果3分组:(1)U251细胞株和T98G细胞株中si-NC组和si-Linc 1#组、si-Linc 2#组、si-Linc 3#组(图3A);(2)U251细胞株中si-NC组和si-Linc00645组(图3B);(3)T98G细胞株中si-NC组和si-Linc00645组(图3C)。结果4分组:(1)U251细胞株中si-NC组和si-Linc00645组(图4A,4C-4E);(2)T98G细胞株中si-NC组和si-Linc00645组(图4B-4E)。结果5分组:(1)U251细胞株中si-NC组和si-Linc00645组(图5E,5F);(2)T98G细胞株中si-NC组和si-Linc00645组(图5E,5G)。
1.8 细胞转染 转染前一天,将5×105贴壁细胞铺到6孔板中。当细胞融合度达到60%~70%时用于进行后续实验。准备无RNase EP管,将EP管A:Opti-MEM培养基250 μL+目的基因质粒4 μL(100 pmol)和B:Opti-MEM培养基250 μL+Lipofectamine 2000 5 μL混合后静置20 min,加入6 孔板中培养4 h。更换新鲜培养基继续培养24~48 h后收集细胞。
1.9 细胞增殖实验 利用北京碧云天公司生产的MTT细胞增殖检测试剂盒进行细胞增殖实验。根据说明书,在15 mL离心管中使用5 mL的MTT溶剂混匀溶解25 mg MTT粉,分装后置于-20 ℃避光保存。将2×103/孔贴壁细胞铺到加入了100 μL培养基的96孔板中培养过夜。每孔加入10 μL MTT溶液后继续孵育4 h。每孔加入100 μL Formazan溶解液,轻轻混匀后继续孵育10 min,在光学显微镜下观察结晶紫的溶解程度。取出培养板后,使用酶标仪检测570 nm处的吸光度,导出数据,根据存活率计算公式得到相应数值,绘制增殖曲线。
1.10 细胞划痕实验 细胞划痕实验是用来检测细胞迁移运动和修复能力的方法。实验前所有工具进行高压灭菌,直尺和信号笔置于超净台中紫外照射30 min。使用信号笔在无菌6孔板背后每隔0.5 cm画一条横穿过孔直线。实验前一天加入5×105细胞铺板,培养过夜。实验时用枪头沿着直尺划过细胞方向与孔板背面画线相垂直,枪头垂直划过贴壁细胞。使用PBS液洗掉脱落的细胞,加入无血清培养基继续培养,在0 h、24 h取样拍照。使用Image J软件分析细胞修复面积,进行统计学分析。
1.11 Transwell侵袭实验 利用美国Corning公司生产的商品化的预包被基质胶Transwell小室进行Transwell侵袭实验。使用时提前取出小室,在上室加入300 μL无血清培养基,在室温下静置30 min水化基质胶,将Transwell小室放入24孔培养板中,小室内部为上室,培养板底部为下室。使用无血清培养基制备细胞悬液。上层小室加入300 μL细胞悬液,下层小室加入500 μL含20%的FBS培养基。继续培养24 h后取出小室,对小室内侧使用蒸馏水轻轻冲洗,使用棉签擦去内层基质胶和上室内细胞。将小室置入含有4%多聚甲醛的孔板内,固定细胞10 min。使用HE染色液染色标记细胞,晾干后翻转小室在显微镜下计数并拍照。
1.12 Western Blot方法 收集细胞,使用RIPA裂解液方法提取总蛋白。使用NanoDrop分光光度计法测定提取蛋白浓度,通过检测纯净的蛋白在280 nm处的吸光值,直接定量蛋白浓度和纯度,上样量为200 μg/孔。使用Bio-Rad垂直电泳系统进行蛋白电泳,然后将蛋白转至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),使用5%的脱脂牛奶在室温下封闭1 h,再使用TBST稀释目的一抗,将PVDF膜浸于一抗中,4 ℃孵育过夜。随后用TBST漂洗移除一抗,再将PVDF膜浸于相应二抗中,室温下在摇床上孵育1 h,TBST漂洗。采用ECL化學发光显色法,显影前以配置1∶1比例配置发光液A液和B液,充分混匀,将PVDF浸润于显色液中,将PVDF膜放置于Bio-Rad凝胶成像系统平台中,使用Biorad Image Lab软件分析目的蛋白的相对灰度值。
1.13 统计学分析 所有数据均采用SPSS v.19.0或者GraphPad Prism v.5.0进行统计学分析。组间比较采用c2检验及Fisher确切概率法,生存期采用Kaplan-Meier 法绘制生存曲线并进行Log-rank检验,基因表达的相关性分析采用Pearson法,以P<0.05认为有显著的统计学意义。
2 结 果
2.1 Linc00645在脑胶质瘤中的表达与生物学功能分析结果 对癌症基因组图谱(TCGA-GBM)数据库中所采集样本的表达数据分析显示,Linc00645在胶质瘤中的表达水平明显高于正常脑组织(P<0.05)(图1A)。对CGGA 数据库中所采集样本的mRNA表达数据分析显示,Linc00645的表达水平随着胶质瘤病理等级的升高而升高(P<0.05)(图1B)。提示Linc00645在正常脑组织和胶质瘤组织中存在差异表达性,且表达量与胶质瘤的恶性程度呈正相关(P<0.05),差异具有统计学意义。对人正常星形胶质细胞株NHA和胶质瘤细胞株U251、LN229、T98G、A172、SHG44采用qRT-PCR检测Linc00645的相对表达水平,结果显示Linc00645在胶质瘤细胞株中的表达水平显著高于正常星形胶质细胞株NHA(P<0.05),差异具有统计学意义(图1C)。以上结果提示,Linc00645在胶质瘤中的表达明显上调。对Linc00645进行GO富集分析,首先利用Starbase V2.0数据库对Linc00645进行靶基因预测,根据相关性选取前50个基因作为靶基因,使用DAVID数据库进行了GO功能注释,结果显示Linc00645主要功能汇聚在金属钛酶活性,间质化迁移,金属离子结合位点,细胞基质黏附等相关分子功能(图1D)。
2.2 Linc00645表达量与脑胶质瘤患者生存期的关系 在TCGA和CGGA数据库中下载GBM患者的临床数据,以Linc00645表达中位数将患者分为高表达组(High expression)和低表达组(Low expression)并对其进行Kaplan-Meier生存分析,结果显示Linc00645高表达组的患者,总体生存期明显缩短,预后较差(P<0.05),差异具有统计学意义,提示胶质瘤中Linc00645高表达与患者预后呈负相关(图2)。
2.3 敲低Linc00645的表达对胶质瘤细胞增殖活性的影响 3组siRNA序列中,si-Linc00645 1#组(si-Linc 1#)敲减效率最明显,故选择用来进行后续实验(图3A)。细胞增殖实验结果显示,U251和T98G细胞株在培养24 h、48 h和72 h后si-Linc00645组的增殖能力低于si-NC组(图3B,图3C),这表明Linc00645的表达下调可抑制胶质瘤细胞的增殖能力。
2.4 敲低Linc00645的表达对胶质瘤细胞侵袭和迁移能力的影响 划痕实验和Transwell侵袭实验结果显示,U251和T98G细胞株在培养24 h后si-Linc00645组胶质瘤细胞的愈合能力和穿过小室的细胞数量均显著低于si-NC组(图4),这表明Linc00645在体外对胶质瘤细胞的发生和发展具有促进作用,Linc00645的表达下调可抑制胶质瘤细胞的侵袭和迁移能力。
2.5 敲低Linc00645的表达对胶质瘤细胞EMT过程的影响 共表达基因相关性分析显示EMT相关标志物N-钙黏蛋白(N-cadherin),波形蛋白(Vimentin)和锌指E-盒结合同源异形盒因子(zincfinger E-box binding homeobox 1,ZEB1)与Linc00645表达呈正相关性,E-钙黏蛋白(E-cadherin)与Linc00645表达呈负相关性(P<0.05)(图5A-D),差异具有统计学意义。Western Blot实验结果表明,U251和T98G细胞株在培养48 h后,si-Linc00645组中E-cadherin表达水平高于si-NC组,而si-Linc00645组中N-cadherin、Vimentin和ZEB1表达水平低于si-NC组,抑制了胶质瘤细胞的EMT过程(图5E-G)。以上结果提示,Linc00645的表达与胶质瘤中EMT过程存在密切相关性。
3 讨 论
LncRNA的功能主要根据其在细胞内特定的分布区域,在细胞质或细胞核中通过各自的序列特殊性结合mRNA、miRNA及相关功能蛋白发挥功能,包括DNA甲基化,对mRNA稳定性的维持,通过“分子海绵”吸附miRNA,以及通过结合转录蛋白发挥转录调控的功能。越来越多的研究显示,LncRNA在肿瘤的恶性生物学行为,神经系统发育和放化疗 抵抗过程中发挥着重要作用。多种LncRNA被认为是肿瘤进展的关键调节因子[9-12]。
EMT指的是上皮细胞在一些因素的作用下,失去极性及细胞间紧密连接和黏附连接,获得了浸润性和游走迁移的能力,变成具备间质细胞形态和特性的细胞的改变。由于胶质瘤细胞来源于胶质细胞,从神经上皮细胞发育而来,因此很多特征不同于经典上皮细胞,但是胶质瘤同样具有高度可塑性,称为EMT样(EMT-like)过程[13-14],调节GBM的侵袭迁移过程。近年来,许多研究报道了EMT或EMT-like机制参与其他非上皮性肿瘤的恶性进程[15-16]。最近定义的GBM的间充质亚型提示在恶性脑肿瘤中,类EMT过程也具有临床重要性。
既往研究显示,LncRNA H19,CCAT2和HOTTIP与胶质瘤的EMT和患者预后不良有关[17-19]。 研究者最先发现Linc00645在子宫内膜癌中存在差异表达,可以作为肿瘤的生物学标志物。据研究报道在对TCGA数据进行WGCNA分析时发现Linc00645在胶质瘤中可能呈高表达状态,并与恶性生存期存在相关性[20]。鉴于Linc00645对胶质瘤细胞的生物学功能可能存在调控作用,本研究进一步探讨潜在的调控机制。首先通过生物信息学的方法,在CGGA胶质瘤样本数据中发现,这些EMT相关标志物的表达水平均与Linc00645呈密切相关。随后通过Western Blot实验,发现Linc00645的表达被抑制后,胶质瘤细胞内 N-cadherin,Vimentin和ZEB1蛋白的表达水平也显著下降。
综上所述,本研究发现,Linc00645的表达水平在胶质瘤组织中上调,并与肿瘤的恶性程度密切相关,上调的Linc00645预示胶质瘤患者的总体生存期较差。Linc00645可能通过调控EMT-like相关标志物N-cadherin,Vimentin和ZEB1蛋白的表达促进胶质瘤细胞的EMT进程,从而促进胶质瘤的增殖、侵袭和迁移能力。至于Linc00645的表达为何在胶质瘤中上调,仍需对其上游调控因子进行进一步的研究来探索。而Linc00645通过何种机制影响这些蛋白的表达,本研究猜测Linc00645可能作为竞争性内源RNA(competing endogenous RNA,ceRNA)靶向結合miRNA,进而调控下游靶基因,从而调控胶质瘤细胞EMT样转化过程。这些结果将增进我们对癌症发展潜在机制的理解,并可能为人类胶质瘤的治疗提供潜在的新策略。
[参 考 文 献]
[1]Molinaro AM,Taylor JW,Wiencke JK,et al.Genetic and molecular epidemiology of adult diffuse glioma[J].Nat Rev Neurol,2019,15(7):405-417.
[2]Broekman ML,Maas SLN,Abels ER,et al.Multidimensional communication in the microenvirons of glioblastoma[J].Nat Rev Neurol,2018,14(8):482-495.
[3]Reifenberger G,Wirsching HG,Knobbe-Thomsen CB,et al.Advances in the molecular genetics of gliomas-implications for classification and therapy[J].Nat Rev Clin Oncol,2017,14(7):434-452.
[4]Synhaeve NE,Van Den Bent MJ,French PJ,et al.Clinical evaluation of a dedicated next generation sequencing panel for routine glioma diagnostics[J].Acta Neuropathol Commun,2018,6(1):126.
[5]Mittal V.Epithelial mesenchymal transition in tumor metastasis[J].Annu Rev Pathol,2018,13(1):395-412.
[6]Rinn JL,Chang HY.Long noncoding RNAs:molecular modalities to organismal functions[J].Annu Rev Biochem,2020,89(6):283-308.
[7]Choudhari R,Sedano MJ,Harrison AL,et al.Long noncoding RNAs in cancer:from discovery to therapeutic targets[J].Adv Clin Chem,2020,95(8):105-147.
[8]Chen BJ,Byrne FL,Takenaka K,et al.Transcriptome landscape of long intergenic non-coding RNAs in endometrial cancer[J].Gynecol Oncol,2017,147(3):654-662.
[9]Tan YT,Lin JF,Li T,et al.LncRNA-mediated posttranslational modifications and reprogramming of energy metabolism in cancer[J].Cancer Commun(Lond),2021,41(2):109-120.
[10]Wang JC,Su ZL,Lu SN,et al.LncRNA HOXA-AS2 and its molecular mechanisms in human cancer[J].Clin Chim Acta,2018,485(7):229-233.
[11]Bhan A,Soleimani M,Mandal SS.Long noncoding RNA and cancer:a new paradigm[J].Cancer Res,2017,77(15):3965-3981.
[12]McCabe EM,Rasmussen TP.lncRNA involvement in cancer stem cell function and epithelial-mesenchymal transitions[J].Semin Cancer Biol,2021,75(10):38-48.
[13]Liu JH,Gao L,Zhan N,et al.Hypoxia induced ferritin light chain(FTL) promoted epithelia mesenchymal transition and chemoresistance of glioma[J].J Exp Clin Cancer Res,2020,39(1):137.
[14]Majc B,Sever T,Zaric' M,et al.Epithelial-to-mesenchymal transition as the driver of changing carcinoma and glioblastoma microenvironment[J].Biochim Biophys Acta Mol Cell Res,2020,1867(10):118782.
[15]Chang LS,Wang JY,Zhou FL,et al.LncRNA RP11-84E24.3 drives tumorigenesis and epithelial-to-mesenchymal transition of glioma cells by promoting TFAP2C-mediated activation of SNAI1[J].J Neurooncol,2021,151(2):157-171.
[16]Iser IC,Pereira MB,Lenz G,et al.The epithelial-to-mesenchymal transition-like process in glioblastoma:an updated systematic review and in silico investigation[J].Med Res Rev,2017,37(2):271-313.
[17]Jia LW,Tian YH,Chen YH,et al.The silencing of LncRNA-H19 decreases chemoresistance of human glioma cells to temozolomide by suppressing epithelial-mesenchymal transition via the Wnt/β-catenin pathway[J].Onco Targets Ther,2018,11(1):313-321.
[18]Zhang SY,Wang WW,Liu GX,et al.Long non-coding RNA HOTTIP promotes hypoxia-induced epithelial-mesenchymal transition of malignant glioma by regulating the miR-101/ZEB1 axis[J].Biomed Pharmacother,2017,95(8):711-720.
[19]Zeng J,Du TP,Song YF,et al.Knockdown of long noncoding RNA CCAT2 inhibits cellular proliferation,invasion,and epithelial-mesenchymal transition in glioma cells[J].Oncol Res,2017,25(6):913-921.
[20]Liang RQ,Zhi YQ,Zheng GZ,et al.Analysis of long non-coding RNAs in glioblastoma for prognosis prediction using weighted gene co-expression network analysis,Cox regression,and L1-LASSO penalization[J].Onco Targets Ther,2019,12(12):157-168.
(收稿2022-04-14 修回2022-08-03)
