注射用头孢呋辛钠中降解杂质的研究
2023-04-29谭胜连周从鹰张旭途刘佳
谭胜连 周从鹰 张旭途 刘佳
摘要:目的 对注射用头孢呋辛钠中4个未公开报道的降解杂质进行研究,并推导其化合物结构。方法 采用YMC C8色谱柱(4.6 mm×50 mm, 3 μm);以0.005 mol/L醋酸铵溶液-乙腈为流动相梯度洗脱,流速0.5 mL/min。离子源:电喷雾离子(ESI)源。结果 注射用头孢呋辛钠中4个未知杂质得到有效分离,使用Q EXACTIVE高分辨质谱确定了杂质的分子量,并依据头孢类化合物的裂解及降解理论推测出其结构与形成机理,与头孢类已知杂质相异,杂质Ⅳ为本品特有的氨降解杂质。结论 本方法操作简便,灵敏度高,可用于评价注射用头孢呋辛钠中的未知杂质,同时,研究结果为注射用头孢呋辛钠的质量标准制订和质量控制提供了重要的参考依据。
关键词:LC-MS/MS;头孢呋辛;降解杂质
中图分类号:R978.1文献标志码:A
Abstract Objective Research of four degradation impurities in cefuroxime sodium for injection which have not been reported publicly, and speculate their structures. Methods Chromatographic separation was performed on a YMC C8 column (4.6 mm×50 mm, 3 μm). The mobile phase consisted of 0.005 mol/L ammonium acetate solution-acetonitrile with the linear gradient elution at a flow rate of 0.5 mL/min. The detection was ESI in the positive mode. Results Four unknown products were effectively separated. The molecular weight of the impurities were exactly determined by Q EXACTIVE HRMS. The structures and the generation mechanism of the four products were preliminarily confirmed according to the cracking and degradation theory of cephalosporins. Unlike normal impurities in cephalosporin, impurity IV is the special ammonia degradation impurity of this product. Conclusion The established LC-MS/MS method is simple and sensitive, and can be used to evaluate unknown impurities in cefuroxime sodium for injection. At the same time, the research results provide an important reference for the quality standards and quality control of cefuroxime sodium for injection.
Key words LC-MS/MS; Cefuroxime; Degradation impurities
我國为药品生产与使用大国,药品的质量及安全情况不仅是监管机构和药企的重点关注领域,也是人民群众普遍关心的热点问题。药品质量的优劣与临床用药的不良反应息息相关,而对药品中杂质的控制更是保证药品质量的关键环节。
头孢呋辛钠由英国葛兰素公司研发,属于第二代半合成头孢菌素抗生素,在体外具有出色的活性,对肠杆菌β-内酰胺酶的稳定性增强,并且具有良好的药动学特性,可用于对头孢呋辛敏感的细菌引起的呼吸道感染、耳鼻喉科感染、泌尿道感染、皮肤和软组织感染等,且可用于术前或术中防止敏感致病菌的生长,减少术中及术后因污染引起的感染[1-2]。现阶段,高效液相色谱串联质谱技术(LC-MS)在药物的杂质研究中已得到广泛的应用,尤其是多级质谱和高分辨质谱更是近年研究的热点技术。研究通过质谱信息确定化合物的分子量进而推测出其可能的分子结构[3-4]。在质谱裂解规律分析中,β-内酰胺类抗生素共有的裂解反应是β-内酰胺环开裂,3位碳上的侧链断裂等[5]。
目前,对注射用头孢呋辛钠的杂质研究大多集中在现有质量标准中的已知杂质或头孢菌素的常见降解杂质,而对其他降解杂质的研究笔者则未见报道。在注射用头孢呋辛钠一致性评价过程中发现4个未知降解杂质,本文分别对其命名为杂质I、杂质Ⅱ、杂质Ⅲ和杂质Ⅳ。4个杂质在参比制剂及自研产品的稳定性研究过程中略有增长。本研究通过液相色谱-串联质谱(LC-MS/MS)法对葛兰素公司及本厂的注射用头孢呋辛钠中4个未知降解杂质进行分析,并对其结构及生成机理进行推导。旨在为注射用头孢呋辛钠产品中的杂质控制及质量研究提供参考依据。
1 实验部分
1.1 药品与试剂
注射用头孢呋辛钠(规格0.25 g,批号2G9F)购自Glaso UK公司;注射用头孢呋辛钠(规格1.5 g,批号190002)来自广州白云山天心制药股份有限公司。色谱级乙腈购自美国Tedia公司;分析级冰醋酸购自天津市大茂化学试剂厂;分析级醋酸钠、醋酸铵和磷酸购自广州化学试剂厂;超纯水由Millipore纯水仪制备。
1.2 儀器
Q EXACTIVE型四极杆-静电场轨道阱质谱仪(美国ThermoFisher Scientific公司);UltiMate 3000 UHPLC液相色谱仪(美国ThermoFisher Scientific公司),包括UltiMate 3000泵、UltiMate 3000二极管阵列检测器、UltiMate 3000自动进样器;工作站:Thermo Xcalibur Qual Browser;分析天平AB-135S(瑞士梅特勒-托利多公司)。
1.3 实验方法
1.3.1 LC-MS/MS系统条件
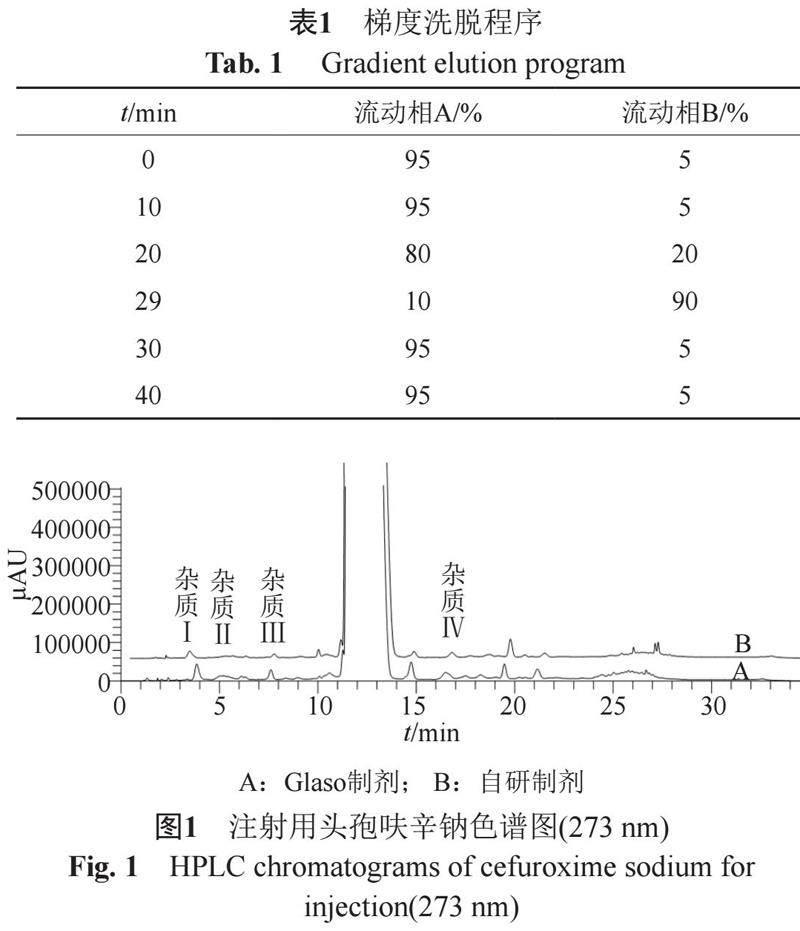
色谱柱:YMC C8(4.6 mm×50 mm, 3 μm);检测波长:273 nm;柱温:30℃;流速:0.5 mL/min ;进样量:20 μL;流动相A:0.005 mol/L醋酸铵盐缓冲液(取0.38 g醋酸铵,加水溶解并稀释成1000 mL,用冰醋酸调节pH至3.4);流动相B:乙腈,按表1梯度洗脱。
质谱条件:离子化方式ESI(+),ddMS2;一级分辨率70000;二级分辨率17500;数据采集范围 120~1800 m/z;喷雾电压:3.8 kV;喷雾温度280℃,离子传输管温度320℃,鞘气压力60 arb;辅助气压力10 arb;S-lens RF level:50;二级碰撞能量:nce 15 40 60。
1.3.2 供试品溶液的配制
取注射用头孢呋辛钠适量,加水溶解并稀释制成0.5 mg/mL的溶液。
2 结果
2.1 两厂家的杂质谱对比
参比制剂与自研制剂的杂质个数均为11个,自研制剂的各未知杂质的含量均小于0.1%,参比制剂杂质量稍高,其中杂质I接近0.15%,色谱图见图1。在一致性评价过程中,杂质I、杂质Ⅱ、杂质Ⅲ和杂质Ⅳ为未知降解产物,在留样过程中有增加趋势,需进行进一步研究。
2.2 杂质I、杂质Ⅱ、杂质Ⅲ和杂质Ⅳ的结构推测
2.2.1 杂质I的结构推测
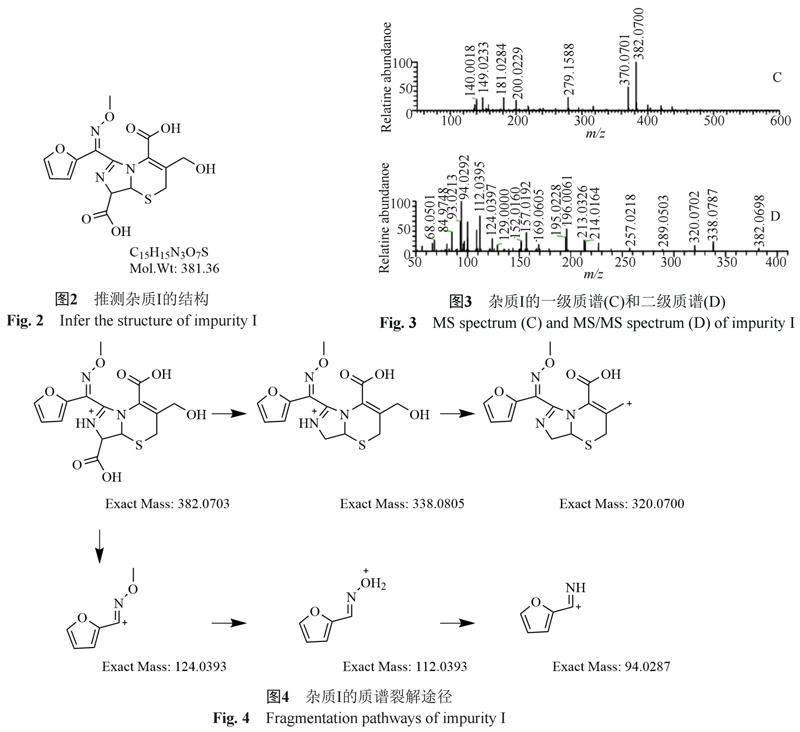
参考《中国药典》青霉素钠杂质D结构及文献资料[6-9]。推测其为头孢呋辛去氨基甲酰基异构化后形成的杂质,见图2。m/z 382为[M+H]+离子峰,m/z 338、m/z 320、m/z 124、m/z 112、m/z 94均为二级离子峰,见图3~4。
2.2.2 杂质Ⅱ的结构推测
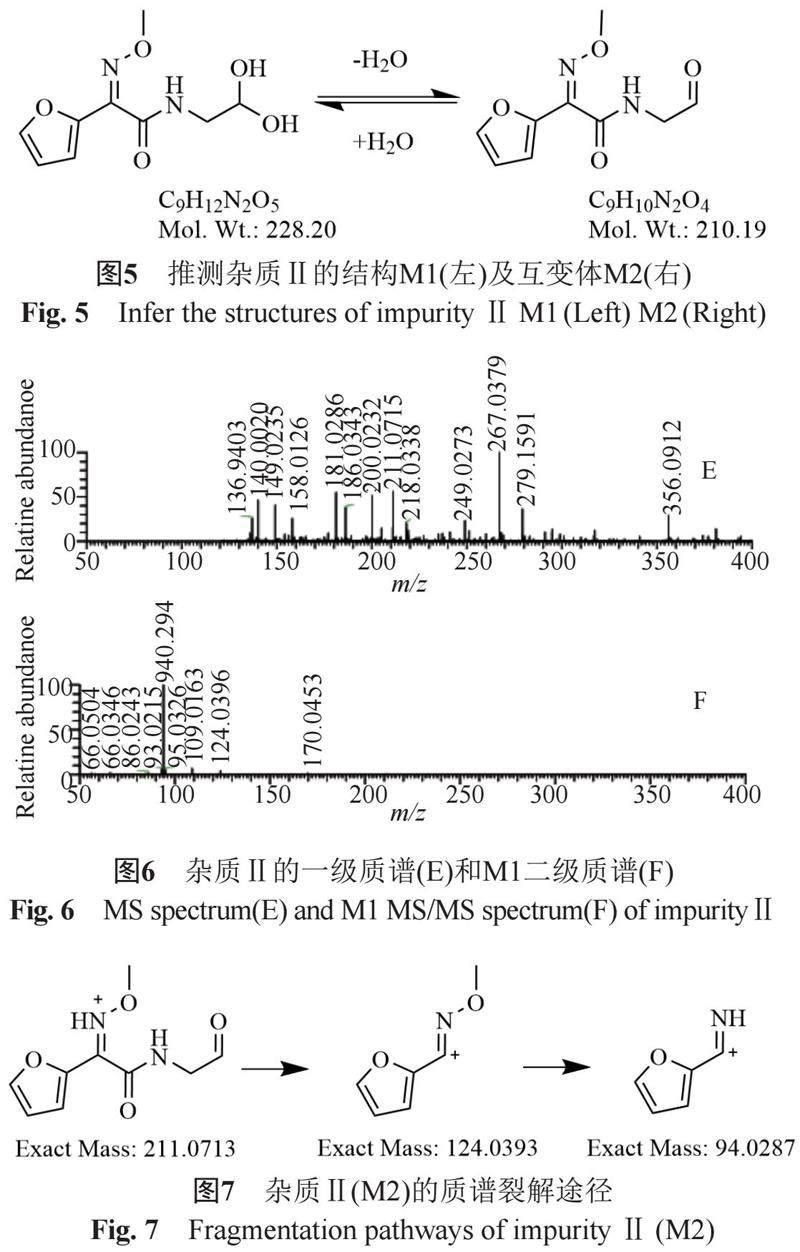
参考《美国药典》头孢地尼杂质b结构及头孢唑林杂质b结构,头孢类易形成双羟基结构的降解产物[10-15]。根据一级质谱的碎片离子峰推测,m/z 267为[M1+K]+离子峰,m/z 249为[M2+K]+离子峰,m/z 211为[M2+H]+离子峰。m/z 124和m/z 94均为m/z 211的二级离子峰。推测杂质Ⅱ为M1与M2。为水合醛与醛的互变体。见图5~7。M1的杂质量较低未能获取二级质谱。
2.2.3 杂质Ⅲ的结构推测
根据杂质Ⅲ的一级质谱m/z 364为[M+H]+离子峰, m/z 336、m/z 318、m/z 211、m/z 179、m/z 165、m/z 137、m/z 124、m/z 94均为二级离子峰。杂质Ⅲ与杂质I的分子量相差18,推测杂质Ⅲ为杂质I的内酯。见图8~10。
2.2.4 杂质Ⅳ的结构推测
根据杂质Ⅳ的一级质谱m/z 419为[M+K]+离子峰,m/z 381为[M+H]+离子峰,m/z 364、m/z 239、m/z 193、m/z 149、m/z 94均为二级离子峰。结合头孢呋辛杂质降解规律,推测其为去氨甲酰头孢呋辛的酰胺化物,见图11~13。
2.2.5 测定结果
高分辨质谱所测定的4个杂质的质荷比与推测结构的质荷比理论值相当,见表2。
2.3 杂质的形成机理推测
头孢呋辛(图14)杂质I、杂质Ⅱ、杂质Ⅲ和杂质Ⅳ的形成机理见图15。
参考青霉素钠杂质D的形成机理[16],头孢呋辛的β-内酰胺环水解开环,5位N对质子化的酰胺羰基(16位C)进行亲核取代,成五元环,所得的醇胺脱水形成杂质I。杂质I脱水,成五元环内酯,形成杂质Ⅲ。
头孢呋辛的β-内酰胺环水解开环,脱羧,6位键水解断裂,形成杂质Ⅱ(M1/M2)。M1与M2为水合醛与醛的互变体。
头孢呋辛9位C上的氨基甲酸酯水解,形成氨基甲酸,氨基甲酸不稳定,进一步分解为氨,氨与头孢呋辛钠中的杂质头孢呋辛内酯发生氨解反应,形成杂质Ⅳ。
3 讨论
《中国药典》2020年版和《英国药典》2021年版中注射用头孢呋辛钠项下均收载有关物质测定方法,流动相同为醋酸钠-冰醋酸缓冲体系。与《英国药典》等度洗脱相比,《中国药典》的梯度洗脱法能检出更多杂质。然而,含有不挥发性盐的流动相严格限制其与质谱的联用,需对流动相进行调整,以可挥发的醋酸铵替代醋酸钠。
近年来,采用二维色谱-质谱系统进行杂质研究的技术已被广泛应用[17]。其原理是在含不挥发性盐流动相的一维色谱上收集特定时段的馏分(杂质峰),经阀切换技术导入第二维色谱脱盐处理,把含不挥发性盐的流动相置换成适合质谱使用的流动相并与质谱联用。该方法优势明显,但背后仍存在限制。如,面对多组分样品,难以一次连贯分析所有成分,毕竟阀切换及二维洗脱需要时间。而洗脱时间的增加会导致一些含量少,稳定性差的杂质发生降解,灵敏度下降。故本研究采用传统方法对注射用头孢呋辛钠的杂质进行研究。即参考《中国药典》方法并优化使其兼容质谱,联合杂质峰的洗脱顺序及杂质量总体分析。
根据EMA的Guideline on setting specifications for related impurities in antibiotics (EMA/CHMP/CVMP/ QWP/199250/2009),半合成抗生素制剂的鉴定限为0.20%。研究注射用头孢呋辛钠在稳定性放置过程中的变化,发现4个未知降解杂质均有增加趋势,为完善注射用头孢呋辛钠的评价,对其进行探索性研究。本文所述的LC-MS/MS分析方法操作简便,能有效鉴定含量约0.01%~0.1%的未知杂质,满足研究需求。
4 結论
本研究通过液相色谱-串联质谱技术对注射用头孢呋辛钠中4个未知降解杂质进行分析,推导其结构及生成机理,可为注射用头孢呋辛钠质量标准的制订和质量控制提供一定的借鉴意义。
参 考 文 献
Wozniak T J, Hicks J R. Analytical profile of cefuroxime sodium[J]. Anal Profiles Drug Subst, 1991, 20: 209-236.
黄莹, 杨仪雪, 王叶茹. 注射用头孢呋辛钠质量统计分析[C]. 中国药学会第四届药物检测质量管理学术研讨会, 2017: 124-128.
李宏亮, 闵巍, 郑磊, 等. 超高效液相色谱-串联质谱测定尿中14种β-内酰胺类抗生素残留[J]. 实用预防医学, 2021, 28(10): 1194-1197.
陈志谦, 钟昌平, 陆齐泉, 等. 高效液相色谱-四极杆飞行时间质谱法鉴定头孢他啶原料药的有关物质[J]. 中国医院药学杂志, 2021, 41(12): 1219-1228.
朱峰, 杨贵方, 杨波, 等. 基于LCMS-IT-TOF技术分析注射用头孢美唑钠有关物质及其质谱裂解规律[J]. 中国处方药, 2019, 17(8): 1-4.
国家药典委员会. 中华人民共和国药典[S].(2020年版二部). 北京: 中国医药科技出版社, 2020: 734.
Liu C, Hai W, Jiang Y, et al. Rapid and simultaneous determination of amoxicillin, penicillin G, and their major metabolites in bovine milk by ultra-high-performance liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B, 2011, 879(7-8): 533-540.
Blaha J M, Knevel A M, Kessler D P, et al. Kinetic analysis of penicillin degradation in acidic media[J]. J Pharm Sci, 1976, 65(8): 1165-1170.
McCarrick T A, McLafferty F W. Penicillin hydrolysis: A kinetic study of a multistep, multiproduct reaction[J]. J Chem Educ, 1984, 61(5): 463-464.
美国药典委员会. 美国药典(第43版)[S]. 国家处方集, 2020: 827.
美国药典委员会. 美国药典(第43版)[S]. 国家处方集, 2020: 822.
Okamoto Y, Itoh K, Namiki Y, et al. Method development for the determination of cefdinir and its related substances by high performance liquid chromatography[J]. J Pharm Biomed Anal, 1996, 14(6): 739-748.
Okamoto Y, Kiriyama K, Namiki Y, et al. Degradation kinetics and isomerization of cefdinir, a new oral cephalosporin, in aqueous solution. 1[J]. J Pharm Sci, 1996, 85(9): 976-983.
Nishino I, Fujitomo H, Umeda T. Determination of a new oral cephalosporin, cefmatilen hydrochloride hydrate, and its seven metabolites in human and animal plasma and urine by coupled systems of ion-exchange and reversed-phase high-performance liquid chromatography[J]. J Chromatogr B, 2000, 749(1): 101-110.
Sivakumar B, Parthasarathy K, Murugan R, et al. Isolation and characterisation of degradation impurities in the cefazolin sodium drug substance[J]. Sci Pharm, 2013, 81(4): 933-950.
Kessler D P, Cushman M, Ghebre-Sellassie I, et al. Investigation of a proposed penicillin G acidic degradation scheme using high pressure liquid chromatography and optimization techniques and mechanistic considerations[J]. J Chem Soc Perkin Trans 2, 1983, 15: 1699-1703.
刘洪祥, 王静, 曹晓云, 等. 二维超高效液相色谱质谱联用技术测定注射用头孢替唑钠的杂质谱[J]. 中国医药工业杂, 2019, 50(5): 559-564.
作者简介:谭胜连,男,生于1964年,硕士,高级工程师,主要从事化学药开发工作,E-mail: TSL801@163.com
