可溶性ST2对急性心肌梗死患者短期心功能及预后的评价价值
2023-04-12王腾叶斐
王腾 叶斐
[摘 要] 目的:探讨血清可溶性生长刺激表达基因2蛋白(growth stimulating expression gene 2,ST2)水平对急性心肌梗死(acute myocardial infarction,AMI)患者短期内心功能及预后的评价价值。方法:首发AMI患者119例,根据血清sST2水平分为三组,A组(39例):sST2≤35 ng/mL,B组(45例):35 ng/mL<sST2<100.16 ng/mL,C组(35例):sST2≥100.16 ng/mL。比较三组基线资料、心功能指标以及30天内主要心血管不良事件(major adverse cardiovascular events,MACE)发生率。结果:三组hs-CRP[C组(16.35±17.24 mg/L)>B组(10.26±11.87 mg/L)>A组(7.22±8.28 mg/L)]、NT-proBNP[C组(2 529.54±3 353.35 pg/mL)>B组(1 293.96±1 400.48 pg/mL)>A组(751.31±1 028.92 pg/m)]水平依次升高,左室射血分数(LVEF)[C组(52.09±9.25)%<B组(56.13±8.97)%<A组(60.08±8.61)%]依次降低,差异均具有统计学意义(P<0.05)。sST2水平与NT-proBNP水平呈正相关(r=0.418,P<0.001)。发生的MACE主要为新发心力衰竭,MACE发生率C组(28.6%)>B组(11.1%)>A组(7.7%),差异有统计学意义(P<0.05)。结论:血清sST2水平对AMI患者短期心功能及预后评价具有重要参考价值。
[关键词] 血清可溶性生长刺激表达基因2蛋白;急性心肌梗死;心功能;预后
[中图分类号] R542.2+2 [文献标志码] B [DOI] 10.19767/j.cnki.32-1412.2023.06.004
急性心肌梗死(acute myocardial infarction,AMI)严重威胁人类生命健康,致死及致残率高,据统计从2002年起我国AMI死亡率持续上升[1],发病呈年轻化趋势。AMI急性期易发生心律失常、急性心力衰竭、心源性休克、心脏破裂等并发症。目前经皮冠状动脉介入已成为AMI治疗的主要手段,但仍有许多患者出现心功能障碍。如何寻找更多指标协助判断患者预后,指导合理治疗及日常护理,具有重要意义。生长刺激表达基因2蛋白(growth stimulating expression gene 2,ST2)是白介素1(IL-1)受体家族成员之一,主要包括跨模型ST2(trans-membrane ST2,ST2L)和可溶性ST2(soluble ST2,sST2),其配体为IL-33,sST2竞争性与IL-33结合,阻断ST2L与IL-33结合,从而削弱ST2L/IL-33信号通路对心血管系统的保护作用。AMI后心肌受到过度机械负荷生成大量sST2,从而加重心室重构及心室功能障碍[2]。本文选取2022年1月—2023年1月于我院心血管内科住院治疗的119例首發AMI患者,研究sST2水平与左心功能及主要心血管不良事件(major adverse cardiovascular events,MACE)的相关性,探讨sST2水平预测AMI患者预后的价值。
1 资料与方法
1.1 一般资料 首发AMI患者119例,符合AMI诊断标准[3]:近期出现急性心肌损伤证据(血清肌钙蛋白增高),同时伴有急性心肌缺血的临床证据,主要包括:(1)急性心肌缺血症状,如胸痛;(2)新的缺血性心电图改变;(3)新发病理性Q波;(4)新的影像学证据如室壁节段运动异常。所有入选患者均行冠脉造影术检查,确诊为AMI。排除标准:(1)既往有心肌梗死病史;(2)既往有严重心功能不全病史或其他类型心肌病;(3)无法耐受抗血小板药物以及他汀类药物等AMI常规治疗者;(4)合并感染、严重肝肾疾病、恶性肿瘤、呼吸疾病、血液病及自身免疫疾病患者。根据患者血清sST2水平分组,A组(39例):血清sST2≤35 ng/mL,处于正常值范围;B组(45例):35 ng/mL<血清sST2<100.16 ng/mL;C组(35例):血清sST2≥100.16 ng/mL。
1.2 实验室及心功能检查 入院后抽取患者静脉血,检测肾功能、N端脑钠肽前体(NT-proBNP)、超敏C反应蛋白(hs-CRP)、血脂、sST2等指标。血清sST2检测:采用m-20型微点干式荧光免疫分析仪,微流控免疫荧光法检测,严格按照试剂盒(深圳微点生物技术公司)说明书操作。心功能检查:患者出院前作超声心动图检查,记录左心室舒张末内径(LVEDD)、收缩末内径(LVESD)、左房内径(LAD)、左室射血分数(LVEF)。
1.3 随访 患者出院后随访30天,主要采取门诊随访,了解患者一般情况、必要的辅助检查结果以及MACE(死亡、心源性休克、心力衰竭、再发心肌梗死、恶性心律失常等)发生。
1.4 统计学处理 应用SPSS 22.0统计学软件进行数据分析处理。计量资料以x±s表示,组间比较采用单因素方差分析;计数资料以频数和率表示,组间比较采用χ2检验;相关性分析采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结 果
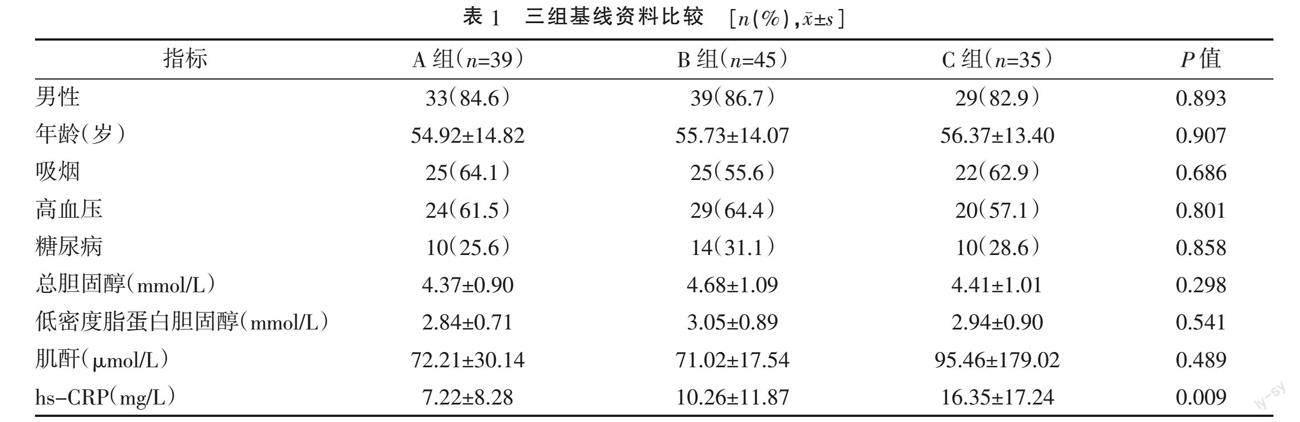
2.1 三组基线资料比较 三组患者性别、年龄、吸烟、高血压、糖尿病、总胆固醇、低密度脂蛋白胆固醇、肌酐水平比较,差异均无统计学意义(P>0.05)。三组间hs-CRP水平的差异有统计学意义(P<0.05),hs-CRP水平C组>B组>A组,A组与C组、B组与C组间的差异均有统计学意义(P<0.05)。见表1。
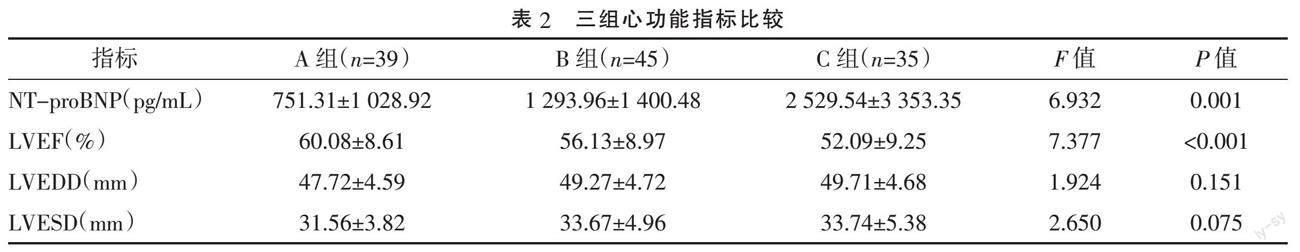
2.2 三组心功能相关指标比较 三组间NT-proBNP水平的差异有统计学意义(P=0.001),C组>B组>A组,各组间两两比较,差异均有统计学意义(P<0.05)。三组间LVEF的差异有统计学意义(P<0.001),C组<B组<A组,各组间两两比较,差异均有统计学意义(P<0.05)。三组间LVEDD及LVESD比较,差异均无统计学意义(P>0.05)。见表2。sST2水平与NT-proBNP水平呈正相关(r=0.418,P<0.001)。
2.3 三组MACE比较 随访30天,A组发生MACE
3例(7.7%),均为新发心力衰竭,B组发生MACE 5例(11.1%),其中新发心力衰竭4例,死亡1例,该死亡病例为高龄女性患者,死因为多脏器功能衰竭。C组发生MACE 10例(28.6%),均为新发心力衰竭。三组间MACE发生率比较,差异有统计学意义(P=0.028)。
3 讨 论
AMI常常由于冠状动脉内粥样硬化斑块进展,出现斑块破裂或侵蚀,冠状动脉血栓形成阻塞血流而引起。AMI局部心肌坏死,进而形成瘢痕组织,丧失收缩能力,影响心功能。目前临床常采用心功能分级、超声心动图、NT-proBNP等评估患者心功能及预后情况。sST2作为新型心脏标志物,对心功能评估具有一定价值。心肌梗死发生后,心室壁受机械牵拉以及内分泌和炎症因子刺激,心肌细胞sST2表达增加,竞争性结合IL-33,阻断ST2L与IL-33结合,从而抑制ST2L对心脏的保护及抗重塑作用[4]。
利钠肽系统是目前心血管领域广泛应用的生物标志物,是诊断心力衰竭的理想标志物[5]。WANG等[6]对180例行冠脉介入术的AMI患者进行研究,认为患者血清sST2水平与NT-proBNP水平相关,sST2可用于心衰诊断。在本研究中ABC三组sST2水平依次递增,同时NT-proBNP水平也依次递增,二者正相关,与WANG等[6]研究结果一致。年龄、种族、体重、高血压、既往心肌梗死、既往心力衰竭、肾功能等因素对sST2的影响较小,而NT-proBNP易受这些因素的影响,因此对肾功能异常患者或老年患者,NT-proBNP水平常不能准确反映心功能状况。有研究指出,sST2与NT-proBNP联合应用有助于对AMI患者进行危险分层,提高心血管死亡风险预测的准确性[7-8]。本研究中三组hs-CRP与sST2水平同步升高,提示sST2可能与炎症有关,有研究指出C-反应蛋白和sST2是慢性心力衰竭患者短期死亡率的预测因子[9]。
WEIR等[10]一项研究纳入100例左室收缩功能障碍(LVEF<40%)的AMI患者,发现无论在基线还是24周时,sST2与LVEF均呈负相关。MI?譙ANA等[11]对109例首发AMI患者的研究也得出类似结论。本研究中三组患者LVEF随sST2水平的升高而降低,差异具有统计学意义,与上述研究结果相似。
一项纳入1 401例AMI的研究收集患者近十年的sST2资料,并进行5年随访,结果显示sST2水平越高,心力衰竭及死亡的风险越高,且不受其他预测指标的影响[12]。CHEN等[13]招募250例患者,结果显示高sST2水平是任何MACE发生的风险预测因素。本研究随访30天,期间共发生MACE18例(15.1%),主要为新发心力衰竭。MACE发生率C组(28.6%)>B组(11.1%)>A组(7.7%),差异有统计学意义(P=0.028)。提示sST2水平越高,MACE发生率越高,sST2水平可预示AMI患者近期发生心力衰竭等事件的风险。
[参考文献]
[1] 《中国心血管健康与疾病报告》编写组. 《中国心血管健康与疾病报告2021》概述[J]. 中国心血管病研究,2022,20(7):577-596.
[2] CICCONE M M,CORTESE F,GESUALDO M,et al. A novel cardiac bio-marker: ST2: a review[J]. Molecules,2013,18(12):15314-15328.
[3] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会. 急性ST段抬高型心肌梗死诊断和治疗指南(2019)[J]. 中华心血管病杂志,2019,47(10):766-783.
[4] 張文婧,郭文玲. IL-33/ST2通路在心血管疾病中作用及机制的研究进展[J]. 中西医结合心脑血管病杂志,2022,20(20):3724-3726.
[5] SAVARIMUTHU S,GOEL P,HARKY A. Soluble ST2: a valuable prognostic marker in heart failure[J]. Heart Fail Rev,2022,27(6): 2155-2164.
[6] WANG Y P,WANG J H,WANG X L,et al. Roles of ST2,IL-33 and BNP in predicting major adverse cardiovascular events in acute myocardial infarction after percutaneous coronary intervention[J]. J Cell Mol Med,2017,21(11): 2677-2684.
[7] SABATINE M S,MORROW D A,HIGGINS L J,et al. Complementary roles for biomarkers of biomechanical strain ST2 and N-terminal prohormone B-type natriuretic peptide in patients with ST-elevation myocardial infarction[J]. Circulation,2008,117(15):1936-1944.
[8] ZAGIDULLIN N,MOTLOCH L J,GAREEVA D,et al. Combining novel biomarkers for risk stratification of two-year cardiovascular mortality in patients with ST-elevation myocardial infarction[J]. J Clin Med,2020,9(2):550.
[9] KUSTER N,HUET F,DUPUY A M,et al. Multimarker approach including CRP,sST2 and GDF-15 for prognostic stratification in stable heart failure[J]. ESC Heart Fail,2020,
7(5):2230-2239.
[10] WEIR R A,MILLER A M,MURPHY G E,et al. Serum soluble ST2: a potential novel mediator in left ventricular and infarct remodeling after acute myocardial infarction[J]. J Am Coll Cardiol,2010,55(3):243-250 .
[11] MI?譙ANA G,N■?譙EZ J,BAY?魪S-GEN?魱S A,et al. ST2 and left ventricular remodeling after ST-segment elevation myocardial infarction: A cardiac magnetic resonance study[J]. Int J Cardiol,2018,270:336-342 .
[12] JENKINS W S,ROGER V L,JAFFE A S,et al. Prognostic value of soluble ST2 after myocardial infarction: A community perspective[J]. Am J Med,2017,130(9):1112.e9-e15.
[13] CHEN D,UNTARU R,STAVROPOULOU G,et al. Elevated Soluble Suppressor of Tumorigenicity 2 Predict Hospital Admissions Due to Major Adverse Cardiovascular Events (MACE)[J]. J Clin Med,2023,12(8):2790.
[收稿日期] 2023-07-07
(本文編辑 缪宏建)
