基于“微生物-肠-脑”轴的肠道菌群参与抑郁症相关研究进展
2023-04-06徐珒昭马岩石王丹萍张旭研杨晓莹于雁松马隆凯汤梦琪许晓曦
徐珒昭,马岩石,王丹萍,张旭研,杨晓莹,于雁松,马隆凯,汤梦琪,许晓曦*
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
抑郁症是一种精神障碍疾病,以显著且持久的兴趣缺失、情绪低落、意识活动减退和躯体异常等症状为主要临床特征,严重影响了人类生活品质和社会稳定。在当前社会竞争激烈和生活节奏加快的背景下,心理及生理压力的过度积累已成为常态,威胁人类健康的主要疾病有向情感精神障碍性疾病转变的趋势。目前,全球抑郁症的总患病人数约为3.5 亿,占世界人口的4.4%[1]。此外,自2019年以来,包括新型冠状病毒在内的流行性疾病严重影响了人们的生活习惯和心理健康状况,对于相关疾病问题所带来的担忧和压力导致抑郁症和焦虑症的患病率更高[2]。
现代生物学认为,抑郁症不仅是一种心理疾病,更是一种普遍由遗传基因和环境应激的累积效应引起的生理疾病。随着对抑郁症发病机制和肠道菌群两个方向研究的深入,发现大部分神经系统疾病与肠道菌群稳态之间存在着密切的相关性,肠道菌群对脑功能、神经发育有重要意义[3-4]。肠道微生物能直接或间接通过内分泌系统、免疫反应和肠道神经系统等途径与大脑相互作用,对宿主的应激反应、焦虑、抑郁和认知功能产生重要影响[5-6]。因此,通过肠道微生物,抑郁症、自闭症谱系障碍、双相障碍和精神分裂症等神经系统疾病都有可能探寻到新的防治方法。目前抑郁症的治疗方法仍存在许多副作用和实施限制,治疗效果和患者配合度不尽人意。而益生菌作为近年来较受关注的功能食品组分,在改善人体健康方面应用前景广阔。本文主要综述抑郁症发病机制与肠道微生物菌群之间的联系,并展望基于肠道菌群调节抑郁症的可行性,以期为通过“微生物-肠-脑(microbe-gut-brain,MGB)”轴途径治疗抑郁症提供参考。
1 肠道菌群与抑郁症
肠道菌群是寄居于人体肠道内的全部微生物群落组成,通过长期与人类协同进化,庞大的微生物群体参与宿主代谢、能量调节、免疫发育等各项人体生命活动中,相当于后天的“器官”[7]。在个体成长过程中肠道菌群保持动态发展,受先天遗传基因、宿主生活地理位置和环境因素等影响最终出现不同的菌群组成表型[8-9]。上述研究表明,抑郁症与肠道菌群之间存在密切的联系。
1.1 抑郁患者肠道菌群特征
抑郁症与肠道菌群丰富度和多样性的改变密不可分。在健康人群中,拟杆菌门与厚壁菌门是最主要的优势菌门,其他菌门丰度占比较小,不同菌群之间保持相对比例的动态平衡以维持肠道正常功能[10-11]。与正常人相比,抑郁症患者的肠道微生物丰富度和多样性显著降低,通常表现为门水平中厚壁菌门比例下降,拟杆菌门、变形菌门与放线菌门比例上升;科水平中毛螺菌科与瘤胃菌科等下降;属水平中粪杆菌属、瘤胃球菌属、乳酸杆菌属和双歧杆菌属丰度下降[12-13]。即使存在部分研究可能由于实验条件或实验对象等的差异在菌群变化上有所出入,但是普遍共识是抑郁患者菌群组成与健康患者明显不同。
同样,抑郁症动物模型中肠道菌群的变化也有发现。慢性温和不可预见性刺激(chronic unpredictable mild stress,CUMS)诱导的抑郁小鼠肠道菌群表现出棒状菌属、嗜冷杆菌属、乳酸杆菌属和粪球菌属相对丰度降低[14-15]。而习得性无助动物抑郁模型会降低如乳酸菌和梭状芽孢杆菌等细菌的相对丰度[16]。此外,在断乳孤养模型、双侧嗅球切除模型和社会失败模型等动物肠道内也均有相似发现,小鼠表现出社会回避和快感缺乏等典型抑郁样行为,伴随肠道菌群变化:厚壁菌门数量减少,拟杆菌门与厚壁菌门丰度比值增加[17-18]。这些研究在揭示抑郁个体肠道菌群与健康个体存在差异现象的同时,也为肠道菌群在抑郁发生发展过程中的变化提供了证据。
1.2 肠稳态劣变诱导抑郁症易感
肠道环境稳态异常变化会导致抑郁症发生概率增加。持续的焦虑和抑郁症状在炎症性肠病(inflammatory bowel disease,IBD)患者中非常普遍,肠道炎症过程中促炎细胞因子分泌增加会直接或间接地影响大脑,从而加剧抑郁症状[19]。在最近的一项关于抑郁与IBD共病的系统综述中,IBD患者中焦虑和抑郁的合并患病率分别为19.1%和21.2%[20]。而对于肥胖个体,肠道通透性增加、肠道免疫细胞群炎症变化及肠道微生物菌群变化也是普遍存在的,因而肥胖人群的抑郁症发病率也高于正常体质量人群[21]。多项研究发现,将MDD患者或快感缺失的抑郁小鼠粪便菌群移植(fecal microbiota transplantation,FMT)到无菌小鼠体内时,受体小鼠会表现出如蔗糖水偏好度下降、悬尾实验和强迫游泳时间延长等抑郁样行为和抑郁样病症[22-23]。但如果接受MDD患者来源的FMT后,再对受体动物进行一次健康人源FMT则会显著改善动物抑郁症状[5,24]。这说明肠道微生物失调会导致焦虑或抑郁易感性的增加和神经功能的缺陷障碍等问题,这为证明肠道菌群在抑郁症中发挥关键作用提供了强有力的证据。
1.3 抗抑郁药物对肠道菌群的影响
抗抑郁药物进入人体后对肠道菌群的影响也有报道,抗抑郁药不仅可以通过调节神经递质等方式发挥作用,还会影响抑郁患者的肠道菌群结构。应激是抑郁症的重要致病因素,会导致肠道内微生物多样性降低、菌群网络简化以及致病菌(如大肠杆菌、志贺氏菌)和条件致病菌(如肠球菌)的丰度增加[25-26]。而许多抗抑郁药最初都是作为抗菌剂使用,但这往往会直接或间接地影响肠道生态,导致菌群的结构失调[1]。例如,经典的抗抑郁药依他普仑被发现对大肠杆菌和乳酸杆菌具有抗菌活性[27]。此外,异丙烟肼在肺结核患者体内用作抗生素使用时因被发现可以抑制单胺类神经递质氧化而被推广,还有氯胺酮对金黄色葡萄球菌、假单胞菌、白色念球菌和粪肠球菌等也具有抗菌作用[28-29]。研究显示,抗抑郁药氟西汀给药会破坏肠道环境的稳定性,上调如另枝菌属和梭状芽孢杆菌等某些微生物群落丰度,导致炎症和有毒次级胆汁酸的产生[30-31]。目前,抗抑郁药在使用过程中往往忽视其对肠道微生态的影响,这也可能是造成负面临床副作用的原因。
2 “微生物-肠-脑轴”:肠道菌群参与抑郁症发病
肠道与大脑之间信息交流的关键交互节点位于中枢神经系统与肠神经(enteric nervous system,ENS)系统,ENS网络遍布肠道,感受来自肠腔的生物、机械及环境作用等刺激信号,将感受信号转换成神经信号、激素信号和免疫信号,与中枢神经系统双向沟通调节机体代谢平衡[22,32]。寄生在肠道内的微生物群可以与肠道细胞作用,刺激分泌神经递质或激素影响大脑和行为,同时,微生物及其代谢产物可以通过ENS系统间接影响中枢神经系统[12,16]。另一方面,中枢神经系统可以通过影响肾上腺素能神经信号、调节肠道运动及肠道内分泌等方式调节微生物群组成和功能[23]。
由于肠道内微生物在调节肠-脑通信中起重要作用,MGB轴概念进入人们视野。这是一个由肠道菌群、菌群代谢物、肠道细胞、多级神经系统、肠激素以及神经体液通路组成的复杂神经体液交互网络[33]。随着现代医学的发展,抑郁症的病理机制逐渐清晰,主要生理学因素包括大脑功能障碍(神经递质失衡、神经可塑性降低)、“下丘脑-垂体-肾上腺(hypothalamic-pituitaryadrenal,HPA)”轴功能异常(负反馈机制障碍)、免疫功能异常(机体炎症)及脑-肠功能异常(胃肠道功能失调、肠道稳态失衡)[10,15,22]。有研究从多个方面支持了肠道微生物通过MGB轴参与抑郁症发生发展过程这一观点,这也表明从肠道微生物角度研究抑郁症发病可能会提供不同的认识[12,22-23]。
2.1 神经递质系统紊乱
“单胺假说”是抑郁症的发病机制研究的主要观点,单胺类神经递质的缺乏或功能降低被认为是抑郁症的生物学基础[34]。单胺类神经递质是神经系统内传导信号的物质,参与调节体温、认知功能、记忆力、情绪反应等相关神经系统的生理功能。临床上发现抑郁症患者脑区表现包括5-羟色胺(5-hydroxytryptamine,5-HT)、去甲肾上腺素(norepinephrine,NE)、多巴胺(dopamine,DA)等单胺类递质的缺失,同时,目前大多数抗抑郁药物的机制也均是以增加突触结构中单胺类神经递质水平为基础[35]。
以5-HT为例,其是重要的中枢神经递质,与人类情绪和行为反应的调节及认知功能有关,同时也是ENS功能和胃肠道功能的关键调控因子[36]。人体中90%以上的5-HT合成和分布自肠道中的肠嗜铬细胞,肠道内色氨酸(5-HT合成前体)主要通过5-HT合成途径和犬尿酸(kynurenic acid,Kyn)途径代谢消耗[37]。研究发现,肠道微生物失调会显著影响宿主色氨酸代谢,从而促进脑组织中Kyn代替5-HT合成,导致5-HT严重消耗,而Kyn还能导致喹啉酸和3-羟基犬尿氨酸等代谢物产生进一步损伤神经元,证实肠道微生物可以通过影响5-HT代谢进而参与抑郁症等精神疾病的发生[38-39]。肠道微生物的改变对宿主脑部的5-HT系统具有显著影响,将无菌小鼠置换到正常小鼠生活环境中后,无菌小鼠血浆中5-HT前体色氨酸水平和海马中5-HT受体表达量均显著增加[40]。许多研究已发现补充益生菌能通过改善肠道通透性、抑制炎症反应或直接影响5-HT代谢途径。肠道微生物,如罗斯氏菌、布劳特氏菌、及梭状芽孢杆菌等,能够以碳水化合物为底物发酵并分泌短链脂肪酸(short-chain fatty acids,SCFAs),进而刺激肠道嗜铬细胞的5-HT合成[41-42]。双歧杆菌通过降低大鼠额叶皮质中的5-羟基吲哚乙酸(5-hydroxyindole acetic acid,5-HIAA)和杏仁皮质中的二羟基苯乙酸(3,4-dihydroxyphenylacetic acid,DOPAC)浓度从而具有抗抑郁特性[43]。
除5-HT以外,DA在机体内主要与情绪、快感、运动功能和成瘾性等有关。NE是DA经酪氨酸羟化酶羟化作用后生成的交感神经节后纤维的神经递质,研究显示,肠道中梭状芽孢杆菌的代谢物4-甲酚和4-羟基苯乙酸可以抑制多巴胺羟化酶将DA转化为NE的过程,进而影响MGB轴[3]。此外,也有研究报道,粪肠球菌可以将DA的前体L-多巴转化为DA,并且能够通过该途径影响宿主中枢神经系统和免疫系统功能[44]。
2.2 神经可塑性失调
抑郁症往往伴随神经可塑性的失调,大脑和外周神经系统广泛存在的神经营养因子在抑郁症的病理过程中发挥了重要的作用。神经可塑性即神经系统的外周适应和反应能力,包括神经发生、神经元重塑及突触结构建立等神经网络复杂作用的过程[32]。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是最主要的神经营养因子之一,在神经发生、神经结构生长和重塑以及神经冲动的传递过程中十分重要,其功能异常易导致抑郁症,常被视为抑郁症的外周生物标志物[45]。进行生物学作用时,BDNF先与原肌球蛋白受体激酶B(tyrosine kinase receptor B,TrkB)结合,刺激下游信号通路激活,然后完成cAMP反应元件结合蛋白(cAMP response element binding protein,CREB)的激活和磷酸化[32,45]。临床试验结果显示,在MDD症患者脑组织和血清中BDNF水平显著减少,抗抑郁药物、电休克治疗可增加脑内BDNF含量,提高突触可塑性促进神经元生存,从而产生抗抑郁作用[46]。
随着神经科学的研究发展,肠道菌群对神经系统发育的影响被大量报道。肠道微生物与BDNF之间通过迷走神经相互影响,菌群变化通过肠外周神经和迷走神经传入大脑进而影响BDNF的生产与传递[7]。研究发现,将小鼠膈下迷走神经切断后,迷走神经切除后海马区BDNF的mRNA表达降低[47]。此外,无菌小鼠与正常小鼠在受到外界刺激时,大脑皮层和海马体中BDNF含量差异十分显著,说明肠道菌群在应激反应过程中对神经网络具有介导调控作用[48]。
2.3 下丘脑-垂体-肾上腺轴功能异常
HPA轴的过度激活参与抑郁症的发病已被许多研究证实。临床研究中发现,在抑郁患者体内HPA轴异常广泛存在,而恢复健康后能观察到HPA轴功能明显改善[7,49]。当机体受到外界刺激,下丘脑合成并释放促肾上腺素激素释放因子(corticotropin releasing hormone,CRH),促进促肾上腺素皮质激素(adrenocorticotropic hormone,ACTH)从垂体分泌,继而刺激肾上腺皮质分泌糖皮质激素(glucocorticoid,GC),GC同时又能进行负反馈调节,调控CRH和ACTH合成与释放[22,25]。临床上利用药物增加糖皮质激素受体敏感度降低GC抵抗,激活修正HPA轴的双向反馈,抑制HPA轴亢进,最终改善患者抑郁症[49]。海马体作为HPA轴的调控中心,在HPA轴功能亢进时GC水平过高会引起海马体神经元损伤,而损伤的海马体又会反向扩大HPA轴功能的异常活跃,引发情绪低落、兴趣丧失和睡眠障碍等抑郁症症状[15,50]。
肠道微生物与HPA轴的关系已被大量研究证实,HPA轴的正常发育离不开肠道菌群。对比无菌(germ free,GF)和无特定病原体(specific pathogen free,SPF)小鼠遭受刺激时HPA轴的不同反应,GF小鼠会表现出更严重的焦虑行为,并且ACTH及皮质酮(corticosterone,CORT)分泌量比SPF小鼠显著增加,很好的证明了HPA轴机制与肠道菌群的联系[15,48]。而对幼年无菌小鼠进行FMT后,肠道内无菌环境导致的HPA轴功能障碍均能得到有效恢复,这体现出肠道微生物对HPA轴功能发育的重要作用[48]。研究表明,对于应激压力导致的HPA轴功能障碍,服用益生菌能显著改善HPA轴激素系统不良状况[51]。
2.4 免疫炎症与屏障渗漏
MDD患者常表现为全身免疫活化或炎症系统分泌紊乱,长期以来,炎症和免疫功能改变一直被认为是抑郁症的重要致病因素。在情绪低落或压力人群中能检测出高于健康人的促炎细胞因子水平,炎症细胞因子会抑制HPA轴负反馈机制正常功能,导致过多皮质醇产生,造成抑郁情绪的出现[5,32]。同时,持续高炎症水平可进一步引起机体神经内分泌系统和免疫功能紊乱,增加抑郁症发病风险[17]。研究显示,个体水平的促炎细胞因子含量增多会破坏5-HT、NE等神经递质的合成和信号转导而引发抑郁样症状[52]。肠道菌群在宿主免疫系统的发育和成熟过程中的重要作用已众所周知,菌群失调与免疫反应密切相关。研究人员发现,分离母体抑郁模型中,动物不仅表现出类似抑郁的行为,而且促炎细胞因子的水平也增加,然而,这些改变在婴儿双歧杆菌干预后恢复到正常水平[53]。另一随机临床试验结果也表明,炎性细胞因子拮抗剂可以减轻炎症生物标志物基线水平较高的患者的抑郁症状,说明了免疫炎症与抑郁症之间的联系[54]。
正常情况下,肠屏障与血脑屏障可以阻止肠道内菌群有害代谢物、腔内抗原和毒素等进入循环系统,而压力和不健康饮食等因素会破坏肠道菌群组成和屏障的完整性,导致“渗漏”使肠腔内有害成分发生易位[8]。抑郁症患者血清中能检测到多种高于正常水平的具有促炎倾向的肠道菌群代谢物,包括脂多糖(lipopolysaccharide,LPS)、LPS结合蛋白、抗内毒素抗体等[13]。LPS是一种革兰氏阴性菌来源的促炎成分,进入血液循环后可激活上皮细胞Toll样受体(toll-like receptor,TLR)4,核因子κB(nuclear factor kappa-B,NF-κB)和丝裂原活化蛋白激酶进而诱导多种促炎细胞因子释放,引发系统性炎症的联级反应[55]。据报道,LPS能诱导小鼠持续的焦虑抑郁行为,增加下丘脑室旁核TLR4的表达,而补充益生菌能降低小鼠炎症反应,改善LPS导致的肠道菌群结构和行为异常[56]。肠道菌群与肠屏障通透性密切相关,遍布肠道内壁的致密共生菌能够调节宿主肠道上皮细胞活性,并且通过生物膜或竞争结合等方式抵御病原体[3]。有研究发现,混合益生菌能够增强屏障功能,降低肠渗漏导致的机体炎症反应并减轻以紧密连接成分表达减少为特征的肠屏障功能障碍,同时可以调整肠道微生物区系的组成[57]。
3 基于肠道微生态干预应对抑郁症的新方法
3.1 传统的抑郁症治疗手段
抑郁症的临床治疗手段主要包括药物治疗、心理治疗和物理治疗。药物治疗是当前最主要的治疗方式,但临床应用中普遍存在副作用,包括心律失常、视觉损伤、头晕失眠、身体震颤及镇静过度等[24,58]。心理治疗中是临床中普遍使用的辅助治疗手段,但在实际操作中往往由于专业门槛高、操作者数量少等问题,极大程度限制了心理治疗的实施和发展[59]。此外,物理治疗如电抽搐治疗和经颅磁刺激技术等一般与药物治疗同时采用,此类治疗方法起效快、效果好,但仍有一定的脑损伤和认知功能损伤等风险,故治疗前应仔细斟酌考虑[29,60]。据调查,抗抑郁药治愈率仅为30%,几乎80%的抑郁症患者会至少复发一次,并且复发率随年龄增长而升高[47,60]。在临床治疗过程中,抑郁症患者的治疗主动性偏低,患者往往伴随着较差依从性和强烈的羞耻感,且仍有许多患者在治疗结束后仍有残留症状[61]。因此,目前抑郁症的治疗仍然是人们面临的巨大难题。
3.2 益生菌介导调控肠道菌群在防治抑郁症方面的应用
传统的抑郁症治疗方法难以顾及抑郁症多系统多方面间交互作用的发病机制,存在副作用大、易复发、治疗流程长、适用范围窄等缺点。MGB轴功能失调与神经精神疾病的发生发展直接相关已被广泛证明[5],可否通过阻碍、延缓或逆转这一过程来达到预防、改善和治疗抑郁症的效果受到广泛关注。如图1所示,随着研究深入,人们发现益生菌及其代谢产物能有效作用于抑郁症发生发展过程,通过调节神经递质系统、参与作用免疫途径、刺激肠神经系统和平衡肠道微生态等多种途径,有助于改善和维持宿主良好的生理及心理状态,因此,益生菌干预目前被认为是一种有潜力、有效果、安全可靠的预防和改善抑郁症的措施。对于益生菌通过调控肠道菌群在防治抑郁症的应用,下面主要从活菌形式益生菌、灭活菌形式益生菌及功能性代谢物3 个方面介绍。
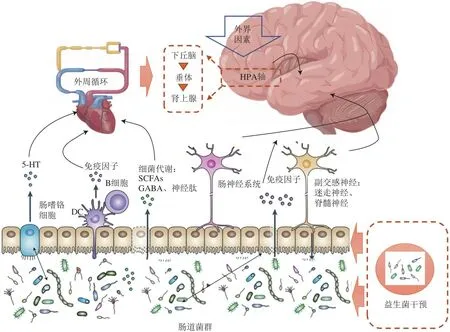
图1 益生菌通过MGB轴防治抑郁症Fig.1 Probiotics intervene in depression through the MGB axis
3.2.1 活菌形式的益生菌
益生菌被定义为能定植于宿主肠道并对机体产生有益作用的活性微生物,在此基础上,对宿主具有精神健康益处的微生物被称为“精神益生菌”。活菌形式益生菌干预对宿主抑郁症状有显著改善效果,可能通过神经免疫、神经激素调节、神经发育及信号传导等途径发挥作用。如表1所示,许多研究均能证明活菌形式益生菌对抑郁症的有效作用。在一项以健康受试者为对象的实验中,补充干预多种益生菌的组合物4 周后,健康受试者对悲伤情绪的整体认知反应显著降低,提示益生菌补充剂可作为一种抑郁预防策略[62]。这种效果在抑郁症动物模型中也得到进一步验证,如丁酸梭菌能够通过刺激肠道胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)分泌、激活大脑GLP-1受体和促进BDNF分泌等途径显著改善动物抑郁行为[63];植物乳杆菌PS128可以提升脑部纹状体内血清素和DA等神经递质水平,每天摄入PS128有助于改善神经精神障碍[64];长双歧杆菌1714干预4 周后可以显著减轻健康受试者压力,并通过增强前额叶皮层活动改善记忆力[65]。另有研究发现,高脂饮食个体的常态化全身炎症会导致抑郁症患病率增加,假小链双歧杆菌CECT 7765能逆转由高脂饮食肥胖导致的HPA继发性变化及动物的抑郁样行为,并能恢复动物神经递质和免疫系统功能至正常水平[26]。而对于健康小鼠,补充婴儿双歧杆菌35624可以显著降低机体炎症水平,同时具有改善神经递质系统及色氨酸代谢途径的功效[43]。
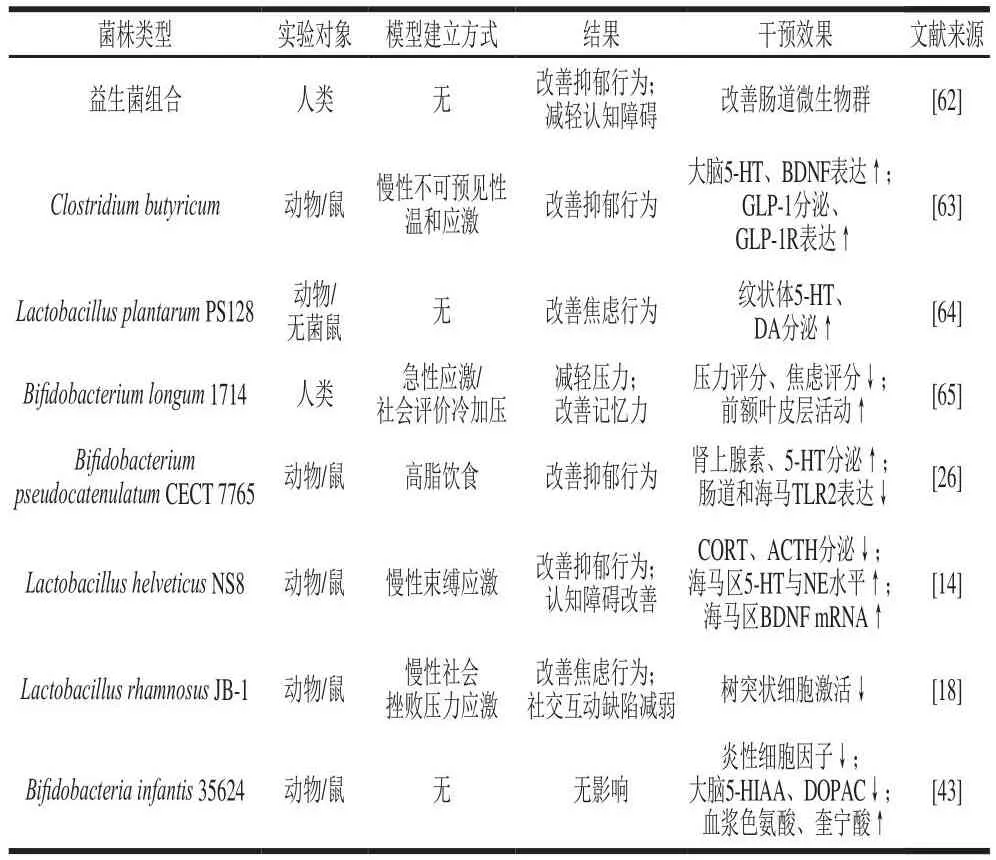
表1 活菌形式益生菌对抑郁症干预效果的相关研究Table 1 Recent studies on live probiotics in improving depression
3.2.2 灭活形式的益生菌
灭活益生菌是通过灭活技术处理有益菌,获得的无生命但仍对人体健康有益的微生物及其成分制剂。灭活益生菌或灭活菌胞内组分也同样被指出具有抗抑郁、降低压力的功效,对其在动物与人体中的抗抑郁效果的相关研究已有大量报道(表2)[66-71]。一项对副干酪乳杆菌NK112活菌及热灭活菌的抗抑郁效果研究中,通过对小鼠过量CORT诱导抑郁症模型进行益生菌干预,发现热处理灭活后的NK112仍然能降低海马中CORT含量,并且逆转模型损伤的BDNF、GC及其受体蛋白水平,最终表现为小鼠抑郁样症状改善[66]。粪肠球菌是一种被日本市场认可的功能性乳酸菌,热灭活处理后的粪肠球菌EC-12能减少小鼠的焦虑和抑郁样行为,显著增加神经递质受体基因Adrb3和Avprla的表达,增加肠道中丁酸球菌和肠球菌的相对丰度[67]。另一项对于轻度社会失败应激模型抑郁小鼠的研究中,经热灭活瑞士乳杆菌MCC1848干预后,小鼠在社会互动测试中的交互作用时间和糖水偏好测试中的蔗糖偏好度明显恢复,并且应激诱导的神经系统发育相关基因表达均有改善,提示益生菌胞内成分对抑郁症有一定作用[68]。

表2 灭活形式益生菌对抑郁症干预效果的相关研究Table 2 Recent studies on inactivated probiotics in improving depression
3.2.3 益生菌功能性代谢物
益生菌分泌微生物代谢物是其发挥功能的基本方式,常见的代谢物包括SCFAs、氨基酸代谢物衍生物、胆汁酸代谢物及一些小分子代谢物等。
SCFAs是膳食纤维在盲肠和结肠中被微生物群代谢的最终产物,也是目前研究最广泛的一类微生物代谢物。SCFAs可以通过被动和主动途径进入中枢神经系统,并能穿透细胞膜进入细胞内部,影响神经递质产生、线粒体功能、免疫激活和基因表达的改变等神经系统功能[72]。研究发现,在抑郁症患者伴随的肠道菌群失调中,SCFAs产生菌相对丰度降低的现象十分常见,在粪便和血液中SCFAs含量结果检测也证实了这一点[73]。在Tian Peijun等[74]的研究中,SCFAs靶向递送体系能够实现在大肠中靶向释放SCFAs,这种靶向的肠腔内SCFAs补充能显著改善慢性应激的抑郁小鼠神经生物学状况,并通过促进紧密连接蛋白表达进而维护肠屏障功能,证明SCFAs对抑郁和肠道生态的改善效果。此外,Yamawaki等[75]研究发现,丁酸具有抑制组蛋白去乙酰化的能力,有效缓解了LPS诱导的小鼠抑郁行为,并且增加了前额皮质中BDNF的表达。
许多必需氨基酸可以由肠道菌群代谢产生,氨基酸是微生物生命活动的一类重要代谢产物。在对抑郁症患者肠道内微生物及粪便代谢物与京都基因与基因组百科全书数据库进行氨基酸代谢途径对比发现,抑郁个体“色氨酸代谢”“苯丙氨酸代谢”和“精氨酸、脯氨酸和γ-氨基丁酸代谢”紊乱尤为突出[76]。微生物可以通过代谢产生色氨酸,并能进一步分解成吲哚及吲哚衍生物等芳烃受体(aryl hydrocarbon receptor,AhR)的配体,如罗伊氏乳杆菌能代谢色氨酸产生吲哚-3-乳酸[77]。研究发现,缺乏AhR激动剂的无菌小鼠易受慢性压力的影响,并表现出焦虑和抑郁样[78]。而口服补充色氨酸或能产生AhR配体的益生菌可缓解结肠炎症状,提示色氨酸代谢产物通过AhR在黏膜免疫稳态中发挥重要作用[31,79]。
胆汁酸由肝脏中的胆固醇合成,然后由肠道内微生物通过酶法修饰将其代谢为次级胆汁酸。最近一项研究表明,胆汁酸受体-法尼醇X受体(farnesoid X receptor,FXR)的过度表达会导致初生大鼠的抑郁行为及海马体BDNF表达下调,同时敲除FXR基因能降低慢性刺激对大鼠神经可塑性及行为学的影响[80]。
4 结 语
随着人们健康意识的提升,疾病预防逐渐得到重视,因此,以非药物方法尝试应对抑郁症成为当前社会中主流健康干预手段。人们对抑郁症的认识从心理到大脑,到神经内分泌及免疫等多系统作用,再到迷走神经-中枢神经通讯,直到今天的MGB轴,所得结论是肠道菌群对于人类情绪、认知和神经活动等功能调节意义重大。可以预期,以益生菌为基础,靶向肠道微生态和肠-脑通信的干预方式将成为抑郁症防治领域的重要部分。然而,不同的菌株作用模式是具有菌株特异性的,其改善情绪的作用途径也一般不同,需要进一步了解每种有切实功效菌株的内在作用途径。另一方面,不同患者的抑郁症亚型差异、肠道微生物结构组成差异和益生菌制剂工艺的差异使治疗有效性和规范性变得复杂,因此,在使用益生菌制剂时需要采取个性化治疗和干预手段,为微生物在防治抑郁症领域奠定基础。目前,这一领域的研究仍处于初期阶段,需要付出更多努力来促进MGB轴在抑郁症等精神障碍疾病方面的发展及应用。
