抗菌肽zp37抑制果汁中单核细胞增生李斯特菌的活性及其作用机制
2023-04-06任俊和陈思睿易兰花
任俊和,曾 平,陈思睿,易兰花,*
(1.西南大学食品科学学院,重庆 400715;2.香港中文大学药剂学院,香港 999077;3.重庆市开州区疾病预防控制中心,重庆 405499)
果汁因富含糖类、VC、果胶及多酚等营养成分而受到消费者喜爱,随着人们生活水平的提高,其加工量和消费量也在不断增长。由于酸度较高,通常认为果汁不是食源性病菌生存的适宜载体。然而,研究表明,某些病原菌可以通过适应低pH值来维持生存[1]。美国疾病预防控制中心的报告指出,已暴发多次与饮用果汁有关的食源性疾病,其中涉及产志贺毒素大肠杆菌、沙门氏菌和单核细胞增生李斯特氏菌(以下简称单增李斯特菌)[2]。美国国家食品微生物标准委员会于1977年将大肠杆菌O157:H7和单增李斯特菌确定为影响果汁食用安全的主要病原菌[3]。其中,由于可以在酸性条件和常规冷藏温度(4 ℃)下生长[4],单增李斯特菌被认为是影响果汁食用安全的主要风险因素,会提高人畜患脑膜炎、心肌炎、败血症等疾病的概率,且在免疫功能低下的人群中致死率相对较高(20%~30%)[5]。因此,抑制果汁中的病原微生物,尤其是单增李斯特菌,是保障果汁食品安全的迫切需要。
果汁中最初的微生物水平通常为1~8(lg(CFU/mL))[6-8],但美国食品药品监督管理局颁布的危害分析和关键控制点要求将微生物水平控制在5(lg(CFU/mL))以下[1,9]。目前果汁加工业普遍采用的是热杀菌技术,热杀菌技术杀菌效果显著,但会改变果汁的色泽,产生热臭的异味,造成香气、新鲜度损失,破坏营养成分,从而影响果汁的感官特性和品质。新兴非热杀菌技术,如脉冲电场、超高压均质和抗菌肽杀菌等,因其能在较低的温度下达到杀菌钝酶的目的,减少了高温对果汁色、香、味、营养成分及新鲜度等的影响,成为果汁杀菌技术的研究热点[10]。其中,抗菌肽是由宿主产生的能抵御外界微生物侵害的一类小分子多肽,由于其抑菌谱广、稳定性好、抑菌机制独特、不易残留等优势,使其在医药行业和食品工业等领域有良好的应用前景[11]。其中,由乳酸菌产生的乳酸链球菌素(Nisin)是其中一种抗菌肽,因其能够抑制腐败细菌和致病菌的生长,且不会对产品物理化学特性造成显著的影响而被广泛应用于果汁中[12]。抗菌肽可以防治多种致病菌感染,目前已有大量报道表明抗菌肽对单增李斯特菌有明显的抑菌功效[13-15],然而,目前除了Nisin,将其他抗菌肽作为食品防腐剂应用于果汁杀菌防腐的研究鲜有报道[16-17]。
本课题组前期研究发现抗菌肽zp3(GIIAGIIIKIKKNH2)由于具有较多的亲水性氨基酸而对多种病原菌表现出良好的抗菌活性[18]。为了通过增加两亲性来提高抗菌肽zp3的抑菌活性,本课题组采用亲水性氨基酸赖氨酸取代抗菌肽zp3第3位的异亮氨酸和第5位的甘氨酸,得到了抗菌肽zp37(GIKAKIIIKIKK-NH2)。本研究旨在明确抗菌肽zp37对单增李斯特菌的抑菌活性并分析其抑菌机制,为抗菌肽作为食品生物防腐剂应用于果汁提供一定的科学依据。
1 材料与方法
1.1 菌株、材料与试剂
单增李斯特菌CMCC54004由西南大学农产品贮藏与物流实验室保藏。
抗菌肽zp37(GIKAKIIIKIKK-NH2)通过将抗菌肽zp3上第3位点的异亮氨酸和第5位点的甘氨酸替换为赖氨酸得到[18]。抗菌肽zp37和用异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的抗菌肽zp37(FITC-zp37)由南京杰肽生物科技有限公司合成,随后,经反相高效液相色谱法纯化至纯度95%以上。
Live/Dead BacLight细菌活力试剂盒、SYTOX绿色染液、geneRuler 1 kb plus DNA marker 美国赛默飞世尔科技有限公司;3,3’-二丙基硫代二碳氰碘化物(DiSC3(5))荧光探针、2’,7’-二氯荧光素二乙酸酯(2’,7’-dichlorofluorescein diacetate,DCFH-DA)、Hoechst染液和尼罗红染液 上海西格玛奥德里奇贸易有限公司;PureLink®基因组DNA mini试剂盒 美国英杰生命技术有限公司;MH肉汤、LB肉汤和PALCAM选择性培养基 美国BD公司。
1.2 仪器与设备
Eclipse Ti2-E活细胞荧光成像系统 上海尼康仪器有限公司;96 孔黑色玻璃板 武汉赛尔维斯科技有限公司;SpectraMax iD3多功能酶标仪 上海美谷仪器有限公司;VEGA3扫描电子显微镜 上海泰斯肯贸易有限公司;TCS SPE共聚焦显微镜 德国徕卡公司;NanoDropTMOneC微量紫外-可见分光光度计 美国赛默飞世尔科技有限公司。
1.3 方法
1.3.1 抗菌肽zp37对单增李斯特菌抑菌活性分析
1.3.1.1 最小抑菌浓度测定
按照临床和实验室标准协会指南(2019年)中的肉汤稀释法[19],在96 孔板上用MH肉汤将抗菌肽zp3和抗菌肽zp37以2 倍逐级稀释至质量浓度分别为128、64、32、16、8、4、2 μg/mL,接种单增李斯特菌菌悬液至菌体终浓度为106CFU/mL,37 ℃培养24 h,观察无菌体生长的最低多肽质量浓度即为最小抑菌浓度(minimum inhibitory concentration,MIC)。
1.3.1.2 生长曲线
将单增李斯特菌菌悬液接种到新鲜LB肉汤培养基中,37 ℃、250 r/min恒温摇床培养2 h至对数生长期。随后,加入抗菌肽zp37至终浓度分别为1、2、4、8 MIC,继续培养10 h。每1 h取样,测定其在600 nm波长处的光密度值(OD600nm)。对照组以无菌水代替抗菌肽zp37溶液。
1.3.1.3 活/死细胞染色实验
取对数生长期菌液于6 500 r/min离心10 min,菌体用9 g/L NaCl溶液(无菌生理盐水)重悬至OD600nm为0.2。然后将菌悬液等分为5 组,其中4 组加入抗菌肽zp37至终浓度分别为1、2、4、8 MIC,剩余一组加入等体积无菌水作为对照,37 ℃培养1 h。按照Live/Dead BacLight细菌活力试剂盒说明书进行染色[18],暗处静置20 min,置于荧光显微镜下观察细胞的荧光图像,放大倍数均为100 倍。
1.3.2 不同果汁中细菌接种及计数
取对数生长期单增李斯特菌液于6 500 r/min离心10 min,菌体用无菌生理盐水重悬至OD600nm为0.5,然后将菌液分别加入灭菌后的草莓汁、猕猴桃汁和苹果汁中,稀释至终浓度为106~107CFU/mL,根据之前的实验结果,加入抗菌肽zp37至终浓度为2 MIC。每24 h取样,采用稀释涂布平板法,用选择性培养基PALCAM计算菌落数。相同处理下,以无菌水代替抗菌肽zp37作为对照组(control)。
1.3.3 菌体的膜电位测定
使用荧光探针DiSC3(5)测定菌体的膜电位[18]。将单增李斯特菌在LB肉汤中培养至对数生长期(OD600nm为0.2),取对数生长期菌液离心。菌体在无菌生理盐水中重悬至OD600nm为0.2。在菌悬液中加入KCl至终浓度为100 mmol/L,接着加入DiSC3(5)至终质量浓度为1 μg/mL,避光反应15 min。随后在96 孔黑色玻璃板前3 列中,每孔加入150 μL菌悬液。最后将抗菌肽zp37按列分别加入至终质量浓度分别为0.5、0.25、0.125 MIC[20]。在激发波长620 nm、发射波长670 nm条件下使用多功能酶标仪连续测定12 min内荧光强度的变化[21]。相同处理下,以1 μmol/L缬氨霉素代替抗菌肽zp37作为阳性对照,以无菌水代替抗菌肽zp37作为阴性对照(control)。
1.3.4 细菌膜完整性测定
将单增李斯特菌接种在新鲜的LB肉汤中,培养至对数生长期后离心收集菌体,在无菌生理盐水中重悬至OD600nm为0.2,加入SYTOX绿色染液至终质量浓度为1 μg/mL,暗处静置5 min。在96 孔板前4 列中分别加入上述菌悬液150 μL。接着,按列分别加入抗菌肽zp37溶液至最终质量浓度分别为1、2、4、8 MIC。在3 h内每0.5 h使用酶标仪测定荧光强度,测定条件:激发波长488 nm、发射波长523 nm。相同处理下,以无菌水代替抗菌肽zp37作为阴性对照(control),以16 μg/mL的蜂毒肽代替抗菌肽zp37溶液作为阳性对照。
1.3.5 扫描电子显微镜观察细胞形态
将菌体在LB肉汤中培养至对数生长期(OD600nm为0.2),加入抗菌肽zp37至终质量浓度为2 MIC,37 ℃下培养2 h后离心收集菌体。菌体使用无菌生理盐水洗涤3 次,之后在4 ℃下,用体积分数2.5%戊二醛溶液在无菌盖玻片上固定过夜。使用10%、30%、50%、70%、80%、90%、100%乙醇梯度脱水并干燥。喷洒金粉后,使用扫描电子显微镜观察细胞形态,电压20 kV、放大倍数20 000。相同处理下,以无菌水代替抗菌肽zp37作为对照。
1.3.6 细胞聚集率计算
参考Yi Lanhua等[19]的方法,取在LB肉汤中培养至对数生长期的菌液离心,菌体用无菌生理盐水洗涤并重悬至OD600nm为0.5,加入抗菌肽zp37至终质量浓度分别为0(control)、0.5、1、2 MIC,37 ℃、150 r/min摇床培养1 h。之后菌体用无菌生理盐水洗涤、重悬至OD600nm为1,室温静置,在36 h内每12 h取200 μL的中间层菌悬液,用无菌生理盐水稀释至2 mL,测定OD600nm。按下式计算细胞聚集率。
式中:A0是0 h的OD600nm;At是每个测定时间的OD600nm。
1.3.7 激光共聚焦显微镜分析细胞作用位置
参考Zeng Peng等[22]方法并有所改动,将对数生长期单增李斯特菌菌体细胞先用Hoechst染液(10 μg/mL)染色20 min,再用尼罗红染料(1 μg/mL)染色30 min,然后添加FITC-zp37至终质量浓度为4 MIC。37 ℃处理1 h后,用体积分数2.5%戊二醛溶液固定细胞30 min,在激光共聚焦显微镜下观察细胞内的荧光分布,放大倍数为630。
1.3.8 DNA结合测定
将单增李斯特菌在LB肉汤中培养至对数生长期后,使用PureLink®基因组DNA迷你试剂盒提取其基因组DNA[19]。将DNA稀释至400 μg/mL后,取8 组30 μL的DNA稀释液,加入等体积不同质量浓度的抗菌肽zp37至终质量浓度分别为200、100、50、25、12.5、6.25、3.125 μg/mL和0 μg/mL。混合均匀,37 ℃下处理1 h,用0.8%琼脂糖凝胶电泳分析DNA迁移。同时,使用紫外-可见分光光度计分别测定反应上清液剩余的DNA质量浓度。
1.3.9 胞内活性氧测定
用DCFH-DA法测定单增李斯特菌产生的活性氧含量[23]。取对数生长期菌液离心,菌体用无菌生理盐水洗涤并重悬至OD600nm为0.5。将上述菌悬液等分成若干组两份,其中一份加入L-抗坏血酸至终浓度为20 mmol/L,之后在两份菌悬液中添加抗菌肽zp37至终质量浓度分别为0(control)、0.5、1、2、4、8 MIC,37 ℃下培养2 h。添加DCFH-DA至终质量浓度为10 μg/mL,暗处放置20 min后,使用酶标仪测定荧光强度,激发波长488 nm、发射波长525 nm。
1.4 数据处理与分析
2 结果与分析
2.1 抗菌肽zp37对单增李斯特菌的抑菌活性
2.1.1 MIC的确定
抗菌肽zp37对单增李斯特菌的MIC为16 μg/mL,而其模板抗菌肽zp3对单增李斯特菌的MIC大于64 μg/mL,结果表明,zp3上第3位异亮氨酸和第5位甘氨酸被替换为赖氨酸后得到的抗菌肽zp37对单增李斯特菌具有更强的抑制效果。另外,根据王双童等[24]的研究,Nisin对单增李斯特菌的MIC为500 μg/mL。由此可见,抗菌肽zp37的抑菌活性远高于Nisin,具有很好的应用前景。
2.1.2 生长曲线
如图1A所示,在新鲜的LB肉汤中培养后,1 MIC和2 MIC处理后的单增李斯特菌光密度值仍持续上升,但菌体密度与对照组相比有明显的下降,表明低质量浓度的抗菌肽zp37只能抑制部分菌体细胞的生长。这可能是由于加入抗菌肽zp37时,单增李斯特菌的菌体密度(约108CFU/mL)远高于测定MIC时的菌体密度(约106CFU/mL),低质量浓度抗菌肽zp37不足以抑制菌体生长。4 MIC处理后光密度值基本不再增大,说明单增李斯特菌的生长已被基本抑制。8 MIC处理后,生长曲线略有下降,细胞数量逐渐减少,表明此质量浓度下的抗菌肽zp37处理可以导致单增李斯特菌的死亡,部分细胞甚至可能发生了裂解。该结果表明,不同质量浓度的抗菌肽zp37对单增李斯特菌的生长均有明显的抑制作用,且抑菌能力与质量浓度呈正相关。
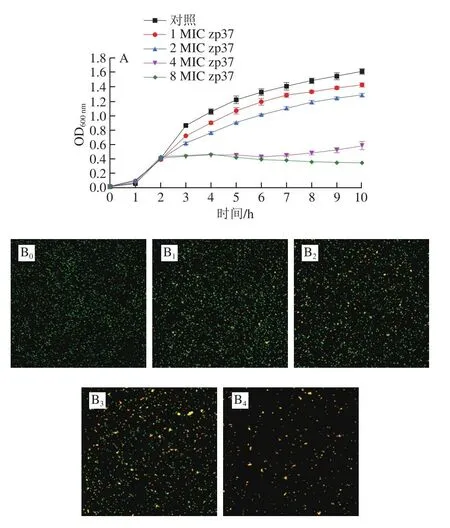
图1 不同质量浓度zp37对单增李斯特菌生长的影响Fig.1 Effects of different concentrations of zp37 on the growth of L.monocytogenes
2.1.3 活细胞和死细胞对比
Live/Dead试剂盒包含两种荧光染料:SYTO9和PI,两种荧光染料透过细胞膜的能力不同,在荧光显微镜下,活细胞呈现SYTO9的荧光,即绿色,而死细胞呈现PI的荧光,即红色。由图1B可知,对照组细胞几乎全部显示绿色荧光,表示细胞死亡率很小;随着抗菌肽zp37质量浓度的增大,呈现橙红色荧光的菌体密度逐渐增加,绿色荧光逐渐减少。从图1B4中可以看出,只有很少的绿色荧光显现,表明用8 MIC的抗菌肽zp37处理1 h后绝大部分菌体已经死亡。实验结果表明,抗菌肽zp37对单增李斯特菌的致死作用随质量浓度增加逐渐增强,该结果与2.1.2节实验结果相互印证。
2.2 抗菌肽zp37对不同果汁中单增李斯特菌的抑制作用
由图2可知,随着时间延长,草莓汁、猕猴桃汁和苹果汁对照组中单增李斯特菌活菌数逐渐下降,这可能是由于目前国内外生产的鲜榨果汁均为低pH值(小于4.0)[6,25],可以抑制细菌的生长繁殖。但是,在贮藏后期,对照组单增李斯特菌活菌数下降趋势减缓,可能是由于少部分菌体已表现出酸适应性,能够在酸性条件下长期存活。根据田牧雨等[26]的报道,单增李斯特菌在低pH值下会发生强烈的诱导性耐酸响应,这种机制可以使其在酸性条件下无法被完全杀灭。在加入抗菌肽zp37后,草莓汁、猕猴桃汁和苹果汁中单增李斯特菌细胞菌落数下降趋势较对照组更为明显,且在第7天均可以降至检测限以下。这表明在果汁中加入抗菌肽zp37可以逐渐杀死所有单增李斯特菌,包括其中的耐酸菌,从而保障果汁的食用安全。此外,抗菌肽zp37对不同果汁的抑菌活性动态变化不同,可能与抗菌肽与果汁介质体系的相互作用有关[27]。
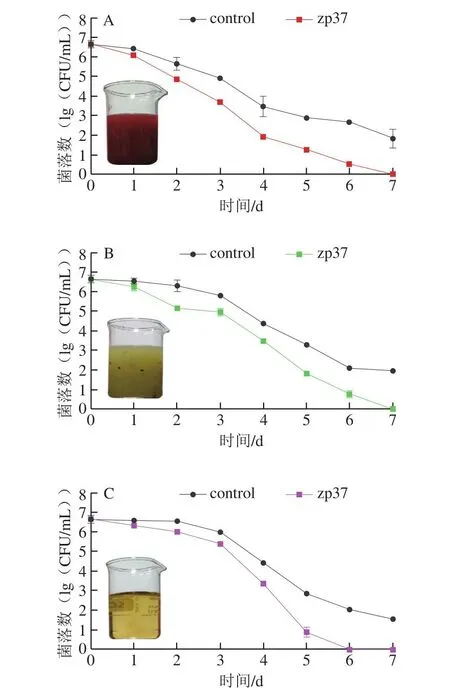
图2 zp37对不同果汁中单增李斯特菌的抑制作用Fig.2 Inhibition of L.monocytogenes in different fruit juices by zp37
2.3 抗菌肽zp37对单增李斯特菌膜电位的影响
荧光探针DiSC3(5)是一种阳离子膜电位敏感荧光染料,当细胞膜完好时,染料在磷脂双分子层内聚集,荧光被猝灭。抗菌化合物可以增加细胞膜离子渗透性,使膜去极化后,电位消失,染料会迅速释放到介质中,导致荧光增强,荧光强度与电位减少程度成正比[28-30]。如图3所示,阴性对照的单增李斯特菌细胞发生荧光猝灭。抗菌肽zp37处理后,抑制了荧光的猝灭,荧光强度逐渐上升,并且各质量浓度zp37处理组的上升趋势均与阳性对照缬氨霉素组相似。缬氨霉素是一种典型的离子载体抗生素,它作为钾离子特异性转运体,能够促进钾离子的扩散,可引起膜电位的耗散,使染料释放到介质中,造成荧光强度增加[30]。同时,对比相同时间下各质量浓度zp37处理组的荧光强度,可以看出抗菌肽zp37质量浓度越大,发出的荧光越强烈,说明在一定范围内,抗菌肽zp37质量浓度越高,对细胞膜的去极化作用效果越明显。该结果表明,抗菌肽zp37在较低质量浓度下可以作用于细胞膜,引起膜离子通透性改变,导致膜内外电势改变,从而抑制单增李斯特菌生长。
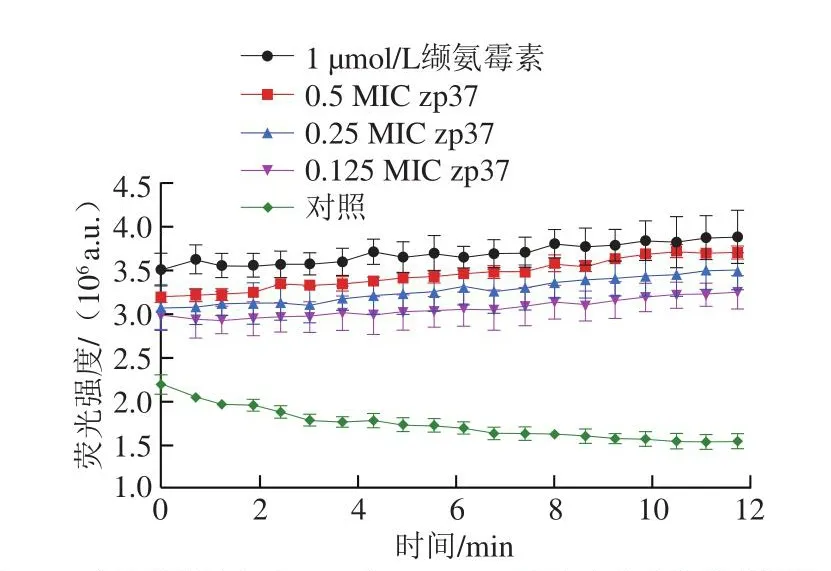
图3 不同质量浓度的zp37和1 μmol/L缬氨霉素对单增李斯特菌膜电位的影响Fig.3 Effects of different concentrations of zp37 versus 1 μmol/L valinomycin on the membrane potential of L.monocytogenes
2.4 抗菌肽zp37对单增李斯特菌膜完整性的影响
根据上述膜电位研究结果,推测抗菌肽zp37可以影响细胞膜通透性,因此,进一步检测细胞膜完整性。SYTOX是非膜通透性染料,不能进入具有完整细胞膜结构的细胞。当细胞膜被破坏时,SYTOX可进入细胞,与DNA结合,导致荧光强度上升。蜂毒肽可以在细胞膜上形成大的孔洞,从而破坏细胞膜完整性,被广泛用作细胞膜完整性研究的阳性对照,包括在破坏单增李斯特菌细胞膜完整性的研究中[23]。如图4所示,蜂毒肽处理0.5 h时,荧光强度就出现了剧烈上升,且随着处理时间的延长基本保持稳定,说明蜂毒肽能够快速破坏单增李斯特菌细胞膜的完整性。与阳性对照组相比,1 MIC和2 MIC抗菌肽zp37处理只引起了荧光强度的微弱升高。随着抗菌肽zp37处理质量浓度的增加,荧光强度的上升趋势较为明显,尤其是8 MIC zp37处理组。该结果表明,抗菌肽zp37能破坏单增李斯特菌细胞膜完整性,且与质量浓度呈正相关,但是与蜂毒肽相比,zp37膜破坏能力较弱。同时,随着抗菌肽zp37处理时间的延长,对细胞膜的破坏能力逐渐增强。结果说明,抗菌肽zp37对细胞膜的作用具有时间累积效应。因此推测,抗菌肽zp37能够破坏单增李斯特菌细胞膜完整性,但并不是通过形成大的孔洞,可能是通过形成较小的微孔,导致胞内小分子物质渗漏,从而影响细胞的生理代谢,甚至杀死单增李斯特菌细胞。
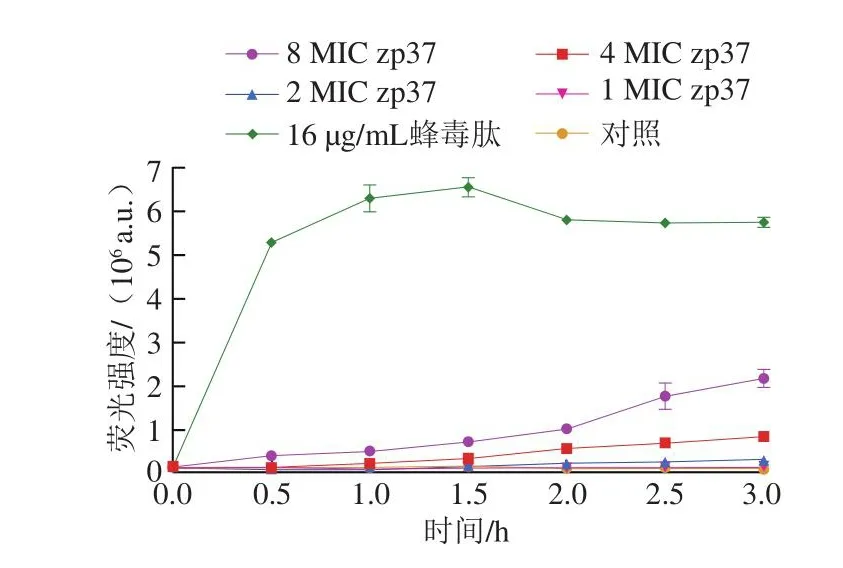
图4 不同质量浓度的zp37和16 μg/mL蜂毒肽对单增李斯特菌膜完整性的影响Fig.4 Effects of different concentrations of zp37 versus 16 μg/mL melittin on the membrane integrity of L.monocytogenes
2.5 扫描电子显微镜观察抗菌肽zp37对单增李斯特菌细胞形态的影响
如图5A所示,对照组具有表面光滑和轮廓完整的正常细胞,且细胞间分散较均匀。然而,经抗菌肽zp37处理后,部分菌体的细胞形态出现了明显变化(图5B红色箭头):一些细胞表面变得不光滑,出现大的凹坑和凹痕;有的变形严重,细胞膜出现明显残缺;部分细胞聚集成堆。该形态变化结果表明,经过抗菌肽zp37处理后,可能会引起细胞被膜的损伤、裂解、甚至溶解,从而导致部分细胞质流出,细胞出现凹陷变形。该细胞形态变化结果与2.1.2节生长曲线中高质量浓度下OD600nm降低、细胞膜完整性破坏等结果一致。

图5 单增李斯特菌的扫描电子显微镜图Fig.5 Scanning electron microscopic pictures of L.monocytogenes
2.6 抗菌肽zp37对单增李斯特菌细胞聚集的影响
扫描电子显微镜观察到抗菌肽zp37处理会导致部分细胞聚集成堆,因此进一步分析不同质量浓度抗菌肽zp37处理对单增李斯特菌细胞聚集性的影响。由图6可知,随着时间的推移,抗菌肽zp37处理促进了单增李斯特菌聚集,并且细胞聚集能力随着质量浓度的增加而增强。当用0.5 MIC的抗菌肽zp37处理时,前24 h细胞的聚集能力与对照组的聚集能力基本相同,在经过36 h处理后,细胞的聚集能力才明显增强。由此可知,当抗菌肽zp37质量浓度较低时,处理效果需经过较长时间才能有所显现。根据Yi Lanhua等[19]的研究,推断抗菌肽zp37处理引起细胞聚集能力增强的原因可能是抗菌肽zp37处理后,细胞被膜完整性被破坏,细胞表面物质的含量和分布发生了改变,引起细胞表面电荷分布发生了变化,从而导致细胞间的疏水相互作用减弱,呈现细胞聚集能力增强。
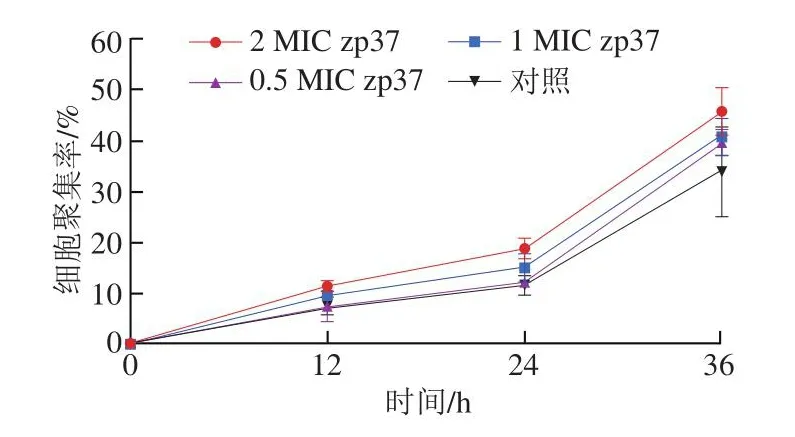
图6 不同质量浓度的zp37对单增李斯特菌细胞聚集的影响Fig.6 Effects of different concentrations of zp37 on the cell aggregation of L.monocytogenes
2.7 抗菌肽zp37对单增李斯特菌细胞的作用位置
上述实验结果表明抗菌肽zp37的作用机理可能与破坏细胞被膜的完整性有关,但抗菌肽zp37是否能够进入细胞内,并对胞内其他物质产生作用并不清楚。因此,进一步研究抗菌肽zp37在单增李斯特菌菌体中的作用位置。利用Hoechst染液对细胞内的DNA进行染色,尼罗红染液对细胞膜进行染色,FITC标记抗菌肽zp37以追踪抗菌肽zp37在细胞中的作用位置。如图7A、C、D所示,大量的绿色荧光与红色荧光重叠并聚集在细胞膜表面,表明抗菌肽zp37在4 MIC处理下,大量累积在单增李斯特菌的细胞膜上。该结果印证了上述抗菌肽zp37抑菌作用与细胞膜的相互作用有关。同时,由图7A、B、C可知,也有一部分细胞显示绿色荧光和蓝色荧光相重叠,这与Zeng Peng等[22]对抑菌肽对鲍曼不动杆菌的抗菌机理研究结果相似,表明抗菌肽zp37的作用机制可能也与其对DNA的影响有关。图7的荧光标记结果表明,抗菌肽zp37在单增李斯特菌细胞中的作用位置包括细胞膜和细胞质。
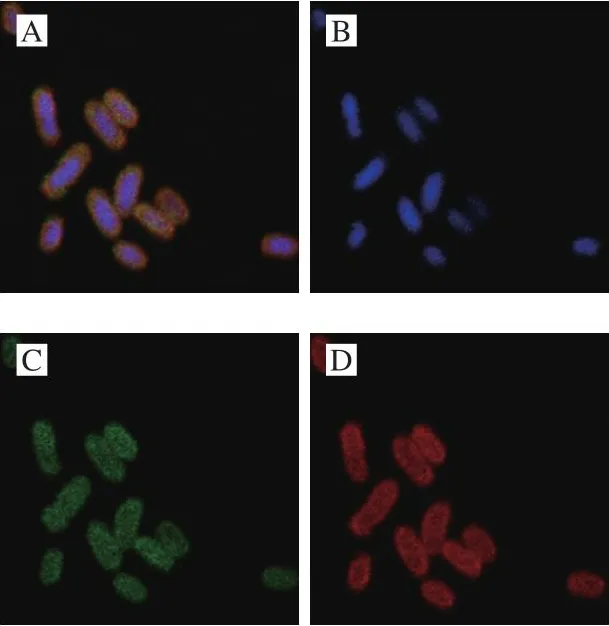
图7 激光共聚焦显微镜观察zp37对单增李斯特菌的作用位置Fig.7 Action sites of zp37 on L.monocytogenes observed by laser confocal microscope
2.8 抗菌肽zp37对单增李斯特菌DNA的影响
荧光示踪实验结果表明,抗菌肽zp37能够进入细胞质,可能与DNA结合,因此,进一步分析抗菌肽zp37与DNA的相互作用。凝胶阻滞实验结果显示,当m(DNA)∶m(zp37)≤200∶50时,抗菌肽zp37会干扰DNA迁移,DNA残留在上样孔中(图8A)。同时,在m(DNA)∶m(zp37)≤200∶100时,测得上清液中残留的DNA质量浓度显著降低,尤其是m(DNA)∶m(zp37)=200∶200时。因此,当抗菌肽zp37质量浓度大于DNA质量浓度的1/4时,可以发生明显的抗菌肽-DNA结合作用。当抗菌肽zp37质量浓度大于或等于DNA质量浓度时,抗菌肽zp37可使绝大部分DNA发生沉淀。根据李冠楠等[11]对抗菌肽的作用机理的研究报道,抗菌肽与细菌的DNA结合是一种常见的抑菌机制,抗菌肽与细胞DNA结合时,可以阻断细胞DNA的复制和转录,影响细胞的生命活动,从而使细胞失去生命活性。这可能也是抗菌肽zp37抑制单增李斯特菌生长的机理之一。
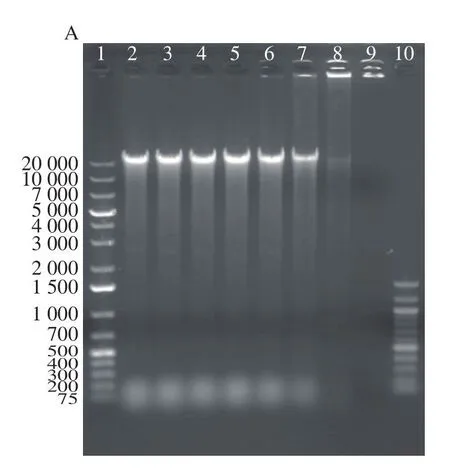

图8 zp37对单增李斯特菌DNA的影响Fig.8 Effect of zp37 on L.monocytogenes DNA
2.9 抗菌肽zp37对单增李斯特菌胞内活性氧产生的影响
DCFH-DA可与活性氧反应产生具有荧光的2’,7’-二氯二氢荧光素(dichlorodihydro-fluoroscein,DCF),因此,通过检测荧光强度即可反映产生的活性氧水平。结果如图9所示,在L-抗坏血酸存在下,不同质量浓度抗菌肽zp37处理后的细胞荧光强度基本没有变化。其原因是L-抗坏血酸是一种抗氧化剂,可还原体系内产生的活性氧[23]。然而,对于只有抗菌肽处理组,加入抗菌肽zp37后,荧光强度显著增强,并且随着抗菌肽zp37质量浓度的增加,荧光强度逐渐上升,均高度显著高于含有L-抗坏血酸组。该结果表明,加入抗菌肽zp37后会诱导单增李斯特菌细胞内产生大量的活性氧,并且随着抗菌肽zp37质量浓度的升高,活性氧产生量不断上升。根据张超等[31]研究,活性氧是形成单增李斯特菌菌膜必不可缺的信号分子,单增李斯特菌中存在类似于负责产生活性氧的还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶,由NADPH氧化酶介导产生的适量活性氧对维持菌细胞正常生命活动有至关重要的意义,过多或过少均会对细胞产生较强的杀灭作用。因此,诱导活性氧产生可能是抗菌肽zp37进入细胞质后杀死单增李斯特菌的另一种作用机制。
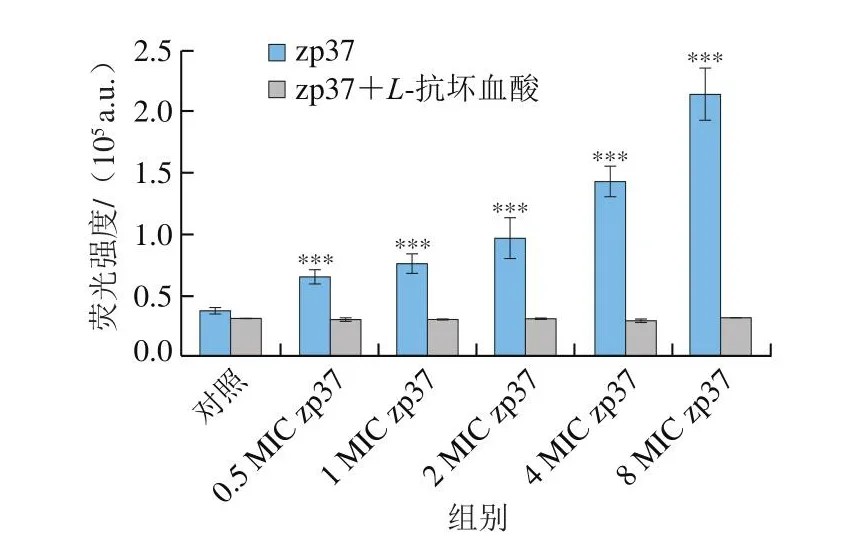
图9 zp37对单增李斯特菌产生活性氧的影响Fig.9 Effect of zp37 on the production of ROS in L.monocytogenes
3 结 论
控制果汁中单增李斯特菌的数量对于保障果汁食品安全性至关重要,但目前缺乏有效的抑制果汁中单增李斯特菌的食品生物防腐剂。本实验设计了一种抗菌肽zp37,并通过一系列相关实验,揭示了抗菌肽zp37对果汁中单增李斯特菌的抑制活性及作用机制。研究结果表明,抗菌肽zp37在体外及果汁中均表现出良好的抑制单增李斯特菌能力。抗菌肽zp37对单增李斯特菌的抑菌机制包括作用于细胞被膜和作用于胞内物质。首先,zp37能够作用于细胞被膜,破坏细胞膜完整性、改变膜电位、引起细胞变形和聚集;进一步,进入细胞质后,抗菌肽zp37与DNA结合,并且诱导胞内活性氧产生。本研究结果对于将抗菌肽zp37作为一种生物防腐剂抑制果汁或其他食品中的病原菌具有一定的指导作用。
