谷氨酰胺转氨酶对高水分豌豆蛋白挤出物结构及消化特性的影响
2023-04-06秦鉴新李江华周景文
刘 潇,秦鉴新,李江华,周景文,陈 坚*
(江南大学未来食品科学中心,江苏 无锡 214122)
根据联合国数据统计,到2050年,世界人口将达到97亿。人口的持续增长导致居民饮食结构与营养来源发生变化,同时粮食安全的保障以及持续恶化的环境导致资源紧缺都是目前亟需解决的问题[1-3]。因此,寻求传统食用动物蛋白以外的新型蛋白来源成为新的发展方向。植物基肉制品是指以植物蛋白为原料,经一定加工工艺制成的具有与动物蛋白类似的质构、风味、形态等品质特征的食品。植物基肉制品的出现不仅缓解了资源环境压力,同时也降低了饱和脂肪酸摄入,满足了人们对营养及口味的追求[4-5]。
豌豆蛋白是一种氨基酸含量相对均衡的优质蛋白质。由于豌豆蛋白没有致敏性并且能够在更温和的气候条件下生长,因此豌豆蛋白正逐渐替代大豆蛋白作为植物基肉制品的原料[6]。目前,植物基肉制品的质构品质与动物肉制品的相似程度是影响其市场接受度的关键因素之一。因此如何改善植物基肉制品的质构口感成为当前面临的主要问题之一[7]。在食品加工过程中,通过添加不同的成分,如蛋白质、多糖和交联剂,可以部分改善食品的质地。作为交联酶,谷氨酰胺转氨酶(transglutaminase,TG)通过催化蛋白质中谷氨酰胺残基的γ-羟胺基团与伯胺化合物(酰基受体)之间发生酰基转移反应,使蛋白质发生共价交联,通过胺的导入、交联及脱胺3 种途径改性蛋白质,从而引起蛋白质的多种功能特性(如凝胶性、热稳定性、乳化性、保水性、流变性等)发生变化,有助于改善食品的质地口感[8]。
高水分挤压技术具有优良的混合和喂料能力、较强的可控性和自洁性,是目前植物蛋白肉最常见的生产加工方式[9]。在挤出过程中,植物蛋白粉料在挤压机中与水混合成均匀状态,之后经过蒸煮区,在高温、高剪切的条件下形成熔融体。混合物在温度降低至临界温度以下时会发生相分离,紧接着在经过细长的冷却套筒过程中使蛋白质分子发生重排、互相交联,最终形成高弹性、高韧性的纤维状组织结构,从而使其质地更接近动物肉组织结构。目前已有研究报道TG改性可以改善植物蛋白肉制品产品的质构属性[10]。
植物基肉制品中纤维和蛋白质分子的结构受其加工技术的影响。近年来,大量研究证明食物的消化特性受其结构的影响。因此,为了评估TG修饰以及挤压对植物基肉制品质构特性的影响,有必要研究其蛋白质消化率[11-12]。目前对于植物基肉制品蛋白质消化率的研究很少。因此,本研究以豌豆蛋白为原料,探究高水分挤出过程中不同比例TG对豌豆蛋白挤出物品质的影响,并通过体外模拟消化,探究TG对豌豆蛋白挤出物的胃肠道消化率及氨基酸释放的影响。
1 材料与方法
1.1 材料与试剂
豌豆分离蛋白(pea protein isolate,PPI)粉(蛋白质干基相对含量为84.2%)由烟台双塔食品有限公司提供。
TG(120 U/g) 江苏东圣生物科技有限公司;α-淀粉酶、胃蛋白酶、胰蛋白酶 西格玛奥德里奇(上海)贸易有限公司;胆汁盐、氯化钠、氯化钾、碳酸氢钠、二硫苏糖醇(dithiothreitol,DTT)、硫酸二氢钠、磷酸氢二钠、尿素、巯基乙醇、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、无水乙醇、三氯乙酸国药控股化学试剂有限公司;除单独说明外,所有其他化学试剂均为分析纯。
1.2 仪器与设备
BCTM-30双螺杆挤出机 瑞士布勒机械有限公司;K9860全自动凯氏定氮仪 山东海能科学仪器有限公司;SU1510日立扫描电子显微镜(scanning electron microscope,SEM) 日本Hitachi公司;TA.XT plus质构分析仪 英国SMS公司;Mastersizer 3000E激光粒度仪英国马尔文帕纳科有限公司;1100高效液相色谱(high performance liquid chromatography,HPLC)仪 美国安捷伦科技有限公司;Synergy H1/Synergy2酶标仪 美国伯腾仪器有限公司。
1.3 方法
1.3.1 PPI粉-TG挤出物的制备
将PPI粉与TG混合均匀,TG添加量分别为0%、0.25%、0.50%、1.00%、1.50%和2.00%(以最终料水混合物的质量计),之后以9 kg/h的恒定速率将混合物送入挤出机(干基)。在第二区以9 kg/h的速率输送水,保持最终进料水分质量分数为50%。挤压机参数如下:螺杆转速为230 r/min,机筒温度从第一区到第八区分别为25、40、60、80、100、120、130、120 ℃。冷却套筒温度保持在90 ℃。待挤出稳定后,收集样品,待样品冷却至室温后分装,保存在-20 ℃备用。
1.3.2 挤出物宏观与微观结构观察
将新鲜的挤出物进行拍照观察,分析挤出物宏观结构差异。将挤出物切片后冷冻干燥,最后将表面用金溅射涂层。用SEM在300 倍下观察其表观形态。
1.3.3 质构及组织化分析
将挤出物裁成10 mm×10 mm×10 mm的形状,使用P/36R探头测定组织化豌豆蛋白的硬度、弹性、内聚性和咀嚼性。具体参数设置为测试前速率为1 mm/s、测试速率为1 mm/s、测试后速率为2 mm/s、下压程度为50%,往复2 次,每组样品重复测试10 次,去掉两个最大值和两个最小值取平均值。
取长方体样品(20 mm×20 mm×10 mm),使用A/CKB探头对其进行剪切测试,具体参数设置为测试前速率为1 mm/s、测试速率为1 mm/s、测试后速率为2 mm/s、剪切程度为75%,每组样品重复测试10 次,去掉两个最大值和两个最小值取平均值。垂直剪切力与平行剪切力的比值被定义为组织化度。
1.3.4 蛋白质溶解度测定
为了揭示挤出物结构形成和维持过程中蛋白质之间的相互作用,制备如表1所示的8 种蛋白提取溶剂,测定样品的蛋白质溶解度并计算化学键的变化。将样品冷冻干燥后粉碎过60 目筛网。称取0.25 g样品于50 mL离心管中,分别加入如表1所示的8 种蛋白提取溶剂,搅拌浸提1 h后,4 ℃、12 000 r/min离心15 min,保留上清液。再分别加入上述8 种蛋白提取溶剂将沉淀重悬,重复浸提一次。用去离子水将获得的上清液稀释20 倍,混匀后向96 孔酶标板中加入20 μL稀释后的上清液。采用BCA蛋白浓度测定试剂盒测定样品在562 nm波长处的吸光度,计算上清液中的可溶性蛋白质量浓度,用凯氏定氮法测定样品的总蛋白质量浓度,计算如公式(1)所示,然后根据公式(2)计算蛋白质溶解度。根据样品在不同溶液中的溶解度进行加减计算得到不同的化学键。

表1 蛋白浸提液及化学键计算方式Table 1 Protein extraction buffer solutions and calculation of corresponding chemical bonds
1.3.5 体外消化实验
对豌豆蛋白挤出物进行体外消化实验。消化实验分3 个阶段进行。
口腔阶段:将挤出物使用研磨机研磨15 s,取1.5 g样品加6 mL去离子水放入25 mL烧杯中,使每组样品中的蛋白质含量保持不变。将7.5 mL含有α-淀粉酶的模拟唾液(simulated salivary fluid,SSF)添加到样品中。最终口服混合物中淀粉酶的活力为75 U/mL。将烧杯密封并在37 ℃的水浴磁力搅拌锅中以500 r/min搅拌2 min。
体外胃消化阶段:将15 g经上述口服阶段的样品与300 mL蒸馏水混合,并用6 mol/L HCl溶液将pH值调节至2.0。加入15 mL模拟胃液(5 g胃蛋白酶溶解于250 mL 0.1 mol/L HCl溶液中),将混合物在37 ℃水浴搅拌,分别在30、60、120 min时取样,每个时间点采样后将样品pH值调至7.0灭酶以终止胃消化。随后在4 ℃、4 000 r/min离心15 min。将上清液与沉淀物分别在-80 ℃保存。
体外肠消化阶段:取165 mL上述胃消化后的混合物,用1 mol/L NaHCO3将pH值调节至7.2,随后加入37.5 mL的胆汁盐和胰酶混合溶液(1.2 g胆汁盐和0.2 g胰酶溶解于100 mL NaHCO3(0.1 mol/L))及37.5 mL NaCl/KCl混合溶液(质量浓度7.02 g/L NaCl、质量浓度0.37 g/L KCl),在37 ℃水浴搅拌,分别在15、30、60、120 min时取样,每个时间点采样后将样品沸水浴5 min灭酶以终止肠消化。随后在4 ℃、4 000 r/min离心15 min。将上清液与沉淀物分别在-80 ℃保存。
1.3.6 消化物的粒度测定
使用Mastersizer 3000E激光粒度分析仪测定消化物的粒度,结果以D4,3表示。
1.3.7 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳测定
在还原条件下,使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)测定初始和消化后的挤出物蛋白质组成。对于未消化的样品,将2.0 mg磨碎的样品与0.5 mL样品缓冲液(0.5 mol/L Tris、2.0% SDS、0.03% DTT、pH 6.8)混合。对于消化过的样品,在沸水中煮5 min以使酶失活。使用1 mol/L NaOH溶液将胃食糜的pH值调节至7.0。然后,将样品缓冲液和食糜以体积比1∶1混合,搅拌3 min。
1.3.8 蛋白质消化率测定
将胃和肠反应得到的消化液分别与3 倍体积的无水乙醇混合,并在4 ℃下反应12 h,以去除未消化的蛋白质和高分子质量肽。然后将样品在4 ℃下以10 000 r/min离心20 min,将沉淀物悬浮在5 mL蛋白质提取缓冲液中以测定未消化的蛋白质含量,将混合物在4 ℃下以4 000 r/min离心5 min,收集上清液,通过BCA蛋白浓度测定试剂盒对上清液中的可溶性蛋白含量进行测定。蛋白质消化率计算如公式(3)所示。
式中:m1为未消化蛋白质量/g;m0为消化前样品中蛋白质量/g。
1.3.9 游离氨基酸质量浓度分析
使用HPLC仪测定游离氨基酸质量浓度。在分析之前,用质量浓度0.1 g/mL三氯乙酸等体积稀释样品,静置1 h。取1 mL样液10 000 r/min离心30 min,然后将上清液通过0.22 μm过滤膜过滤用于HPLC分析。
1.4 数据统计与分析
实验数据结果以平均值±标准差表示。利用Origin 2018与SPSS 26.0软件对数据进行统计和方差分析,用Duncan法进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 宏观和微观结构分析结果
对挤出物而言,其质构品质与动物肉制品的相似程度是评价其品质的一个关键因素。而宏观和微观观察是评价挤出物质构特性的直接手段[13-15]。选取新鲜的豌豆蛋白挤出物样品,拍照观察不同TG诱导对豌豆蛋白组织结构的影响。由图1可知,所有的豌豆蛋白挤出物都呈现出各向异性结构。相较于添加TG的挤出物,未添加TG的挤出物纤维层次感较差,且形成的纤维较粗糙、易断裂。而TG添加量为0.25%~1.00%的挤出物样品组织纤维层次感强烈,且纤维较细密,并且TG添加量越大,挤出物的纤维结构越好,呈现出正相关趋势。这是由于TG的加入促进了蛋白分子间交联,使蛋白分子间形成了致密的网络结构。当TG添加量达到1.5%之后,样品的各向异性减弱,组织纤维感变差,只能看到“V”型的组织化纤维趋势,且纤维易断裂,没有形成细小的纤维结构,原因可能是过量酶的加入对纤维的形成起到了抑制作用[10]。

图1 不同添加量TG诱导豌豆蛋白挤出物样品Fig.1 Pea protein extrudates with different TG concentrations
通过SEM观察豌豆蛋白挤出物的形态。由图2可知,挤出物的微观结构与样品宏观形态基本保持一致。添加TG的挤出样品与未添加TG样品(图2A)的形态差别较大。可以明显看出未添加TG样品的微观结构纤维感差,蛋白为块状聚集体,略有分层。而添加TG的挤出样品则分层明显,且有强烈的纤维感。当挤出物的TG添加量为1.00%时(图2D),其纤维结构细密且纤维感最强烈,具有类似肉类纤维的层次感和形态。而随着TG添加量的增加,挤出物的微观形态又发生了变化,如图2F所示,虽然有层状结构出现,但纤维感较差,且蛋白多为块状聚集体,缺乏动物肉类的纤维感。结合宏观、微观分析结果可知,TG的加入有利于豌豆蛋白挤出物纤维结构的形成,但过量的TG会起到抑制作用。

图2 不同添加量TG诱导豌豆蛋白挤出物的SEM观察结果Fig.2 Microstructures of pea protein extrudates with different TG concentrations observed by SEM
2.2 挤出物质构分析
挤出物的质构特性是评价挤出物品质优劣的重要标准[16-18]。TG添加量对豌豆蛋白挤出物质构的影响如表2所示。交联酶的添加在一定程度上会有利于挤出物各向异性结构的形成[10,19]。在一定范围内(0~1%),增加TG添加量,豌豆蛋白挤出物的硬度和咀嚼度均显著增大。当TG添加量在0.25%以上时,样品的硬度和咀嚼度显著大于未添加TG的豌豆蛋白挤出物。当TG添加量为1.00%时,硬度和咀嚼度最大,而弹性最小,约为0.79。但是随着TG添加量的进一步增加,挤出物的硬度和咀嚼度开始减小,原因可能是过量TG的加入由于其高浓度导致表面蛋白分子间快速且高度的交联,形成了致密的蛋白交联网络,进而阻碍了TG与蛋白分子的进一步交联。总而言之,TG诱导豌豆蛋白交联,增加了其硬度与咀嚼感,同时使弹性下降,进一步改善了其凝胶特性。
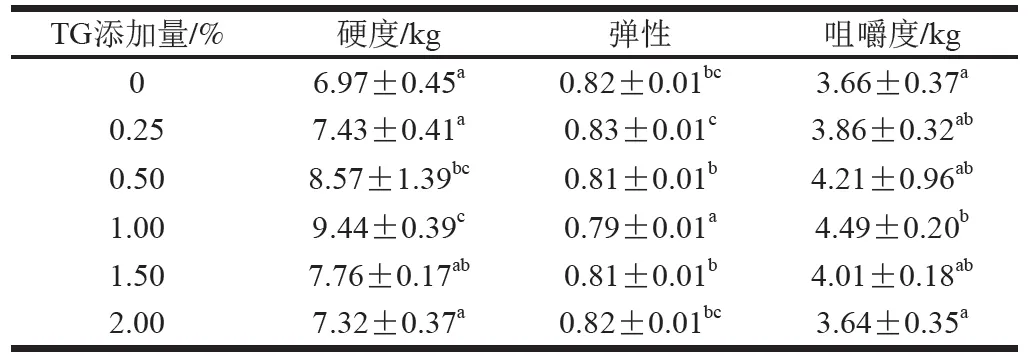
表2 TG添加量对豌豆蛋白挤出物质构特性的影响Table 2 Effects of TG concentration on the texture of pea protein extrudates
豌豆蛋白挤出物的组织化度随TG添加量的变化如表3所示。随着TG添加量(0%~1.00%)的逐渐增大,样品的平行切力、垂直切力以及组织化度与0% TG相比都有所提高,这是TG的交联作用造成的[20-21]。当TG添加量为1.00%时,样品的组织化度最高,而TG添加量超过1.00%,组织化度等指标又出现减小的趋势。由此说明,添加1.00% TG对豌豆蛋白的交联效果最好,此时豌豆蛋白挤出物的组织化度最高。
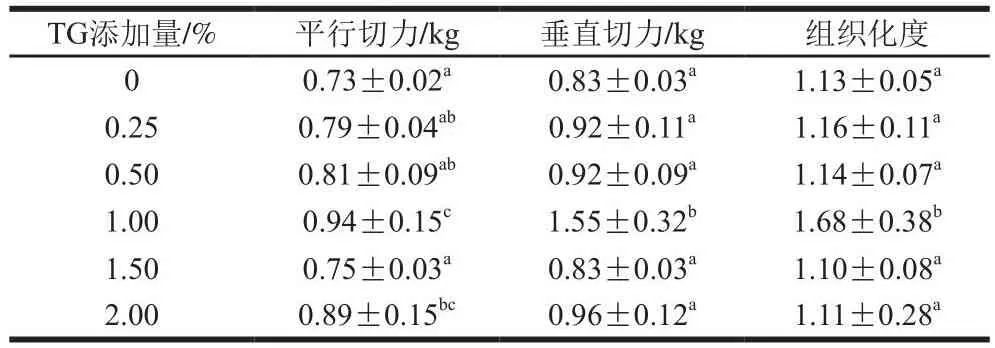
表3 TG添加量对豌豆蛋白挤出物组织化度的影响Table 3 Effects of TG concentration on the texturization degree of pea protein extrudates
2.3 蛋白质溶解度及分子间作用力分析结果
根据不同TG添加量诱导的豌豆蛋白挤出物在8 种浸提溶剂中的溶解度,计算得到挤出物化学键的变化,如表4所示。蛋白质分子间的相互作用力有很多种,包括共价键和非共价键及其交互作用[21]。与未添加TG的样品组相比,添加TG的挤出物样品氢键和二硫键数量有所减少,而氢键&二硫键交互作用以及疏水&二硫键交互作用有所增强。总体而言,随着TG添加量的增大,挤出物样品氢键和疏水相互作用的数量呈下降趋势,而氢键&疏水&二硫键作用呈上升趋势。而当TG添加量为0.50%时,氢键&二硫键的交互作用以及氢键&疏水&二硫键作用最强。
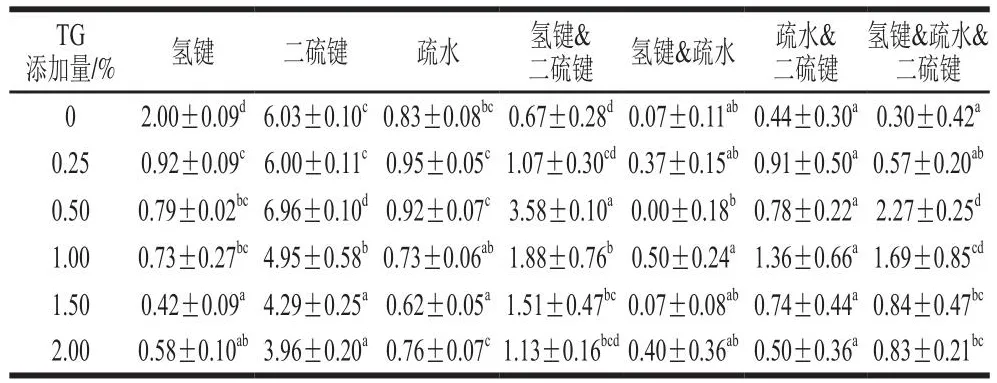
表4 TG添加量对豌豆蛋白挤出物化学键的影响Table 4 Effects of TG concentration on chemical bonds of pea protein extrudates
有研究表明,二硫键在确定挤出物结构的完整性和纤维形成方面起着关键作用[22]。而本研究中TG的诱导作用使得挤出物的二硫键数量随TG的添加量增加先增加后减少,但其仍然是维持豌豆蛋白挤出物结构的主要作用力,这与之前的研究结果[23]相似。与此同时,两种及多种化学键之间的交互作用也增强。
2.4 体外消化过程挤出物的粒度分析
由于在肠消化阶段挤出物的大部分纤维已被破坏,蛋白质已水解成肽和氨基酸,导致粒度不能准确检测,这里仅分析在胃消化30、60 min和120 min时消化物的粒度。从图3可知,在胃消化过程中,不同添加量TG诱导的豌豆蛋白挤出物的粒度存在明显差异。在胃消化30 min时,未添加TG的样品粒度最大,约为127 μm,与其他添加TG的挤出物存在显著差异(P<0.05)。这表明TG的加入促进了挤出物纤维结构的分解。经胃消化60 min后,挤出物样品的粒度呈现出减小的趋势,表明大部分纤维结构已被胃蛋白酶水解破坏[23]。当胃消化过程结束时,TG添加量为1.00%的挤出物样品粒度最小,即纤维结构的分解率最高。上述结果表明,TG的加入对挤出物在胃消化过程中的分解速率有很大影响。添加适量TG(1.00%)挤出物的分解率更高。
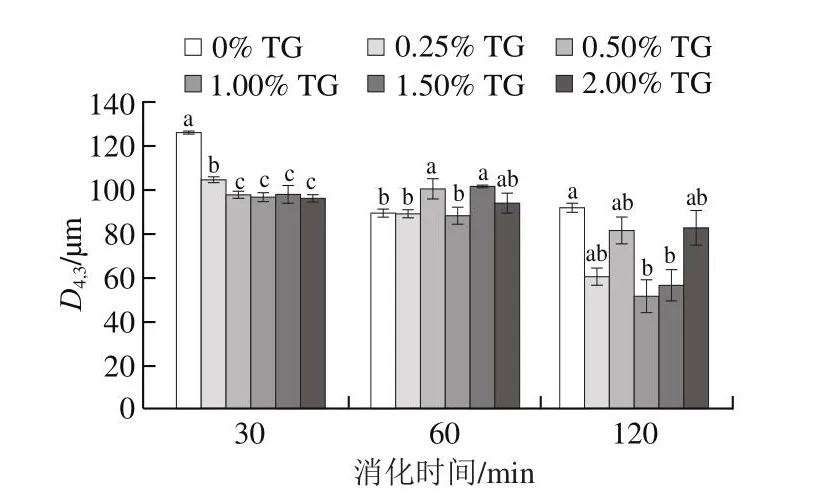
图3 在胃消化过程中不同添加量TG豌豆蛋白挤出物的粒度Fig.3 Particle size of pea protein extrudates with different TG concentrations during gastric digestion
2.5 体外消化过程挤出物的SDS-PAGE分析结果
使用SDS-PAGE验证不同TG诱导的豌豆蛋白挤出物和未添加TG的体外蛋白质消化情况。如图4所示,消化前,挤出样品中在蛋白胶泳道上方条带的强度高于未添加TG样品,这可能是由于在挤出过程中形成了蛋白质的聚集和交联。在挤压过程中,蛋白质经历了大约4 种主要的构象变化:分子链的展开、缔合、聚集以及潜在降解或氧化的交联[10]。在胃消化30 min后,可以明显看到所有样品的蛋白条带灰度下降,这表明蛋白质已被水解成肽和游离氨基酸,只有分子质量在44 kDa左右的蛋白条带仍然存在,研究表明该蛋白为11S球蛋白[24-25]。随着消化时间的延长,胃蛋白酶将大分子蛋白质(>180 kDa)分解,导致部分蛋白条带变清晰[24]。而大部分条带没有明显变化,说明蛋白水解主要发生在胃消化早期。
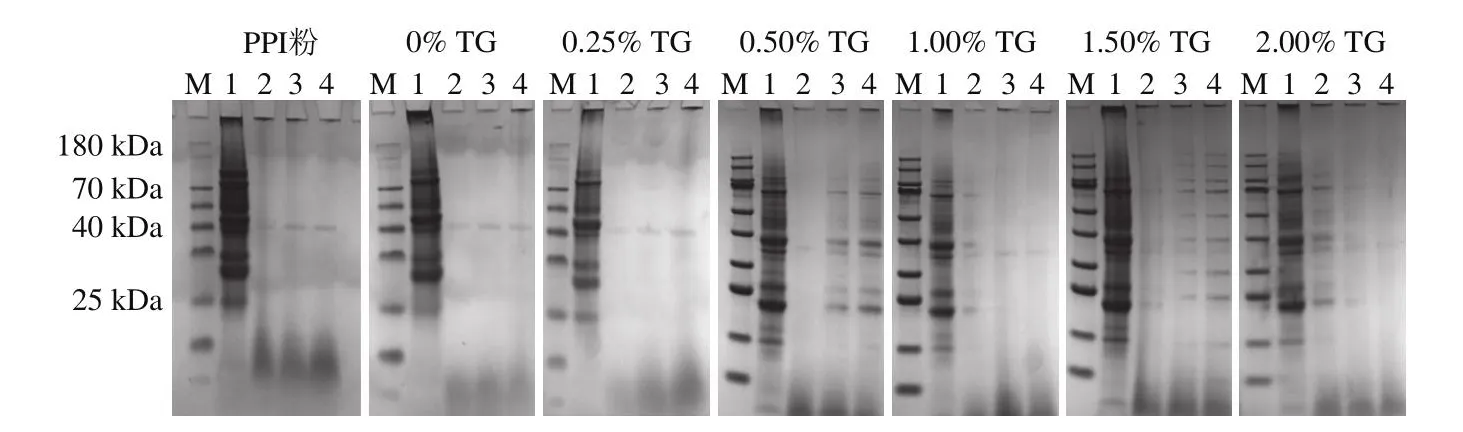
图4 胃消化过程中添加不同TG豌豆蛋白挤出物的SDS-PAGE图谱Fig.4 SDS-PAGE profiles of pea protein extrudates with different TG concentrations during gastric digestion
结合上述挤出物蛋白质分子间作用力的结果可以得出,挤压过程导致挤出物二硫键数量增多,使挤出物样品的大分子蛋白质含量高于PPI样品,并且TG的加入降低了二硫键的数量,造成了样品更易被胃蛋白酶分解。以上结果表明,豌豆蛋白中隐藏的疏水基团在TG的作用下暴露出来并与其他分子相互作用,而疏水基团的展开导致更多的胃蛋白酶底物受体位点暴露。这种机制可能是造成TG诱导的豌豆蛋白挤出物更易分解的原因。
2.6 体外消化过程挤出物的消化率分析结果
蛋白质的生物利用度通常通过消化率来评估[26-28]。TG对豌豆蛋白高水分挤出物在模拟胃肠消化下消化率的影响如表5所示。在胃消化30 min时,豌豆蛋白挤出物的消化率已经达到96%左右。这表明豌豆蛋白挤出物在胃中的消化速度更快,但在小肠中的消化速度较慢,这可能是由于绝大多数蛋白已在胃相中被消化,也有研究表明,豌豆蛋白的蛋白质类型、结构组织和膳食纤维更易被胃蛋白酶结合并分解[29-30]。在胃消化阶段,挤出处理后豌豆蛋白的消化率低于未挤出的豌豆蛋白(PPI粉),这说明在挤出过程中,热机械作用使豌豆蛋白的分子结构发生变化,更难被消化酶所分解。当TG添加量为2.00%的豌豆蛋白挤出物消化率远低于其他样品,这可能是过量的TG诱导导致形成的豌豆蛋白分子网络交联过于紧密,难以在短时间内分解完全[10]。在肠消化阶段,也有相似的趋势。

表5 TG添加量对豌豆蛋白挤出物消化率的影响Table 5 Effects of TG concentration on the digestibility of pea protein extrudates
2.7 体外消化过程挤出物的游离氨基酸分析结果
蛋白质只有在水解为单个氨基酸或短多肽后才会在肠道中吸收。因此,消化过程中产生的游离氨基酸量可用于反映蛋白质的消化率和生物利用度[24,31]。高水分挤压和使用酶制剂处理会导致蛋白质变性或者使蛋白发生分子间交联,从而导致蛋白质聚集,影响消化酶的效果和氨基酸的释放。
TG处理对豌豆蛋白挤出物在胃肠消化过程中游离氨基酸释放的影响如表6、7所示。有研究表明,挤压过程可能有利于美拉德反应的进行,经过挤压处理的蛋白,其分子结构会发生很大的变化,会出现游离氨基酸含量降低,蛋白亚基发生聚集等现象[30]。在胃消化120 min时,挤出后的豌豆蛋白样品释放的游离氨基酸总量均小于PPI粉,这表明挤出过程缓解了豌豆蛋白游离氨基酸的释放。而随着TG添加量的增加,豌豆蛋白挤出物的总氨基酸释放量呈现出先增加后减小的趋势,当TG添加量为1.00%时,挤出物样品的游离氨基酸的总释放量达到最大值,为707.62 mg/mL。这表明TG在一定的添加量范围内(0%~1.00%),能够促进游离氨基酸的释放。样品的消化率也呈现类似的变化趋势。肠消化120 min后,未被挤压的PPI粉的总游离氨基酸释放量要高于豌豆蛋白挤出物。而在豌豆蛋白挤出物中,添加0.50% TG的样品的游离氨基酸总释放量最高。这与样品的消化率呈现出相似的变化趋势。同时这也表明挤压可以增强蛋白样品的耐消化程度,并且可以通过改变TG的添加量来调节游离氨基酸的释放。
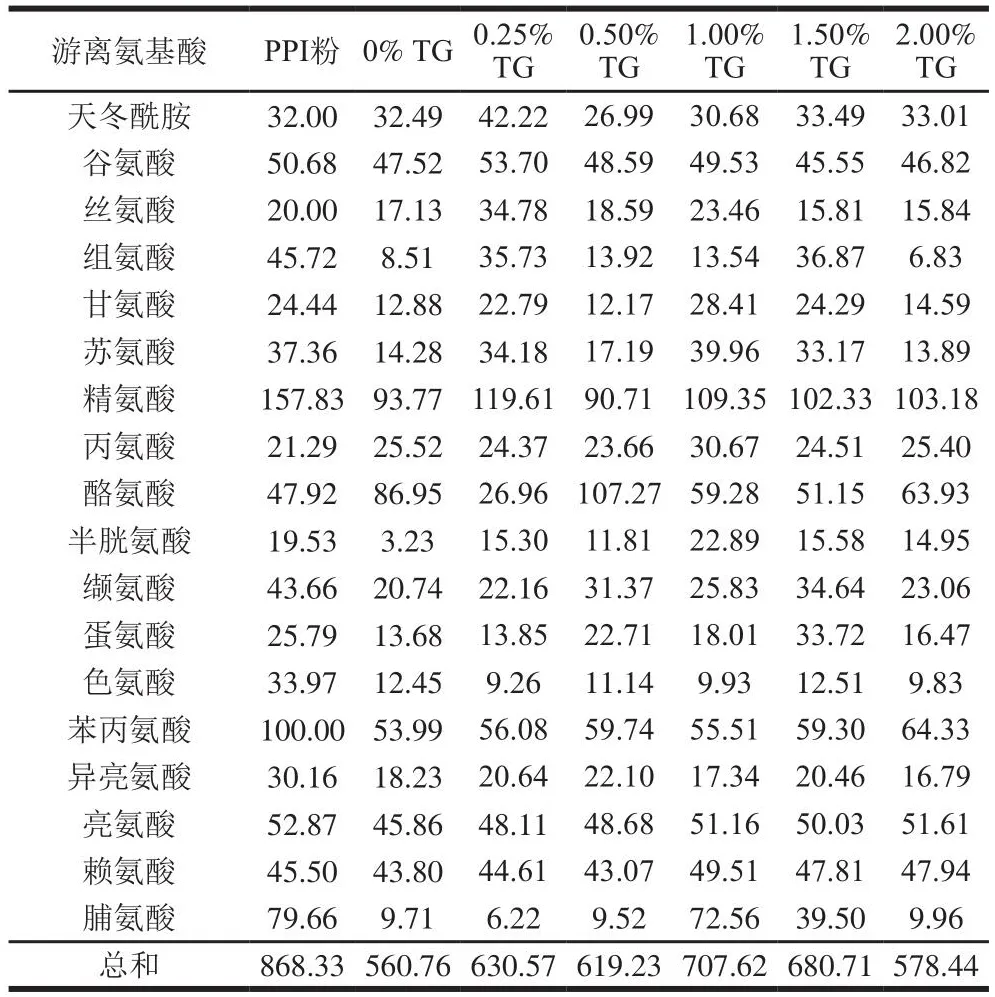
表6 体外胃消化120 min后样品的游离氨基酸的释放量Table 6 Release of free amino acids from pea protein extrudates after in vitro gastric digestion for 120 min mg/mL
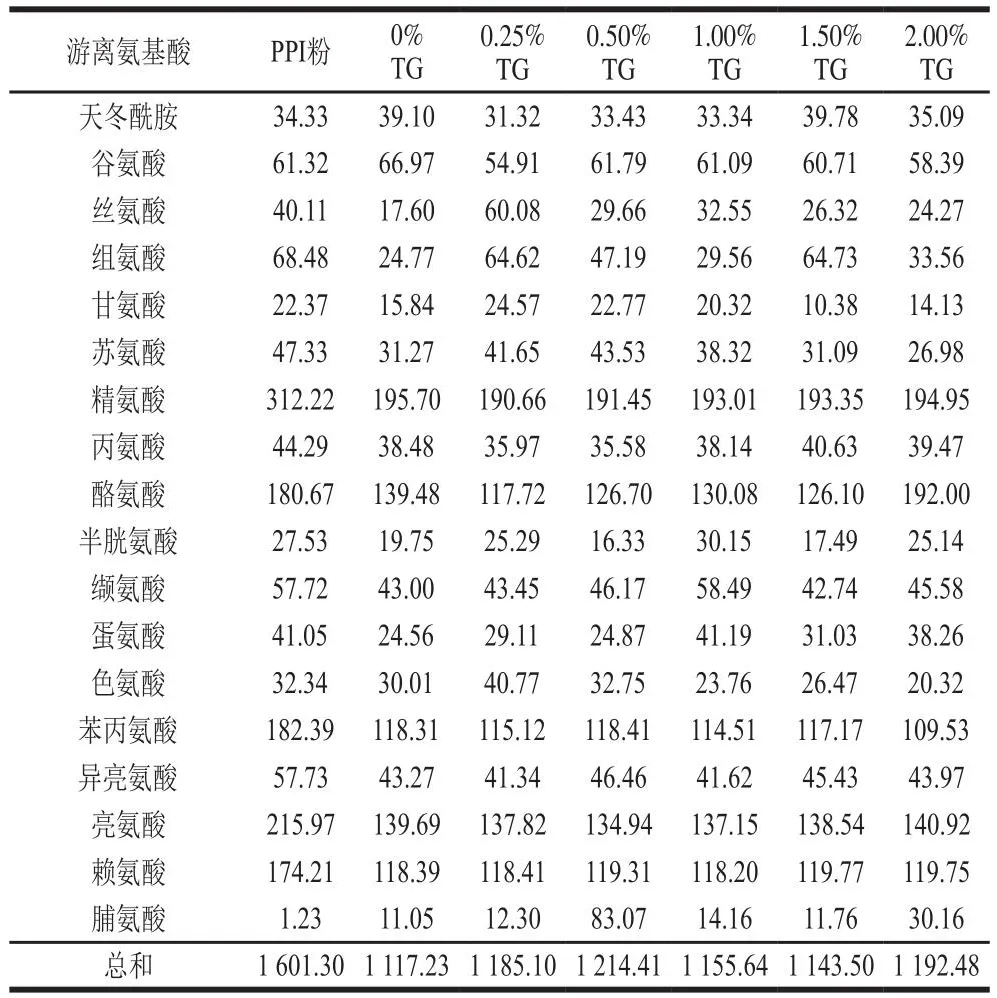
表7 体外肠消化120 min后样品的游离氨基酸的释放量Table 7 Release of free amino acids from pea protein extrudates after in vitro intestinal digestion for 120 min mg/mL
3 结 论
本研究表明,相比于未添加TG样品,适量添加TG的豌豆蛋白高水分挤出物的组织化度有所升高。通过对不同添加量TG的豌豆蛋白挤出物进行宏观和微观观察,发现添加1.00% TG的样品更具有类似肉类的纤维结构,TG通过其交联作用增强了挤出物的纤维特性。同时体外消化实验表明挤压过程中的热-机械处理使蛋白质分子变性,从而导致其消化率降低。通过对不同添加量TG诱导的豌豆蛋白挤出物胃食糜进行SDS-PAGE蛋白凝胶电泳和游离氨基酸分析,发现添加1.00% TG的样品更易消化,且游离氨基酸释放量较多,更易于人体吸收利用。该研究表明TG作为交联剂在高水分挤压生产中有广阔的应用潜力,有利于开发出具有较高营养价值的肉类类似物。
