壳寡糖对过氧化氢诱导肝细胞损伤的改善作用及机制
2023-04-06侯智兴茅洪维龚劲松许泓瑜许正宏史劲松
刘 朋,侯智兴,茅洪维,李 恒,*,龚劲松,蒋 敏,许泓瑜,许正宏,史劲松,*
(1.糖化学与生物技术教育部重点实验室,江南大学生命科学与健康工程学院,江苏 无锡 214122;2.上海市农业科学院食用菌研究所,上海 201403;3.江南大学生物工程学院,江苏 无锡 214122;4.粮食发酵与食品生物制造国家工程研究中心,江苏 无锡 214122)
氧化应激与多种疾病的发生发展相关,其引起的过量氧自由基或活性氧(reactive oxygen species,ROS)可以导致DNA和细胞大分子大规模损伤,如改变膜的流动性和通透性、破坏细胞骨架、促进蛋白变性等,最终引起细胞凋亡、癌变等在内的细胞功能障碍现象[1-2]。因此,抗氧化应激治疗成为改善疾病进程的有效策略之一。壳寡糖(chitooligosaccharides,COS)作为自然界中的一种低聚寡糖,具有抗肿瘤、抗凝、伤口修复、抗氧化等生理活性。此外,COS在酒精性肝损伤、脂肪肝、肝癌等多种肝脏疾病中均表现出较好的改善效果,但其具体作用机制仍然不清楚[3-5]。鉴于氧化应激在肝脏疾病中的重要作用[6-7],本实验利用过氧化氢(H2O2)诱导肝细胞L-02建立氧化应激细胞损伤模型,分析COS对其保护作用,为COS的保肝作用提供理论参考。
1 材料与方法
1.1 材料与试剂
COS(聚合度2~4) 扬州日兴生物科技股份有限公司;胎牛血清 以色列Biological Industries公司;胰蛋白酶、青霉素-链霉素、活性氧荧光探针(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)上海碧云天生物试剂公司;逆转录试剂盒 上海翊圣生物科技有限公司;RPMI 1640培养基、H2O2美国Sigma-Aldrich公司;SYBR Green Mix试剂盒 瑞士Hoffmann-La Roche公司;细胞毒性实验细胞计数(cell counting kit-8,CCK-8)试剂盒 日本同仁公司。
1.2 仪器与设备
Multiskan MK3全波长酶标仪 德国Eppendorf公司;CFX96 Touch荧光定量聚合酶链反应分析仪美国Bio-Rad公司;CytoFlex流式细胞仪 美国Beckman公司;实时单细胞多模态分析仪 江苏瑞明生物科技有限公司;TCS SP8激光共聚焦显微镜 德国Leica公司。
1.3 方法
1.3.1 细胞培养
L-02细胞生长在含10%胎牛血清、1%青霉素-链霉素双抗的RPMI 1640培养基中,于37 ℃、5% CO2的环境中培养。
1.3.2 L-02细胞存活率检测
待细胞生长至对数期后,用胰蛋白酶消化以获得细胞悬液,96 孔板中每孔加入相同体积的L-02细胞悬液(1.2×104个),静置培养24 h。弃上清液,并加入添加或不添加COS(终质量浓度31.25、62.5、125、250、500、1 000 µg/mL)的新鲜培养基继续培养24 h。然后吸弃每孔培养基,用pH 7.5磷酸盐缓冲溶液(phosphatebuffered saline,PBS)冲洗3 遍,更换含10% CCK-8溶液的无血清培养基,避光孵育1.5~2.0 h后于450 nm波长处检测OD值,根据下式计算细胞存活率。
1.3.3 H2O2刺激L-02细胞氧化应激模型的建立
96 孔板每孔加入同体积L-02细胞悬液(1.2×104个),待细胞贴壁后,添加不同浓度H2O2(0.5、1、2、4、8 mmol/L)继续培养1 h。然后通过CCK-8检测不同分组细胞在450 nm波长下的吸光度,细胞存活率计算同1.3.2节,通过计算细胞存活率以确定H2O2造模浓度。
同体积的L-02细胞悬液加入96 孔板中(1.2×104个)。细胞分为对照组、模型组(H2O2组)、低剂量组(质量浓度100 µg/mL COS)、中剂量组(质量浓度200 µg/mL COS)和高剂量组(质量浓度400 µg/mL COS)。待细胞完全贴壁后,根据分组不添加或添加不同质量浓度的COS至培养基中继续培养24 h,在最后1 h时加入H2O2(终质量浓度为1 mmol/L、母液浓度为880 mmol/L)。后续细胞存活率检测同1.3.2节,ROS水平分析方法见1.3.4节。
1.3.4 ROS水平测定
激光共聚焦显微镜分析:细胞处理参照1.3.3节。细胞在H2O2处理后,去掉培养基并用PBS清洗3 遍后,加入10 mmol/L DCFH-DA探针(终浓度为10 µmol/L),避光37 ℃孵育30 min后,无血清培养基清洗3 遍。然后加入Hoechst 33342探针孵育15 min进行细胞核复染。最后,在发射波长(λex)/激发波长(λem)=488 nm/525 nm和λex/λem=346 nm/460 nm条件下经激光共聚焦显微镜拍照观察。
流式细胞仪分析:步骤同上,在获得细胞悬液(1×106个/100 µL)后加入1 µL DCFH-DA探针避光37 ℃孵育30 min后,850 r/min离心3 min,PBS清洗掉未进入细胞的游离探针。最后重悬于PBS中,选择荧光素5-异硫氰酸酯(fluorescein isothiocyanate,FITC)通道进行流式细胞仪分析。
单细胞纳米生化分析:步骤同上,分析质量浓度400 µg/mL COS对损伤单细胞的保护作用。细胞经H2O2处理后,倒掉培养基并用PBS清洗3 遍后,更换0.5 mL新鲜无血清培养基。参照Zheng Xinting等[8-9]方法,在正常1640培养基中孵育,记录稳态背景荧光(F0),之后将光纤纳米探针精确插入单个细胞的细胞质中,随即在培养基中添加0.5 mL质量浓度20 µmol/L DCFH-DA探针溶液,通过荧光检测系统在单个细胞中测定荧光强度(F1)以动态观察胞内ROS水平变化情况。
1.3.5 线粒体膜电位变化测定
细胞处理参照1.3.3节。在获得细胞悬液(1×106个/100 µL)后加入质量浓度5 µg/mL罗丹明123探针避光37 ℃孵育30 min后,850 r/min离心3 min,PBS清洗去掉未入胞的游离探针。最后重悬于PBS中,选择FITC通道进行流式细胞仪分析。
1.3.6 荧光定量聚合酶链式反应分析
分离总RNA后,根据Hifair®III 1st Strand cDNA Synthesis SuperMix试剂盒将0.5 µg RNA逆转成目标cDNA。反应体系为200 ng cDNA,各5 nmol/L的上下游引物,SYBR Green混合物,总体系体积为10 µL,在95 ℃15 s、60 ℃ 30 s条件下反应,共40 个循环。测定核因子E2相关因子2(nuclear factor E2 p45-related factor 2,Nrf2)、血红素氧合酶1(heme oxygenase-1,HO-1)、白细胞介素(interleukin,IL)-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、半胱氨酸蛋白酶3(Caspase3)、半胱氨酸蛋白酶 9(Caspase9)、β细胞淋巴瘤-2(β-cellymphoma-2,Bcl-2)、Bcl-2相关蛋白X(Bcl-2-associated X protein,Bax)和β-肌动蛋白(β-actin)基因的相对表达水平,并用2-ΔΔCT方法进行分析。引物序列见表1。

表1 荧光定量聚合酶链式反应引物序列Table 1 Primer sequences used for florescence quantitative polymerase chain reaction
1.4 数据统计与分析
实验结果以平均值±标准差表示,数据采用单因素方差分析,P<0.05具有显著性差异。所有数据结果用GraphPad Prism 5软件分析并作图。
2 结果与分析
2.1 COS对L-02细胞存活率的影响
COS处理24 h后,与对照组比较,COS在质量浓度31.25~1 000 µg/mL范围内对L-02细胞增殖能力无显著影响(P>0.05)(图1)。
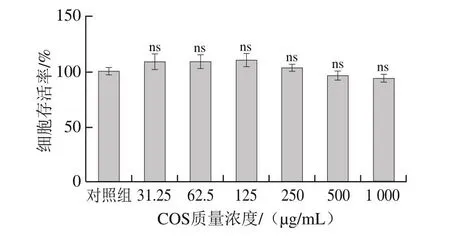
图1 COS对L-02细胞存活率的影响Fig.1 Effect of COS on L-02 cell viability
2.2 H2O2对L-02细胞氧化应激模型的影响
由图2可知,随H2O2浓度的增加,L-02细胞增殖活力逐渐降低,与对照组比较,当1 mmol/L H2O2刺激细胞1 h时细胞存活率显著下降(P<0.05),而且细胞形态表现出明显的皱缩、变圆及触角断裂等变化。综合考虑,选择1 mmol/L H2O2诱导L-02细胞1 h进行后续实验。

图2 H2O2对L-02细胞增殖的抑制作用Fig.2 Inhibitory effect of H2O2 on proliferation of L-02 cells
2.3 COS对损伤L-02细胞增殖活力的改善作用
如图3所示,相较于对照组,H2O2组细胞增殖活力显著降低(P<0.05)。与H2O2组相比,低剂量组(质量浓度100 µg/mL COS)对细胞增殖活力无显著改善作用(P>0.05),而中剂量和高剂量COS可以显著提高H2O2损伤L-02细胞的增殖活力(P<0.05)。进一步观察细胞形态变化发现,COS明显改善了氧化应激导致的细胞皱缩、变圆等状态。
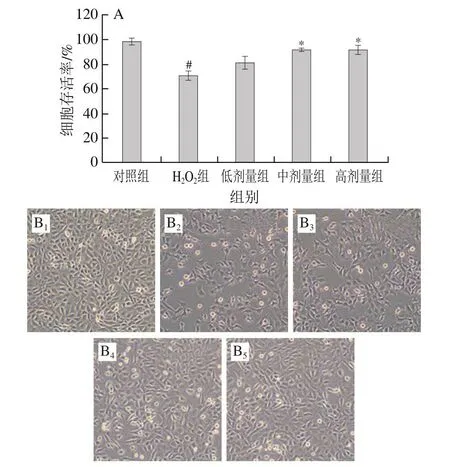
图3 COS对H2O2损伤L-02细胞的改善作用Fig.3 Ameliorative effect of COS on proliferation and morphology of H2O2-injured L-02 cells
2.4 COS对损伤L-02细胞ROS水平的改善作用
DCFH-DA是检测ROS的最常用探针,本身无荧光,渗透进胞内后荧光强度与ROS水平成正比。经DCFH-DA探针检测后发现,与对照组比较,H2O2组的荧光强度明显增强,经COS处理后的细胞荧光强度则呈下降趋势(图4A)。通过流式细胞仪定量分析发现,H2O2组平均荧光强度高度显著高于对照组(P<0.001),与H2O2组比较,COS中高剂量组平均荧光强度显著降低(P<0.05)(图4B)。另外,通过单细胞纳米生化分析仪检测发现,加入DCFH-DA探针后,与对照组比较,H2O2组细胞的荧光强度逐渐增强,高剂量COS干预组细胞的荧光强度则明显低于H2O2组,结果表明,COS处理后可以缓解胞内ROS水平升高(图5)。
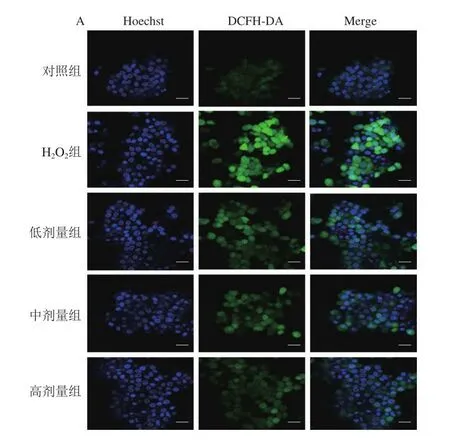
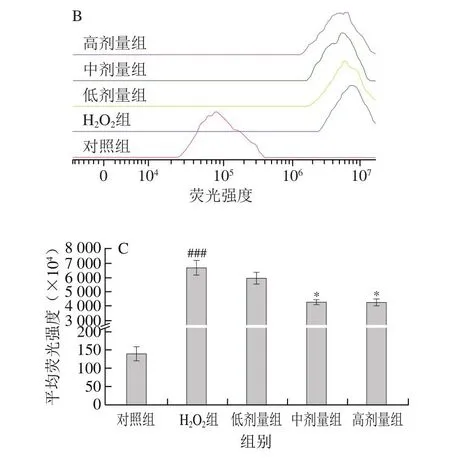
图4 COS对H2O2损伤L-02细胞ROS水平的改善作用Fig.4 Effect of COS on ROS level in H2O2-injured L-02 cells
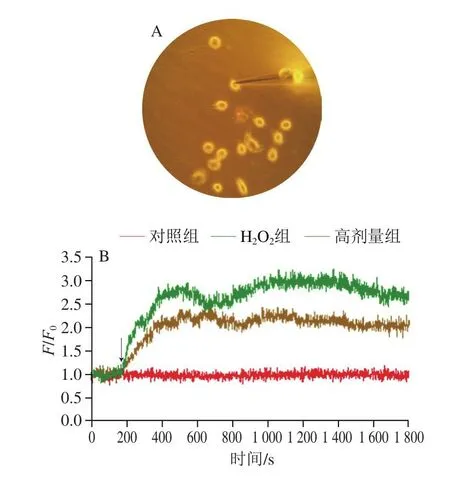
图5 L-02单细胞中ROS水平变化Fig.5 Changes in ROS level in single L-02 cells
2.5 COS对损伤L-02细胞线粒体膜电位变化的影响
线粒体膜电位的下降象征了细胞凋亡现象的发生。如图6所示,相较于对照组,H2O2组中线粒体膜电位下降的细胞占比高度显著提高(P<0.001)。与H2O2组相比,质量浓度200 µg/mL和400 µg/mL COS处理则极显著或高度显著降低了该部分细胞的占比(P<0.01、P<0.001)。以上结果说明COS的处理能够明显改善由H2O2造成的L-02细胞凋亡。
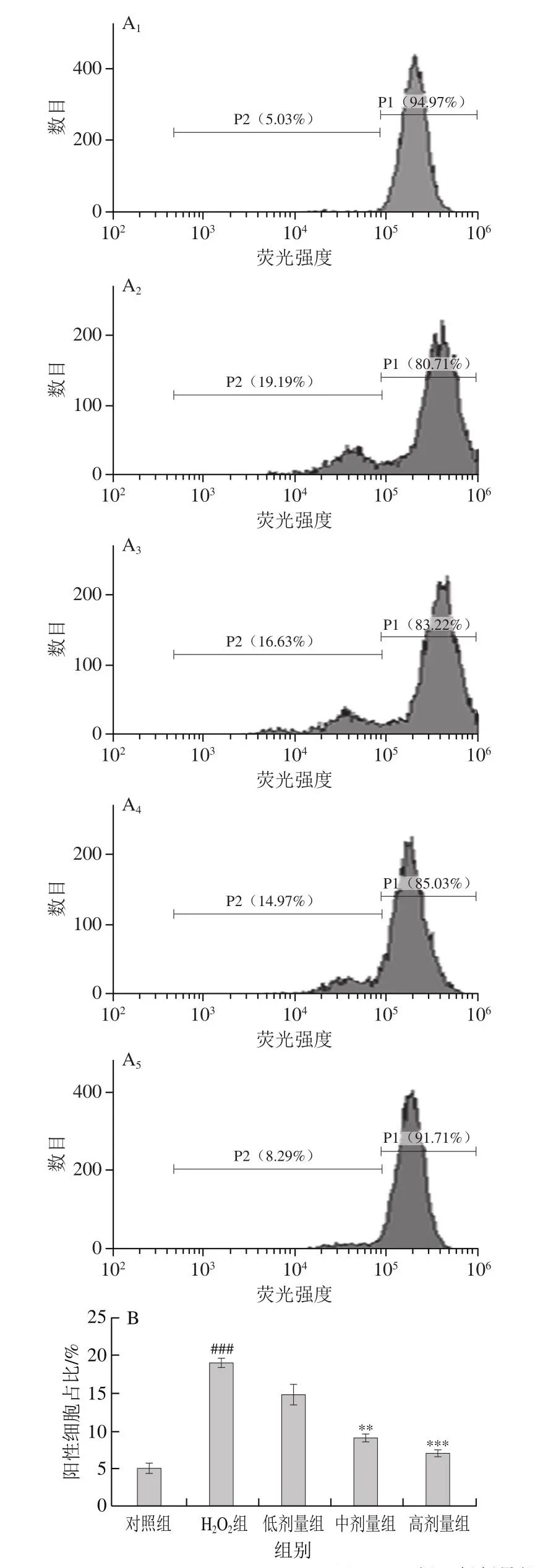
图6 COS对H2O2损伤L-02细胞线粒体膜电位变化的影响Fig.6 Effect of COS on mitochondrial membrane potential of H2O2-injured L-02 cells
2.6 COS对H2O2损伤L-02细胞炎症和凋亡相关基因mRNA相对表达量的影响
鉴于氧化应激损伤与细胞凋亡之间具有直接关系,为进一步评估COS对损伤细胞的修复作用,本实验探究了损伤细胞炎症、凋亡相关基因的mRNA相对表达量。如图7所示,与对照组比较,H2O2组细胞炎症因子相关基因IL-6、TNF-α和凋亡相关基因Caspase 3、Caspase 9、BaxmRNA相对表达量极显著或高度显著提高(P<0.01、P<0.001);与H2O2组相比,COS处理后细胞炎症因子相关基因和凋亡相关基因存在下降趋势,而与对照组比较,Bcl-2mRNA相对表达量在H2O2组细胞中高度显著下降(P<0.001)。经COS处理后,Bcl-2mRNA相对表达量较H2O2组显著升高(P<0.05、P<0.01、P<0.001)。
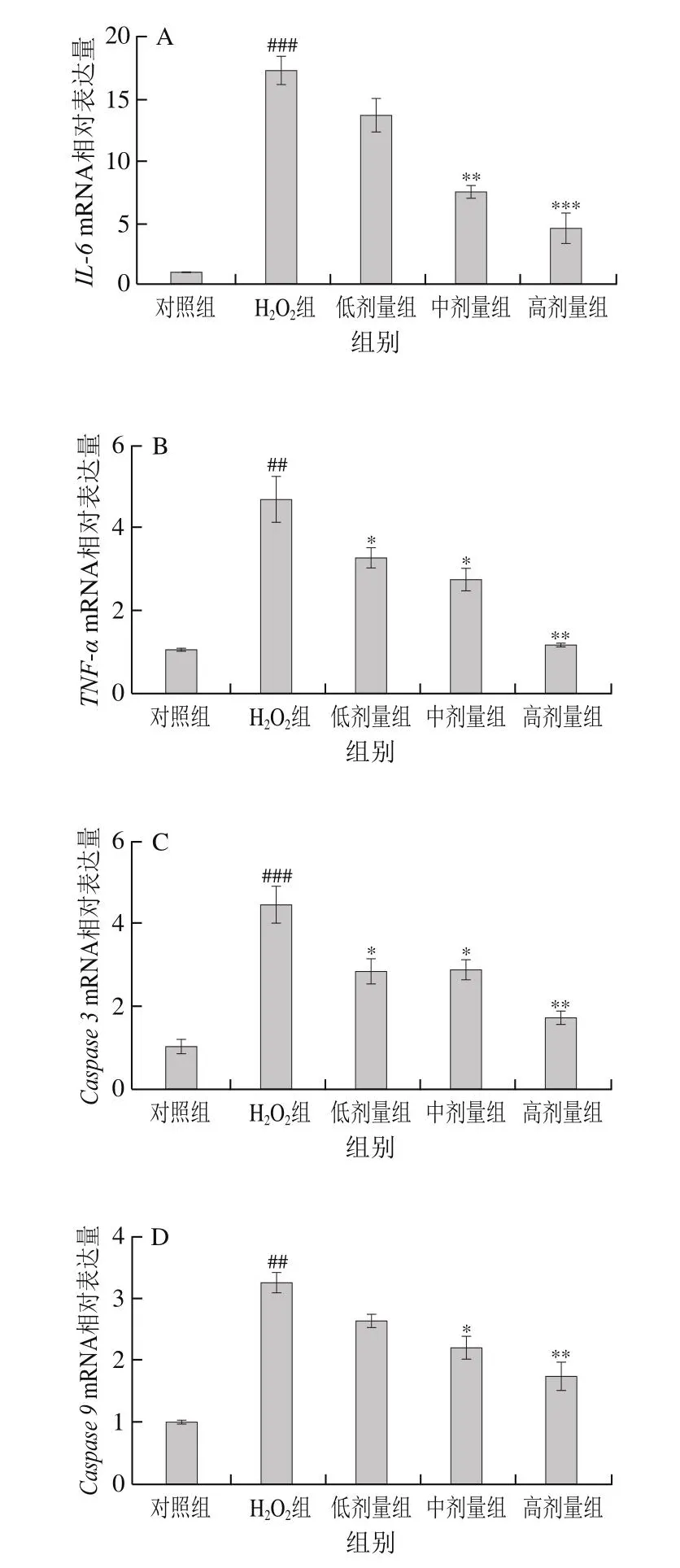
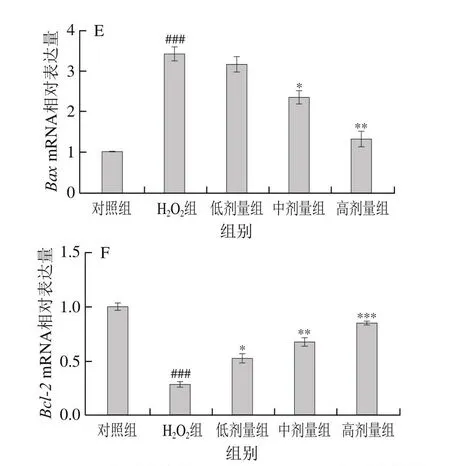
图7 COS对H2O2损伤L-02细胞炎症和凋亡相关基因水平的影响Fig.7 Effect of COS on mRNA expression levels of inflammation- and apoptosis-related genes in L-02 cells injured by H2O2
2.7 COS对H2O2损伤L-02细胞Nrf2/HO-1通路的调控作用
转录调节因子Nrf2与其下游调控因子HO-1二者通过级联反应在氧化应激反应中发挥关键作用。为探究COS的潜在作用机制,分析了Nrf2和HO-1mRNA相对表达量。如图8所示,与对照组比较,H2O2组细胞Nrf2、HO-1mRNA相对表达量高度显著或极显著提高(P<0.001、P<0.01);与H2O2组相比,中、高剂量COS孵育后Nrf2、HO-1mRNA相对表达量显著或极显著下降(P<0.05、P<0.01)。这说明Nrf2/HO-1通路可能参与了COS抗L-02细胞损伤的作用过程中。
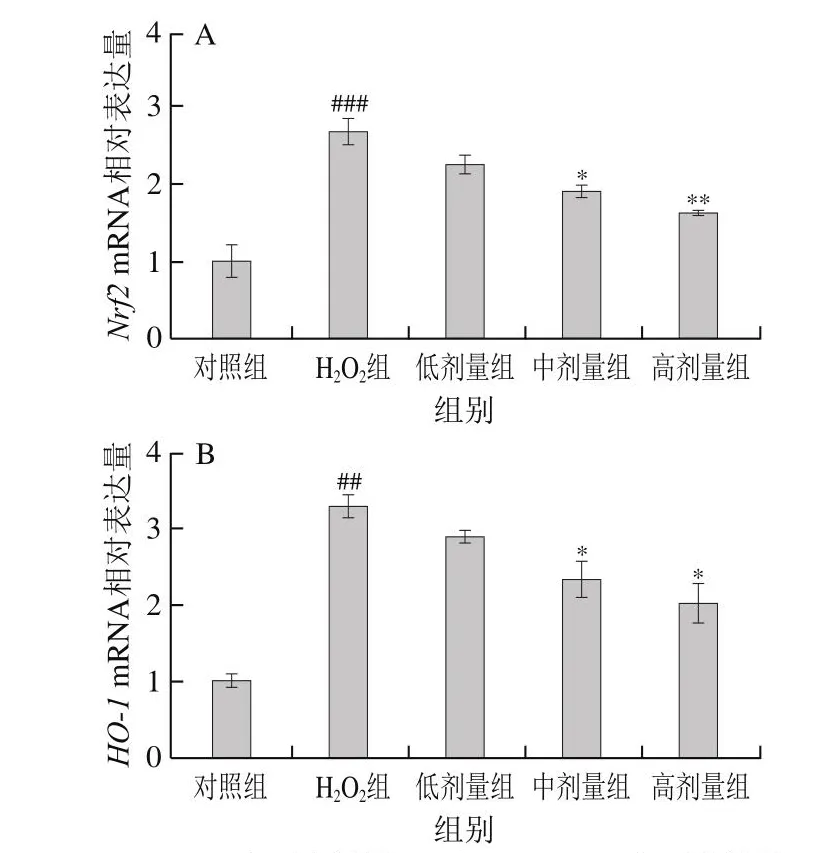
图8 COS对H2O2损伤L-02细胞Nrf2/HO-1通路的影响Fig.8 Effect of COS on Nrf2/HO-1 signaling pathway in H2O2-injured L-02 cells
3 讨 论
氧化应激反应在肿瘤、炎症以及神经性疾病中均发挥重要作用,而肝脏作为机体主要的解毒器官,在物质代谢和解毒过程中极易受到氧化应激的损伤,从而引起肝脏的炎症、水肿甚至坏死现象发生[10-12]。机体内过量ROS的出现是氧化应激的主要表现形式,主要由肝脏中的线粒体产生,并由抗氧化酶、II相代谢酶等清除ROS,从而维持氧化还原系统的稳态[13-14]。然而有害刺激可以打破氧化应激的平衡状态,氧化应激刺激能够通过线粒体、死亡受体、内质网应激等途径直接介导细胞凋亡及病理损伤[15]。因此,以高水平ROS为特征的氧化应激与肝病的发生发展关系越来越密切,寻找具有高抗氧化能力的ROS清除剂显得十分有必要。
COS作为天然抗氧化剂,被广泛应用于功能性食品的开发利用,已有报道显示COS拥有抗炎、降血脂、降血糖、心脑血管疾病保护等独特的生理活性[5-7,16-18]。H2O2通过诱导ROS的过量产生导致蛋白质变性或脂质损伤,是诱导氧化应激模型最常用的促氧化剂[19]。本实验通过H2O2诱导肝细胞L-02氧化应激反应,用来探究COS对肝细胞氧化应激的改善效果。结果发现,COS可以降低H2O2诱导L-02细胞氧化应激的ROS水平,改善细胞增殖活力及细胞病理状态。监测单个细胞内ROS动态变化有助于了解COS对其作用机制,结果发现在给予H2O2刺激后,与对照组相比,未经COS处理的L-02细胞内ROS水平高度显著升高(P<0.001),然而,COS处理组的胞内ROS水平则一定程度上低于H2O2组。
鉴于氧化应激与细胞凋亡具有直接诱导关系,因此,评估COS对损伤L-02细胞凋亡的保护作用十分有意义。细胞生理功能的正常发挥依赖于线粒体内膜两侧形成的梯度电位,因此,线粒体膜电位的下降是细胞早期凋亡的一种表现形式[20]。当细胞受到氧化应激刺激时,会诱导线粒体膜电位降低或丧失,能量耗尽,而导致细胞凋亡[21-23]。在H2O2诱导的L-02细胞氧化应激模型中,线粒体膜电位明显下降,COS可以显著改善损伤细胞的线粒体膜电位下降情况。Caspase 3作为Caspase家族成员之一,是参与细胞凋亡过程的关键蛋白酶,扮演着细胞凋亡实施者的角色[24]。Bcl-2和Bax是目前已知的Caspase 3上游调控基因,Bax在外界刺激因素下可以聚集到线粒体膜上,并通过形成多聚体形式破坏线粒体膜,从而影响膜内离子浓度,促进促凋亡因子的释放[25-26]。促凋亡因子会激活Caspase 9,而活化的Caspase 9进一步诱导Caspase 3活化。但是Bcl-2的高表达可以抑制促凋亡因子的释放,平衡氧化应激反应,阻断凋亡进程[27]。本研究中COS可以抑制H2O2诱导的L-02细胞氧化应激模型中Caspase 3、Caspase 9、Bax基因水平的高表达,提高Bcl-2基因水平,进一步体现出COS对损伤细胞的抗凋亡效果。有研究发现,COS在神经元损伤和肠道氧化应激损伤中均可以通过降低Caspase家族的表达水平从而发挥保护作用[28-29]。这与本实验结果基本一致。Nrf2作为细胞氧化应激的关键蛋白,介导着胞内凋亡、炎症等多种生理反应,可增强下游抗氧化酶的表达,在机体抗氧化应激过程中起重要作用。然而,本研究结果显示,与对照组比较,H2O2刺激提高细胞中Nrf2基因的表达水平,且COS可逆转其水平。陈晶晶等研究发现,H2O2亦可诱导SH-EP1细胞中Nrf2的高表达[30]。在生理状态下,Nrf2以非活性形式存在于细胞质内,在机体处于应激状态时,会进入细胞核发挥其级联效应。故在后续实验中,应进一步检测细胞核内Nrf2及其下游因子的蛋白水平变化情况,以剖析COS改善L-02细胞氧化应激损伤的作用机制。
综上,COS可改善H2O2诱导L-02细胞的凋亡和氧化应激损伤,研究结果可为COS的进一步功能评价和应用提供一定的参考。
