嗜黏蛋白阿克曼氏菌对高尿酸血症小鼠血清尿酸及组织炎症的影响及机制
2023-04-06张里华刘佳秀夏效东
张里华,刘佳秀,夏效东*
(大连工业大学食品学院,国家海洋食品工程技术研究中心,辽宁 大连 116034)
高尿酸血症是一种代谢性疾病,它的病因主要是人体内嘌呤代谢紊乱导致体内尿酸生成过多或者尿酸排泄过少[1]。近些年随着人们生活水平的提高以及富含嘌呤食物摄入量的增多,高尿酸血症发病率不断提高,同时该病患者发病年龄也有降低的趋势[2]。由于高尿酸血症与痛风高度相关,因此探索控制高尿酸血症的有效方法具有重要的现实意义。肝脏是体内尿酸合成的主要部位,有多种酶参与尿酸的合成,其中黄嘌呤氧化酶(xanthine oxidase,XOD)是体内尿酸合成的关键酶,它能催化尿酸前体物质生成尿酸,体内尿酸含量与XOD活性和表达量息息相关[3]。XOD也是目前降尿酸药物的重要作用靶点,目前已有研究表明某些具有降尿酸效果的天然产物和益生菌也能通过抑制XOD改善高尿酸血症。研究发现槐花提取物能有效降低小鼠尿酸水平,而槐花提取物中含有的异鼠李素就被证实是一种有效的黄酮类XOD抑制剂[4]。益生菌方面,有研究发现鼠李糖乳杆菌R31、鼠李糖乳杆菌R28-1和罗伊氏乳杆菌L20M能有效抑制XOD活性,缓解小鼠高尿酸血症[5]。
研究表明高尿酸会导致体内炎症的发生[6]。当体内尿酸过多时会沉积形成结晶,造成相关部位出现病理损伤,同时伴随相应的炎症反应,研究表明高尿酸血症患者可以通过调控炎症来达到改善疾病程度的目的[7]。因此炎症也是侧面反映高尿酸血症程度的重要指标[8]。先前的研究发现仙草提取物、鹅肌肽能减轻由高尿酸血症引发的炎症反应,其中核因子κB信号通路在其中发挥重要作用[9-10],同时也有研究表明通过调节白细胞介素(interleukin,IL)-6的表达也能改善小鼠体内尿酸水平[11]。此外,Toll样受体4(Toll-like receptors 4,TLR4)和Caspase 1能调控IL-1β的产生[12-13]。荷叶碱能调控TLR4和IL-1β的表达,减轻炎症反应,从而有效缓解小鼠高尿酸血症[14]。有学者发现TLR4和NOD样受体蛋白(NOD-like receptor protein 3,NLRP3)交叉调控的炎症反应参与了高尿酸血症的发生或者发展,而且证实了TLR4和NLRP3交叉调控能激活IL-1β[15],这些研究均表明炎症与高尿酸血症有重要的关联。
由于现有的降尿酸类药物具有一定的副作用,研究人员仍在积极探索能改善尿酸水平的天然活性物质,如茶多酚、槲皮素、黄酮等均被报道有一定的降尿酸作用[16-17]。随着人们对发酵食品健康功效的逐渐重视,近年来有研究发现某些益生菌以及某些具有发酵作用的菌株也具有降尿酸的作用,例如浆水中分离的乳酸菌JL-3可降低小鼠体内尿酸水平[18]。嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila)于2004年首次被分离,嗜黏蛋白阿克曼氏菌目前被认为是下一代益生菌的代表菌株之一[19]。该菌在预防和改善肥胖、肠道炎症和糖尿病等方面具有显著的功效,也有研究发现它能减轻肥胖小鼠的炎症反应[20-22]。然而,目前鲜有研究探索该菌对高尿酸血症的影响。因此,本研究将活的以及巴氏杀菌处理的嗜黏蛋白阿克曼氏菌用于干预高尿酸血症模型小鼠,研究不同形式的嗜黏蛋白阿克曼氏菌对血清尿酸水平以及组织炎症的影响,并初步探讨其可能的机制。
1 材料与方法
1.1 动物、材料与试剂
6 周龄、雄性ICR小鼠购自辽宁省长生生物技术有限公司,生产许可证号:SCXK(辽)2020-0001。
A.muciniphila菌株(ATCC-BAA835)购自美国模式培养物集存库(American Type Culture Collection,ATCC)。
小鼠普通饲料 辽宁长生生物科技有限公司;20%酵母膏饲料 成都达硕实验动物有限公司;羧甲基纤维素钠、次黄嘌呤、氧嗪酸钾 上海麦克林生化科技股份有限公司;脑心浸萃液体培养基(brain heart infusion,BHI) 北京陆桥技术股份有限公司;黏蛋白、L-半胱氨酸 美国Sigma公司;硝酸纤维膜 美国Pall公司;尿酸检测试剂盒、凝胶制备试剂盒 北京索莱宝科技有限公司;XOD活性检测试剂盒 南京建成科技有限公司;极超敏ECL化学发光试剂盒、Caspase 1 上海碧云天生物技术有限公司;β-actin 美国Cell Signaling Technology公司;XOD 武汉Proteintech公司;IL-1β英国Abcam公司;TLR4 武汉Abclonal公司。
1.2 仪器与设备
Infinite M200多功能酶标仪 瑞士Tecan公司;荧光倒置显微镜 日本Nikon公司;电泳仪 美国Bio-Rad公司;凝胶成像系统 以色列DNR生物影像系统有限公司。
1.3 方法
1.3.1A.muciniphila菌液制备
A.muciniphila菌株在厌氧培养工作站进行菌种培养。通过离心(8 000×g、10 min、常温)收集培养48 h的A.muciniphila菌体,用无菌磷酸盐缓冲液(phosphate buffered saline,PBS)调节菌液浓度为109CFU/mL,巴氏杀菌的A.muciniphila则在离心重悬后置于70 ℃水浴30 min。
1.3.2 动物模型构建
动物实验由大连工业大学大学动物伦理委员会批准(批准号:DLPU2020016),并遵循国家、国际动物实验伦理原则开展。所有小鼠平均分成4 个小组(模型组:Model;空白对照组:Con;灌胃活菌A.muciniphila组:L-AKK;灌胃巴氏杀菌A.muciniphila组:P-AKK),每组8 只小鼠。小鼠均置于SPF等级的动物实验房饲养,12/12 h明暗循环。小鼠在动物房适应一周开始实验。Con组小鼠给予正常饲料,Model、L-AKK和P-AKK组则使用含有20%(以体系质量计)酵母膏的特制饲料。所有的建模药物均以质量分数0.05%羧甲基纤维素钠为溶剂,A.muciniphila则以无菌PBS重悬。每天早上9点开始灌胃,Con组灌胃质量分数0.05%羧甲基纤维素钠,Model、L-AKK和P-AKK组按体质量灌胃280 mg/kgmb氧嗪酸钾、100 mg/kgmb次黄嘌呤。间隔6 h后Con和Model组灌胃无菌PBS,L-AKK和P-AKK组分别灌胃活的A.muciniphila菌和巴氏杀菌的A.muciniphila菌(浓度均为109CFU/mL)。所有灌胃剂量约为0.2 mL,连续灌胃21 d。
1.3.3 采集血液和组织样品
小鼠在处死前禁食8 h,采取眼眶取血的方式,在常温静置1 h后离心(3 000×g、10 min)。组织样品经PBS洗涤后液氮冷冻,结束后转移至-80 ℃冰箱保存。
1.3.4 血清中尿酸浓度的测定
小鼠血清尿酸浓度采用试剂盒检测,严格按照试剂盒说明书进行操作。
1.3.5 肝脏中XOD活力检测
取100 mg肝脏,严格按照XOD活性检测试剂盒操作测定XOD活力。
1.3.6 肾和肠道病理切片观察
在处死小鼠时收集新鲜的肾脏和结肠部分样品,于质量分数4%多聚甲醛溶液中固定24~36 h,然后脱水,石蜡包埋。将包埋好的组织蜡块切成5 μm左右厚度的切片,然后采用苏木精-伊红染色法染色:组织切片放入烘箱中烘烤(60 ℃),用二甲苯进行脱蜡后,将切片依次放入体积分数为100%、95%、90%、80%、70%的乙醇溶液中进行复水。用苏木精对切片染色(30 s),染色完成后在流水下轻轻冲洗,洗去多余的苏木精。然后放入体积分数1%盐酸-乙醇溶液中进行分化,控制时间在7 s左右,再次用流水冲洗切片,直到组织变为蓝色。再将其放入伊红染液中复染。染色完成后,将切片置于体积分数依次为70%、80%、95%、95%、100%的乙醇溶液及二甲苯中进行透明处理。使用中性树脂对切片封片,于通风处晾干,在显微镜下观察小鼠肾和肠道组织病理变化,放大倍数为100。
1.3.7 蛋白质印迹转印
将保存于-80 ℃的组织样本置于冰上溶解,称取约20 mg组织样品放置于提前准备好的 RIPA裂解液(加入蛋白酶和磷酸酶抑制剂)中,使用珠式研磨器研磨充分,静置,然后离心(12 000×g、5 min、4 ℃)收集上清液。得到的上清液为蛋白质溶液。使用BCA蛋白质量浓度测定试剂盒进行蛋白质量浓度测定,将所有蛋白样品质量浓度调节为2 mg/mL。然后使用凝胶制备试剂盒根据目的蛋白分子质量制备凝胶。利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,再将其通过电泳转印到硝酸纤维膜上,用5%的脱脂牛奶封闭2 h,使用目的抗体(XOD、TLR4、Capase1、IL-1β)于4 ℃孵育过夜,经TBST洗涤后使用辣根过氧化物酶(即二抗)常温下摇床孵育2 h,用凝胶成像系统曝光观察。
1.4 数据处理与分析
所有数据均以平均值±标准差表示。采用双尾t检验评估各组之间的显著性差异,数据使用统计学软件GraphPad Prime 8进行统计分析。
2 结果与分析
2.1 L-AKK和P-AKK处理对小鼠血清尿酸浓度的影响
血清尿酸浓度是检测小鼠高尿酸模型是否成功的指标,如图1所示,对比Con组,Model组血清尿酸浓度升高了180.53%,表明高尿酸模型建立成功。对比Model组,经过A.muciniphila处理后小鼠血清尿酸水平有明显的降低(L-AKK组降低了18.62%;P-AKK组降低了26.81%),初步表明A.muciniphila干预能缓解小鼠高尿酸血症。
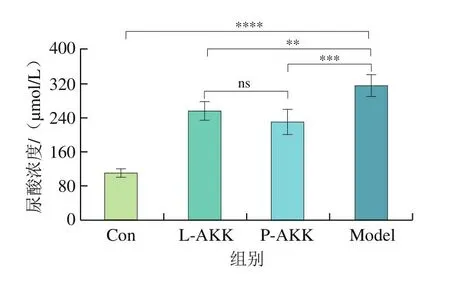
图1 活的和巴氏杀菌A.muciniphila对小鼠血清中尿酸浓度的影响Fig.1 Effect of live and pasteurized Akkermansia muciniphila on uric acid concentration in serum of mice
2.2 L-AKK和P-AKK对小鼠肝脏XOD活性的影响
肝脏是体内尿酸生成的主要部位,其中XOD是影响尿酸生成的关键酶。如图2A所示,Model组中XOD活力对比Con组增强了100.20%,表明肝脏尿酸生成活性增加。经过A.muciniphila处理后,相较于Model组,L-AKK和P-AKK的XOD活力分别减弱了14.01%和10.93%,表明肝脏尿酸产生量相应降低。为了进一步确定肝脏中XOD的表达情况,对肝组织中XOD蛋白进行了Westernblot分析。对比Con组,Model组XOD的相对表达量上调了183.90%,明显提升(图2B)。这也和XOD活性以及血清尿酸浓度检测结果相印证。A.muciniphila干预后,相较于Model组,L-AKK和P-AKK组XOD相对表达量分别下调了32.91%和18.17%,结果也进一步证明A.muciniphila能通过抑制XOD活性和XOD的表达来减轻小鼠高尿酸血症。
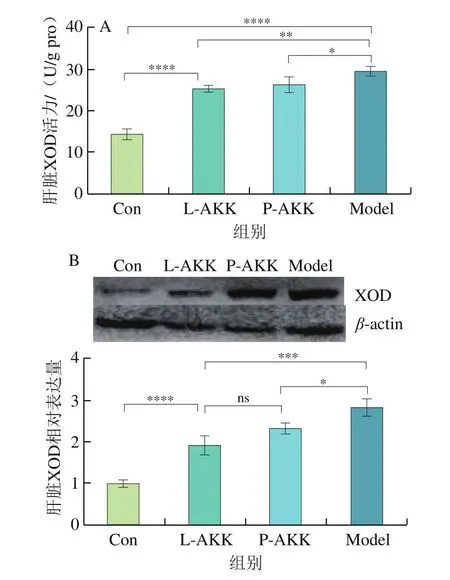
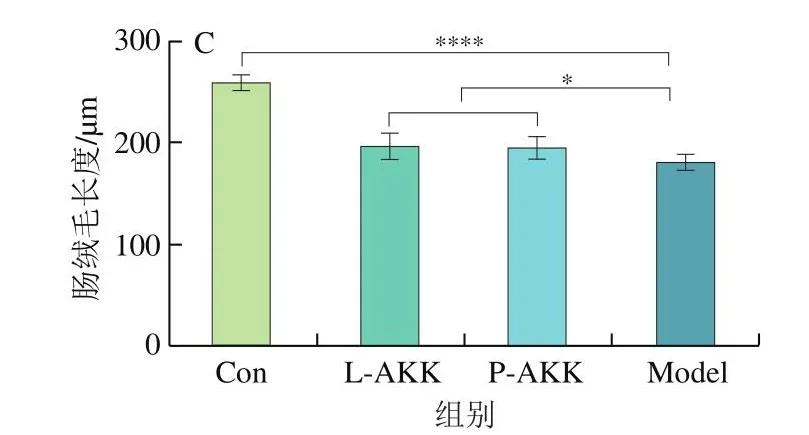
图2 活的和巴氏杀菌A.muciniphila对肝脏中XOD活力(A)以及XOD相对表达量(B)的影响Fig.2 Effect of live and pasteurized Akkermansia muciniphila on XOD activity (A) and relative expression of XOD in liver (B)
2.3 L-AKK和P-AKK缓解肾脏和肠道病理损伤
高尿酸血症会引发很多并发症,造成器官的病理损伤。尿酸过多会在肾脏内生成尿酸盐结晶,破坏肾脏结构,可能引发肾小球萎缩、肾间质纤维化等后果。如图3A所示,Model组小鼠肾脏出现肾小球空泡化和萎缩、炎性细胞浸润等情况。经过A.muciniphila处理后可以观察到小鼠肾脏病变减轻,肾小球萎缩情况好转,炎性细胞浸润程度降低,表明A.muciniphila能缓解高尿酸血症引发的肾脏病变。肠绒毛受损会导致肠腔绒毛表面积减少,肠道通透性增强。由图3C可知,相较于Con组,Model组小鼠肠绒毛极高度显著变短,而A.muciniphila干预后两组绒毛长度较Model组显著增加(P<0.05)。
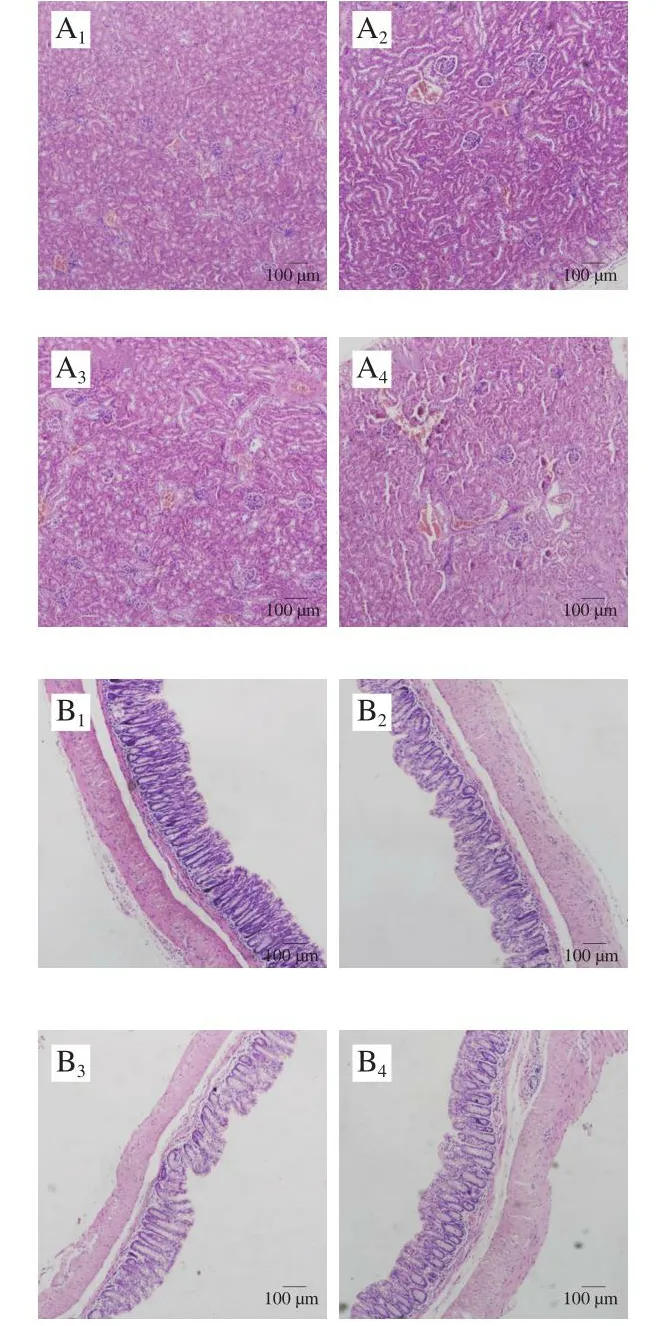
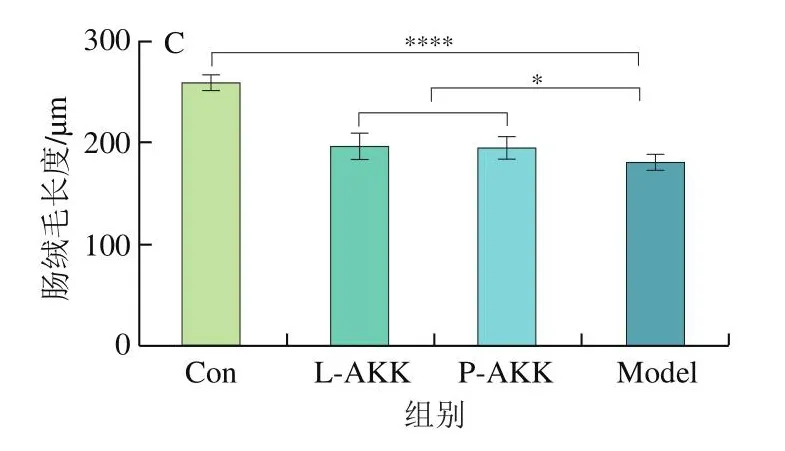
图3 活的和巴氏杀菌A.muciniphila对小鼠肾脏病理切片(A)、肠道病理切片(B)和肠绒毛长度(C)的影响Fig.3 Effect of live and pasteurized Akkermansia muciniphila on pathological section of kidney (A) and intestine tract (B) and length of intestine villus (C)
2.4 L-AKK和P-AKK对小鼠肾脏和肠道中TLR4、Caspase 1和IL-1β的影响
高尿酸血症会引发体内炎症反应。炎症信号能通过TLR4激活炎性小体(NLRP3)。NLRP3能促进Caspase 1表达,最终促进IL-1β产生。由图4A、B、C可知,与Con组相比,Model组小鼠肾脏中TLR4、Caspase 1和IL-1β相对表达量分别上调了106.20%、119.18%和110.97%。经过A.muciniphila处理后,与Model组相比TLR4、Caspase 1和IL-1β相对表达量在L-AKK组分别下调了37.82%、40.38%和46.79%,而在P-AKK组则分别下调了66.43%、32.80%和36.53%。从上述结果可知A.muciniphila缓解了高尿酸血症在肾脏中引发的炎症反应。由图4D、E、F可知,相较于Con组,Model组小鼠肠道中TLR4、Caspase 1和IL-1β相对表达量分别上调了46.53%、48.50%和69.80%。经过A.muciniphila处理后,与Model组相比,TLR4、Caspase 1和IL-1β相对表达量在L-AKK组分别下调了25.08%、17.58%和18.78%,而在P-AKK组则分别下调了24.31%、30.37%和31.68%。从上述结果来看,A.muciniphila处理后肠道的炎症反应也得到缓解。综上可知,A.muciniphila能够有效缓解高尿酸血症介导的炎症反应。
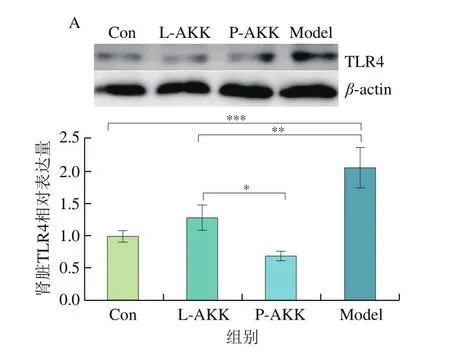
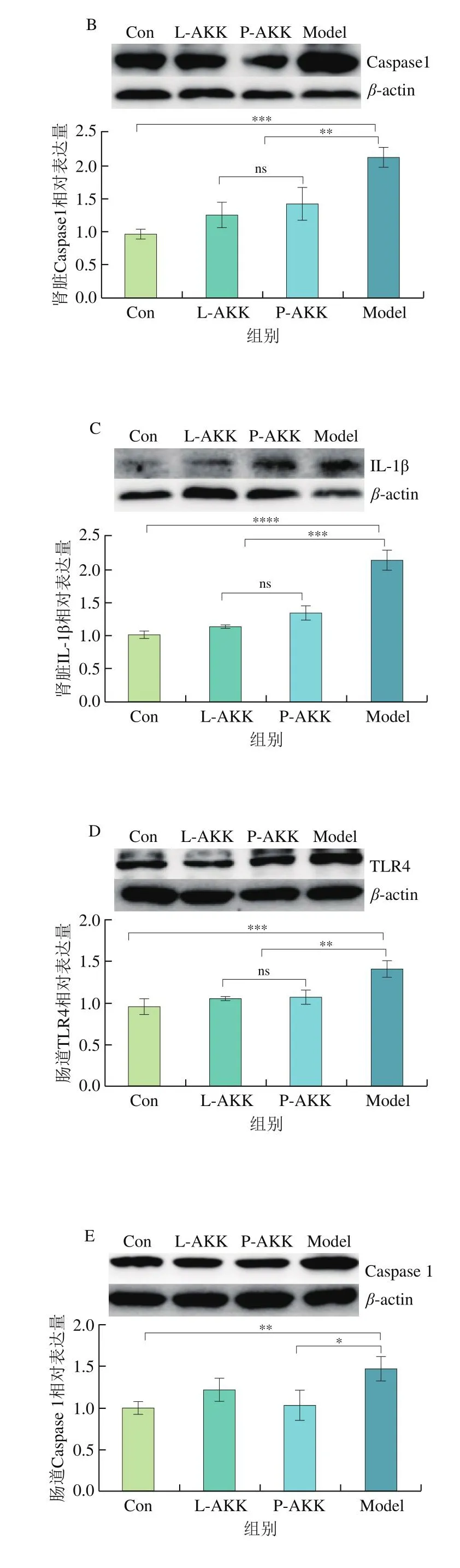
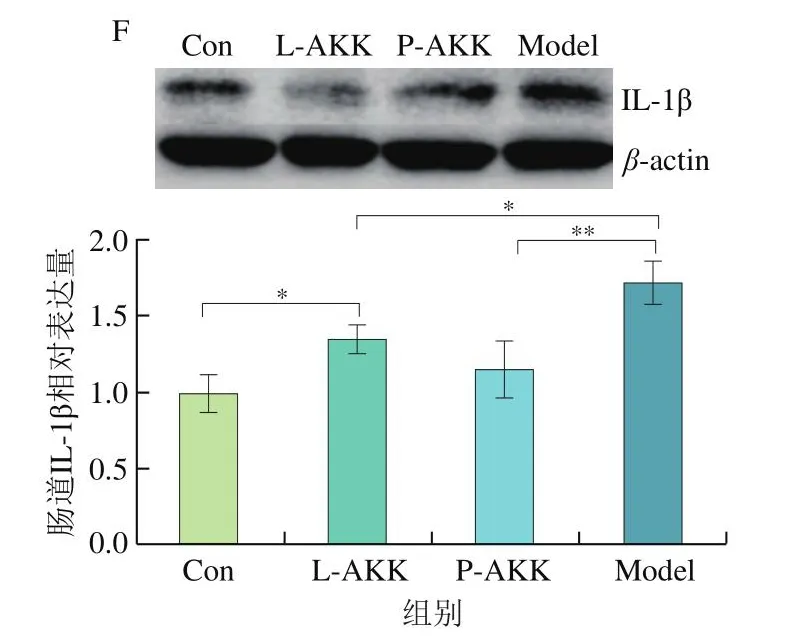
图4 活的和巴氏杀菌A.muciniphila对肾脏中TLR4(A)、Caspase 1(B)和IL-1β(C)的相对表达量(n=4)以及肠道中TLR4(D)、Caspase 1(E)和IL-1β(F)的相对表达量(n=5)的影响Fig.4 Effect of live and pasteurized Akkermansia muciniphila on relative expression of TLR4 (A), Caspase-1 (B) and IL-1β (C) in kidney(n = 4) and intestine tract (n = 5)
3 讨 论
高尿酸血症是一种常见的代谢性疾病,而药物治疗是目前高尿酸血症常规的治疗途径,但是药物普遍具有一定的副作用,因此通过膳食途径来预防或者改善高尿酸血症具有重要意义。目前除了研究人员广泛研究的具有降尿酸活性的植物化学物质之外,近来能用于预防和治疗高尿酸血症的微生物菌株也逐渐受到关注。例如,Lactobacillus gasseriPA-3菌株可以通过在胃肠道中直接吸收食物来源的嘌呤来降低尿酸水平[23],同时有学者报道从浆水中分离得到的乳酸菌菌株JL-3能通过直接降解尿酸从而缓解小鼠高尿酸血症[18]。这些结果均表明使用益生菌预防和改善高尿酸血症具有一定潜力。本实验结果表明,不仅活的A.muciniphila能有效降低小鼠血清中尿酸水平,而且巴氏杀菌的A.muciniphila也有同样功效。本研究不但拓宽了A.muciniphila的健康功能,也为后生元(益生菌成分或代谢物)类产品的开发提供了一定的参考依据。
体内尿酸的合成场所主要是肝脏,XOD则是尿酸合成途径中起到关键作用的酶之一,目前高尿酸血症成熟的治疗药物如别嘌呤醇,其作用方式是通过抑制XOD的活性实现降尿酸[24]。此外,研究表明侧柏提取物中槲皮素和芦丁、岩藻多糖等活性物质对高尿酸血症的影响也都涉及对XOD的调节作用[17,25],有学者发现仙草提取物对小鼠血清和肝脏中XOD活性具有显著抑制作用,能有效降低小鼠高尿酸血症[9]。本研究结果显示A.muciniphila能抑制高尿酸血症小鼠肝脏中XOD活性,而且蛋白免疫印迹结果表明A.muciniphila也能抑制XOD蛋白的表达。研究表明A.muciniphila的膜蛋白成分Amuc_1100能改善高脂饮食引发的肥胖、胰岛素敏感性和高胆固醇血症等;同时Amuc_1100还能修复肠道屏障、调节机体免疫反应[26-28]。A.muciniphila可能通过某些膜蛋白或分泌蛋白进入循环系统[29],这也可能是活的和巴氏杀菌的A.muciniphila都具有抗高尿酸的部分原因,但尚需今后进一步探究。除此之外,有研究表明活的和巴氏杀菌处理的A.muciniphila均能改变小鼠肠道菌群组成,增加有益菌丰度[30]。同时A.muciniphila能够促进肠道中短链脂肪酸的产生,部分短链脂肪酸能进入体循环到达肝脏,从而发挥抑制肝脏XOD活性的功能[31-35]。因此,推测两种形式的A.muciniphila也可能通过改善肠道菌群、增加肠道及血清中的短链脂肪酸从而发挥其抑制XOD的活性,但这也需后续研究加以证实。
高尿酸血症患者会因其体内尿酸的沉积,引发痛风、关节炎、肾结石等病症,进而导致肾脏和肠道的病理损伤,通常会出现肾小球萎缩、肾间质炎性细胞浸润、肠黏膜受损等症状[36-37]。病理损伤通常会引发炎症应激,而且高尿酸血症也会激发体内炎症信号通路,诱导细胞炎症因子表达。TLR4和Caspase 1能调控IL-1β的产生,对高尿酸血症有重要影响[38]。很多具有降尿酸效果的活性物质都能降低TLR4、Caspase 1以及IL-1β的表达[15,39]。本研究表明高尿酸血症小鼠的肾脏、肠道存在一定程度的炎症,而A.muciniphila干预能下调炎症通路及促炎因子的表达。这与先前的研究发现A.muciniphila能缓解代谢性疾病引发的炎症反应相一致[40]。由于肾脏和肠道功能损伤会影响尿酸排泄,而炎症与肾肠损伤关系密切,因此A.muciniphila也可能通过缓解肾脏和肠道炎症反应,促进肾脏和肠道的尿酸排泄,从而降低血尿酸的水平[41]。
4 结 论
活的以及巴氏杀菌处理的A.muciniphila均能显著降低小鼠血清中尿酸水平,抑制肝脏XOD的活性及表达。此外,两种形式的A.muciniphila处理能有效缓解小鼠高尿酸血症所引发的肾脏和肠道的损伤及炎症效应。本研究拓展了A.muciniphila菌的潜在健康功能,也为今后基于A.muciniphila菌开发预防和改善高尿酸血症的益生菌及相关产品提供了一定的理论支撑。
