沉默RALA基因表达对前列腺癌细胞的增殖、迁移及凋亡的影响*
2023-03-31翁吴斌刘昌明张家彬李国敏薛清平林宁峰陈光炳
翁吴斌 刘昌明 张家彬 李国敏 薛清平 林宁峰 陈光炳
目前前列腺癌发病率为13.5%,位居男性全部恶性肿瘤第二位[1],且随着人口老龄化,其发病率和病死率将逐年升高,对社会和家庭均造成巨大负担,因此寻找有效的治疗方案成了当务之急。RALA 作为RAL(Ras 相关性蛋白,Ras-like)家族的一员,其基因最早由类人猿RALA 基因序列中分离出来的,定位在人类7 号染色体上,其长度为84 642 bp[2]。相关研究数据显示RAL 家族蛋白在恶性肿瘤的生长、侵袭及转移等生物行为中起着至关重要的作用,在包括结肠癌、肺癌在内的多种肿瘤中都发现RAL 家族基因的表达改变[2]。另有研究表明,在多种肿瘤的生长中,RALA 作为癌基因起着关键性作用[3]。在前列腺癌的发生、发展中是否存在RALA 的参与目前尚不明确。因此本研究通过小干扰RNA 沉默前列腺癌DU145 细胞株中RALA 基因的表达来观察对DU145 细胞增殖、凋亡及迁移的影响,以及探讨可能机制。
1 材料与方法
1.1 材料 人前列腺癌细胞株LNCap、PC-3 和DU145 购于中国科学院上海细胞库。PRMI1640 培养基、0.25%胰蛋白酶、胎牛血清均购于北京赛默飞世尔科技有限公司;链霉素、青霉素来源于山东鲁抗医药;PBS 缓冲液、细胞裂解液(RIPA)、RTPCR 试剂盒、Trizol 试剂购于杭州博日生物科技有限公司;LipofectamineTM2000 购于Invitrogen 公司;Annexin V/PI 染色试剂、噻唑蓝比色法(MTT)盒均购自北京鼎国生物技术有限公司;未包被基质胶 的Transwell 小室美国Sigma 公 司;PCR 引物和RALA-siRNA 由上海生工生物工程有限公司合成,于-20 ℃下保存;BCA 蛋白浓度测定试剂盒、ECL试剂盒均购于碧云天生物技术研究所;山羊抗兔IgG 第二抗体、山羊抗鼠IgG、兔抗人RALA 多克隆抗体第二抗体购于英国Abcam 公司。
1.2 方法
1.2.1 细胞培养 人前列腺癌LNCap、DU145 和PC-3 细胞,置于37 ℃、5%CO2、饱和湿度的培养箱中,用含有10%胎牛血清的RPMI-1640 培养液进行传代培养。每2~3 天更换一次培养液,维持培养液pH 值在7.2~7.4,当前列腺癌细胞以致密单层的形式平铺在培养瓶壁上后则用于传代,使用0.25%胰蛋白酶进行消化,实验用的前列腺癌细胞采用对数生长期细胞。
1.2.2 RT-PCR 检测前列腺癌DU145、PC-3 和LNCap 细胞中RALA mRNA 的表达水平 收集对数生长期的DU145、PC-3 和LNCap 细胞,按照Trizol试剂说明书,用Trizol 试剂提取细胞总RNA,取2 μg 总RNA 逆转录合成cDNA,并以该cDNA 作为模板,用RT-PCR 试剂进行PCR 扩增,检测三种细胞株中RALA mRNA 的表达,以GAPDH 为内参照。PCR 引物由上海生工生物工程有限公司合成,RALA上游引物5′-ATCGGAAGAAGGTAGTGC-3′,下游引物5′-AAATCTGCTCCCTGAAGT-3′;GAPDH上游引物5′-GGGTGATGCTGGTGCTGAGTATGT-3′,下游引物5′-AAGAATGGGAGTTGCTTTGAAGTC-3′,RALA 与GAPDH 扩增片段的长度分别为182 bp、700 bp。PCR 反应条件:94 ℃ 2 min,94 ℃ 30 s,56 ℃(RALA)/60 ℃(GAPDH)30 s,72 ℃ 30 s,共40 个循环。根据2-ΔΔCt法对数据进行相对定量分析。
1.2.3 分组转染与MTT 法检测细胞的增殖率 收集对数生长期的DU145 细胞,以细胞悬液的形式接种于6 孔细胞培养板中,每孔细胞数达5×105个,于孵育箱中培养。待细胞融合度达60%,利用LipofectamineTM2000 进行转染(操作步骤参照LipofectamineTM2000 说明书),转染RALA-siRNA为RALA-siRNA组,也即实验组,转染negativesiRNA 为阴性对照组,而在空白对照组中只加入等体积无血清RPMI-1640 培养液。在96 孔板中,将三组以5×104个细胞/mL 的密度进行接种,每孔100 μL,每组设4 个复孔,置于孵育箱中,分别培养12、24、48、72 和96 h 后在避光环境下添加5 mg/mL MTT,10 μL/孔,再培养4 h 后吸弃培养液,以150 μL/孔的量添加DSMO,然后放在摇床上低速震荡,时间为10 min,于酶标检测仪波长为490 nm 处检测每个孔的OD值,作为细胞增殖的指标。实验重复开展3次,然后绘制细胞的增殖曲线。
1.2.4 Transwell 法检测细胞的迁移 收集对数生长期空白对照组、阴性对照组和实验组的细胞重悬于RPMI-1640 培养液中,该培养液中含有1 mmol/L 的氯化镁、0.2 mmol/L 的氯化锰、1 mmol/L 的氯化钙及5 g/L 的牛血清白蛋白,调整细胞浓度为2.5×105/mL。在Transwell 上室中加入200 μL 重悬细胞液,在下室的每室中添加500 μL 含有10%胎牛血清的RPMI-1640 培养液。置于孵育箱中培养12 h,取出小室,吸弃培养液,湿棉签抹除没有穿过小室膜的细胞,在室温环境中4%多聚甲醛固定细胞15 min,1×PBS 缓冲液洗涤固定后的细胞3次,每次时长5 min,结晶紫染色时长3 min,1×PBS 缓冲液清洗干净,干燥后置于100 倍光镜下观察计数并拍照。
1.2.5 流式细胞仪检测细胞的凋亡率 转染72 h后,置于离心机中进行离心,然后收集空白对照组、阴性对照组和实验组的细胞,预冷PBS 缓冲液洗涤细胞3次,离心后去除上清液,应用200 μL Binding Buffer 重悬细胞,然后分别添加5 μL 的PI及10 μL 的Annexin V-FITC,轻轻混匀,在避光及室温环境下反应20 min。通过流式细胞仪来测细胞的凋亡率,每次实验重复开展3 次。
1.2.6 RT-PCR 检测沉默RALA 基因后DU145 细胞株中RALA 基因的表达水平 转染72 h后,收集空白对照组、阴性对照组和实验组的细胞,按1.3 节的RT-PCR 法检测DU145 细胞株中RALA mRNA 的表达水平。
1.2.7 Western blot 检测沉默RALA 基因后DU145细胞株中RALA 蛋白的表达水平 转染72 h后,收集空白对照组、阴性对照组和实验组的细胞,用RIPA 提取细胞总蛋白(步骤参照RIPA 说明书)。BCA 法进行蛋白质定量,并根据定量结果调整平衡蛋白量。充分混匀等体积的上样缓冲液与样品,在98 ℃下变性5 min,室温下冷却。取10 μg 上样在SDS-PAGE 凝胶上电泳,电泳结束后目的蛋白移到PVDF 膜上,进行膜的染色,5%脱脂奶粉的封闭液室温封闭1 h,加入一抗RALA、GAPDH(工作浓度分别为1∶1 000、1∶2 000)4 ℃孵育过夜;加入相应辣根过氧化物标记的二抗(1∶1 000 稀释),在室温环境下平缓摇动,时间为1 h。滤纸干燥PVDF膜,根据ECL 试剂盒的说明书进行发光、压片。
1.3 统计学处理 应用统计软件SPSS 22.0 进行数据分析,计量资料以用(±s)描述,组间比较采用t检验或方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 RT-PCR 检测前列腺癌细胞中RALA mRNA 的表达 收集对数生长期的DU145、LNCap 和PC-3细胞,应用RT-PCR 检测细胞中RALA mRNA 的表达水平,以GAPDH 为内参照。其结果显示:RALA在体外培养的DU145、LNCap 和PC-3 细胞中均有表达,且相对表达水平分别为(0.83±0.02)、(0.41±0.01)、(0.37±0.07),RALA 在DU145 细 胞中的表达水平最高(P<0.05),见图1。遂取DU145细胞作为后续实验的研究细胞。

图1 RT-PCR检测前列腺癌DU145、LNCap和PC-3 细胞中RALA mRNA的表达
2.2 沉默RALA 基因对DU145 细胞增殖的影响 MTT 法测空白对照组、阴性对照组和实验组DU145 细胞的增殖。结果显示:转染RALA-siRNA 2 d后,实验组与空白对照组、阴性对照组相比较,其DU145 细胞的增殖速度明显降低(P<0.05),见表1。
表1 各组细胞增殖情况的比较(±s)
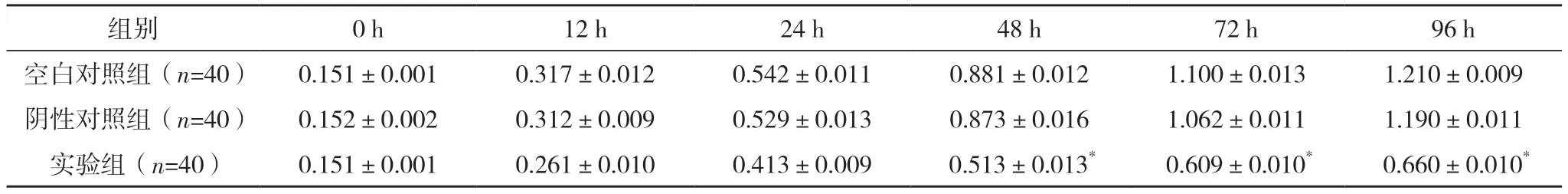
表1 各组细胞增殖情况的比较(±s)
*与空白对照组、阴性对照组比较,P<0.05。
2.3 沉默RALA 基因对DU145 细胞迁移能力的影响 用未包被基质胶的Transwell 小室检测空白对照组、阴性对照组和实验组细胞的迁移,结果显示:实验组穿膜细胞数(26.00±9.29)明显少于空白对照组(157.00±16.03)及阴性对照组(149.01±12.03),实验组与阴性对照组、空白对照组比较差异有统计学意义(P<0.05),见图2。
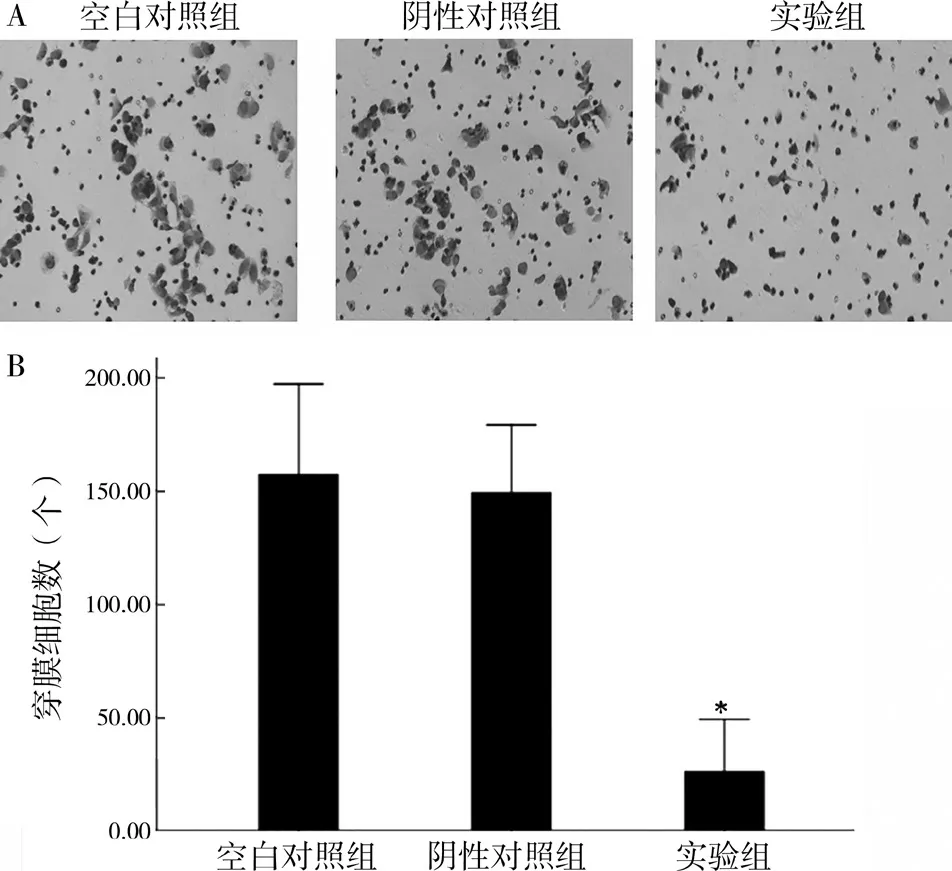
图2 转染RALA-siRNA抑制DU145细胞的迁移
2.4 沉默RALA 基因对DU145 细胞凋亡的影响转染RALA-siRNA 72 h后,用流式细胞仪检测空白对照组、阴性对照组和实验组DU145 细胞的凋亡。空白对照组细胞的凋亡率为(2.71±0.78)%,阴性对照组细胞的凋亡率为(2.39±0.89)%,实验组细胞凋亡率为(17.21±1.33)%,实验组与阴性对照组、空白对照组比较差异有统计学意义(P<0.05),见图3。

图3 转染RALA-siRNA促进DU145细胞的凋亡
2.5 RT-PCR 和Western blot 检测转染RALAsiRNA 后DU145 细胞中RALA 的表达水平 转染RALA-siRNA 72 h后,RT-PCR 检测结果(图4A)显示实验组RALA mRNA 的表达水平(0.21±0.03)明显低于空白对照组(0.81±0.09)和阴性对照组(0.79±0.05),差异有统计学意义(P<0.05)。Western blot 结果(图4B、4C)显示与空白对照组(0.82±0.03)、阴性对照组(0.80±0.02)比较,实验组(0.21±0.03)DU145 细胞中RALA 蛋白表达明显受抑制(P<0.05)。

图4 转染RALA-siRNA后DU145细胞中RALA的表达水平
3 讨论
前列腺癌在全球男性恶性肿瘤中的占比呈逐年递增趋势,与此同时,由于老龄化人口增多、生活压力变大、生活饮食习惯改变及前列腺癌筛查普及等因素,我国前列腺癌发病率近年来呈明显上升趋势[4]。得益于前列腺癌筛查的开展,早期前列腺癌的诊断率明显升高,但在我国仍有约60%患者就诊时已处于前列腺癌晚期,已无法通过根治性治疗获得良好疗效,需终生采用综合性治疗,主要采用内分泌治疗[5-6]。目前,抗雄治疗仍是晚期前列腺癌治疗的首选方案,但绝大多数的患者经1 年半至2 年的内分泌治疗,均会进展到去势抵抗性前列腺癌(CRPC)阶段。虽然阿比特龙等新型雄激素生物合成酶抑制剂的使用,提高了患者的生存率,但耐药性、副作用及价格昂贵等限制了其广泛应用。因此目前前列腺癌基础研究的重要及主要方向仍是寻找新的靶向基因。
在肿瘤的生长过程中,RAS 作为原癌基因发挥着重要及关键性的作用。RAS 基因的激活,并通过调控一系列下游信号通路,最终导致机体内肿瘤的形成。RALA 作为RAS 信号通路下游蛋白,在肿瘤的形成、发展中发挥重要作用[7]。RALA 是RAL 家族的一员,属于小GTP 酶超家族,对细胞生物学功能具有重要的调控作用,包括信号转导、基因表达、细胞骨架动力学、膜转运和细胞分裂等[8-9]。研究表明,在肿瘤的生长、转移及浸润等方面,RAL 家族蛋白起着重要作用[10]。RAL 家族是一类低分子量的蛋白质,以两种形式存在,分别为非活性的RALGDP 和活性的RALGTP[11-12]。RALA生物学功能主要通过非活性的RALAGDP 与活性的RALAGTP 两种形态间的相互转化得以实现,其过程受RAL 特异的鸟嘌呤核苷酸交换因子(RALspecific guanyl nucleotide exchange factor,RALGEF)调节[13]。在RAS 信号通路中RALGEF 介导恶性肿瘤的发生及发展,发挥关键性作用[14]。RALBP1(RALA binding protein 1)作 为RALA下游效应物,通过与活化的RALA 结合而得以激活[15-16]。活化RALBP1 能够调控cyclin B-CDK1 的活性,从而促进细胞有丝分裂期的线粒体分裂。同时激活RALBP1 可活化Rac1 和Cdc42,两者分别在迁移细胞细胞膜的变化及细胞丝状伪足的形成中起着促进作用[15]。RALBP1 的结合蛋白REPS2/POB1(partner of RALBP1)的活性受RALBP1 调节。REPS2/POB1的表达在癌细胞中是呈抑制状态的,当其过表达时能抑制癌细胞的生长及诱导其凋亡[17]。另外通过增强蛋白质转换,活化的RALA 可以抑制Cdc42 所致的转录减少来抑制凋亡调节蛋白CFLAR(CASP8 and FADD-like apoptosis regulator)的表达,以此来抑制肿瘤细胞的凋亡[18-19]。散射因子(scatter factor,SF)是一种肝细胞生长因子,通过在肿瘤内大量堆积对抗肿瘤细胞的凋亡,而RALA 参与调解SF 通过NF-κB 信号通路介导对肿瘤细胞保护和抗凋亡[20-21]。本实验将RALA-siRNA 转染人前列腺癌DU145 细胞,结果显示DU145 细胞增殖、迁移能力受抑制(P<0.05),细胞凋亡明显加剧(P<0.05),细胞RALA 表达水平明显下降(P<0.05),说明沉默前列腺癌细胞中RALA 的表达能抑制其增殖、迁移,并促进细胞凋亡。
综上所述,沉默RALA 基因能抑制人前列腺癌细胞在体外的增殖及迁移,并能促进细胞凋亡,其机制与沉默RALA 后抑制其下游蛋白(例如RALBP1)的活化相关,提示RALA 可作为治疗前列腺癌新的靶向基因。
