基于生物信息学分析胃癌中MMP7表达及临床意义
2023-03-22王绎博
王绎博
(佳木斯大学临床医学院,黑龙江 佳木斯 154002)
胃癌是全球范围常见的恶性肿瘤之一,它是第四大最常诊断癌症及第三大癌症死亡病因〔1〕。研究表明,2018年全球新增胃癌病例多达100万例,且有约78.3万人死于该病〔2〕。胃癌的发病有明显的性别和地域差异,表现为男性高于女性,东亚高于北美、北欧和非洲地区〔2〕。目前认为,幽门螺杆菌是胃癌的主要危险因素,有近90%的非贲门性胃癌与其相关〔3〕。此外,一些饮食和生活习惯,如食用腌制食物、低水果摄入、饮酒和吸烟也是明确的胃癌风险因素〔2〕。
基质金属蛋白酶(MMPs)由前肽序列、催化结构域、铰链区和血凝素(PEX)结构域组成〔4〕。研究表明,MMPs可通过消化细胞外基质(ECM)成分和刺激细胞表面蛋白,在ECM的重构中起至关重要的作用〔5〕。此外,MMPs还可以控制其他蛋白酶、生长因子、趋化因子和细胞受体活性,并调节许多生物学功能〔6〕。研究表明,肿瘤演进过程中的肿瘤生长、局部侵袭和转移在很大程度上也依赖于MMPs的蛋白水解活性,它们通过降解ECM成分和释放基质因子、细胞表面结合的细胞因子、生长因子等影响肿瘤免疫细胞招募和恶性转化过程〔7〕。MMP7是MMPs家族中最小的酶类,其具有MMPs的共同特征,即降解酪蛋白、纤维连接蛋白、明胶和蛋白聚糖〔8〕。越来越多的证据表明,MMP7通过减少细胞黏附、抑制癌细胞凋亡和诱导血管生成,在肿瘤的发生发展中起关键作用〔9,10〕。此外,MMP7也被认为参与了肿瘤转移、侵袭和炎症级联反应〔10,11〕。本研究利用生物信息学方法探讨MMP7在胃癌中的表达及临床意义。
1 材料与方法
1.1数据收集与预处理 从癌症基因组图谱(TCGA)数据库(https://cancergenome.nih.gov)下载胃癌和正常胃组织RNA-seq表达谱数据,并进行每百万转录本(TPM)标准化,将TPM值作为样本的表达值。另外,除了基因表达数据,还下载了每个患者的临床参数,如年龄、性别、种族、生存状态、肿瘤等级、肿瘤分期等。
1.2差异基因识别 利用UALCAN数据库(http://ualcan.path.uab.edu/)计算每个基因在正常和肿瘤样本中的平均TPM值,并进行两组样本间的差异统计,根据显著性识别到了正常和肿瘤样本之间的差异表达基因,最后保留前25个显著高表达的基因并以热图形式展示。
1.3差异表达分析 利用UALCAN数据库计算正常非癌组织与癌组织的MMP7基因表达水平。此外,利用临床患者数据对原发肿瘤样本进行分类,并生成不同亚组中每个基因的表达水平。
1.4生存分析 利用UALCAN数据库用Kaplan-Meier(K-M)绘制生存率曲线。为了评估基因表达和临床参数如患者种族、性别等的组合生存效果,采用多变量Kaplan-Meier生存分析。使用Log-rank检验计算组间差异的统计学显著性。
1.5免疫浸润分析 使用TIMER数据库(https://cistrome.shinyapps.io/timer/)确定MMP-7基因表达与相关基因、免疫浸润的关系。根据6种类型的免疫浸润细胞(包括B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突细胞)的丰度与MMP-7基因表达进行相关性分析。
1.6统计学分析 采用SPSS24.0软件进行t检验和秩和检验,不符合正态分布的采用中位数和四分位数间距表示。Pearson相关性分析用于识别与MMP7基因显著相关的基因。
2 结 果
2.1MMP7在胃癌组织中表达 胃癌组织中高表达基因的分布表明,MMP7为胃癌中第7位高表达基因(图1)。与非癌组织〔2.462(0.120,9.138)〕比较,胃癌患者组织中MMP7表达水平〔29.558(7.698,101.378)〕显著升高(P<0.01)。对患者年龄分析可见,41~60岁、61~80岁患者组织的MMP7表达水平显著高于非癌组织(P<0.05)。此外,男性、女性、白种人及亚裔患者MMP7表达量均明显高于非癌组(P<0.05)。见表1。
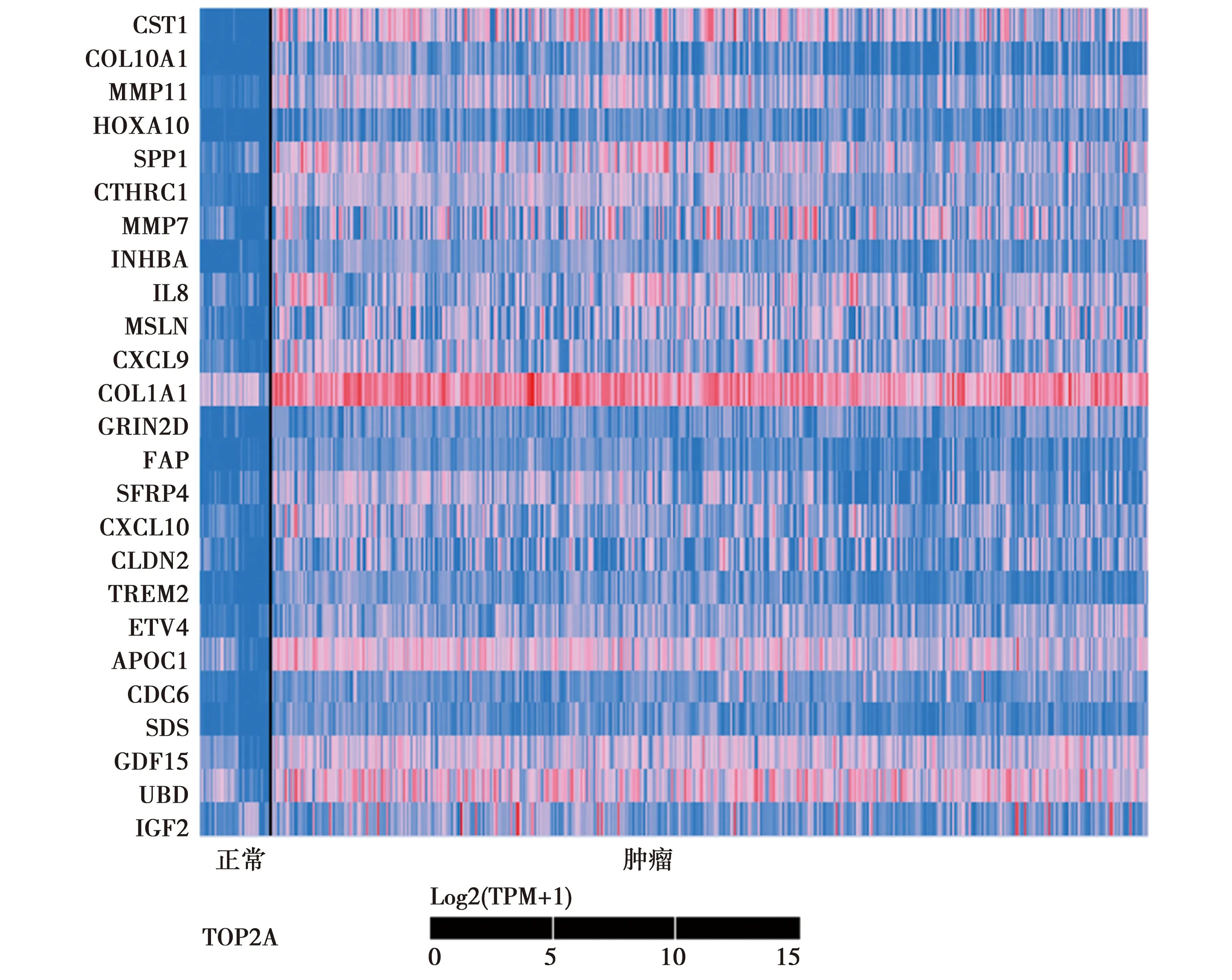
图1 胃癌中25个显著高表达基因热图
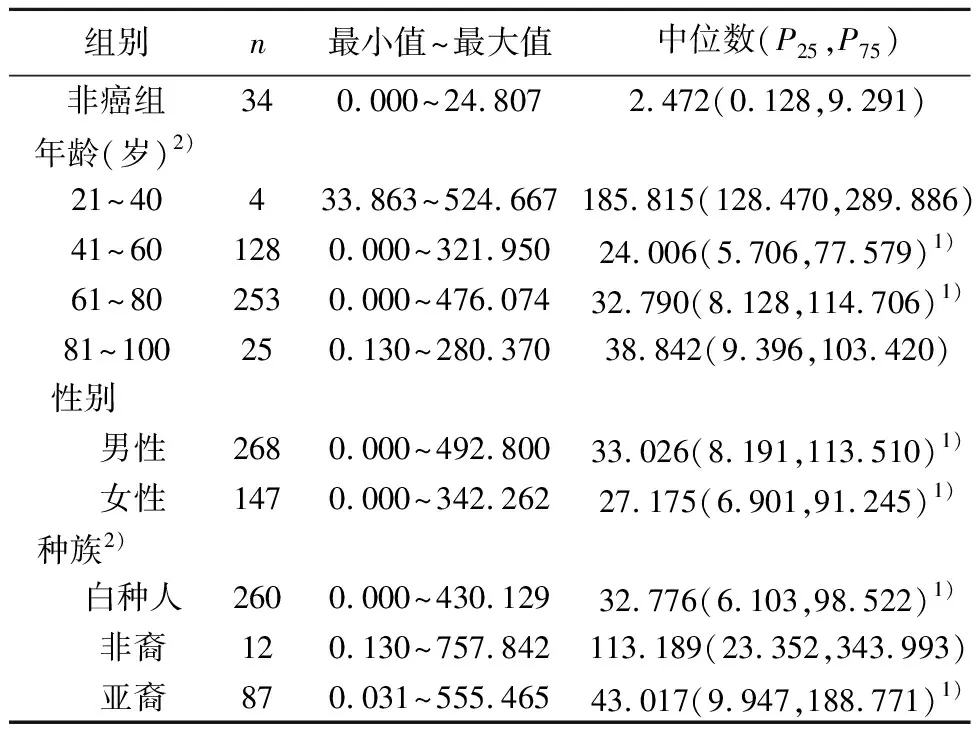
表1 非癌组及不同年龄、性别、种族胃癌患者MMP7表达
2.2MMP7与胃癌中高表达基因的相关性 胃癌中MMP7与前6位高表达基因中的半胱氨酸蛋白酶抑制剂(CST)1、Ⅰ型胶原α1链(COL10A1)、MMP11、同源盒(HOX)A10、胶原三螺旋重复蛋白(CTHRC)1具有显著相关性(r=0.164、0.144、0.194、-0.181、0.163;均P<0.05),而与分泌型磷蛋白(SPP)1无相关性(r=0.053;P>0.05)。见图2。
2.3不同临床病理参数胃癌患者的MMP7表达情况 Grade 1、2、3级患者组织的MMP7表达水平均显著高于非癌组,且Grade 3级显著高于Grade 1级。此外,Stage Ⅰ、Ⅱ、Ⅲ和Ⅳ期患者组织的MMP7表达水平也均显著高于非癌组(P<0.05)。与非癌组比较,有和无TP53突变患者组织的MMP7水平均显著升高(P<0.001)。见表2。
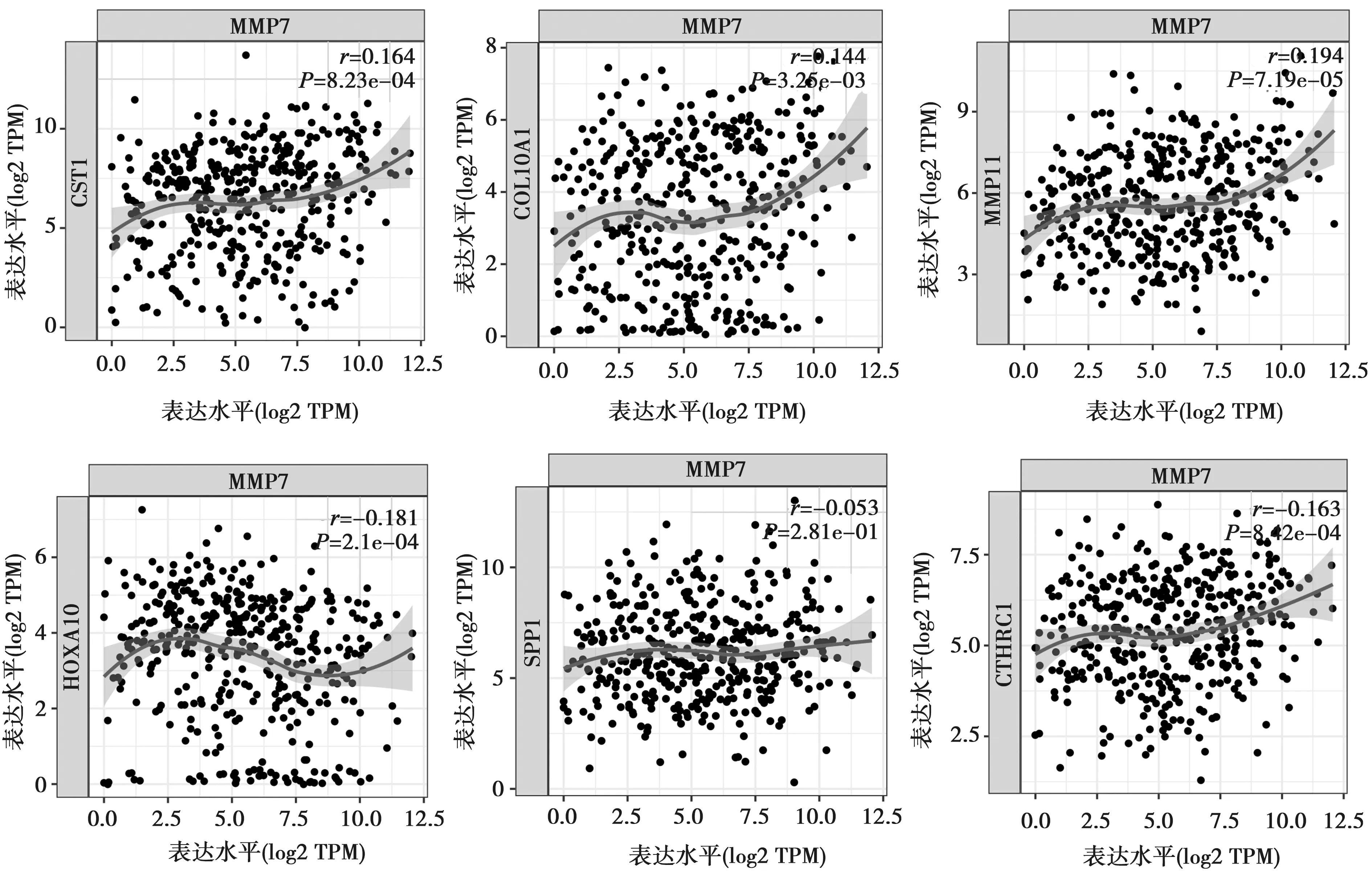
图2 MMP7与胃癌中高表达基因具有显著相关性
2.4不同组织分型、幽门螺旋杆菌感染、淋巴结转移胃癌患者的MMP7表达情况 与非癌组比较,非特异性腺癌、弥漫性腺癌、印戒细胞腺癌、非特异性肠型腺癌、肠型管状腺癌、肠型乳头状腺癌的MMP7表达水平均显著升高(P<0.05),但肠型黏液腺癌与非癌组无显著差异(P>0.05)。印戒细胞腺癌和肠型乳头状腺癌组的MMP7表达水平显著低于非特异性腺癌和弥漫性腺癌组(P<0.05)。此外,有(或无)幽门螺旋杆菌感染、不同淋巴结转移分期患者MMP7表达量均明显高于非癌组(P<0.05)。见表3。
2.5MMP7表达上调与胃癌患免疫细胞浸润相关性 免疫细胞浸润评估显示,MMP7高表达与胃癌中的CD8+T细胞、巨噬细胞、中性粒细胞、树突细胞浸润相关(r=0.183、0.112、0.228、0.186,均P<0.05),而与B细胞和CD4+T细胞浸润无关(r=-0.077、0.004,均P>0.05)。见图3。
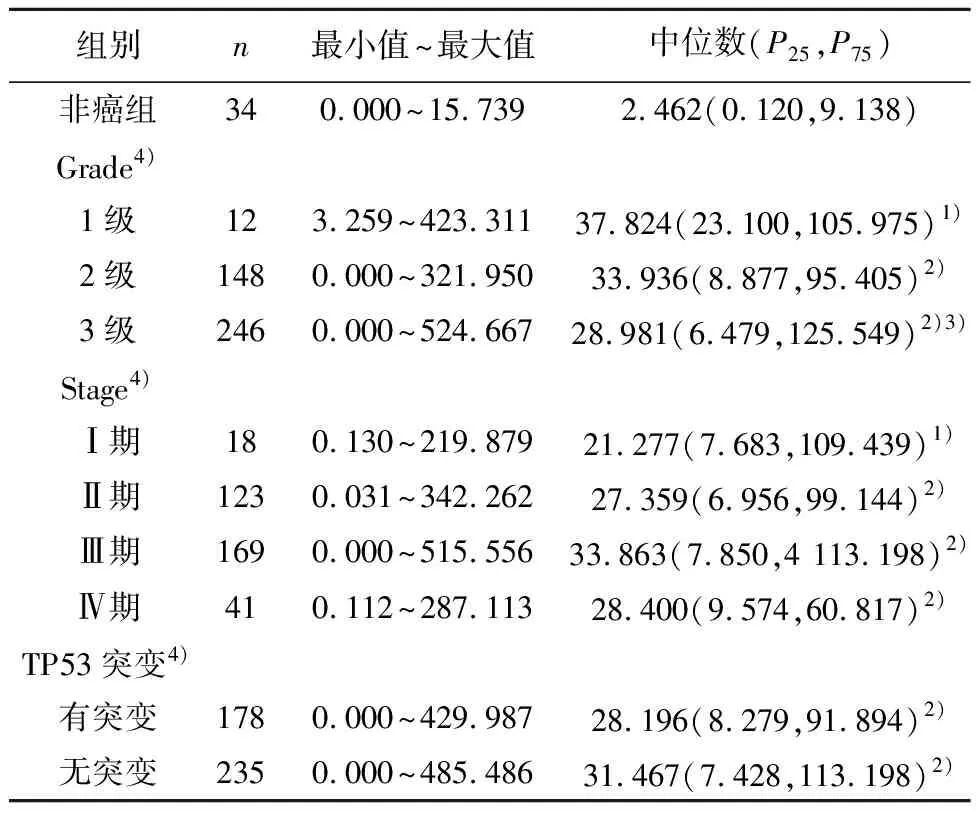
表2 不同临床病理参数胃癌患者MMP7表达 情况
2.6MMP7表达上调可反映胃癌患者预后不良 生存分析显示,高表达MMP7患者总体生存率显著低于低/中表达组。多变量Kaplan-Meier生存分析显示,MMP7高表达的男性患者和亚裔患者的预后最差。见图4。

表3 不同组织分型、幽门螺旋杆菌感染、 淋巴结转移胃癌患者的MMP7表达
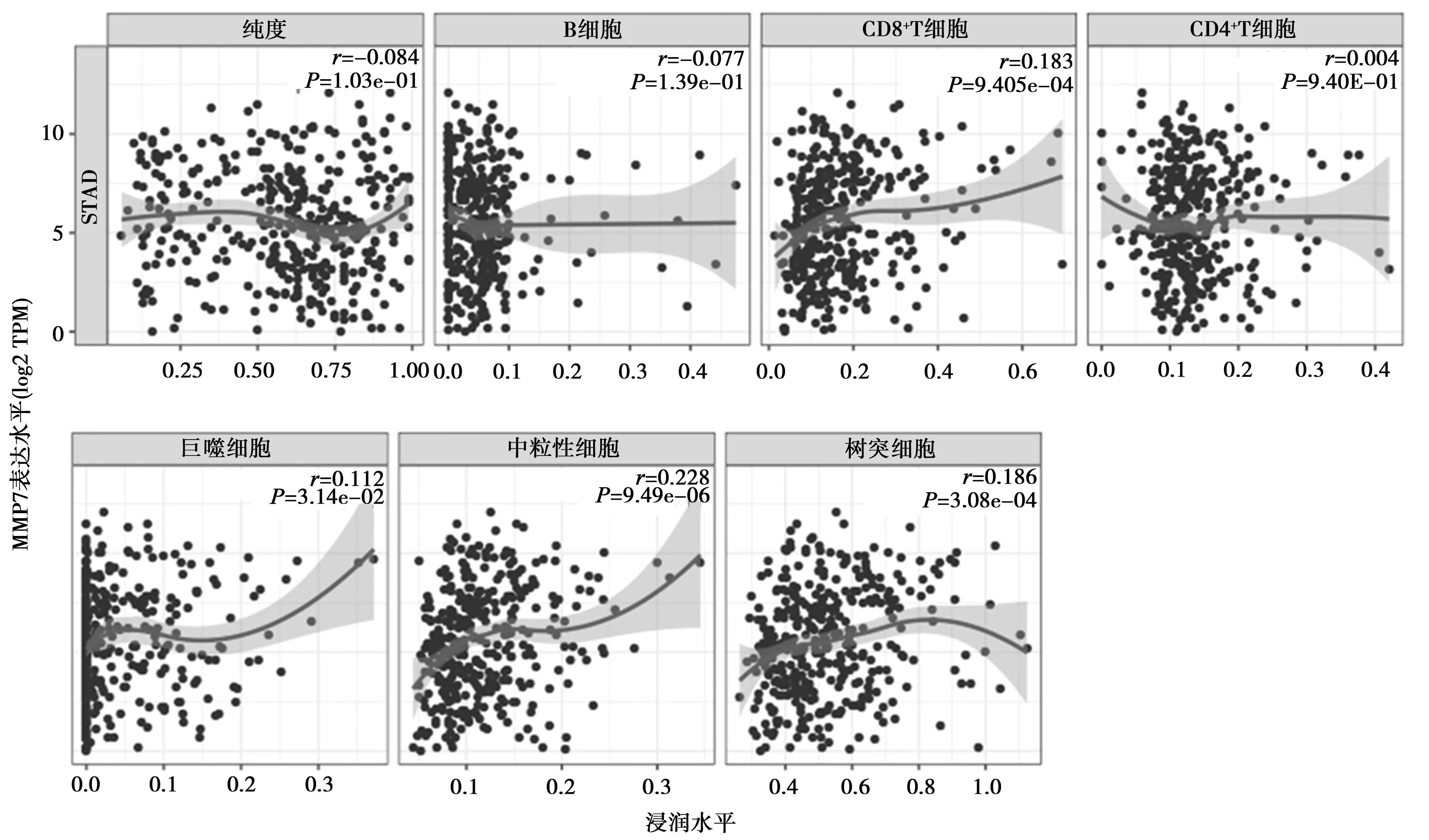
图3 MMP7表达上调与胃癌患免疫细胞浸润具有相关性
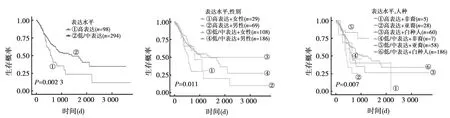
图4 MMP7表达上调可反映胃癌患者预后不良
3 讨 论
正常和病理情况下ECM蛋白的水解及各种细胞表面分子的加工过程是由一大类依赖锌的蛋白酶介导的,包括约24个MMPs,35个解聚蛋白样金属蛋白酶(ADAMs)和19个含Ⅰ型血小板结合蛋白基序解聚蛋白样金属蛋白酶(ADAMTS)〔12〕。MMPs家族根据其结构域可被分为胶原酶、明胶酶、基质溶酶、母质溶酶和模型MMPs(MT-MMPs)〔13〕。MMPs可在生理和病理状态下调节细胞的生长、迁移、存活和黏附。由于MMPs的关键作用,其表达水平的失调和激活可导致肿瘤细胞增殖、血管生成、生存、侵袭、恶性转化和免疫失调〔14,15〕。肿瘤微环境(TME)是由实体肿瘤团块内的细胞、ECM中的生化和生物物理成分相互作用形成的。在TME中含有大量的MMPs底物,包括天然的纤维胶原蛋白、变性的明胶及层粘连蛋白。MMPs可通过影响TME中 ECM的重构促进肿瘤细胞的进展和侵袭〔7〕。
MMP7也称为基质溶解素,可调控多种病理生理过程,如伤口愈合、衰老、骨生长、炎症和血管生成等〔9〕。MMP7上调已在多种人类癌症类型中得到证实,这包括肺癌、黑色素瘤、食道癌、胆囊癌、胰腺癌、膀胱癌等。研究表明,下调MMP7可抑制肿瘤细胞的增殖、迁移和侵袭〔16〕。本研究结果显示,在胃癌中高表达的前7位基因,均被证实可通过Wnt、转化生长因子(TGF)β2/Smad/甲基转移酶样蛋白(METTL)3、缺氧诱导因子(HIF)-1α/趋化因子受体(CXCR)4等多条信号通路来促进胃癌进程〔17~21〕。本研究结果提示,MMP7可作为评估胃癌进程的生物标志物。Zhu等〔22〕在宫颈癌的研究中也证实了较高的MMP7表达与淋巴转移、病理分级和临床分期具有相关性。胃癌是一种高度异质性肿瘤,因此病理组织学分型的临床实用性十分有限,Lauren根据组织结构和生物学行为提出的胃癌分型则被认为是最具预后价值的组织学分型〔23〕。本研究结果显示,各型MMP7表达较正常组织均显著上调。研究证实,在TME中,MMPs也可引导免疫细胞、成纤维细胞和间充质干细胞(间充质间质细胞)的过度募集,导致肿瘤组织的进一步混乱,最终促进肿瘤细胞的侵袭和扩散〔12〕。基于此,本实验最后研究了MMP7与免疫细胞浸润之间的关联,结果提示MMP7参与了胃癌的免疫学进程和机制。
综上,MMP7为胃癌中高表达基因,且其表达与其他促进胃癌进程的高表达基因具有显著相关。此外,上调表达的MMP7还与胃癌患者临床病理参数、预后不良、免疫细胞募集等具有相关性。
