海洋寡糖及在功能食品中的应用研究进展
2023-03-22李玲翠王培培吴文惠陈舜胜
李玲翠,王培培,2,3*,吴文惠,2,3,陈舜胜,2,3
1(上海海洋大学 食品学院,上海,201306)2(上海海洋大学,上海水产品加工及贮藏工程技术研究中心,上海,201306) 3(上海海洋大学,农业农村部水产品贮藏保鲜质量安全风险评估实验室(上海),上海,201306)
海洋多糖广泛存在于海洋动植物及微生物中,且具有多种生物活性。通过化学、物理和生物酶法等手段降解海洋多糖得到的一系列寡糖片段称为海洋寡糖,具有水溶性好、分子质量低、易吸收等优点[1],近年,逐渐成为研究热点。本文通过CNKI在线分析了近10年来与海洋寡糖研究相关度前500篇的文献,得到文献互引网络关系如图1所示。不同来源的海洋寡糖及其活性研究等是该领域的研究热点。海洋寡糖来源丰富,结构具有多样性,具有广泛的生物学活性,加之其独特的物理化学特性,近年来,作为添加剂在功能食品的开发中展现出巨大应用前景。基于此,本文从近年来海洋寡糖的来源、结构及生物活性出发,汇集分析了其在功能食品和食品添加剂中的应用研究进展,以期为基于海洋寡糖的蓝色食物开发提供参考。

图1 国内近十年海洋寡糖相关文献引用及其共被引关系图Fig.1 The citations and co-citations of domestic marine oligosaccharide related literature in the past 10 years
1 海洋植物寡糖
海藻是海洋植物的主体,主要包括红藻(rhodophyta)、褐藻(phaeophyta)和绿藻(chlorophyta)等。海藻多糖是海藻的重要组成物质。其中,褐藻胶寡糖(alginate oligosaccharides,AOS)是褐藻胶(alginate)通过物理、化学及生物学方法降解生成的聚合度为2~10的线性寡糖[2],是目前研究较为广泛和成熟的一类海洋寡糖,其基本结构单元为1,4-糖苷键链接的α-L-古罗糖醛酸和β-D-甘露糖醛酸[3]。AOS的结构因其不同的降解方法而展现出显著的差异性,结构如图2所示。例如,通过控制微波降解,可获得聚合度主要为2~10的甘露糖醛酸寡糖(产率可高达71%)[4];经酶水解可制备3种AOS,即古罗糖酸寡糖、甘露糖醛酸寡糖及杂合寡糖片段[4];化学降解法可得到饱和糖醛酸寡糖,酸水解是制备AOS的传统方法[5]。
褐藻糖胶(fucoidan)是广泛存在于褐藻中的另一类活性聚糖,因其岩藻糖(Fuc)和硫酸基含量较高也称为岩藻聚糖硫酸酯。其结构复杂,主要可分为2类,一类为主要有不同链接方式的Fuc和硫酸根组成;另一类单糖成分较复杂,除Fuc外,还含有阿拉伯糖(Ara)、半乳糖(Gal)、甘露糖(Man)、葡萄糖醛酸(GlcA)及木糖(Xyl)等单糖。褐藻糖胶经过酶降解或酸水解可获得聚合度不同的褐藻糖胶寡糖(fuco-oligosaccharide)[6]。王培培等[7]从海蒿子中制备得到褐藻糖胶,进一步采用三氟乙酸在60 ℃下水解2 h得到杂合寡糖,再用 Superdex Peptide HR 30凝胶色谱柱进行分离纯化,共得到6种寡糖组分,其单糖组成主要由Fuc、Xyl、和Gal组成。

a-褐藻胶的均聚片段均聚甘露糖醛酸polyM;b-褐藻胶的均聚片段均聚甘露糖醛酸均聚古洛糖醛酸polyG; c-杂聚片段polyM/G;d-α-1,3/1,4 交替连接的褐藻糖胶寡糖图2 褐藻来源的寡糖结构Fig.2 Oligosaccharide structure from brown algae
卡拉胶和琼脂是红藻细胞壁中基质多糖的主要成分。卡拉胶是一种硫酸化线性多糖,主要分为κ卡拉胶,ι卡拉胶、λ卡拉胶等。其结构具有重复的α-(1→4)-D半乳吡喃糖-β-(1→3)-D-半乳吡喃糖(或36内醚-D-半乳吡喃糖)二糖骨架结构[8]。琼脂的基本结构是由1,4糖苷键连结的3,6-脱水A-L-半乳呋喃糖和1,3糖苷键连结的B-D-半乳呋喃糖相间连结而成。卡拉胶和琼脂的高黏度、低水溶性和低生物利用度极大地限制了其高附加值应用。通过控制硫酸、盐酸和乙酸等酸水解条件,可得到不同分子质量的红藻寡糖[9]。例如,宋日健[10]通过将卡拉胶脱硫从而制备出含不同硫酸酯基的κ/β-卡拉胶寡糖。采用自由基解聚法、微酸水解法、卡拉胶酶解法和部分还原水解法分别降解ι卡拉胶,可得到4种ι卡拉胶低聚糖[11]。常见不同结构的卡拉胶寡糖和琼胶寡糖结构如图3所示。

a-κ-卡拉胶;b-λ-卡拉胶;c-ι-卡拉胶;d-琼胶寡糖图3 红藻来源的寡糖结构Fig.3 Structure of oligosaccharides derived from red algae
2 海洋动物寡糖
海洋动物多糖主要包括甲壳素(chitin)、糖原(glycogen)、硫酸软骨素(chondroitin sulfate,CS)、硫酸角质素(keratan sulfate,KS)以及透明质酸(hyaluronic acid,HA)等。其中,来源于海洋甲壳类动物外壳的甲壳素是目前产量最高的一类海洋动物多糖,其分子结构是由2-乙酰氨基-2-脱氧-D-吡喃葡萄聚糖和2-氨基-2-脱氧-D-吡喃葡萄聚糖以β-1,4糖苷键连接而成的二元线型聚合物(图4),在酸性溶液中的高黏度和在中性pH下的低溶解性限制了其应用。甲壳素完全或部分脱乙酰化可生成壳聚糖,壳聚糖的降解产物壳寡糖(chitooligosaccharide,COS)具备多种生物学功能和良好的水溶性。目前,通过物理法、化学法(包括酸解法和氧化法)以及酶解法(壳聚糖酶或纤维素酶)降解可制备COS。XING等[12]比较了传统制备方法、微波辐射和酶水解制备的3种COS,发现传统方法所制备的COS主要由2糖和3糖组成,微波辐射法制备的寡糖主要由含或不含乙酰基的2~6糖组成,酶水解法制备的寡糖主要由3~5糖组成,不含乙酰基。近年来,一些新型环保的预处理方法已应用于甲壳素转化生产COS。HUSSON等[13]研究证明,小龙虾壳可通过高压均质化变成蓬松的网状结构,经高压均质处理的龙虾壳能被壳聚糖酶降解,产生COS。
CS是从动物组织中提取制备的酸性黏多糖,主要重复二糖单元为D-葡萄糖醛酸和N-乙酰氨基半乳糖,在酸性、碱性及酶解条件下可制备CS寡糖。鲁姣姣[14]对鲨鱼软骨的CS酸水解,经多级质谱分析,鉴定出了包括2糖、3糖和4糖在内的11种CS寡糖。此外,岩藻糖基化的硫酸软骨素(fucosylated chondroitin sulfate,FCS或FuCS)是海参体壁中含有的1种结构独特的糖胺聚糖,主要由N-乙酰氨基半乳糖和D-葡萄糖醛酸组成的CS骨架以及硫酸化岩藻糖组成。TAMURA等[15]通过化学合成的方法获得了岩藻糖2,4位硫酸化的FCS三糖。ZHANG等[16]利用酶降解得到基础合成原料,通过12步线性步骤合成了FuCS 6糖和9糖。
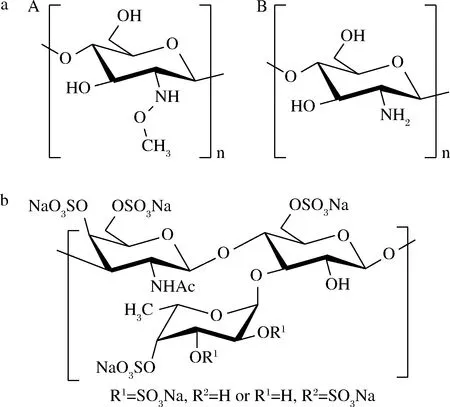
a-壳寡糖;b-岩藻糖基化的硫酸软骨素图4 海洋动物来源的寡糖结构Fig.4 Oligosaccharide structures of animal origin
3 海洋寡糖的生物活性
3.1 抗肿瘤活性
海洋寡糖的抗肿瘤活性及作用机制已有诸多研究。海洋寡糖可通过预防癌细胞增殖和转移、免疫调节、抗氧化性和抗炎等多种途径发挥抑癌作用。例如,对卡拉胶寡糖抗肿瘤潜在机制研究表明,ι卡拉胶寡糖可诱导骨肉瘤细胞(human osteoma cells,HOS)凋亡,并通过抑制Wnt/β-连环蛋白信号通路进而抑制HOS的增殖。此外,卡拉胶寡糖还可以竞争性抑制细胞外基质蛋白质和细胞膜表面蛋白聚糖的糖胺聚糖之间的相互作用,进而阻断癌细胞与基质的黏附,从而有效抑制癌细胞转移扩散[17]。体内实验表明,CS寡糖可以有效地被吸收并传递到肿瘤部位,并通过抑制细胞增殖和诱导凋亡显著抑制人结肠癌细胞HT-29异种移植瘤的生长,有望成为一种潜在的预防结直肠癌的营养物质[18]。与天然CS相比,经超声处理的低分子质量硫酸化CS片段增强了对A549肺癌细胞的增殖抑制和迁移作用[19]。
3.2 抗病毒活性
海洋寡糖具有较好的抗病毒活性,其主要机制是海洋寡糖中含有的糖醛酸、硫酸根等酸性基团能与病毒表面的功能蛋白作用,进而影响病毒对宿主细胞的黏附。例如,MAZUMDER等[20]发现琼胶寡糖可以阻止流感病毒B对宿主细胞的黏附作用;卡拉胶寡糖可以显著抑制流感病毒(H1 N1)的增殖,其原因可能是卡拉胶寡糖抑制了病毒的吸附过程,从而阻断了病毒在细胞中的繁殖[21];此外,AOS具有抗病毒活性,可应用于植物疫苗。例如,研究发现AOS对烟草马铃薯X病毒和烟草花叶病毒具有明显的防治效果[22]。此外,从海参中分离出的FCS寡糖也被报道是一种潜在的抗病毒活性物质[23]。
3.3 抗阿尔茨海默症活性
阿尔茨海默症(Alzheimer’s disease,AD)是一种与衰老相关的神经退行疾病,其主要特征是智力和社会功能逐渐恶化、记忆丧失、认知障碍、个性改变和自我照顾能力丧失。AD的形成与β淀粉样蛋白(amyloid-β,Aβ)的神经毒性相关。“甘露寡糖二酸”(GV-971)是一种已上市的抗AD药物,该药物可抑制Aβ纤丝的形成和解聚来发挥治疗作用。此外,GV-971还能调节机体免疫失衡、重塑肠道菌群稳态,进而降低脑神经性炎症,从而阻止AD病程进展[24-25]。海洋动物寡糖在改善AD方面也有显著效果。CS寡糖可能通过改变淀粉样前体蛋白代谢、阻断神经炎症、抑制活性氧的产生和减轻tau蛋白异常来改善AD[26]。通过Aβ诱导的AD细胞和动物模型评估N-乙酰壳寡糖(N-acetyl chitooligosaccharides,NACOS)的活性,发现NACOS显著改善了AD大鼠在水迷宫任务中的获得(学习)和保持(记忆)能力。脑组织切片HE染色显示,NACOS可改善Aβ诱导的海马神经退行性变,说明NACOS能减轻AD细胞和动物模型中淀粉样蛋白Aβ诱导的神经损伤[27]。
3.4 改善心脑血管疾病
心血管疾病是一类涉及心脏或血管的慢性代谢综合征,已成为全球公共卫生的重大挑战。心血管疾病的发生与高脂饮食和肠道微生物之间存在密切关系。AOS可通过改善脂质代谢、减少脂肪积累和调节肠道微生物菌群的失调而发挥降血脂作用[28]。此外,王珊[29]研究发现AOS能通过调控miR-34a改善线粒体功能和氧化应激作用延缓D-半乳糖诱导的心肌细胞衰老。藻酸双酯钠(propylene glycol alginate sodium sulfate,PSS)是我国第一代海洋糖类寡糖药物,可以高效抑制凝血酶介导的纤维蛋白的形成,进而发挥较好的抗凝血作用。
3.5 改善组织损伤和伤口愈合
壳寡糖在组织损伤和伤口愈合方面显示出潜在的治疗效果,如保护受损组织免受感染、增强渗透性、支持细胞黏附和促进细胞增殖[30]。裴彤[31]通过建立新西兰大白兔膝关节软骨缺失模型,发现CS寡糖能够更好地促进软骨修复和伤口愈合, 其原因可能是小分子质量的CS寡糖更易于机体吸收,因而使得软骨修复和伤口愈合的效果更为显著。李南等[32]研究发现,CS寡糖能促进大鼠受损心肌细胞的增殖进而加快其受损心肌组织的修复。
除此以外,海洋寡糖还具有其他生物活性,如表1所示。

表1 常见海洋动植物来源寡糖及其生理活性Table 1 Bioactivities of oligosaccharides from marine animals and plants

4 在功能性食品中的应用
4.1 减肥食品
肥胖症是一种常见代谢性疾病。目前,在临床使用的大部分化学减肥药物虽然有着明显效果,但是所带来的副作用仍然困扰着患者,有些不良反应甚至会给部分患者造成伤害。因此,具有减肥作用且安全性高的寡糖被越来越多的科研人员作为新的研究目标。寡糖能与胆固醇、脂肪酸等结合,减少人体对脂肪的吸收。因此,可将寡糖添加到食品中,以期达到减肥效果。
研究表明,如图5所示,在HFD诱导的小鼠模型中,添加AOS能抑制脂肪细胞的生长,表明其具有潜在的抗肥胖作用[36]。研究人员给高脂饮食诱导的的肥胖症小鼠饲料中添加新琼寡糖,发现其可抑制肥胖症小鼠体重增加和血清总胆固醇(total cholesterol,TC)和甘油三酯(triglycerides,TG)含量升高[37]。傅楚涵[38]将COS制成滴丸后对肥胖大鼠进行给药,结果表明在不影响食欲的条件下,COS能抑制高脂饮食诱导的SD肥胖大鼠体重增加及减缓大鼠体内的脂肪含量增加。低分子质量COS抑制小鼠长期高脂饮食诱导的肥胖症状,其降脂作用可能是通过胆汁酸结合引起的粪便脂肪或胆汁酸排泄增加介导的。由于胰腺脂肪酶活性的抑制,小肠对膳食脂质(TC和TG)的吸收减少[39]。目前,市面上已经出现了一些添加一定量寡糖的咀嚼片、饮料以及糖果等减肥保健食品[40]。
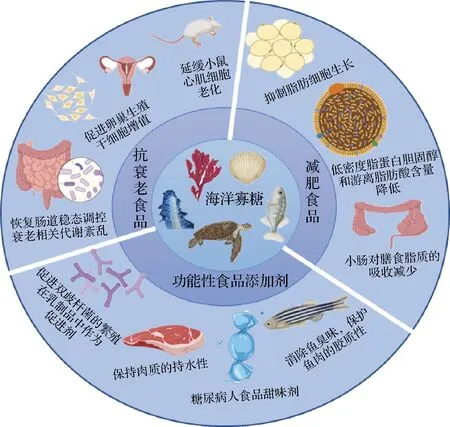
图5 海洋寡糖在功能性食品中的应用Fig.5 Application of marine oligosaccharides in functional foods
4.2 抗衰老食品
目前,高效且毒副作用小的天然活性物质是开发抗衰老食品原料的重要来源。海洋生物活性物质对衰老的干预机制主要有:(1)增加端粒酶活性延缓衰老;(2)调控AMPK-mTOR-ULK1信号通路干预衰老;(3)调节抗氧化酶活性减轻氧化损伤;(4)清除自由基减缓细胞凋亡;(5)恢复肠道稳态调控衰老相关代谢紊乱[41]。海洋寡糖具有易吸收、低毒性以及良好的生物相容性等特点,同时有助于机体调节肠道菌群、抗氧化和调控衰老相关基因表达等活性,因此可作为开发抗衰老功能性食品的原料来源。
研究表明,如图5所示,D-半乳糖与体内活性氧含量升高、线粒体功能受损、白介素水平升高及DNA损伤有关,AOS可以延缓D-半乳糖诱导的小鼠心脏老化从而延长寿命[42]。COS通过调控巨噬细胞的细胞因子分泌,间接促进卵巢生殖干细胞的增殖,抑制其衰老[43]。浒苔和石莼来源的绿藻寡糖可降低丙二醛和晚期糖基化终产物的水平,提高了小鼠体内谷胱甘肽、过氧化氢酶、超氧化物歧化酶和端粒酶水平以及总抗氧化能力,在小鼠衰老方面具有潜在的治疗作用[44]。
4.3 功能性食品添加剂
传统的食品添加剂只是改善了食品的风味、外观和组织结构,不具备营养保健功能,而功能性食品添加剂同时具备了以上2种功能以满足特定消费者的需求。海洋寡糖安全性高,具有多种生物活性,因此可将寡糖作为一种添加剂应用于食品中。例如,将寡糖添加到健康营养饮料中,既起到了改善风味和稳定的作用,又赋予该饮品一定的营养强化功能。COS可以作为食品工业中的添加剂[45]。如图5所示,添加COS可抑制蛋白质巯基氧化,从而抑制食品冷冻储存期间蛋白质巯基含量降低[46]。涂抹COS能更好地降低果实的呼吸强度,从而对冷藏水蜜桃起到一定的保鲜效果[47]。将低分子CS加入肉类食品中可发挥抗氧化功能且防止出现褐变问题,低分子CS还能通过改善鱼肉风味和提高鱼肉的持水性,从而提高鱼肉品质[48]。
5 结论与展望
海洋生物资源是一类有待深入开发的具有巨大潜力的生物资源。环境多样性决定了生物多样性,进而决定了化合物的多样性。海洋生物多糖有异于陆上动植物多糖,大多属杂多糖,且其构成的单糖种类多,因而海洋寡糖种类繁多,结构与功能更为复杂。海洋寡糖作为一个重要的海洋资源,因其优异的生物活性受到越来越多的关注,已成为海洋食品研究的一个重要发展趋势,也是潜在的经济增长点。目前,海洋寡糖主要是通过物理、化学等方法从海洋多糖中获得。如何高效、经济、快速大量制取海洋寡糖是当前迫切需要解决的关键技术问题。此外,海洋寡糖生物活性广泛且安全性高,可应用于功能性食品的开发,但仍需要加强这些功能性食品的质量与安全评价,建立更加完善的质量评价体系,从而提升海洋寡糖类功能食品的品质。