解冻方式对鸡腿肉蛋白氧化特性的影响
2023-03-22梁诗惠冯钰敏邓华荣刘巧瑜白卫东吴俊师陈海光
梁诗惠,冯钰敏,邓华荣,刘巧瑜,白卫东,吴俊师,陈海光*
1(仲恺农业工程学院 轻工食品学院,广东省岭南特色食品科学与技术重点实验室, 农业农村部岭南特色食品绿色加工与智能制造重点实验室,现代农业工程创新研究院, 广东 广州,510225)2(深圳市金谷园实业发展有限公司,广东 深圳,518000)
冷冻肉不仅作为国家调节肉类食品市场的重要产品,也是肉制品在国内运输及进出口贸易的主要形态[1]。但是肉品在冷冻解冻过程中会引起蛋白质和脂质氧化,最终影响食用品质。肌原纤维蛋白氧化是指肉类肌肉中的主要结构蛋白及功能性蛋白发生了由活性氧、活性氮直接诱导的,或氧化生成的次级产物间接诱导的一些共价修饰。这些共价修饰会使蛋白质发生一些不可逆改变,如蛋白变性、结构损伤等,最终影响食品的食用品质[2]。
近年来,关于解冻方式对肉类蛋白质氧化的研究很多。王琳琳等[3]主要研究5种不同解冻方式对牦牛肉蛋白氧化功能特性及新鲜度的影响,研究发现牦牛肉经空气解冻后,其肌原纤维蛋白氧化程度最大,具体表现为羰基含量、表面疏水性指数最高,巯基含量和Ca2+-ATPase活性最低。蔡璐昀等[4]研究不同超声辅助解冻对海鲈鱼肌原纤维蛋白理化性质的影响,发现超声微波解冻方式对海鲈鱼蛋白质的降解程度影响较小,该方式可以更好地维持海鲈鱼蛋白质结构。刘磊等[5]用不同解冻方式(低温解冻、流水解冻和微波解冻)对鹅腿肉进行解冻,以拉曼光谱的测定结果表征蛋白质二级结构的变化,发现低温解冻对蛋白质二级结构的影响较小,流水解冻的影响较大。
本文以冷冻鸡腿肉为研究对象,在前期研究基础上,探究室温解冻、流水解冻、冷藏解冻、微波解冻4种解冻方式对蛋白质氧化程度、蛋白质聚集或降解情况、蛋白质结构以及组织学特性方面进行研究,探讨不同解冻方式对冷冻鸡腿肉肌原纤维蛋白的影响,以明确不同解冻方式对鸡肉品质影响的可能机制。
1 材料与方法
1.1 材料与仪器
冷冻鸡腿肉(厚度为1 cm的鸡腿块),深圳市金谷园实业发展有限公司;三氯乙酸、无水乙醇(均为分析纯),天津市百世化工有限公司;2,4-二硝基苯肼、盐酸胍(均为分析纯),南京圣比奥生物科技公司;三羟甲基氨基甲烷盐酸盐(Tris-HCl 缓冲液),上海麦克林生化科技有限公司;超微量Ca2+-ATPase试剂盒,南京建成生物工程研究所;双缩脲试剂盒,上海源叶生物科技有限公司。
JY600C电泳仪,北京君意东方电泳设备有限公司;RT—6000酶标分析仪,深圳雷社生命科学股份有限公司;XploRA PLUS共聚焦拉曼光谱仪,堀场(中国)贸易有限公司。
1.2 试验方法
1.2.1 解冻方式
(1)室温解冻(A)。将冷冻鸡腿肉样品(20±0.5) ℃的室温下解冻,用数字温度计测得鸡腿肉中心温度为0 ℃即可。
(2)流水解冻(B)。将冷冻鸡腿肉样品置于流水下进行解冻,保持流速恒定。用数字温度计测得鸡腿肉中心温度为0 ℃即可。
(3)冷藏解冻(C)。将冷冻鸡腿肉样品放入冰箱中进行4 ℃冷藏解冻,用数字温度计测得鸡腿肉中心温度为0 ℃即可。
(4)微波解冻(D)。将冷冻鸡腿肉样品用保鲜袋装好后放入微波炉中进行解冻,用数字温度计测得鸡腿肉中心温度为0 ℃即可。
1.2.2 肌原纤维蛋白(myofibrillar protein,MP)的提取
参考LIU等[6]的方法并稍作修改,从鸡腿肉中分离提取MP。将鸡腿肉和预冷的Tris-HCl缓冲液(0.1 mol/L KCl溶液和20 mmol/L Tris-HCl溶液,pH 7.0)按料液比1∶4(g∶mL)用高速匀浆机以10 000 r/min的速度匀浆3次。用20目筛网过滤后离心(5 000 r/min,4 ℃,离心15 min)。上清液倒出,将颗粒收集为粗MP。重复上述步骤4次,获得高质量的MP。整个过程均在4 ℃下进行。
1.2.3 羰基含量的测定
测定羰基的方法按照LEVINE等[7]方法进行修改,方法如下:准确称取质量0.1 g鸡肉糜加入0.9 mL的匀浆介质进行匀浆后离心(2 500 r/min,10 min),使用双缩脲法测定上清液的蛋白浓度。同时取0.45 mL蛋白溶液与0.05 mL的缓冲溶液混匀后离心(11 000 r/min,10 min)。取0.1 mL上清液,加入0.4 mL 2, 4-二硝基苯肼的盐酸溶液(空白样品反应液中不含2, 4-二硝基苯肼),37 ℃下避光反应30 min,加入0.5 mL质量分数20%的三氯乙酸,振荡后离心(12 000 r/min,10 min)。将蛋白沉淀用1 mL的V(乙醇)∶V(乙酸乙酯)=1∶1溶液洗涤4次,加1 mL盐酸胍溶液(6 mol/L),在37 ℃下水浴15 min溶解沉淀,离心(12 000 r/min,15 min)。取上清液于370 nm处测定吸光值,使用摩尔吸光系数计算。
1.2.4 巯基含量的测定
参考BEVERIDGE等[8]的Ellman试剂分析方法并稍加改动测定MP总巯基,将提取好的MP用20 mmol/L pH 6的磷酸盐缓冲液稀释至质量浓度为5 mg/mL的MP溶液。吸取10 μL肌原纤维蛋白溶液和150 μL Ellman试剂到酶标板孔中,剧烈振荡使其反应完全,以不加2-硝基苯甲酸[5,5′-dithiobis-(2-nitrobenzoic acid),DTNB]组为对照,在405 nm处测定吸光值,计算蛋白总巯基含量。
1.2.5 表面疏水性的测定
参照CHELH等[9]的方法稍作修改,取5 mL MP溶液(5 mg/mL)与1 mL溴酚蓝溶液(1 mg/mL)混合均匀后2 000 r/min离心15 min。以无MP的磷酸盐缓冲液为空白对照,上清液稀释10倍后在595 nm处测定吸光度。以溴酚蓝结合量来计算,如公式(1)所示:
(1)
1.2.6 Ca2+-ATPase活性的测定
Ca2+-ATPase活性按试剂盒说明进行测定。
1.2.7 SDS-PAGE分析
将提取好的MP用缓冲液稀释至质量浓度为40 mg/mL的MP溶液。采用MARINO等[10]的方法进行试验,使用4%浓缩胶和12%分离胶来分析解冻后样品的蛋白质变化。
1.2.8 组织学特性
参考JIANG等[11]的方法并进行修改:将样品切成小块后用4%多聚甲醛浸泡24 h,再用70%~95%乙醇溶液梯度脱水1 h,经二甲苯透明处理后再包埋、染色。用CaseViewer软件进行分析。使用10×的物镜倍数,截取片段,以及随机选取5个点测量其肌纤维间隙,每点共测量10组肌纤维直径的数据。
1.2.9 肌原纤维蛋白二级结构测定
参考袁丽等[12]的方法稍作修改,将MP均匀涂抹在载玻片上,采用激发波长532 nm,曝光时间8 s,循环15次,衰减程度25%,波数为400~2 000 cm-1测定参数随机选取的3个位置进行测定。
1.3 数据处理与分析
所有试验重复3次,结果以平均值±标准偏差表示。用IBM SPSS Statistics 19软件进行显著性分析,用Origin 2018制图。
2 结果与分析
2.1 不同解冻方式对鸡腿肉羰基含量的影响
羰基是肽键断裂和氨基酸侧链被自由基氧化生成的主要产物之一,是判断肌原纤维蛋白氧化程度的重要指标之一[13]。蛋白氧化会使包裹在蛋白质分子内部的氨基酸暴露,使羰基化合物的生成量增多[14]。由图1可知,室温解冻鸡腿肉中羰基含量最高(3.63 nmol/mg),微波解冻次之(3.24 nmol/mg),二者之间差异并不显著(P>0.05)。这与侯晓荣等[15]的研究结果相似,其研究发现中国对虾在微波解冻时因温度较高从而导致羰基化合物的生成量偏大。冷藏解冻的羰基含量较低(2.04 nmol/mg),也可能是因为低温抑制了蛋白酶活性。流水解冻方式下的羰基含量最低(p<0.05),为0.97 nmol/mg,说明流水解冻方式下生成的羰基化合物较少,氧化程度较轻。
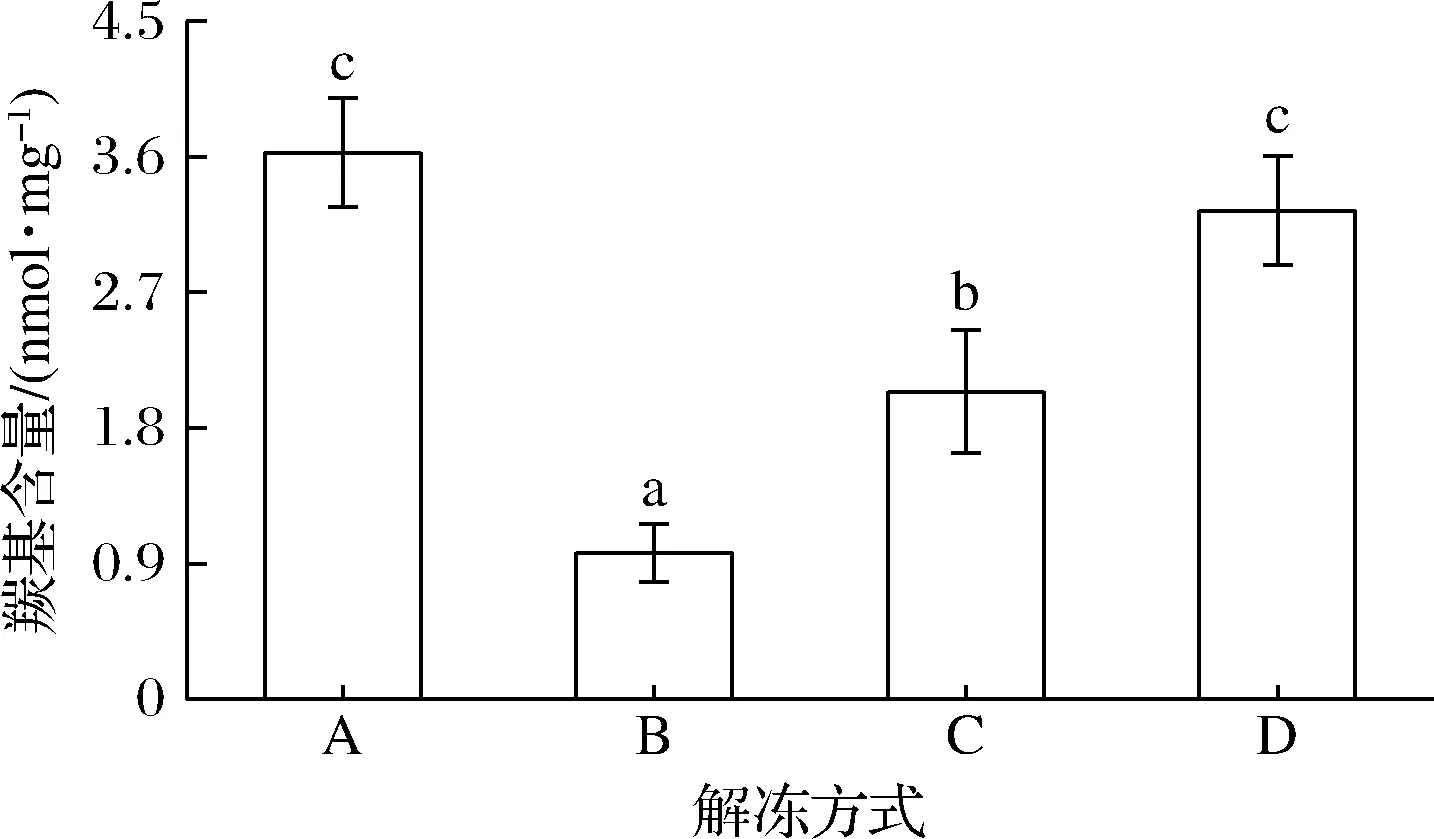
图1 不同解冻方式对鸡腿肉羰基含量的影响Fig.1 Effect of different thawing methods on the carbonyl content of chicken thigh meat注:不同小写字母代表显著性差异(P<0.05)下同
2.2 不同解冻方式对鸡腿肉巯基含量的影响
研究表明,冷冻解冻过程中,巯基容易发生氧化生成二硫键以及生成相应的共价化合物,从而导致巯基含量降低[16]。由图2可知,冷藏解冻的巯基含量(285.23 μmol/g)显著高于其他3种解冻方式(P<0.05),说明低温解冻方式对鸡腿肉的总巯基损失影响较小,这与崔燕等[17]提出的低温高湿解冻可以有效降低鲳鱼巯基的氧化速度的研究结果一致。流水解冻的疏基含量次之,为188.31 μmol/g,氧化程度相对较低。室温解冻的巯基含量最低(110.55 μmol/g),可能原因是解冻温度较高且解冻时间较长,导致该组样品的肌球蛋白头部结构发生变化,巯基间的相互作用导致蛋白质的聚集作用更加强烈[18]。就巯基含量这一指标而言,冷藏解冻方式优于其他3种解冻方式。
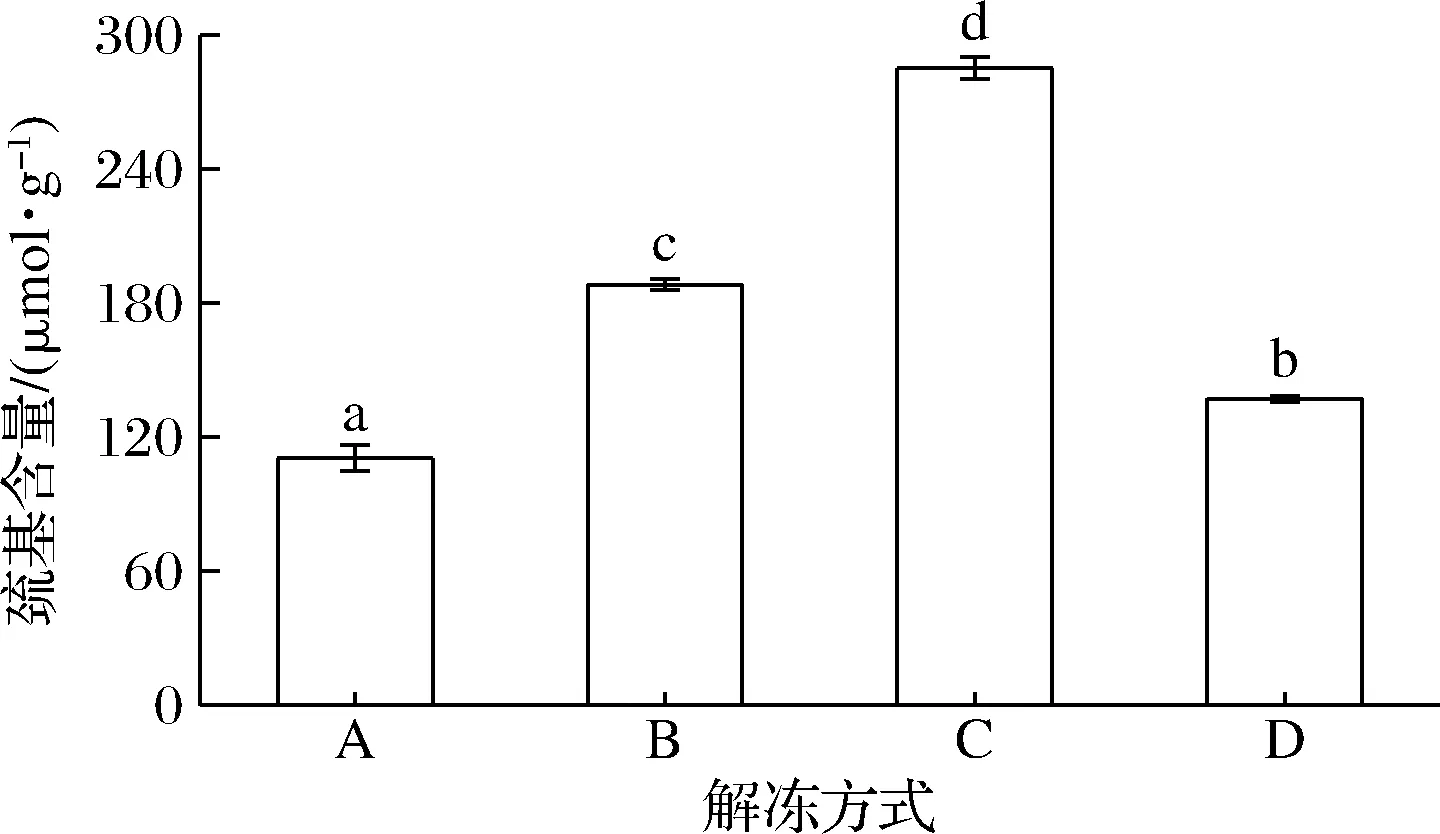
图2 不同解冻方式对鸡腿肉巯基含量的影响Fig.2 Effect of different thawing methods on the sulfhydryl content of chicken thigh meat
2.3 不同解冻方式对鸡腿肉表面疏水性的影响
表面疏水性表征的是蛋白质分子表面疏水性氨基酸的相对含量,是评估蛋白构象稳定性的重要指标之一[19]。不同解冻方式对冷冻鸡腿肉表面疏水性的影响如图3所示,微波解冻的表面疏水性(16.43 μg),显著高于其他3种解冻方式(P<0.05),这说明微波解冻会改变肌原纤维蛋白的构象,使蛋白质发生降解作用及变性作用,蛋白质内部的疏水基团大量暴露,最终导致表面疏水性含量增高[20]。流水解冻的表面疏水性最低,为10.36 μg(P<0.05),说明流水解冻方式下的鸡腿肉的蛋白构象变化较小。冷藏解冻由于解冻温度低,能够有效抑制微生物的生长,抑制蛋白的变性程度,因此其表面疏水性较低(12.86 μg),这与陈胜[21]的研究结果相似。
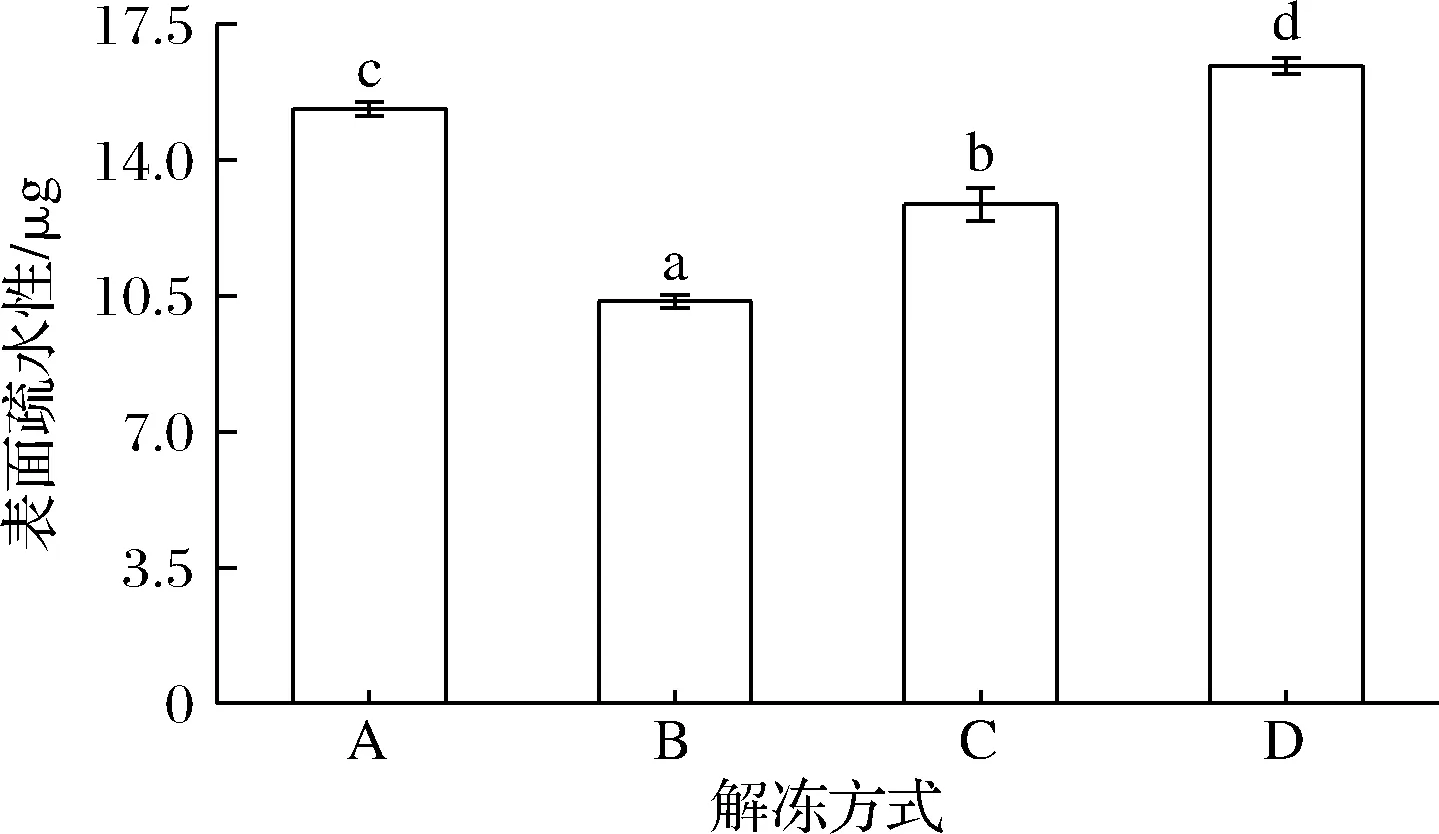
图3 不同解冻方式对鸡腿肉表面疏水性的影响Fig.3 Effect of different thawing methods on the surface hydrophobicity of chicken thigh meat
2.4 不同解冻方式对鸡腿肉Ca2+-ATPase活性的影响
Ca2+-ATPase活性主要源自肌球蛋白,Ca2+-ATPase活性的降低可能是因为肌球蛋白的球状头部结构发生改变以及蛋白质分子的聚集[22]。由图4可知,室温解冻对鸡腿肉的Ca2+-ATPase活性影响程度最大,Ca2+-ATPase活性为0.72 U/mg,说明室温解冻与其他3种解冻方式相比,酶活性损失较大,该种解冻方式对肌球蛋白的影响较大,肌球蛋白变性程度严重。有学者认为,Ca2+-ATPase活性与巯基的变化有关,肌球蛋白头部巯基的氧化会使Ca2+-ATPase活性下降[23]。研究发现室温解冻的巯基含量最低,这可能是导致室温解冻组Ca2+-ATPase活性较低的原因。

图4 不同解冻方式对鸡腿肉Ca2+-ATPase活性的影响Fig.4 Effect of different thawing methods on the Ca2+-ATPase activity of chicken thigh meat
2.5 不同解冻方式对鸡腿肉SDS-PAGE的影响
SDS-PAGE分析可以反映蛋白是否发生氧化,其蛋白亚基是否发生降解或聚集反应[24]。不同解冻方式对鸡腿肉肌原纤维蛋白SDS-PAGE的影响如图5所示。通过比对分子质量可以辨别出图中由上到下依次为肌球蛋白重链(myosin heavy chain,MHC)、副肌球蛋白(paramyosin)、肌动蛋白(actin)、肌球蛋白轻链(myosin light chain,MLC),其中MHC和actin是主要的蛋白质条带。在本研究中,4种解冻方式中MHC条带边缘模糊,蛋白有降解现象;actin条带的变化差异并不明显;MLC条带则有明显变化,有发生降解或聚集。MLC条带中冷藏解冻条带颜色变深,分子质量增大,发生了聚集;室温解冻条带颜色最弱,说明该组的肌原纤维蛋白降解程度较大。
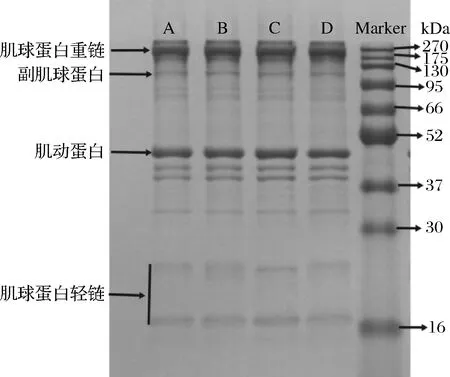
图5 不同解冻方式下鸡腿肉的SDS-PAGE图谱Fig.5 SDS-PAGE profiles of chicken thigh meat with different thawing methods
2.6 不同解冻方式对鸡腿肉组织结构的影响
不同解冻方式对肌束膜的破坏有不同程度的影响,肌束膜一旦遭受破坏,其肌肉组织的完整性和致密结构也会受到影响[22],具体表现为肌纤维间隙变大,肌肉保水性下降,汁液损失严重等。不同解冻方式鸡腿肉的纵切面如图6所示。结合表1数据可知,室温解冻的肌纤维间隙较明显,可能是因为鸡腿肉暴露在空气中的时间较长导致的蛋白变性,引起肌肉松弛,肌纤维间隙增大[22]。流水解冻后的鸡腿肉的肌纤维间隙较小,肌束结合相对紧密,说明流水解冻方式的保水性较好。冷藏解冻的肌纤维间隙仅次于流水解冻,可能是低温抑制了蛋白酶活性和肌纤维降解。微波解冻后的鸡腿肉出现明显的肌原纤维收缩断裂的现象,这可能是因为微波解冻过程中样品局部加热导致部分肉熟化甚至过度脱水,从而导致其肌纤维间隙增大,组织结构的紧密性下降,结构破坏严重[25]。
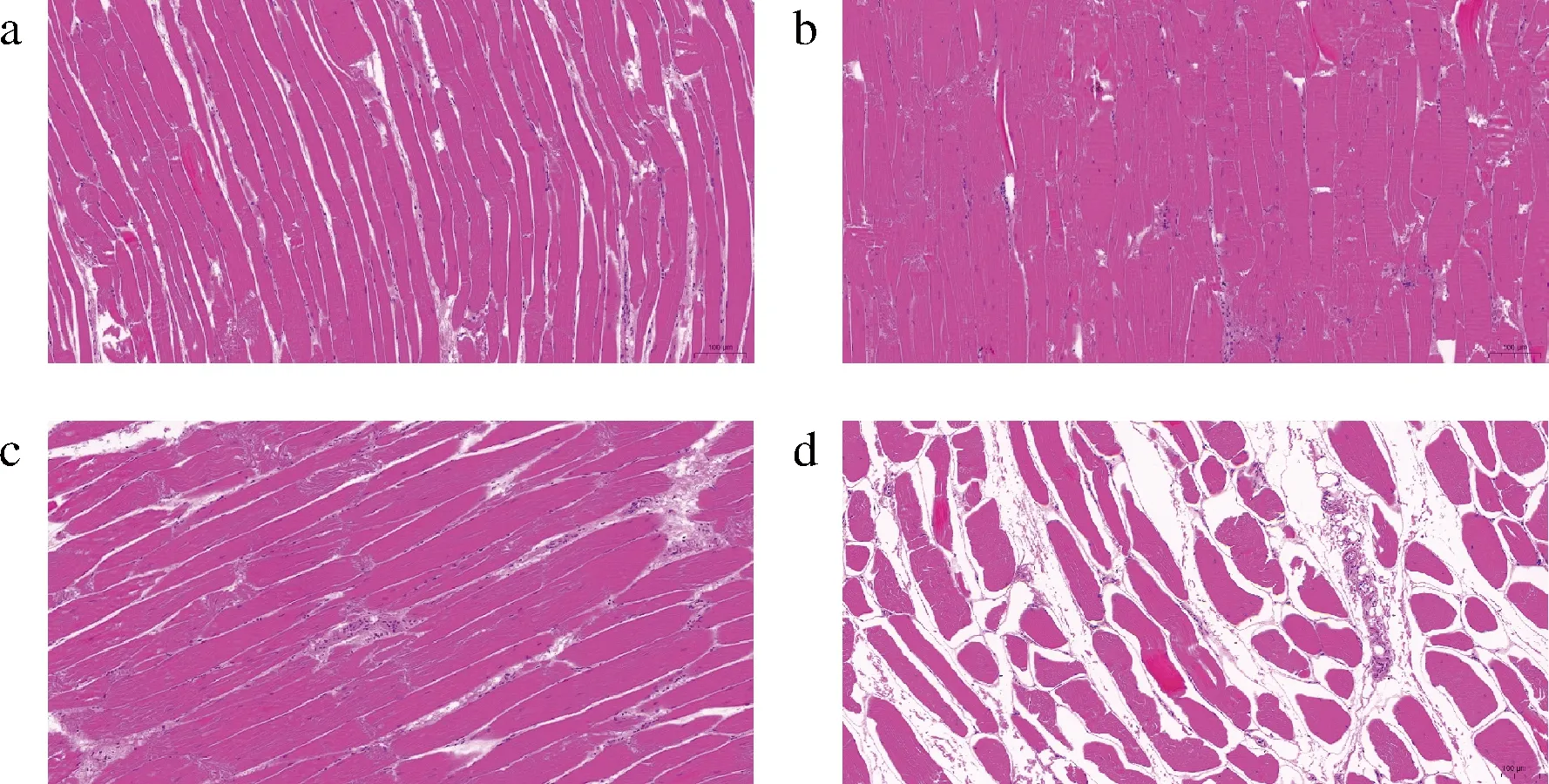
a-室温解冻;b-流水解冻;c-冷藏解冻;d-微波解冻图6 不同解冻方式对鸡腿肉组织结构的影响Fig.6 Effect of different thawing methods on the tissue structure of chicken thigh meat

表1 不同解冻方式对鸡腿肉肌纤维间距的影响Table 1 Effect of different thawing methods on muscle fiber spacing of chicken thigh meat
2.7 不同解冻方式对肌原纤维蛋白二级结构的影响
酰胺Ⅰ带(1 600~1 700 cm-1)是反映蛋白质二级结构的主要谱带[26]。包括β-折叠(1 615~1 637 cm-1)、无规则卷曲(1 640~1 648 cm-1)、α-螺旋(1 650~1 664 cm-1)、β-转角(1 673~1 686 cm-1)[27]。
利用软件PeakFit v 4.12对拉曼图谱进行拟合分析得到图7和图8。如图7所示,不同解冻方式对冷冻鸡腿肉MP结构有显著影响。就拉曼峰的相对强度来看,流水解冻组样品的拉曼强度要高于其他3种解冻方式,室温解冻组的拉曼强度最低。说明室温解冻破坏了肌原纤维蛋白原有的二级结构,形成了新的蛋白质结构。由图8可知,流水解冻组α-螺旋含量最高(58%),表明蛋白质结构状态良好,稳定性强[12],由此说明流水解冻对蛋白质二级结构的影响最小。而微波解冻组α-螺旋含量最少(29%),β-折叠含量相对较高(18%),这可能是因为解冻过程中受热不均,且局部熟化导致α-螺旋向其他结构转化[20],从而导致其蛋白质稳定性降低。鸡腿肉经室温解冻后,β-转角含量(26%)和无规则卷曲含量(31%)相对较高,无规则卷曲含量越多,则说明蛋白质结构紊乱,蛋白质的变性程度大[12],因此室温解冻组的蛋白质二级结构的稳定性较差。

a-室温解冻;b-流水解冻;c-冷藏解冻;d-微波解冻图7 不同解冻方式对肌原纤维蛋白的拉曼光谱拟合曲线图Fig.7 Raman spectrum fitting curve of myofibrillar protein by different thawing method

图8 不同解冻方式对肌原纤维蛋白二级结构 分布比例的影响Fig.8 Effect of different thawing method on the distribution ratio of myofibrillar protein secondary structure
3 结论
试验结果表明,室温解冻的羰基含量(3.63 nmol/mg)、巯基含量(110.55 μmol/g)和Ca2+-ATPase活性(0.72 U/mg)最低,蛋白氧化最为严重;肌球蛋白轻链条带模糊,有轻微降解现象;拉曼强度最低,且β-折叠和无规则卷曲含量相对较高,蛋白质结构的稳定性较差。流水解冻的羰基含量(0.97 nmol/mg)和表面疏水性最低(10.36 μg), Ca2+-ATPase活性最高(2.95 U/mg),其蛋白氧化程度较轻,组织结构紧密;拉曼强度和α-螺旋含量(58%)最高,蛋白质二级结构完整性较好。冷藏解冻的巯基含量最高(258.23 μmol/g),巯基损失较小;肌球蛋白轻链条带聚集;微波解冻的组织结构破坏严重,有肌纤维断裂和肌纤维间隙增大等现象;蛋白质二级结构较紊乱,α-螺旋结构向其他无序结构转化。综上所述,流水解冻对冷冻鸡腿肉的蛋白影响较小,是较为理想的解冻方式。
