马铃薯多酚氧化酶的分离纯化及酶学特性研究
2023-03-15洪丽萍汪文华何恩铭张文惠
洪丽萍 汪文华 何恩铭 张文惠
洪丽萍,汪文华 ,何恩铭,等.马铃薯多酚氧化酶的分离纯化及酶学特性研究[J].福建农业科技,2023,54(12):54-61.
收稿日期:2023-11-02
作者简介:洪丽萍,女,1969年生,助理研究员,主要从事植物生理及农产品保鲜研究。
*通信作者:汪文华,男,1985年生,副研究员,主要从事植物逆境生理研究(E-mail:wangwenhua0629@163.com)。
基金项目:厦门市重大科技计划项目(3502Z20211004);厦门市科技扶贫项目(3502Z20194509、3502Z20204504-2、3502Z20204501-3)。
摘 要:为控制马铃薯在贮藏和加工過程发生的酶促褐变,对马铃薯多酚氧化酶进行分离纯化,并研究其酶学特性。采用缓冲液提取、低温离心得到马铃薯多酚氧化酶(PPO)粗酶液,粗酶液经硫酸铵分级盐析、Sephadex G-25分子凝胶柱层析脱盐处理、DEAE Sepharose Fast Flow 阴离子交换柱层析和Sephadex G-75分子筛凝胶过滤层析分离纯化得到马铃薯PPO,进一步对其部分酶学特性进行研究。结果显示:纯化后的马铃薯PPO其比活力为 283.0 U·mg-1,回收率为16.8% ,纯化倍数为18.6倍;该酶最适反应温度为30℃,最适反应pH为6.5;以邻苯二酚为底物时,最适底物浓度为50 mmol·L-1。该酶对焦性没食子酸、间苯二酚的底物亲和性较强,对4-甲基儿茶酚、咖啡酸、没食子酸、对苯二酚、邻苯二酚、绿原酸的底物亲和性较低,对N-BOC-酪胺、愈创木酚亲和性很低。
关键词:马铃薯;多酚氧化酶;纯化;酶学特性
中图分类号:S 532 文献标志码:A 文章编号:0253-2301(2023)12-0054-08
DOI: 10.13651/j.cnki.fjnykj.2023.12.008
Study on the Separation and Purification of Polyphenol Oxidase from Potatoand Its Enzymatic Properties
HONG Li-ping, WANG Wen-hua*, HE En-ming, ZHANG Wen-hui
(Fujian Key Laboratory of Subtropical Plant Physiology and Biochemistry, Fujian Institute ofSubtropical Botany, Xiamen, Fujian 361006, China)
Abstract: In order to control the enzymatic browning of potato during the storage and processing, the potato polyphenol oxidase was isolated and purified, and its enzymatic properties were studied. The crude enzyme fluid of potato polyphenol oxidase (PPO) was obtained by the extraction of buffer solution and centrifugation at low temperature. Then, the crude enzyme fluid was separated and purified through the ammonium sulfate salt fractionation, Sephadex G-25 molecular gel column chromatography desalination treatment, DEAE Sepharose Fast Flow anion exchange column chromatography and Sephadex G-75 molecular sieve gel filtration chromatography to obtain the potato polyphenol oxidase, and some of its enzymatic properties were further studied. The results showed that: the specific activity of purified PPO was 283.0 U·mg-1, the recovery rate was 16.8%, and the purification fold was 18.6 times. The optimum reaction temperature and pH of the enzyme were 30℃ and 6.5, respectively. When catechol was used as the substrate, the optimal concentration of substrate was 50 mmol·L-1. The enzyme had strong substrate affinity for pyrogallic acid and resorcinol, and had low substrate affinity for 4-methylcatechol, caffeic acid, gallic acid, hydroquinone, catechol and chlorogenic acid, while having low affinity for N-BOC-tyramine and guaiacol.
Key words: Potato; Polyphenol oxidase; Purification; Enzymatic properties
马铃薯Solanum tuberosum L.是除小麦、大米和玉米之外,世界上消费量最大的食物之一,含有丰富的碳水化合物、膳食纤维、类胡萝卜素、花青素和微量营养素(如维生素C、维生素B6、钾、叶酸、铁、硫胺、核黄素和烟酸),生产周期相对较短且产量很高,可以用各种方式烹饪用于不同的菜肴,如土豆泥、土豆面包、薯条、土豆片和土豆沙拉等,深受消费者喜爱。马铃薯在收获、贮藏和运输过程中常常因机械损伤而发生酶促褐变,在新鲜加工过程和加工后也容易发生酶促褐变,造成营养、感官、味道等多种重要品质发生下降,对马铃薯的生产产生不利影响。
酶促褐变是果蔬贮藏和加工过程中的常见现象,主要是由多酚氧化酶引起的。多酚氧化酶(polyphenol oxidase, PPO)是自然界中普遍存在的一类含铜酶,能利用氧分子催化单酚的羟化反应生成二酚,并进一步氧化生成具有颜色和高度活性的醌,醌类物质经自身缩合或与内源性氨基酸和蛋白质发生反应,形成黑色或褐色物质,促使果蔬发生酶促褐变,影响果蔬及其加工产品的营养风味及加工性能[1-4]。因此,研究马铃薯多酚氧化酶的酶学特性对马铃薯贮藏保鲜及产品加工过程中防褐变技术的开发应用具有重要意义。
目前,国内外对果蔬中多酚氧化酶分离纯化及特性研究已十分广泛,包括山药[5]、丝瓜[6]、硬粒小麦[7]、芒果[8]、人参果[9]和茶叶[10]等 。对马铃薯多酚氧化酶的分离纯化及酶学性质方面的研究也有见报道[11-13],但因品种、纯化方法不同而有不同结果,纯化得到的酶活性偏低,对酶学特性的研究尚不够全面。本研究选用易褐变的马铃薯品种Favorita[14]为研究材料,通过缓冲液提取、硫酸铵分级盐析和柱层析进行分离纯化获得马铃薯多酚氧化酶,并对其酶学性质进行研究,以期完善马铃薯多酚氧化酶的纯化方法及酶学特性研究,为探索多酚氧化酶对马铃薯块茎发生褐变的作用机制,调控马铃薯贮藏和加工过程中的褐变提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1 供试样品 供试马铃薯来自吉林省马铃薯研究所的Favorita品种。
1.1.2 主要试剂 牛血清蛋白(BSA)标准品(≥96%)、考马斯亮蓝G-250染色液:上海阿拉丁生化科技股份有限公司;邻苯二酚、磷酸二氢钠、抗坏血酸钠、柠檬酸、N-BOC-酪胺、绿原酸、邻苯二酚、4-甲基儿茶酚、间苯二酚、焦性没食子酸、对苯二酚、咖啡酸、没食子酸、愈创木酚:均为分析纯,上海麦克林生化科技有限公司;柠檬酸钠、磷酸氢二钠、乙酸钠、磷酸:均为分析纯,西陇科学股份有限公司;聚乙烯吡咯烷酮、葡聚糖凝胶SephadexG-25柱、琼脂糖凝胶DEAE-FF阴离子交换层析柱、葡聚糖凝胶SephadexG-75柱:北京索莱宝科技有限公司;氯化钠、硫酸铵、无水乙醇:均为分析纯,国药集团化学试剂有限公司。
1.1.3 仪器与设备 试验所用仪器主要有分析天平(BSM 120,上海卓精电子科技有限公司)、pH计(ION700,北京索莱宝科技有限公司)、紫外可见分光光度计(UV-1200,上海美谱达仪器有限公司)、金属浴(H2O3-100C,卡尤迪生物科技宜兴有限公司)、台式高速离心机(3K30,德国Sigma)、电泳仪(E1102,上海碧云天生物技术有限公司)。
1.2 马铃薯多酚氧化酶的分离纯化
1.2.1 马铃薯PPO粗酶液的制备 参考Christoph Eicken等[15]的方法,略做修改。取4℃条件下预冷24 h的新鲜马铃薯,清洗干净后去除表皮,称取500 g加入已经预冷的200 mL分离缓冲液中(含1.26 g乙酸钠、0.2 g抗坏血酸钠、1.17 g氯化钠,pH 6.0),加入20 g聚乙烯吡咯烷酮,于4℃条件下匀浆,用4层纱布过滤,即得粗酶液。
1.2.2 硫酸铵分级盐析 将硫酸铵研磨成粉状,缓慢加入到上述制备的粗酶液中,使粗酶液中硫酸铵浓度达到20%饱和度,于4℃下静置24 h后将混合溶液离心(4℃、15000 r·min-1、20 min),取上清液继续用30%~80%不同饱和度硫酸铵进行盐析,测定每次盐析后上清液中的酶活力。以粗酶液中的酶活力为100%,得到每次测定后的相对酶活力[16]。
1.2.3 Sephadex G-25凝胶柱层析 使用Sephadex G-25凝胶柱对硫酸铵分级盐析后的酶液进行脱盐。用超纯水清洗Sephadex G-25凝胶柱,再使用0.02 mol·L-1磷酸盐缓冲溶液(pH 7.0)平衡柱子。将分级沉淀后的样品上样,洗脱流速为1.0 mL·min-1,测定各管的PPO活性,合并收集酶活性峰。
1.2.4 DEAE Sepharose Fast Flow阴离子交换柱层析 参考滕杰[17]的方法,略做修改。经Sephadex G-25凝胶柱脱盐后的酶液,上样于DEAE Sepharose Fast Flow阴离子交换色谱柱,选用磷酸盐缓冲液(50 mmol·L-1,pH6.8),流速为1.0 mL·min-1,平衡缓冲液洗脱至完全吸附;接着用NaCl梯度为0~1.0 mol·L-1的磷酸盐缓冲液(50 mmol·L-1,pH6.8)进行洗脱,流速为1.0 mL·min-1。测定各管的PPO活性和蛋白质浓度。合并收集酶活性峰。
1.2.5 Sephadex G-75分子筛凝胶过滤层析 参考滕杰[17]的方法,略做修改。使用磷酸缓冲液(50 mmol·L-1,pH 6.8,含0.1 mol·L-1 NaCl)平衡Sephadex G-75凝胶层析柱后,將1.2.4步骤所得样品上样,用磷酸缓冲液以1 mL·min-1的速度洗脱。测定各管的PPO活性和蛋白质浓度。最后收集目标酶液浓缩备用。
1.3 马铃薯多酚氧化酶酶学特性分析
1.3.1 蛋白质含量测定 采用紫外分光光度法[18]和Bradford法(考马斯亮蓝法)[19-20]测定蛋白质的含量。(1)标准曲线制作:以牛血清蛋白配制标准蛋白溶液,制作标准曲线。(2)蛋白含量测定:按照制作标准曲线的方法测定酶液吸光度值,根据标准曲线上相应蛋白质质量,计算出酶液中蛋白质含量。
1.3.2 PPO酶活力测定 参考曹健康等[20]的方法,略做修改。取150μL 50 mmol·L-1邻苯二酚溶液(于pH6.8磷酸缓冲液中溶解),50μL PPO于不同离心管中,在30℃金属浴上保温5 min,混合均匀后计时至3 min,记录反应体系在420 nm处的吸光度值,每30 s记录1次OD420,制作OD420随时间变化曲线,根据曲线的初始线性部分计算每分钟吸光度变化值△OD420[20]。一个酶活力单位定义为:在测定条件下,反应后每分钟OD420值增加0.001,定义为一个酶活力单位(U)[21]。酶的相对活性定义为:以酶液在最适条件下的酶活力作为100%,其余条件下测得的酶活力与之相比,即为酶的相对活性[21]。酶的比活力定义为:每分钟1 mg蛋白质OD值增加0.001定义为1个比活力单位,通常使用酶活力和蛋白质含量的比值来表示[22]。
1.3.3 PPO反应进程曲线的制作 按1.3.2酶活测定体系,150 μL 50 mmol·L-1邻苯二酚溶液(于pH6.8磷酸缓冲液中溶解)于30℃预热5 min,取50 μL酶液加入混合均匀后,每隔1 min测1次酶活性,以酶活力(U)表示。
1.3.4 PPO最适温度的测定 取50 μL酶液,将反应温度分别设置为20℃、30℃、40℃、50℃、60℃、70℃、80℃,按1.3.2的方法测定酶活性,以酶液最适条件下的酶活力作为100%,其余温度条件下测得酶活力与之相比的相对酶活性表示[23]。
1.3.5 PPO最适pH的测定 酶反应缓冲液pH值分别设置为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,其中0.1 mol·L-1柠檬酸-柠檬酸钠缓冲液用于pH 3.0、3.5、4.0、4.5、5.0的配制,0.1 mol·L-1磷酸盐缓冲液用于pH 6.0、6.5、7.0、7.5、8.0的配制。取50μL酶液,按1.3.2的方法测定酶活性,以酶液最适条件下的酶活力作为100%,其余pH条件下测得酶活力与之相比的相对酶活性表示[23]。
1.3.6 PPO最适底物浓度的测定 设置底物邻苯二酚浓度分别为10、20、30、40、50、60、70、80、90、100 mmol·L-1,取50 μL酶液,按1.3.2的方法测定PPO酶活性,以酶液最适条件下的酶活力作为100%,其余底物浓度测得酶活力与之相比的相对酶活性表示[23]。
1.3.7 PPO底物特异性试验 分别对N-BOC-酪胺、绿原酸、邻苯二酚、4-甲基儿茶酚(4-MC)、间苯二酚、焦性没食子酸、对苯二酚、咖啡酸、没食子酸、愈创木酚进行底物特异性试验。配制1 mL 50 mmol·L-1上述底物溶液,另取酶液1 mL,分别加入5 g新鲜马铃薯丝中拌匀,记录4 h后马铃薯丝颜色变化情况。
2 结果与分析
2.1 马铃薯PPO分离纯化结果
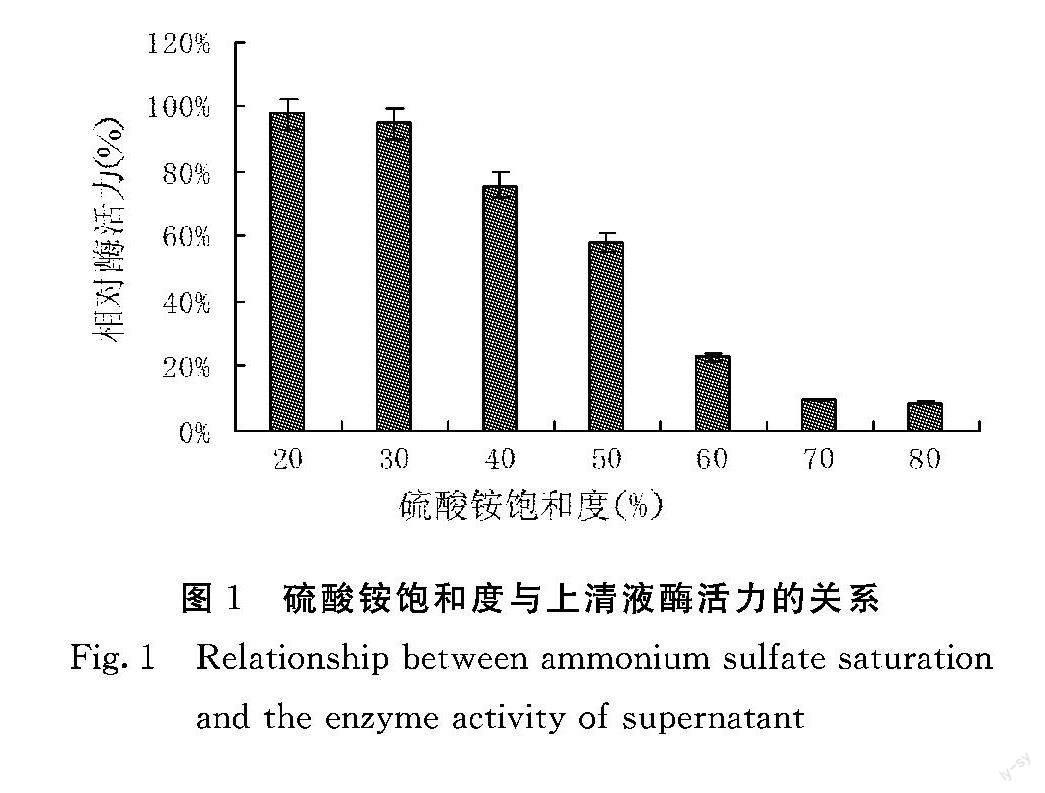
由图1可知,当粗酶液中加入20%饱和度浓度的硫酸铵时,上清液中PPO活性达到最高,此时沉淀物中主要为杂蛋白;继续往上清液中加入硫酸铵,离心后测得上清液中PPO活性逐渐降低;当上清液中加入硫酸铵浓度达到70%~80%饱和度时,离心后测得上清液中PPO活性最低,几乎不含酶蛋白。本试验选择粗酶液中加入20%饱和度的硫酸铵沉淀后,取上清液继续加入硫酸铵使饱和度达到70%,此时PPO主要存在于沉淀物中。该沉淀物以乙酸钠缓冲液(50 mmol·L-1,PH 5.5)溶解,用于后续的试验。
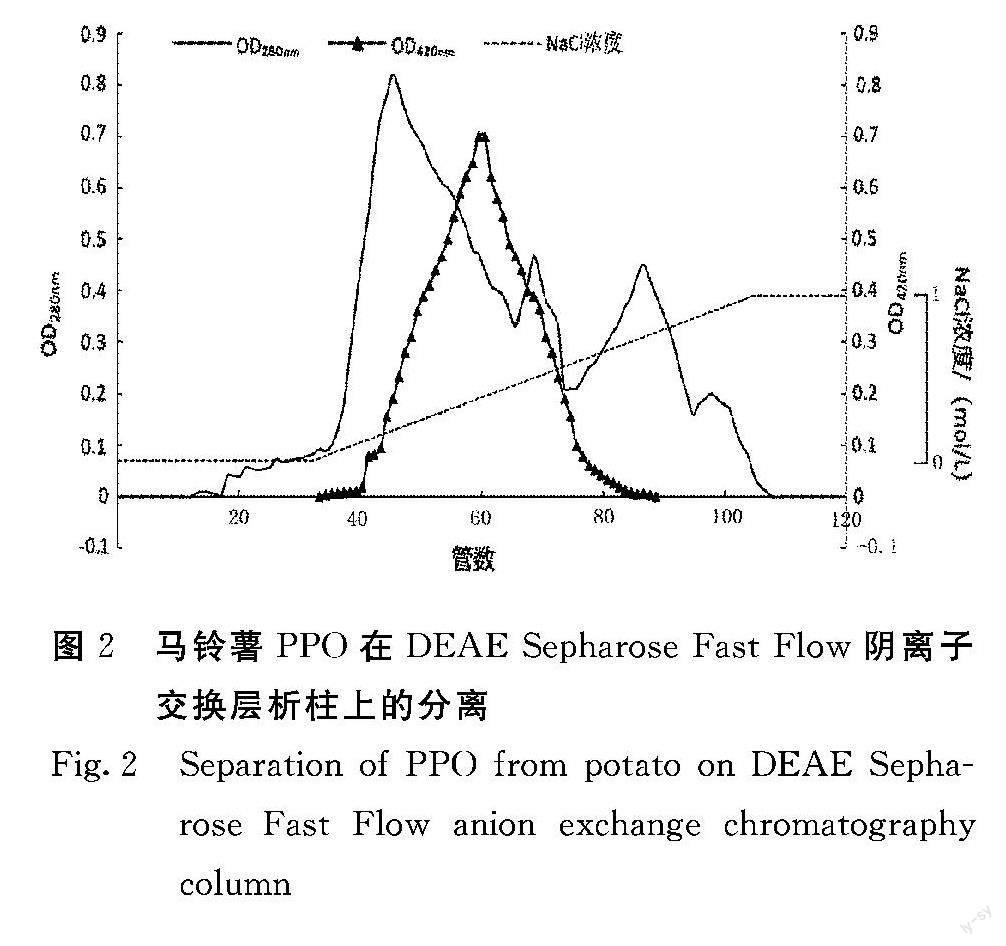
粗酶液经20%~70%的硫酸铵分级沉淀后,去除了一部分的杂蛋白,酶活力虽有一定的降低,但酶比活力则比粗酶液提高1倍。经硫酸铵沉淀后的粗酶液中含有较高浓度的硫酸铵,将影响后续的纯化,本试验采用Sephadex G-25凝胶柱进行脱盐处理。经脱盐处理后的PPO采用DEAE Sepharose Fast Flow 阴离子交换柱层析进行进一步纯化,纯化结果见图示。用含浓度梯度为0~1 mol·L-1 Nacl的磷酸盐缓冲溶液洗脱后,结果可见1个大的蛋白质洗脱峰,和3个小的蛋白质洗脱峰,酶活性峰位于第1个蛋白质峰和第2个蛋白质峰之间,第1个蛋白质峰的酶活性很低,说明此时洗脱去除了大部分杂蛋白。酶活性峰对应的洗脱液中NaCl浓度约为0.4 mol·L-1,酶比活力从粗酶液的15.2提高到102.3。将活性最高的目标酶液合并浓缩,进行Sephadex G-75分子筛凝胶过滤层析柱纯化。
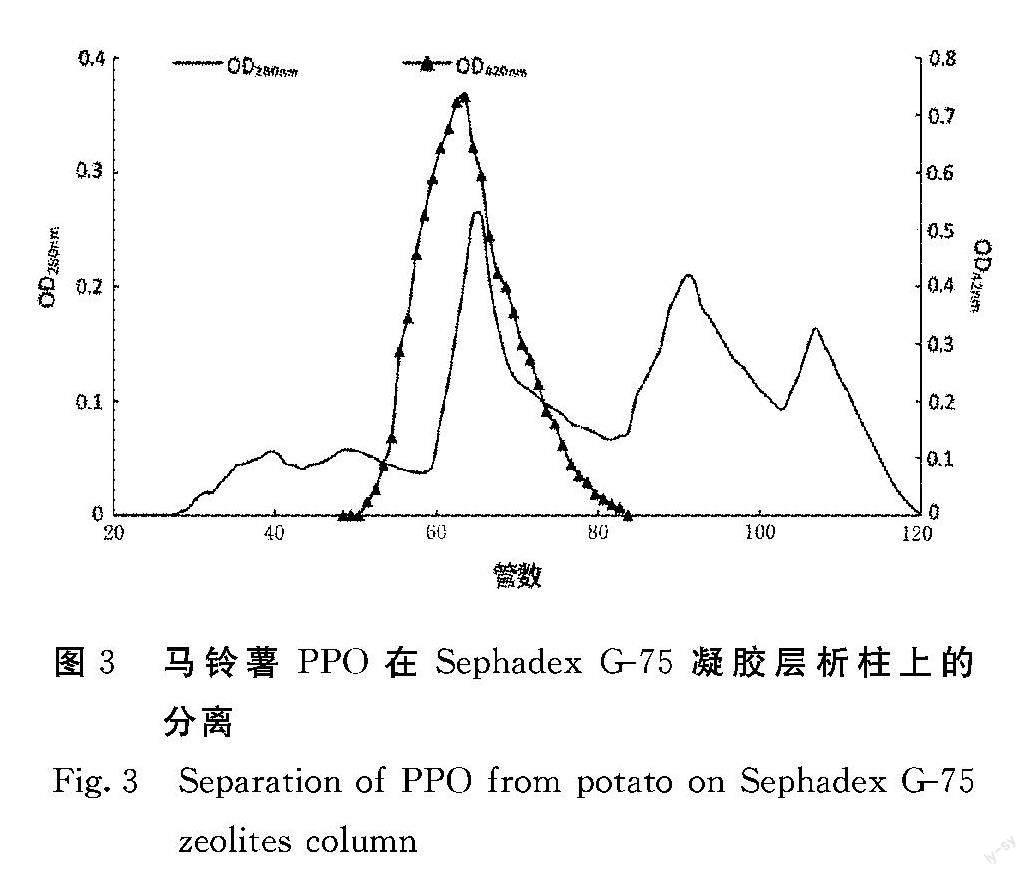
由图3可见,经Sephadex G-75分子筛凝胶过滤层析洗脱后出现3个蛋白质吸收峰,第1个蛋白质吸收峰与酶活性峰接近重叠。将酶活性最高的目标酶液合并,测得其蛋白质含量为1.0 mg,酶活力为283.0 U,酶比活力为283.0 U·mg-1。整个纯化过程完成之后,PPO纯化倍数达到18.6,其蛋白质含量和酶活力呈现下降趋势,酶活力在纯化过程有相应的损耗,但经过纯化之后目标蛋白浓度升高,说明整个纯化步骤,特别是使用DEAE Sepharose Fast Flow 陰离子交换柱层析、Sephadex G-75分子筛凝胶过滤层析的方法是纯化PPO的有效方法。
由表1可知,马铃薯粗酶液经过硫酸铵分级盐析、阴离子交换柱层析和G-75凝胶柱层析等步骤进行分离纯化后,蛋白质含量大大降低,酶活力明显下降,但酶比活力显著升高,说明实验过程中目标蛋白得以纯化。
2.2 马铃薯PPO部分酶学特性
2.2.1 马铃薯PPO的反应进程曲线 由图4可知,以邻苯二酚为底物时,PPO活力随时间呈对数上涨,在3 min左右,曲率最大,达到最大反应速度,之后趋势慢慢减小直至逐渐变平和。
图4 马铃薯PPO的反应进程曲线
Fig.4 Reaction process curve of potato polyphenol oxidase
2.2.2 马铃薯PPO的最适反应温度 随着温度升高,酶促反应速率加快,使酶活性提高;另一方面,过高的温度也会使酶蛋白变性,破坏酶活性部位三维结构的完整性和稳定性,促使酶活力下降[24-25]。温度对马铃薯PPO活性的影响如图5所示。马铃薯PPO酶活性在20~30℃时,随温度升高逐渐增强,30℃时活性最高;30~60℃时,酶活性随温度升高快速下降,表明在此温度阶段抑制马铃薯PPO的活性最为有效;80℃时酶活性趋近于0。以邻苯二酚为底物时,马铃薯PPO在20~35℃期间有较高活性。最适反应温度为30℃,与人参果相同[9],但高于鸭梨果肉(25℃)[26],低于桑叶(40℃)[27]。
图5 温度对马铃薯PPO活性的影响
Fig.5 Effect of temperature on the activity of potato polyphenol oxidase
2.2.3 马铃薯PPO的最适反应pH值 pH值是影响酶活性的重要因素,pH值通过影响酶构象的改变而产生对酶活性的影响[28],pH值偏高或者偏低会造成酶结构中Cu2+的解離及蛋白质变性。由图6可知,马铃薯PPO在pH 3.0~6.0时,酶活性随着pH值的上升逐渐增强,在pH 6.0~6.5时酶活性达到高峰,在pH 6.5时酶活性最高;在pH 6.5~7.0时酶活性随着pH值的上升受到强烈抑制,从100%迅速降低到15%,表明pH值在6.5~7.0阶段抑制马铃薯PPO的活性最为有效;pH 7.0之后酶活性变化不大。由此可知,以邻苯二酚为底物时,马铃薯PPO在pH 6.0~6.5之间活性最高,马铃薯PPO最适反应pH为6.5,这与香菜叶[29]和甘薯叶[30]相同,高于洋蓟头(pH 6.0)[31],稍低于蒲菜(pH 6.8)[32] 。最适pH值的研究为马铃薯贮藏及加工条件的进一步优化提供理论依据。
2.2.4 马铃薯PPO最适底物浓度 底物浓度对酶活性的影响见图7。可以看到底物浓度在10~50mmol·L-1范围内,马铃薯PPO活性随底物浓度的上升逐渐升高,底物浓度达到50 mmol·L-1时酶活性最大;当底物浓度继续升高时,酶活性不变。由此可知,以邻苯二酚为底物时,马铃薯PPO的最适底物浓度为50 mmol·L-1。
2.2.5 马铃薯PPO的底物特异性 由图8可知,与对照组(无处理)相比,N-BOC-酪胺、绿原酸、邻苯二酚、4-甲基儿茶酚、间苯二酚、焦性没食子酸、对苯二酚、咖啡酸、没食子酸、愈创木酚与马铃薯丝混合,于25℃下4 h后颜色均发生不同程度的变化,说明上述10种底物均可与马铃薯PPO发生酶促反应。
由图9可知,马铃薯PPO对间苯二酚、焦性没食子酸的底物亲和性较强,相对酶活分别为100%和90%,对4-甲基儿茶酚、咖啡酸、没食子酸、对苯二酚、邻苯二酚、绿原酸的底物亲和性较低,相对酶活均为20%以下,对N-BOC-酪胺、愈创木酚则无亲和性。这表明马铃薯PPO主要的反应底物为二酚类的间苯二酚和三酚类的焦性没食子酸。
3 结论与讨论
酶的分离纯化研究是进一步进行酶学性质研究、开发相应的抑制剂及酶学应用研究的基础。该试验研究分离纯化得到马铃薯PPO,酶比活力为 283.0 U·mg-1,酶回收率为16.8%,纯化倍数为18.6。这一研究结果与李洁媛等[13]通过透析和阴离子交换层析分离纯化得到的结果相比,比活力明显更高,回收率则较低,纯化倍数略高一些;由此分析纯化方法及条件的不同会影响目标蛋白纯化倍数、回收率。分析回收率偏低的原因可能是由于纯化操作过程的损耗,该纯化条件有待于进一步优化。
酶学特性研究显示,马铃薯PPO在以邻苯二酚为底物时,最佳底物浓度为50 mmol·L-1,在3 min时反应速率最大,10 min左右逐渐趋于平缓。马铃薯PPO在20~35℃活性相对稳定,35~60℃活性呈迅速下降的趋势,最适反应温度为30℃;在pH 6.0~6.5活性为最佳,最适pH值为6.5 。该试验结果与李俊等以Favorita马铃薯为材料,用磷酸盐缓冲液提取获得的PPO酶学性质相同[12]。与Rasmussen等以磷酸盐、乙酸盐混合体系提取,经Hi-trap亲和层析柱纯化后的马铃薯PPO最佳反应温度为40℃,最适反应pH为5.0的结果不一致[11];与李洁媛等[13]的研究结果(最适pH为6.0)、孟雅等[33]的研究结果(最适pH为7.0)也有差异,可能是由于品种不同,纯化方法也有差异。马铃薯PPO与间苯二酚、焦性没食子酸有最强的底物亲和性,其次是4-甲基儿茶酚、咖啡酸、没食子酸、对苯二酚、邻苯二酚、绿原酸,对N-BOC-酪胺、愈创木酚亲和性极低。马铃薯中存在一定量的酚类物质,绿原酸是其中最主要的酚类物质[34],但试验结果显示绿原酸与马铃薯PPO的亲和性并不高。由马铃薯PPO的底物特异性研究可知酚类物质的种类、数量、分布都会影响与马铃薯PPO的反应活性,从而造成不同品种马铃薯褐变情况的差异。上述研究结果表明,可通过调节pH值、低温贮藏并结合低温贮藏前进行短时间的热处理、根据底物特异性差异开发褐变抑制剂等方法来使马铃薯多酚氧化酶在贮藏、加工过程保持较低的酶活性,从而控制马铃薯的褐变。
参考文献:
[1]王璋.食品酶学[M].北京:轻工业出版社,1990:254-274.
[2]林敏,邱凌,周盛梅,等.4-卤代苯甲酸对马铃薯多酚氧化酶的抑制效应[J].食品科学,2008,29(5):56-59.
[3]SHI Y,CHEN Q X,WAN G Q,et al.Inhibitory effects of cinnamic acid and its derivatives on the diphenolase activity of mushroom(Agaricus bisporus)tyrosinase[J].Food Chemistry,2005,92(3):707-712.
[4]CIOU J Y,LIN H H,CHI P Y,et al.The role of polyphenol oxidase and peroxidase in the browning of water caltrop pericarp during heat treatment[J].Food Chemistry,2011,127(2):523-527.
[5]LUO Z S,WANG Y S,JIANG L,et al.Effect of nano-CaCO3-LDPE packaging on quality and browning of fresh-cut yam[J].Journal of Food Science and Technology,2015,60(2):1155-1161.
[6]吴海霞,曹雨舟.丝瓜多酚氧化酶的分离纯化及酶学性质[J].食品科学,2014,35(7):187-191.
[7]ALTUNKAYA A,GKMEN V.Partial purification and characterization of polyphenoloxidase from durum wheat(Triticum durum L.)[J].Journal of Cereal Science,2012,55(3):300-304.
[8]CHEEMA S,SOMMERHALTER M.Characterization of polyphenol oxidase activity in ataulfo mango[J].Food Chemistry,2015,171:382-387.
[9]祁立波,褚津,郑皎皎,等.人参果多酚氧化酶的酶学特性及纯化[J].大连工业大学学报,2013,32(6):391-394.
[10]TENG J,GONG Z H,DENG Y L,et al.Purification, characterization and enzymatic synthesis of theaflavins of polyphenol oxidase isozymes from tea leaf(Camellia sinensis)[J].Journal of Food Science and Technology,2017,84:263-270.
[11]RASMUSSEN C B,ENGHILD J J,SCAVENIUS C.Identification of polyphenol oxidases in potato tuber(Solanum tuberosum)and purification and characterization of the major polyphenol oxidases[J].Food Chemistry,2021,365:130454.
[12]李俊,卢扬,刘永翔,等.不同品种马铃薯多酚氧化酶酶学特性对比[J].食品科技,2020,45(6):218-223.
[13]李洁媛,李东,童凯,等.马铃薯多酚氧化酶的分离纯化、酶学性质及酶促合成茶黄素性能研究[J].食品与发酵工业,2021,47(11):26-31.
[14]陳明俊,舒启琼,徐建飞,等.抗褐变马铃薯品种(系)鉴定与筛选[J].作物学报,2020,46(8):1208-1216.
[15]EICKEN C,ZIPPEL F,BULDT-KARENTZOPOULOS K & KREBS B.Biochemical and spectroscopic characterization of catechol oxidase from sweet potatoes(Ipomoea batatas)containing a type-3 dicopper center[J].FEBS Lett,1998,436:293-299.
[16]MARRI C,FRAZZOLI A,HOCHKOEPPLER A,et al.Purification of a polyphenol oxidase isoform from potato(Solanum tuberosum)tubers[J].Phytochemistry,2003,63:745-752.
[17]滕杰.茶叶多酚氧化酶同工酶分离鉴定及其酶促合成茶黄素研究[D].长沙:湖南农业大学,2015.
[18]余瑞元.生物化学试验原理和方法[M].北京:北京大学出版社,1994.
[19]李玉花.蛋白质分析实验技术指南[M].北京:高等教育出版社,2011.
[20]曹健康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2017.
[21]杨广,江凯,曹少谦,等.蓝莓多酚氧化酶的部分纯化及其酶学特性研究[J].食品安全质量检测学报,2021,12(13):5403-5408.
[22] BURGESS R R,DEUTCHER M P.蛋白质纯化指南[M].北京:科学出版社,2013.
[23]赵芯,成丽丽,邓玉,等.巨大芽孢杆菌产胞外核糖核酸酶的分离纯化及部分酶学性质研究[J].食品科学,2012,33(19):254-258.
[24]张宽朝,全明吉.黑豆多酚氧化酶的分离纯化及其酶学特性研究[J].中国饲料,2012(19):38-41.
[25]MDLULI K M.Partial purification and characterisation of polyphenol oxidase and peroxidase from marula fruit(Sclerocarya birrea subsp.Caffra)[J].Food Chemistry,2005,92(2):311-323.
[26]李桂琴,刘坤,高志华,等.鸭梨果肉多酚氧化酶的活性研究与纯化[J].河北农业大学学报,2010,33(5):45-49.
[27]黄涛,杨洋,聂静然,等.桑叶多酚氧化酶分离及活性研究[J].食品科学,2008,29(12):473-476.
[28]李君兰,李怡华,赵秋玲,等.鸡腿蘑多酚氧化酶特性研究[J].食品科学,2007,28(1):187-191.
[29]孫才云,方玲,唐云明.香菜叶多酚氧化酶的分离纯化与部分酶学性质研究[J].食品科学,2015,36(7):105-110.
[30]梁建荣,黄洁,苏茉,等.甘薯叶多酚氧化酶的分离纯化和部分性质研究[J].西南大学学报:自然科学版,2011,33(2):76-81.
[31]AYDEMIR T.Partial purification and characterization of polyphenol oxidase from artichoke(Cynara scolymus L.)heads[J].Food Chemistry,2004,87(1):59-67.
[32]孔庆新,祝冬青.蒲菜多酚氧化酶的酶学性质研究[J].安徽农业科学,2011,39(20):12027-12028,12033.
[33]孟雅,李刚,崔焱,等.马铃薯多酚氧化酶的提取纯化条件对其活性影响的研究[J].化学与生物工程,2006,23(10):47-49.
[34]宋吉轩,陈超,雷尊国,等.马铃薯加工过程中褐变机理及其抑制效果研究[J].安徽农业科学,2010,38(1):329-331.
(责任编辑:林玲娜)
