伏立康唑与利福平药物相互作用的临床回顾性研究
2023-03-14陈婷婷林志强吴水发张清泉
陈婷婷?林志强 吴水发?张清泉
摘要:目的 回顧性研究利福平对伏立康唑谷浓度的影响和影响持续的时间,以及两者相互作用的影响因素。方法 收集2018年5月—2022年12月我院收治的均使用过伏立康唑和利福平且进行伏立康唑TDM的病例,汇总患者的一般资料、利福平给药方案、伏立康唑给药方案、其他合并用药及伏立康唑TDM结果。结果 共纳入32例患者,15例同期联用利福平,17例未同期联用利福平。联用利福平组伏立康唑平均谷浓度为(1.58±3.01) mg/L,66.7%(10例)患者低于目标范围下限,达标率为26.7%;未联用利福平组伏立康唑平均谷浓度为(3.67±2.44) mg/L,0例患者谷浓度低于下限,达标率为82.4%,两组谷浓度分布存在显著统计学差异(P<0.01)。联用组中,谷浓度低于目标范围的10例患者,首次TDM时机均为停用利福平7 d内,其中6例患者停用利福平后多次复查谷浓度,3例在停药7 d后谷浓度上升至目标范围下限;联用组内首次TDM谷浓度>1.0 mg/L的5例患者中,3例为危重症患者,SOFA评分均大于10分,其中1例同时联用大剂量PPI;1例在利福平停药第7 d实施伏立康唑TDM;1例在联用利福平前谷浓度超标。结论 伏立康唑与利福平联用时,谷浓度显著降低,利福平停药7 d以上,谷浓度可能恢复至目标范围内;利福平对伏立康唑的代谢诱导作用可能受患者病情严重程度的影响。
关键词:伏立康唑;利福平;治疗药物监测;药物相互作用;回顾性研究
中图分类号:R978.1文献标志码:A
Retrospective study on the interaction between voriconazole
and rifampin in clinical patients
Chen Tingting, Lin Zhiqiang, Wu Shuifa, and Zhang Qingquan
(Department of Pharmacy, Quanzhou First Hospital, Quanzhou 362000)
Abstract Objective To retrospectively study the induction and duration of rifampin on voriconazole trough concentration and the interfering factors of the interaction between rifampin and voriconazole. Methods The data of patients in our hospital who had been treated with voriconazole and rifampin and also underwent voriconazole TDM from May 2018 to December 2022 was collected. The basic information, rifampin regimen, voriconazole regimen, other co-medications and voriconazole TDM results were analyzed. Results A total of 32 patients were collected; 15 patients had concomitant use of voriconazole with rifampin in the same period, while 17 patients did not. The mean trough concentration of voriconazole was (1.58±3.01) mg/L in the combined group, with 66.7% (10/15) of patients below the target range and 26.7% (4/15) of patients in the target range. The mean trough concentration was (3.67±2.44) mg/L in the uncombined group, with 82.4%(14/17) of patients achieving the target concentration and no patient below the target range. The distribution of voriconazole trough concentration between the two groups was significantly different (P<0.01). In the combined group, the initial TDM of 10 patients who were below the target range were all sampled within 7 days after discontinuing rifampin; 6 patients repeated voriconazole TDM several times, while 3 patients achieved the therapeutic concentration after discontinuing rifampin for more than 7 days. There were 5 patients with voriconazole trough concentrations beyond 1.0 mg/L in the combined group, including 3 critically ill patients with a SOFA score greater than 10 and one patient who had coadministration with a heavy dose of PPI at the same time; one patient underwent TDM after discontinuing rifampin for 7 days; and one patient who had voriconazole trough concentrations over the target range twice before coadministration with rifampin. Conclusion The trough concentration of voriconazole will be significantly reduced when coadministration with rifampin, but may increase into the target range after discontinuing rifampin for more than 7 days. The induction of rifampin in voriconazole's metabolism may affected by the SOFA score of patients.
Key words Voriconazole; Rifampin; Therapeutic drug monitoring; Drug-drug interaction; Retrospective study
伏立康唑在体内主要经肝脏代谢,它既是CYP2C19、CYP2C9、CYP3A4的底物,又是其抑制剂,临床应用中易与其他CYP酶底物、抑制剂或诱导剂发生药物相互作用。利福平是CYP酶的强诱导剂,伏立康唑说明书明确指出两者应禁止联用。然而,目前关于伏立康唑与利福平相互作用的临床研究罕见有报道,尤其是利福平对伏立康唑诱导作用的持续时长,这关系到停用利福平后伏立康唑的再次启用时机。伏立康唑治疗药物监测(therapeutic drug monitoring, TDM)是实施个体化治疗监护的重要手段[1-2],本文通过回顾性研究伏立康唑TDM,探索利福平对伏立康唑谷浓度的影响和其代谢诱导作用的持续时间,以及两者相互作用的影响因素,为两者相互作用的研究提供更多的临床数据。
1 材料与方法
1.1 病例资料
检索2018年5月—2022年12月我院收治的均使用过伏立康唑和利福平的病例。排除标准:①未实施伏立康唑TDM的病例;②年龄<18周岁的病例;③资料不完整的病例。汇总患者的一般资料、利福平给药方案、伏立康唑给药方案、其他合并用药及伏立康唑TDM结果。
1.2 伏立康唑TDM
本回顾性研究中伏立康唑谷浓度采用HLPC法测定,参考国内外指南[3-6],设定伏立康唑谷浓度目标范围为1.0~5.5 mg/L。
1.3 伏立康唑合并用药评价
参考《中国伏立康唑个体化用药指南》[7]中药物相互作用部分所列出的药品目录,包括:①不推荐与伏立康唑同时使用的药品,②联用时需增加伏立康唑剂量的药品,③联用时需密切监测伏立康唑安全性与有效性的药品,将伏立康唑用药前3 d及用药期间合并使用的目录内药品,纳入本研究中的合并用药。
1.4 数据分析
本研究的数据使用SPSS 25.0软件进行统计分析。正态分布连续变量的比较采用T-test,非正态分布连续变量的比较采用Wilcoxon秩和检验,分类变量的比较采用Fisher确切概率法,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
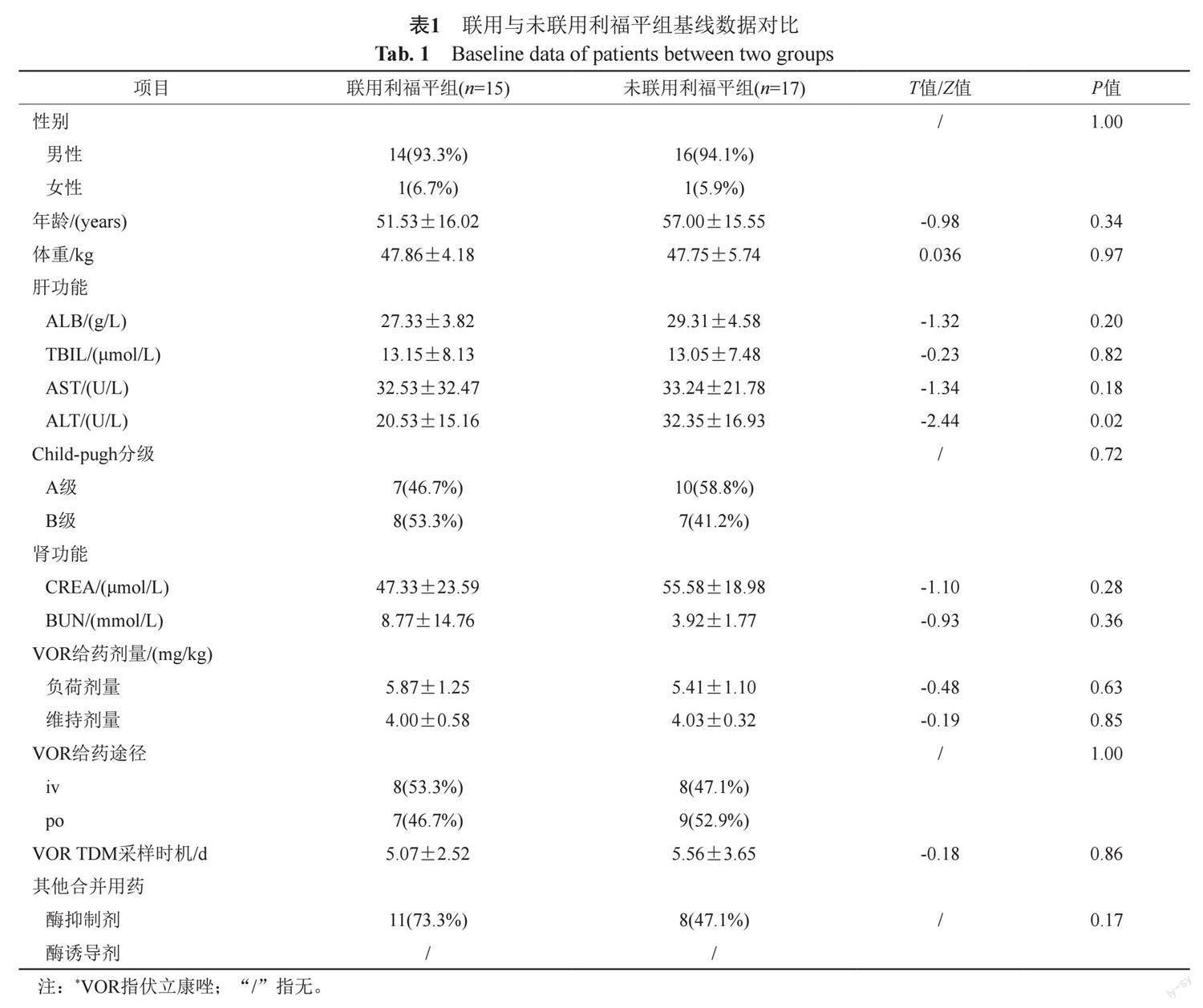
2018年5月—2022年12月我院均使用过伏立康唑及利福平并实施伏立康唑TDM的病例共32例。患者科室分布:呼吸与危重症科21例、重症医学科4例、感染病科4例、血液内科1例、骨科1例、消化内科1例;利福平用药目的:肺结核20例、结核性腹膜炎1例、非结核分枝杆菌感染4例、经验治疗7例;伏立康唑用药目的:曲霉菌病17例、念珠菌病2例、马尔尼菲篮状菌病2例、经验治疗11例。其中,伏立康唑与利福平同期联用的病例15例,伏立康唑与利福平未同期联用的病例17例,两组在性别、年龄、体重、肝肾功能、伏立康唑用法用量、伏立康唑TDM时机及合并用药等方面均无统计学差异,患者的基线数据对比如表1所示。
2.2 联用与未联用利福平组伏立康唑首次TDM结果
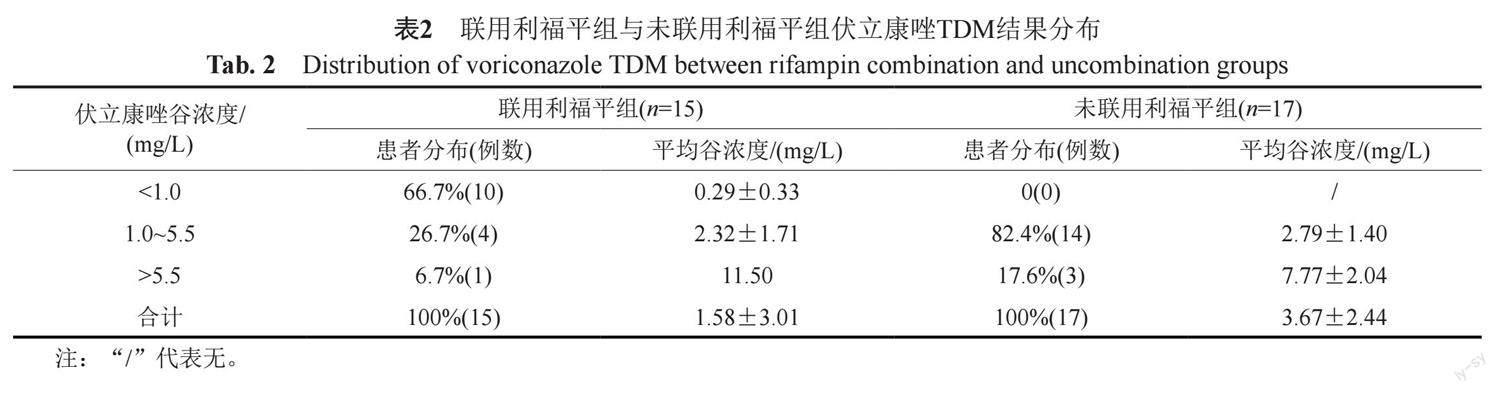
联用组中15例患者,伏立康唑与利福平平均联用天数为3.5(0~10) d,TDM前平均联用天数为3.3(0~10) d;未联用组中17例患者,10例患者多次办理出入院并在非同次住院期间分别使用伏立康唑与利福平,7例患者在同次住院期间使用伏立康唑与利福平,其中4例患者在联用利福平前实施伏立康唑TDM,另外3例患者两药间距时间分别为4、7和12 d。联用组与未联用组伏立康唑平均谷浓度分别为(1.58±3.01)和(3.67±2.44) mg/L,两者存在统计学差异(Z=-3.31, P<0.01);联用组与未联用组谷浓度达标率分别为26.7% (4/15)和82.4% (14/17),两者存在显著差异(Z=-3.57, P<0.01);聯用组中66.7%(10/15)病例谷浓度低于目标范围下限,未联用组0例低于下限。 联用组与未联用组伏立康唑TDM结果见表2。
2.3 伏立康唑谷浓度与利福平停药天数
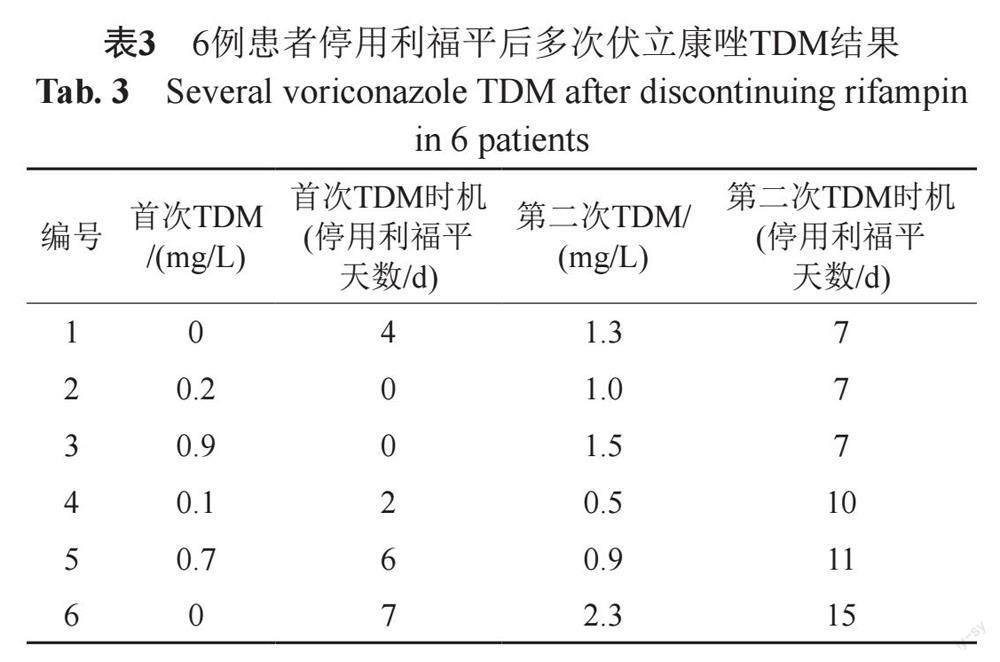
联用组中15例患者,首次TDM谷浓度低于目标范围的10例患者采样时机均为停用利福平7 d内,其中6例患者多次进行伏立康唑TDM:3例患者停用利福平7 d后,第二次复查谷浓度达标;2例患者停用利福平10 d以上,复查谷浓度仍低于目标范围下限;1例患者停用利福平15 d并增加伏立康唑剂量后,谷浓度达标。伏立康唑多次TDM结果详见表3。
2.4 联用组中伏立康唑谷浓度>1.0 mg/L的病例
联用组中,5例患者首次TDM谷浓度>1.0 mg/L:3例为危重症患者,SOFA评分分别为12、16、16,其中1例患者同时联用大剂量PPI;1例患者在停用利福平第7天进行伏立康唑TDM;1例患者在联用利福平前的两次TDM谷浓度分别为9.9和8.9 mg/L,联用利福平后TDM谷浓度为1.7 mg/L。5例患者的具体用药信息见表4。
3 讨论
3.1 利福平对伏立康唑谷浓度的影响
2017年1项Meta分析显示[8],许多酶诱导剂与伏立康唑存在药物相互作用。利福霉素为CYP酶的强诱导剂,可与许多药物发生药物相互作用[9]。利福平及利福布丁可导致伏立康唑AUC、Cmax及平均谷浓度下降[10],伏立康唑说明书明确提出禁止与利福平合用,尽量避免与利福布汀合用。伏立康唑与利福平的相互作用,2007年在1例急性淋巴细胞白血病的患者中报道[11],两者联用致伏立康唑的整体暴露量下降99%。伏立康唑与利福布丁的相互作用,2008年在1例爪蟾分枝杆菌合并烟曲霉肺部感染的患者中报道[12],患者按体重给予伏立康唑后,谷浓度始终未达标,增加伏立康唑剂量后,谷浓度升至0.68 mg/L。本研究中,联用组伏立康唑谷浓度达标率为26.7%,显著低于未联用组82.4%;联用组66.7%患者谷浓度低于下限范围,未联用组则没有病例低于下限。本研究进一步确证了利福平可致伏立康唑谷浓度明显下降。
3.2 利福平对伏立康唑代谢诱导作用的持续时间
利福平对伏立康唑的代谢诱导作用会持续多久,是临床值得关注的问题,关系到停用利福平后再次启用伏立康唑的时机,若时机过早,不但不能达到治疗效果,还会造成药物的浪费。Nassar等[13]的研究表明,利福平的诱导作用在给药22 h后出现,大约28~30 h后达到最大值,然后在1~2 h内急剧下降,几乎到基线水平。有研究表明,利福平停药14 d后残余的诱导作用最小[14-15]。而其他临床研究表明[16-17],利福平停用7 d以上,伏立康唑谷浓度可能达到治疗浓度。西娜等[18]的研究也表明利福霉素对伏立康唑谷浓度的影响需要大约一周时间才会消除。但停用利福平后,伏立康唑谷浓度恢复到基线水平需要14 d甚至更长时间[17]。本研究中,联用组内10例谷浓度偏低的患者,首次TDM均在停用利福平7 d内,3例患者停用利福平7 d后复查谷浓度达标,2例患者停药10 d后复查谷浓度仍未达标,本研究认为停用利福平7 d以内,不建议再次使用伏立康唑,伏立康唑再次启用时机可能需要利福平停药至少7 d以上。
3.3 病情严重程度对伏立康唑谷浓度的影响
重症患者中的各种病理生理变化可导致抗菌药物PK改变,从而使其最佳剂量方案复杂化[19-20]。Blot 等[19]的研究指出,重症患者中主要存在五个因素导致抗菌药物PK改变,包括表观分布容积增大、蛋白结合率改变、肾功能增强或减退及肝功能障碍,进而引起抗菌药物血药浓度下降或升高。Bienvenu等[21]的研究表明,Sofa评分≥10为伏立康唑谷浓度增加的相关因素。本研究中,联用组内3例患者病情危重,Sofa评分均大于10,其中2例患者伏立康唑谷浓度在目标范围内,另1例患者谷浓度为11.7 mg/L,电子病例显示,该患者当天同时做了万古霉素血药浓度监测,结果显示谷浓度>50 mg/L,同样远超出目标范围。本研究表明,患者病情严重程度可能影响伏立康唑谷浓度,进而改变利福平与伏立康唑相互作用的结局。此外,研究表明联用PPIs可增加伏立康唑谷浓度[10,22],以上3例患者均同时联用了PPIs,因此患者病情严重程度对伏立康唑谷浓度的影响需要进一步验证。
3.4 其他因素对伏立康唑谷浓度的影响
伏立康唑临床应用个体差异影响因素很多[23-25],包括基因型、年龄、胃肠吸收、药物相互作用及患者的病理生理状态等。大部分PPIs是CYP2C19抑制剂,与该酶的底物联用时可发生药物相互作用。2003年一项研究表明[26],与奥美拉唑40 mg qd po联用时,伏立康唑平均Cmax和AUCt分别增加15%及41%。而2012年另一项多中心研究表明[22],与任何PPI联用时,伏立康唑谷浓度均显著增加。此外,Cojutti等[10]的研究表明,伏立康唑谷浓度的增加与PPI的类型及剂量有关,伏立康唑与酶抑制剂或者与酶抑制剂及酶诱导剂同时联用时,谷濃度均大大增加,尤其是联用大剂量PPI时。本研究中,1例患者同时联用伏立康唑、利福平及大剂量PPI,谷浓度为4.9 mg/L,联用大剂量PPI可能与血药浓度提高有关,但由于该患者同时是一位危重患者,该多重合并用药对伏立康唑谷浓度的影响仍需进一步确证。
在CYP2C19慢代谢者中,伏立康唑的Cmax和AUC值比正常代谢者高2~5倍[27]。研究显示了CYP2C19基因多态性对伏立康唑初始稳态谷浓度的影响[28]。而CYP2C19基因多态性分布因种族而异,约15%~20%的亚洲人群是慢代谢者,而白种人中慢代谢者仅约2%~3%[29]。本研究中,1例患者联用利福平后谷浓度为1.7 mg/L,而联用利福平前的两次TDM均高于目标范围,分别为9.9及8.9 mg/L,该患者不存在其他合并用药,TDM结果可能与该患者的CYP2C19基因型有关,但患者未实施基因型检测。
4 结论与展望
本回顾性研究显示,伏立康唑与利福平联用时,谷浓度显著降低,利福平停药7 d以上,谷浓度可能恢复至目标范围内,利福平停药至少7 d以上方建议加用伏立康唑;利福平对伏立康唑的代谢诱导作用可能受患者病情严重程度的影响。
然而,本研究存在一定的局限性。首先,样本量较少;其次,该研究为回顾性研究,不能排除患者由用药依从性所致的影响;此外,本次研究中析无患者的CYP2C19基因多态性检测内容,不能排除基因型对患者伏立康唑谷浓度的影响。因此,利福平对伏立康唑代谢诱导作用的持续时间需要更多的数据进行验证,与此同时,患者病情严重程度、联用大剂量PPI及CYP2C19基因型对利福平与伏立康唑相互作用的影响也需要进一步探索。
参 考 文 献
Luong M L, Al-Dabbagh M, Groll A H, et al. Utility of voriconazole therapeutic drug monitoring: A meta-analysis[J]. J Antimicrob Chemother, 2016, 71(7): 1786-1799.
John J, Loo A, Mazur S, et al. Therapeutic drug monitoring of systemic antifungal agents: A pragmatic approach for adult and pediatric patients[J]. Expert Opin Drug Metab Toxicol, 2019, 15(11): 881-895.
Ashbee H R, Barnes R A, Johnson E M, et al. Therapeutic drug monitoring (TDM) of antifungal agents: Guidelines from the british society for medical mycology[J]. J Antimicrob Chemother, 2014, 69(5): 1162-1176.
Chau M M, Kong D C, van Hal S J, et al. Consensus guidelines for optimising antifungal drug delivery and monitoring to avoid toxicity and improve outcomes in patients with haematological malignancy, 2014[J]. Intern Med J, 2014, 44(12b): 1364-1388.
Laverdiere M, Bow E J, Rotstein C, et al. Therapeutic drug monitoring for triazoles: A needs assessment review and recommendations from a Canadian perspective[J]. Can J Infect Dis Med Microbiol, 2014, 25(6): 327-343.
Takesue Y, Hanai Y, Oda K, et al. Clinical practice guideline for the therapeutic drug monitoring of voriconazole in non-asian and asian adult patients: Consensus review by the Japanese society of chemotherapy and the Japanese society of therapeutic drug monitoring[J]. Clin Ther, 2022, 44(12): 1604-1623.
Chen K, Zhang X, Ke X, et al. Individualized medication of voriconazole: A practice guideline of the division of therapeutic drug monitoring, Chinese pharmacological society[J]. Ther Drug Monit, 2018, 40(6): 663-674.
Li T Y, Liu W, Chen K, et al. The influence of combination use of CYP450 inducers on the pharmacokinetics of voriconazole: A systematic review[J]. J Clin Pharm Ther, 2017, 42(2): 135-146.
Baciewicz A M, Chrisman C R, Finch C K, et al. Update on rifampin, rifabutin, and rifapentine drug interactions[J]. Curr Med Res Opin, 2013, 29(1): 1-12.
Cojutti P, Candoni A, Forghieri F, et al. Variability of voriconazole trough levels in haematological patients: Influence of comedications with cytochrome P450(CYP) inhibitors and/or with CYP inhibitors plus CYP inducers[J]. Basic Clin Pharmacol Toxicol, 2016, 118(6): 474-479.
Geist M J, Egerer G, Burhenne J, et al. Induction of voriconazole metabolism by rifampin in a patient with acute myeloid leukemia: Importance of interdisciplinary communication to prevent treatment errors with complex medications[J]. Antimicrob Agents Chemother, 2007, 51(9): 3455-3456.
Schwiesow J N, Iseman M D, Peloquin C A. Concomitant use of voriconazole and rifabutin in a patient with multiple infections[J]. Pharmacotherapy, 2008, 28(8): 1076-1080.
Nassar Y M, Hohmann N, Michelet R, et al. Quantification of the time course of CYP3A inhibition, activation, and induction using a population pharmacokinetic model of microdosed midazolam continuous infusion[J]. Clin Pharmacokinet, 2022, 61(11): 1595-1607.
Burman W J, Gallicano K, Peloquin C. Comparative pharmacokinetics and pharmacodynamics of the rifamycin antibacterials[J]. Clin Pharmacokinet, 2001, 40(5): 327-341.
Gallicano K D, Sahai J, Shukla V K, et al. Induction of zidovudine glucuronidation and amination pathways by rifampicin in HIV-infected patients[J]. Br J Clin Pharmacol, 1999, 48(2): 168-179.
孟現民, 张莉. 伏立康唑药物相互作用与处理对策[J]. 中国新药与临床杂志, 2009, 28(6): 415-420.
林志强, 傅新阳, 陈婷婷, 等. 利福平影响伏立康唑血药浓度2例并文献复习[J]. 中国感染与化疗杂志, 2021, 21(3): 292-296.
西娜, 赵冠人, 陈明, 等. 伏立康唑的治疗药物监测在结核病患者中的应用[J]. 中国抗生素杂志, 2021, 46(5): 481-486.
Blot S I, Pea F, Lipman J. The effect of pathophysiology on pharmacokinetics in the critically ill patient--concepts appraised by the example of antimicrobial agents[J]. Adv Drug Deliv Rev, 2014, 77: 3-11.
Roberts J A, Joynt G M, Choi G Y, et al. How to optimise antimicrobial prescriptions in the Intensive Care Unit: Principles of individualised dosing using pharmacokinetics and pharmacodynamics[J]. Int J Antimicrob Agents, 2012, 39(3): 187-192.
Bienvenu A L, Pradat P, Plesa A, et al. Association between voriconazole exposure and sequential organ failure assessment (SOFA) score in critically ill patients[J]. PLoS One, 2021, 16(11): e0260656.
Dolton M J, Ray J E, Chen S C, et al. Multicenter study of voriconazole pharmacokinetics and therapeutic drug monitoring[J]. Antimicrob Agents Chemother, 2012, 56(9): 4793-4799.
Cheng L, Xiang R, Liu F, et al. Therapeutic drug monitoring and safety of voriconazole in elderly patients[J]. Int Immunopharmacol, 2020, 78: 106078.
Boast A, Curtis N, Cranswick N, et al. Voriconazole dosing and therapeutic drug monitoring in children: Experience from a paediatric tertiary care centre[J]. J Antimicrob Chemother, 2016, 71(7): 2031-2036.
Blanco-Dorado S, Maro?as O, Latorre-Pellicer A, et al. Impact of CYP2C19 genotype and drug interactions on voriconazole plasma concentrations: A spain pharmacogenetic-pharmacokinetic prospective multicenter study[J]. Pharmacotherapy, 2020, 40(1): 17-25.
Wood N, Tan K, Purkins L, et al. Effect of omeprazole on the steady-state pharmacokinetics of voriconazole[J]. Br J Clin Pharmacol, 2003, 56(Suppl 1): 56-61.
Ikeda Y, Umemura K, Kondo K, et al. Pharmacokinetics of voriconazole and cytochrome P450 2C19 genetic status[J]. Clin Pharmacol Ther, 2004, 75(6): 587-588.
Lamoureux F, Duflot T, Woillard J B, et al. Impact of CYP2C19 genetic polymorphisms on voriconazole dosing and exposure in adult patients with invasive fungal infections[J]. Int J Antimicrob Agents, 2016, 47(2): 124-131.
Yin S J, Ni Y B, Wang S M, et al. Differences in genotype and allele frequency distributions of polymorphic drug metabolizing enzymes CYP2C19 and CYP2D6 in mainland Chinese Mongolian, Hui and Han populations[J]. J Clin Pharm Ther, 2012, 37(3): 364-369.
