基于液质联用技术和网络药理学的附子理中汤干预溃疡性结肠炎的活性成分和作用机制研究
2023-03-14冉倩梁鸽张翠涵程泽芳沈长虹程芳姚子晴张若琪
冉倩 梁鸽 张翠涵 程泽芳 沈长虹 程芳 姚子晴 张若琪
摘要:目的 基于高分辨質谱仪、靶向定量代谢组学技术和网络药理学探讨附子理中汤(FZLZD)治疗溃疡性结肠炎(UC)的活性成分及作用机制。方法 首先,通过高分辨液质联用仪对附子理中汤进行定性检测,将其测定的成分进行验证并结合有关文献报道筛选出可能活性化合物;然后利用靶向定量代谢组学技术、结合多元统计分析方法,对筛选出的化合物进行靶向定量;最后运用网络药理学预测附子理中汤治疗溃疡性结肠炎可能的机制。结果 本研究共获得苯甲酰新乌头原碱、苯甲酰乌头原碱、白术内酯Ⅰ、白术内酯Ⅱ、白术内酯Ⅲ、党参炔苷、8-姜酚、10-姜酚、甘草苷、甘草素、甘草酸、6-姜烯酚、苯甲酰次乌头原碱、乌头原碱、6-姜酚、次乌头碱、腺苷、异甘草苷、异甘草素和甘草次酸20个活性成分,各不同来源的附子和甘草的活性成分含量差异较大,附子理中汤治疗溃疡性结肠炎与癌症通路、癌症中的蛋白聚糖、EGFR酪氨酸激酶抑制剂耐药性、AGE-RAGE信号通路,以及IL-6、IL-8等炎症通路有关。结论 虽然各来源都选用合格中药,但质量标志物的含量范围会影响其临床效果;将附子、甘草含量差异较大的活性成分:甘草酸、异甘草素、甘草素、苯甲酰次乌头原碱、甘草苷、甘草次酸作为主要筛选中的Q-marker;此研究有助于对中药不同来源及其主要活性成分含量进行质量控制,对中药-疾病可能的通路靶点进行预测,为后续进一步的药理作用及机制研究提供依据。
关键词:附子理中汤;溃疡性结肠炎;质量控制;网络药理学;Q-marker;靶点;通路
中图分类号:R285文献标志码:A
Study on the active ingredients and mechanism of Fuzi lizhong decoction in the intervention of ulcerative colitis based on UPLC-MS and network pharmacology
Ran Qian1, Liang Ge2, Zhang Cuihan1, Cheng Zefang1, Sheng Changhong1,
Cheng fang, Yao Ziqing1 and Zhang Ruoqi1
(1 College of Pharmacy,Chengdu University of Traditional Chinese Medicine, State Key Laboratory of Southwestern Chinese Medicine Resources, Chengdu 611137; 2 Metabolomics and Proteomics Technology Platform, West China Hospital, Sichuan University, Chengdu 610041)
Abstract Objective High-resolution mass spectrometry, targeted quantitative metabolomics and network pharmacology were used to explore the active ingredients and mechanism of action of Fuzi lizhong decoction (FZLZD) in the treatment of ulcerative colitis (UC). Methods First of all, the qualitative detection of FZLZD was carried out by high-resolution liquid chromatography, the components determined were verified, and the possible active compounds were screened out in combination with relevant literature reports. Thereafter, targeted quantitative metabolomics techniques, combined with multivariate statistical analysis, were used to quantify the targeted compounds. Finally, network pharmacology was applied to predict the possible mechanisms of the treatment of UC with FZLZD. Results A total of 20 active ingredients were obtained in this study,including benzoylmesaconine, benzoylaconitine, atractylenolide Ⅰ, atractylenolide Ⅱ, atractylenolide III, lobetyolin, 8-gingerol, 10-gingerol, liquiritin, liquiritigenin, glycyrrhizic acid, 6-shogaol, benzoylhypacoitine, aconine, 6-gingerol, hypaconitine, adenosine, isoliquiritin, isoliquiritigenin, β-glycyrrhetinic acid. The content of the active ingredients of the various sources of monkshood and liquorice varied considerably. FZLZD for the treatment of collapse and cancer pathway, proteoglycans in cancer, EGFR tyrosine kinase inhibitor resistance and AGE-RAGE signaling pathway, and inflammatory pathways such as IL-6 and IL-8 are related. Conclusion Although qualified herbs are used in all sources, the range of quality markers can affect their clinical effects. The active ingredients with widely varying contents of monkshood and liquorice: glycyrrhizic acid, isoliquiritigenin, liquiritigenin, benzoylhypacoitine, liquiritin, glycyrrhetinic acid were used as Q-markers in the primary screening. This study is useful for quality control of different sources of Chinese medicines and their main active ingredient contents, and for prediction of possible pathway targets of Chinese medicines-diseases, providing a basis for further pharmacological action and mechanism studies to follow.
Key words Fuzi lizhong decoction(FZLZD); Ulcerative colitis(UC); Quality control; Network pharmacology; Q-marker; target; Pathway
附子理中汤出自《三因极—病证方论》卷二,其由附子、人参、干姜、白术以及甘草5味中药,按1:1:1:1:1组成[1],后因党参和人参功效类似,价格更为便宜,现在多以党参入药,该方有补虚回阳,温中散寒之效,据报道其对于胃肠道疾病如溃疡性结肠炎[2]、腹泻[3]和胃溃疡[4]等有较好疗效。其中君药附子具有抗炎镇痛[5]作用,但附子多用会引起毒性反应[6],发挥效用和毒性作用都是由于附子含有多种类型且活性和毒性不同的乌头碱,其中包含活性和毒性都强的双酯型生物碱、毒性较弱而活性较强的单酯型生物碱,以及活性和毒性都较弱的醇胺型生物碱,因此有必要建立一种可测定单、双酯型生物碱的方法,从而控制附子的毒性,并确保临床疗效[7]。
附子理中汤作为经典中药方剂,为了其更好地发挥疗效,药材来源及质量必须得到保证,中药复方有多成分多靶点的特点[8]。中药的活性成分和差异标记物是中药质量控制的常用方法,对于复方来说往往是多种中药的多种成分协同发挥药效,所以不同中药及其不同成分的含量控制及其重要[9]。刘昌孝院士在2016年首次提出中药质量标志物(quality marker, Q-Marker)的概念[10],其由“属性-效应-成分”理论衍生而来的,将中药的活性化合物,治疗疾病的成分、靶点联合,是一种有效体现中药治疗疾病的成分、及其稳定性、特异性的策略[11]。
高分辨质谱具有高分辨率和高特异性运用广泛[12],三重四级杆质谱仪有方便快捷、灵敏度高[13]等特点,先用高分辨质谱仪进行定性,再用三重四级杆质谱仪进行靶向定量,二者结合可以更好地找到发挥药效的活性物质作为Q-Marker。
网络药理学(network pharmacology)从系统生物学和生物网络平衡的角度阐释疾病的发生发展过程、从改善或恢复生物网络平衡的整体观角度认识药物与机体的相互作用,以研究方药、疾病之间的关联,其核心是“网络靶标”,交叉多学科、利用多角度,探索药物与治疗对象之间的分子关联,从而揭示药物的系统性药理机制[14-15]。
本文通过高分辨质谱仪对附子理中汤的冻干粉进行定性,将检测到的化合物结合文献报道的活性成分进行定量,再结合网络药理学研究,对附子理中汤治疗溃疡性结肠炎的活性成分进行预测,以期为附子理中汤系统性地质量评价,为附子理中汤治疗溃疡性结肠炎的后续研究提供依据。
1 材料
1.1 药物
1.1.1 原料药
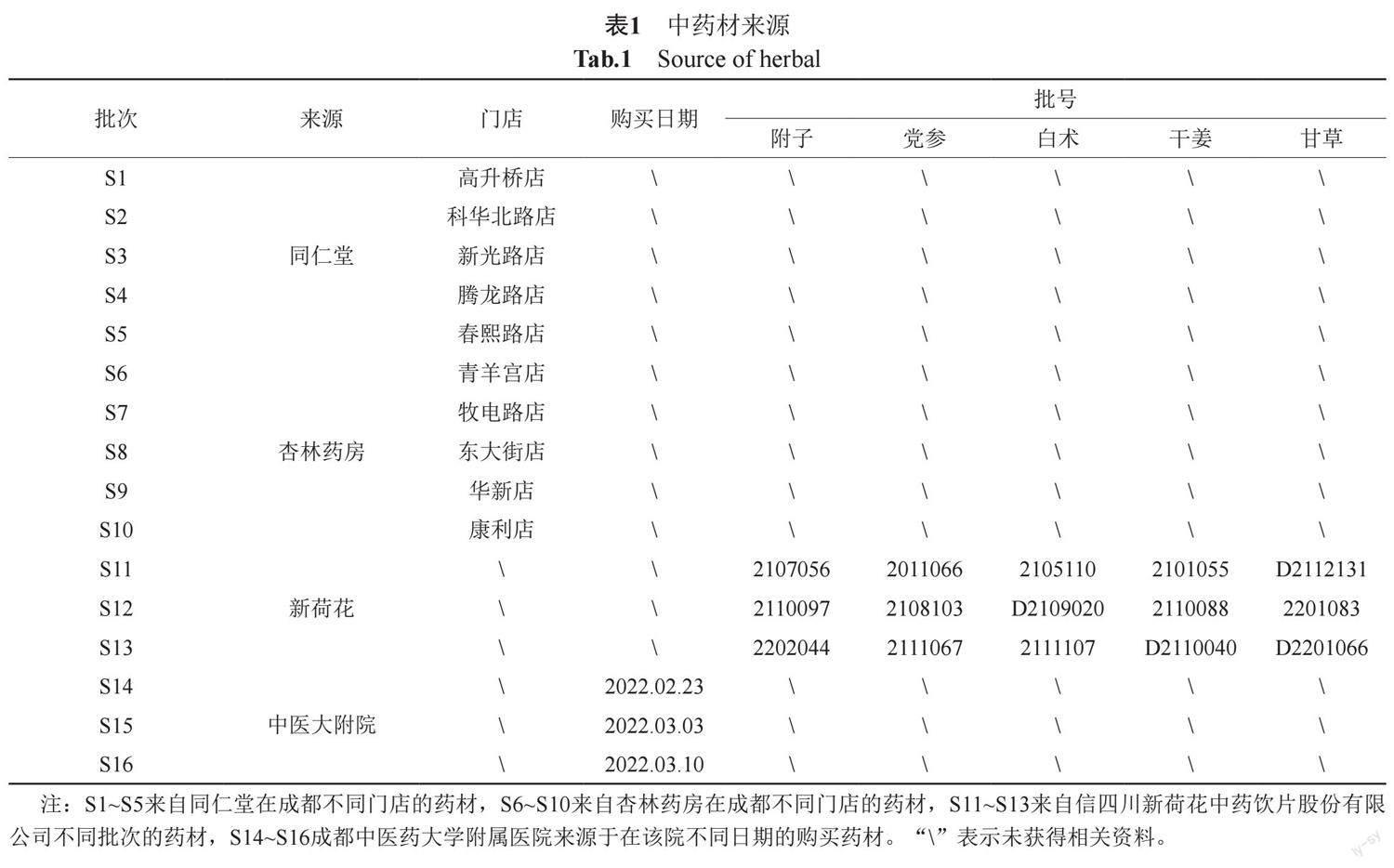
附子理中汤由白附片(9 g)、党参(9 g)、麸炒白术(9 g)、干姜(9 g)、炙甘草(9 g)组成。这5种药材的植物来源分别为附子、党参、白术、干姜、甘草。16批药用植物材料购北京同仁堂(本文缩写为TRT,后文同)、杏林药房(XLYF)、四川新荷花中药饮片股份有限公司(XHH)和成都中医药大学附属医院(ZYD)。中药材来源的详细信息列于下表1。
1.1.2 试剂
苯甲酰新乌头原碱(批号MUST-22031710)、苯甲酰乌头原碱(批号MUST-22042014)、白术内酯Ⅰ(批号MUST-21051010)、白术内酯Ⅱ(批号MUST-21111614)、白术内酯Ⅲ(批号MUST-21110617)、党参炔苷(批号MUST-22061005)、8-姜酚(批号MUST-21032804)、10-姜酚(批号MUST-21063004)、甘草苷(批号MUST-22042114)、甘草素(批号MUST-22041602)、甘草酸(批号MUST-21120305)、6-姜烯酚(批号MUST-21060810)、苯甲酰次乌头原碱(批号MUST-22030911)、乌头原碱(批号MUST-21060306)、6-姜酚(批号MUST-22011411)、次乌头碱(批号MUST-22032212)、腺苷(批号MUST-21070613)、异甘草苷(批号MUST-21051501)、异甘草素(批号MUST-21081312)和甘草次酸(批号MUST-22031710),均购自成都曼思特生物科技有限公司,以上所有对照品的纯度均大于98%。甲醇、乙腈为色谱纯,均购自美国Fisher公司。水为超纯水。
1.1.3 仪器
Exion LC-X500R高效液相色谱质谱联用系统(美国AB Sciex公司);UPLC - QTRAP 6500+(美国AB Sciex公司);电子天平(Sartorius,SQP)。
1.2 汤剂提取及冻干粉制备
取附子(白附片)9 g、党参9 g、白术(麸炒白术)9 g、干姜9 g、甘草(炙甘草)9 g剪碎(小颗粒状),全部药物先用洁净水浸泡30 min,附子先煎1 h。第1次煎煮加入1:8的洁净水,武火煮沸,文火煮30 min,过滤滤液;第2次煎煮加入1:5的洁净水武火煮沸,文火煮20 min,过滤滤液;第3次煎煮加入1:3的洁净水武火煮沸,文火煮15 min,过滤滤液,合并3次滤液。在减压浓缩(温度40 ℃,压力-0.09 MPa)至浓度约
1 g/mL的浓缩液,然后将浓缩液先放置于冰箱冷冻,再放入冻干机制得附子理中汤冻干粉[1 g附子理中汤冻干粉相当于2~4 g(2.75~3.93 g)生药量]。
2 方法与结果
2.1 AB SCIEX QTOF系统测定附子理中汤的成分
2.1.1 色譜及质谱条件
液相条件:SCIEX Exion LC,色谱柱Waters Acquity UPLC HSS T3(100 mm × 2.1 mm,1.8 ?m);流动相:A相为水相(含 2 mmol/L甲酸胺和 0.1%甲酸水),B相为乙腈,梯度洗脱程序见表2,体积流量0.3 mL/min;进样体积:1 μL。
质谱条件:SCIEX Triple TOF System X500;MS mode (pos/neg):00~1000 m/z;MS/MS mode-10 MS/MS,each 50~1000 m/z;数据采集 (IDA+DBS pos & neg):在SCIEX QTOF 100HZ 的扫描速度下,信息依赖采集方式(IDA)结合独有的动态背景扣除(DBS)。鉴定:SCIEX OS软件&天然产物数据库。
2.1.2 样品的制备
取2 g冻干粉,加入 10 mL的70%甲醇,涡旋至膏状样溶解,超声1 h,13000 r/min离心10 min后取上清进样。
2.1.3 质谱鉴定结果
根据文献报道附子理中汤主要的活性化合物为苯甲酰新乌头原碱、苯甲酰乌头原碱、白术内酯Ⅰ、白术内酯Ⅱ、白术内酯Ⅲ、党参炔苷、8-姜酚、10-姜酚、甘草苷、甘草素、大黄素、甘草酸、6-姜烯酚、苯甲酰次乌头原碱、乌头碱、新乌头碱、乌头原碱、6-姜酚、次乌头碱、腺苷、异甘草苷、异甘草素、甘草次酸等23种化合物[16-18],根据其结果对高分辨检测到的化合物依次进行鉴定,质量偏差范围设定为5 ppm,通过一级质量偏差,同位素比例偏差,二级谱图及标品保留时间进行确认,鉴定到了除大黄素、乌头碱和新乌头碱以外的20种化合物,见表3。鉴定结果确信度高,且质量偏差均在2 ppm以内,表明仪器精度高。其中 N/A 表示该化合物在该样品中未检出。根据甘草苷和异甘草苷,甘草素和异甘草素的单标确认,两对同分异构体实现分离。
2.2 AB SCIEX QTRAP 6500+系统靶向定量附子理中汤的20种活性成分
2.2.1 色谱及質谱条件
液相条件:色谱柱Shimadzu (100 mm × 2.1 mm, 2 ?m);流动相为水(含 0.1% 甲酸)(A)-乙腈(含 0.1% 甲酸)(B);梯度洗脱,洗脱程序见表4;体积流量0.3 mL/min;进样体积1 μL。
质谱条件:QTRAP 6500+,采用正负模式同时监测,离子源温度450 ℃,喷雾气(Gas 1)为50 psi,辅助气(Gas 2)为50 psi。离子喷雾电压为5500 V,-4500 V。质谱多反应监测(MRM)用于定量。对每个离子对的碎裂电压、碰撞能量值和停留时间进行优化,以获得最高丰度。
2.2.2 样品制备
待测样品溶液:精密称量S1~S16这16个批次的样品,加入甲醇依次稀释成100 mg/mL的样品溶液储备液,再加入50%乙腈分别稀释成5和1 mg/mL的待测液。对照品溶液:精密称量苯甲酰新乌头原碱1.57 mg、苯甲酰乌头原碱1.58 mg、白术内酯Ⅰ1.74 mg、白术内酯Ⅱ1.42 mg、白术内酯Ⅲ1.28 mg、党参炔苷1.79 mg、8-姜酚1.33 mg、10-姜酚1.66 mg、甘草苷1.10 mg、甘草素1.31 mg、甘草酸1.47 mg、6-姜烯酚1.53 mg、苯甲酰次乌头原碱1.65 mg、乌头原碱1.03mg、6-姜酚1.94mg、次乌头碱 2.54 mg、腺苷1.58mg、异甘草苷1.51 mg、异甘草素1.63 mg、甘草次酸1.54 mg,通过用甲醇溶解,并用50%乙腈水适当稀释混合储备溶液来制备一组标准溶液,以获得校准曲线。
2.2.3 线性关系考察
将制备的系列浓度混合对照品溶液,按“2.2.1”项下条件检测,获得各对照品的XIC提取离子流色谱图,以各对照品浓度为横坐标(X),峰面积值为纵坐标(Y),计算线性回归方程,以R2>0.995 作为线性关系良好的考察依据,见表5。
2.2.4 精密度试验
取同一份样品溶液,连续进样6次,每次进样
1 μL,计算6次进样中各对照品的XIC提取离子流色谱图峰面积值的 RSD 值,见表5。
2.2.5 稳定性试验
取同一批附子理中汤样品溶液1份,分别于 0、2、4、6和8 h进样检测,每次进样1 μL,计算5次进样中各对照品的XIC提取离子流色谱图峰面积值的 RSD 值,见表5。
2.2.6 重复性试验
平行制备6份同一批次附子理中汤样品溶液,分别进样1 μL,计算6份样品中各成分XIC提取离子流色谱图峰面积值的RSD值,见表5。
2.2.7 样品测定
取各药材制备16个批次附子理中汤(S1~S16)样品溶液,按优化的检测条件测定,计算各成分的质量分数,见表6。
2.2.8 多元统计分析
(1) 聚类分析(cluster analysis)
将样品进行聚类分析,如图1所示,来源于新荷花(XHH)的S13、S11、S12相差较远,其余3个来源聚类较好。说明新荷花的3个批次含量差异较大,同仁堂(TRT)、杏林药房(XLYF) 和中医大(ZYD)的3个来源各自批次的含量差异较小。
(2)差异化合物的筛选
为了更好地评价样品质量一致性,20种分析物(16×20)的含量数据导入(https://www.metaboanalyst.ca),通过方差分析方法(ANOVA)和偏最小二乘法判别分析(PLS-DA)进行分析。首先采用ANOVA对样品进行方差分析。再采用运用PLS-DA方法,即是一种用于优化不同组样品之间的分离的监督统计模型,获得了4个来源的16个样品之间的分离趋势,见图2,其中R2>Q2,且均大于0.5,说明模型可靠;为了防止模型过拟合,采用了100次的置换检验,P<0.02,说明模型没有过拟合。
为了筛选主要差异化合物,以P<0.05和VIP值>1作为筛选标准,获得的差异化合物分别为:甘草酸、异甘草素、甘草素、苯甲酰次乌头原碱、甘草苷、甘草次酸,见表7。苯甲酰次乌头原碱为该经典方中的君药附子的单酯二萜生物碱类成分,这也是《中国药典》含量测定的规定成分。
2.3 网络药理学
2.3.1 药物活性成分的潜在靶点筛选
将20个成分分别在PubChem网站获得Smiles号,导入ShwissTarget Prediction网站(http://www.swisstargetprediction.ch/)得到预测靶点,删除重复靶点后共计489个。
2.3.2 溃疡性结肠炎靶点筛选
通过GeneCards(https://www.genecards.org/)数据库分别获得溃疡性结肠炎的作用靶点,去除重复值后得到4896个相关靶点,根据Revelance score 值大于10筛选得潜在靶点374个。
2.3.3 药物和疾病靶点的交集
将得到的药物靶点与疾病靶点通过Venny2.1.0软件作图工具平台取交集,得到附子理中方和溃疡性结肠炎的共同作用靶点36个,图3。
2.3.4 PPI(protein-protein interaction)蛋白相互作用网络的构建
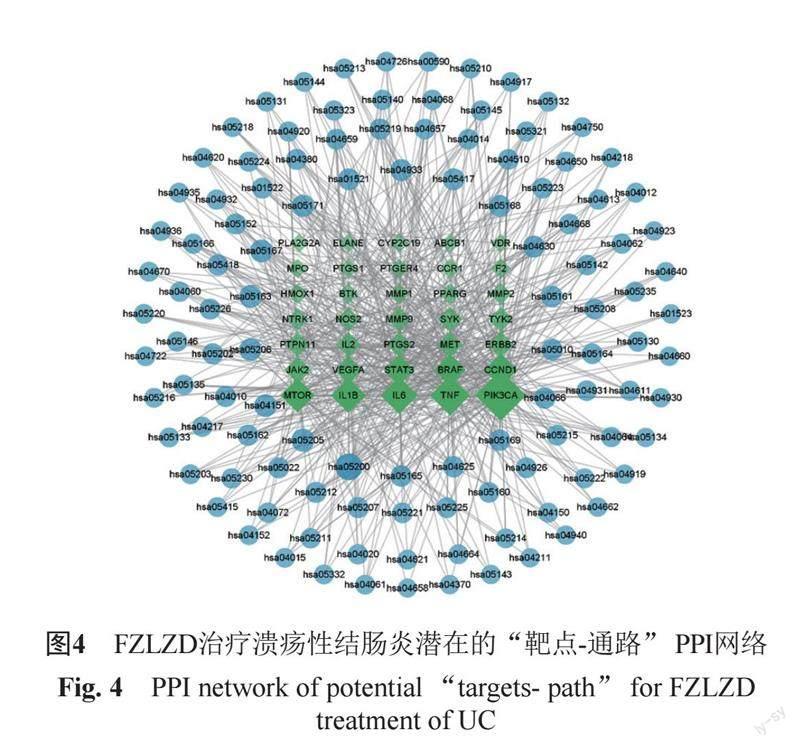
按照交集靶点和交集靶点经KEGG富集分析所得通路的相互关系构建network文件和type文件,导入Cytoscape3.9.1中,以构建靶点-通路图。经Aanyze Network分析各节点Degree值。节点越大,Degree值越大,表示该节点连接其他节点越多,该节点则越重要。绿色四边形节点表示成分所对应的靶点,蓝色圆形表示36个靶点形成的KEGG通路。靶点PIK3CA显著,见图4。
2.3.5 核心靶点的筛选
将36个交集靶标导入Cytoscape3.9.1的String APP插件中,之后通过Largest Subnetwork APP隱藏一些断开连接的节点,形成PPI网络。并在Cytoscape3.9.1中对PPI网络图使用Analyze Network工具进行拓扑分析,利用EXCEL获取拓扑参数度值、介数中心性和中心接近度的中位数分别是15、0.006453821、0.636363636,筛选出大于其中位数的靶点构成Hhb集,得CCND1、ERBB2、IL-1β、IL-2、IL-6、JAK2、MMP2、MMP9、MPO、MTOR、PIK3CA、PPARG、PTGS2、STAT3、TNF、VEGFA。 在Cytohuba插件拓扑分析中有12种算法,选择MCC为最优算法,筛选出排名前20的靶点构成MCC集,得CCND1、ERBB2、HMOX1、IL-1β、IL-2、IL-6、JAK2、MET、MMP1、MMP2、MMP9、MPO、MTOR、NOS2、NTRK1、PPARG、PTGS2、STAT3、TNF、VEGFA同样利用MCODE插件对PPI网络进行聚类分析,默认参数设置识别出2个蛋白质模块,同一蛋白质模块中的蛋白质靶点相互作用更紧密且功能特征相近,共涉及关键靶点21个,得IL-1β、IL-2、ERBB2、CCND1、MET、MTOR、MPO、JAK2、VEGFA、PTGS2、TNF、IL-6、MMP2、HMOX1、STAT3、MMP9、PPARG、NOS2、NTRK1、PIK3CA、PTPN11以上3种方法筛选出的核心靶点取交集,筛选出交集靶点共15个,分别为:CCND1、ERBB2、IL-1β、IL-2、IL-6、JAK2、MMP2、MMP9、MPO、MTOR、PPARG、PTGS2、STAT3、TNF、VEGFA该交集靶点为附子理中方治疗溃疡性结肠炎的核心靶点。
2.3.6 GO功能富集分析与KEGG通路富集分析
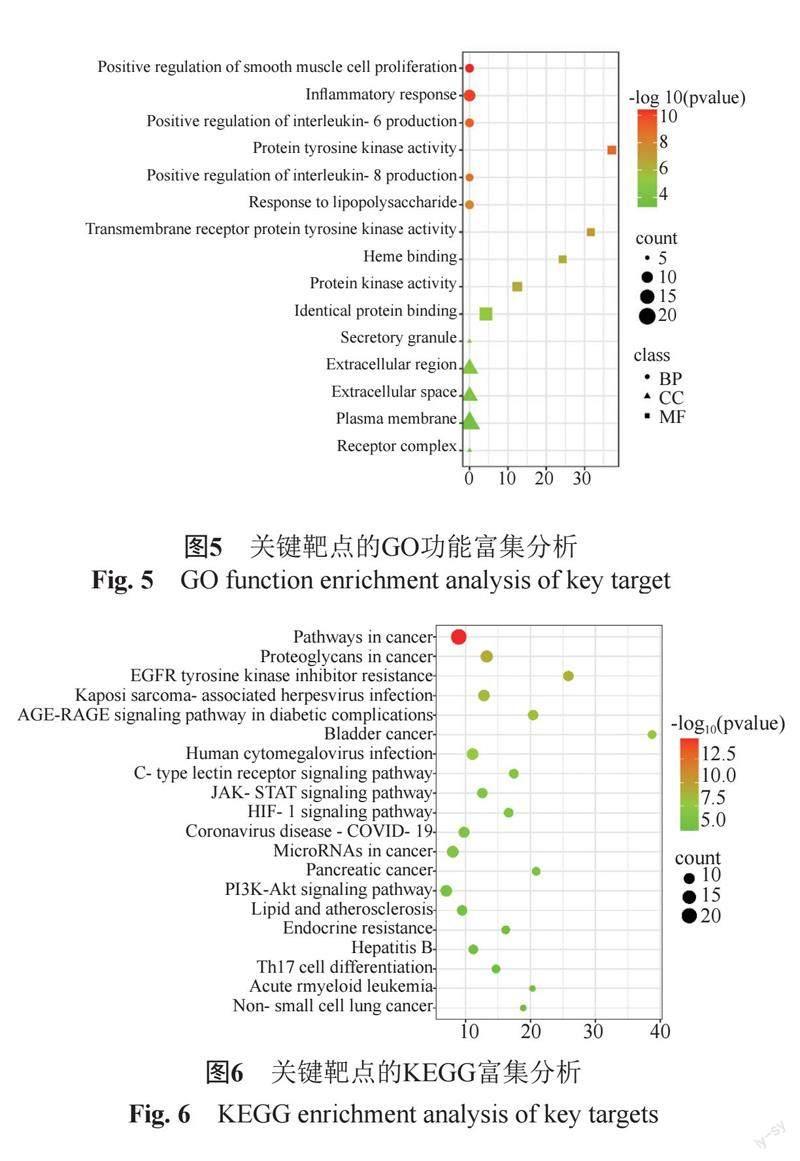
利用DAVID数据库对附子理中方治疗溃疡性结肠炎的36个交集靶点进行GO功能富集分析(P<0.05),共得到270条信号通路,其中生物过程217条、 细胞成分19条、分子功能34条(下图5列出了生物过程前5、细胞成分前5和分子功能中的前5个条目),发现附子理中方治疗溃疡性结肠炎核心靶点GO功能富集分析主要涉及炎症反应、白细胞介素-6产生的正调节、白细胞介素-8产生的正调节、对脂多糖的反应的生物过程;细胞成分主要为:分泌颗粒、细胞外区、细胞外间隙、质膜、受体复合物;分子功能涉及:蛋白酪氨酸激酶活性、跨膜受体蛋白酪氨酸、酶活性、血红素结合、蛋白激酶活性、同一蛋白结合。对附子理中方治疗溃疡性结肠炎的核心靶点进行KEGG通路富集分析(P<0.05),得到103条信号通路,其中前20条富集结果利用微生信在线作图进行可视化。富集基因数和P值决定节点的颜色与大小,颜色从红色到绿色代表P值从小到大,节点从大到小代表富集基因数从多到少。筛选出用于研究内容相关的信号通路,结果显示,附子理中方主要通过Pathways in cancer、Proteoglycans in cancer、EGFR tyrosine kinase inhibitor resistance、Kaposi sarcoma-associated herpesvirus infection、AGE-RAGE signaling pathway in diabetic complications等多条通路对溃疡性结肠炎起作用,通路上涉及的靶点越多则代表该通路在附子理中方治疗溃疡性结肠炎过程中发挥作用的可能性越大,见图5~6。
3 讨论
本实验考察了水、50%甲醇、甲醇3种溶剂对样品进行溶解,超声30min和50min,经测定分析,纯甲醇溶解超声50min的样品中的部分化合物可以得到更高的响应,这可能是有些化合物极性较小,在甲醇中能溶解地更充分;为了获得最佳的洗脱条件,本实验测试了各种流动相,如不含甲酸、含0.025%、0.05%和0.1%的甲酸水溶液与乙腈搭配,以及0.1%的甲酸水溶液和0.1%甲酸的乙腈溶液,从含有0.1%甲酸的乙腈和0.1%甲酸水溶液的混合物中获得最佳的峰形和分离度,这是因为加入甲酸可以使得[M+H]+离子的丰度;此外,对流动相梯度进行了研究,最后经过条件摸索将梯度运行时间优化至18 min。建立的液相色谱-质谱检测方法方便、快速、稳定性好,可为附子理中汤更多化学成分的含量测定提供实验依据,对中药复方的多成分测定提供参考。
活性物质的含量范围会对其临床效果产生影响,本研究将获得的6个差异化合物,即来源于附子的苯甲酰次乌头原碱和干姜的甘草酸、异甘草素、甘草素、甘草苷、甘草次酸作为主要筛选中的Q-marker,对今后生产高一致性批次的附子理中汤提供参考。附子理中汤是治疗溃疡性结肠炎等胃肠道疾病的经典方剂[16],本研究结果表明,附子理中汤的20个活性成分与溃疡性结肠炎构建的PPI网络图,获得PIK3CA靶点最为显著显著;根据GO功能富集分析与KEGG通路富集分析,影响白介素-6(IL-6)、白介素-8(IL-8)等炎症通路的调节、炎症反应和脂多糖反应,与癌症通路、蛋白聚糖、EGFR酪氨酸激酶、AGE-RAGE信号等多条信号通路等紧密相关。磷脂酰肌醇3-激酶(PI3KCA)是mTOR通路的正調节因子,PI3KCA 通路的激活可能会通过影响自噬细胞产生肠道炎症[19]。IL-1β、IL-6、TNF、IL-2等作为附子理中汤治疗溃疡性结肠炎的核心靶点,均受到核转录因子-κB(NF-κB)经典炎症通路的调控[20],PI3KCA 通路可调节IL-6的分泌而减轻炎症[21]。
据报道IL-6是溃疡性结肠炎癌变的重要促炎因子[22],据报道溃结患者的血清和结肠组织中的IL-6水平均高于正常对照组[23];IL-8是一种促使黏膜炎症的中性粒细胞[24],其可作为溃疡性结肠炎患者鉴别诊断和疾病活动的潜在标志物,IL-8水平的高低放映了UC患者的严重程度[25];IL-6和IL-8都会影响肠上皮细胞产生黏膜炎症,影响结肠炎的发生和发展[26]。参与AGE-RAGE信号的激活可以使得PI3K-Akt信号通路和丝裂原活化蛋白激酶(MAPK)信号通路激活而影响炎症[27],所以FZLZD可能能通过调节AGE-RAGE信号通路和IL-6、IL-8等炎症通路而治疗UC,为后续附子理中汤治疗溃疡性结肠炎的机制研究提供参考。
参 考 文 献
赵广刚. 附子理中汤治疗溃疡性结肠炎的临床疗效及其安全性[J]. 临床合理用药杂志, 2019, 12(24): 28-29.
刘青松, 郝彦伟, 张怡, 等. 基于网络药理学和实验验证探讨加味附子理中汤治疗阳虚型溃疡性结肠炎的作用机制[J]. 中药药理与临床, 2022, 38(5): 32-38.
潘雨烟, 苏晓兰, 许爱丽, 等. 附子理中汤治疗腹泻型肠易激综合征的网络药理学机制研究[J]. 辽宁中医杂志, 2021, 48(11): 9-13.
黄家望, 谢希, 陈平安, 等. 附子理中汤治疗胃溃疡的药效机制探讨[J]. 中医药学报, 2019, 47(6): 36-40.
谢晓芳, 王培, 许欣, 等. 附子抗炎、镇痛作用与产地相关性研究[J]. 中华中医药学刊, 2022, 40(11): 152-156.
范冰舵, 赵保胜, 翟华强, 等. 附子的临床安全用药[J]. 临床药物治疗杂志, 2013, 11(5): 51-54.
刘敏, 张海, 蔡亚梅, 等. 附子总生物碱提取物中3个双酯型和3个单酯型乌头碱成分的含量测定[J]. 药学实践杂志, 2013, 31(3): 181-184.
Qi Y, Li S, Pi Z, et al. Chemical profiling of Wu-tou decoction by UPLC-Q-TOF-MS[J]. Talanta. 2014, 118: 21-29.
Zhuang B, Bi Z M, Wang Z Y, et al. Chemical profiling and quantitation of bioactive compounds in Platycladi Cacumen by UPLC-Q-TOF-MS/MS and UPLC-DAD[J]. J Pharm Biomed Anal, 2018, 154: 207-215.
刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念[J]. 中草药, 2016, 47(9): 1443-1457.
Liang G, Yang J, Liu T, et al. A multi-strategy platform for quality control and Q-markers screen of Chaiqin chengqi decoction[J]. Phytomedicine, 2021, 85: 153525.
Ming J, Liu W, Wu H, et al. The active ingredients and mechanisms of Longchai Jiangxue Formula in treating PV, based on UPLC/Q-TOF-MS/MS, systematic pharmacology, and molecular biology validation[J]. Biomed Pharmacother, 2021, 140: 111767.
Wang Y, Gu E M, Du X, et al. A novel UPLC-MS/MS assay for the measurement of linezolid and its metabolite PNU-142300 in human serum and its application to patients with renal insufficiency[J]. Front Pharmacol, 2021, 2: 641872.
He T, Wang M, Kong J, et al. Integrating network pharmacology and non-targeted metabolomics to explore the common mechanism of Coptis Categorized Formula improving T2DM zebrafish[J]. J Ethnopharmacol, 2022, 284: 114784.
蔡可珍, 鄭琴, 朱徐东, 等. 基于UPLC-Q-TOF-MS结合网络药理学与实验验证探讨四君子汤治疗阿尔茨海默病的作用机制[J]. 中国中药杂志, 2023, 48(6): 1-16.
杨阳, 辛杨, 马凤延, 等. UHPLC-Q-Exactive-Obitriap MS快速定量附子理中汤10种化学成分[J]. 中草药. 2020, 51(07): 1839-1844.
Dong Y Z, Liu Z L, Liu Y Y, et al. Quality control of the Fuzi Lizhong pill through simultaneous determination of 16 major bioactive constituents by RRLC-MS-MS[J]. J Chromatogr Sci, 2018, 56(6): 541-554.
Zhang Z, Jiang M, Wei X, et al. Rapid discovery of chemical constituents and absorbed components in rat serum after oral administration of Fuzi-Lizhong pill based on high-throughput HPLC-Q-TOF/MS analysis[J]. Chin Med, 2019, 14: 6.
黄茂光, 谢胜, 王金鑫, 等. 自噬在溃疡性结肠炎中的作用及中药干预研究进展[J/OL]. 中国实验方剂学杂志, doi:10.13422/j.cnki.syfjx.20230428.
Lai J L, Liu Y H, Liu C, et al. Indirubin inhibits LPS-induced inflammation via TLR4 abrogation mediated by the NF-kB and MAPK signaling pathways[J]. Inflammation, 2017, 40(1): 1-12.
Bougen-Zhukov N M, Lee Y Y, Lee J J, et al. PI3K catalytic subunits α and β modulate cell death and IL-6 secretion induced by talc particles in human lung carcinoma cells[J]. Am J Resp cell Mol, 2020, 62(3): 331-341.
Wang C, Li W, Wang H, et al. Saccharomyces boulardii alleviates ulcerative colitis carcinogenesis in mice by reducing TNF-α and IL-6 levels and functions and by rebalancing intestinal microbiota[J]. BMC Microbiol. 2019, 19(1): 246.
Wu X, Wei S, Chen M, et al. P2RY13 exacerbates intestinal inflammation by damaging the intestinal mucosal barrier via activating IL-6/STAT3 pathway[J]. Int J Biol Sci, 2022, 18(13): 5056-5069.
Mitsuyama K, Toyonaga A, Sasaki E, et al. IL-8 as an important chemoattractant for neutrophils in ulcerative colitis and Crohn's disease[J]. Clin Exp Immunol, 1994, 96(3): 432-436.
He Z, Liu Y, Liu J J, et al. PLR and IL-8 were potential markers in differential diagnosis and disease activity in Ulcerative Colitis patients[J]. Clin Lab, 2022, 68(9). doi: 10.7754/Clin.Lab.2021.211141.
Arai F, Takahashi T, Furukawa K, et al. Mucosal expression of interleukin-6 and interleukin-8 messenger RNA in ulcerative colitis and in Crohn's disease[J]. Dig Dis Sci. 1998, 43(9): 2071-2079.
Shou X, Wang Y, Zhang X, et al. Network pharmacology and molecular docking analysis on molecular mechanism of Qingzi Zhitong decoction in the treatment of ulcerative colitis[J]. Front Pharmacol, 2022, 13: 727608.
