表伊快霉素对耐甲氧西林金黄色葡萄球菌毒力和生物被膜的影响
2023-03-14陆春菊梁莉芬傅春青张耿思李海艳周冬梅高程海刘永宏徐新亚
陆春菊?梁莉芬?傅春青?张耿思?李海艳?周冬梅?高程海?刘永宏?徐新亚
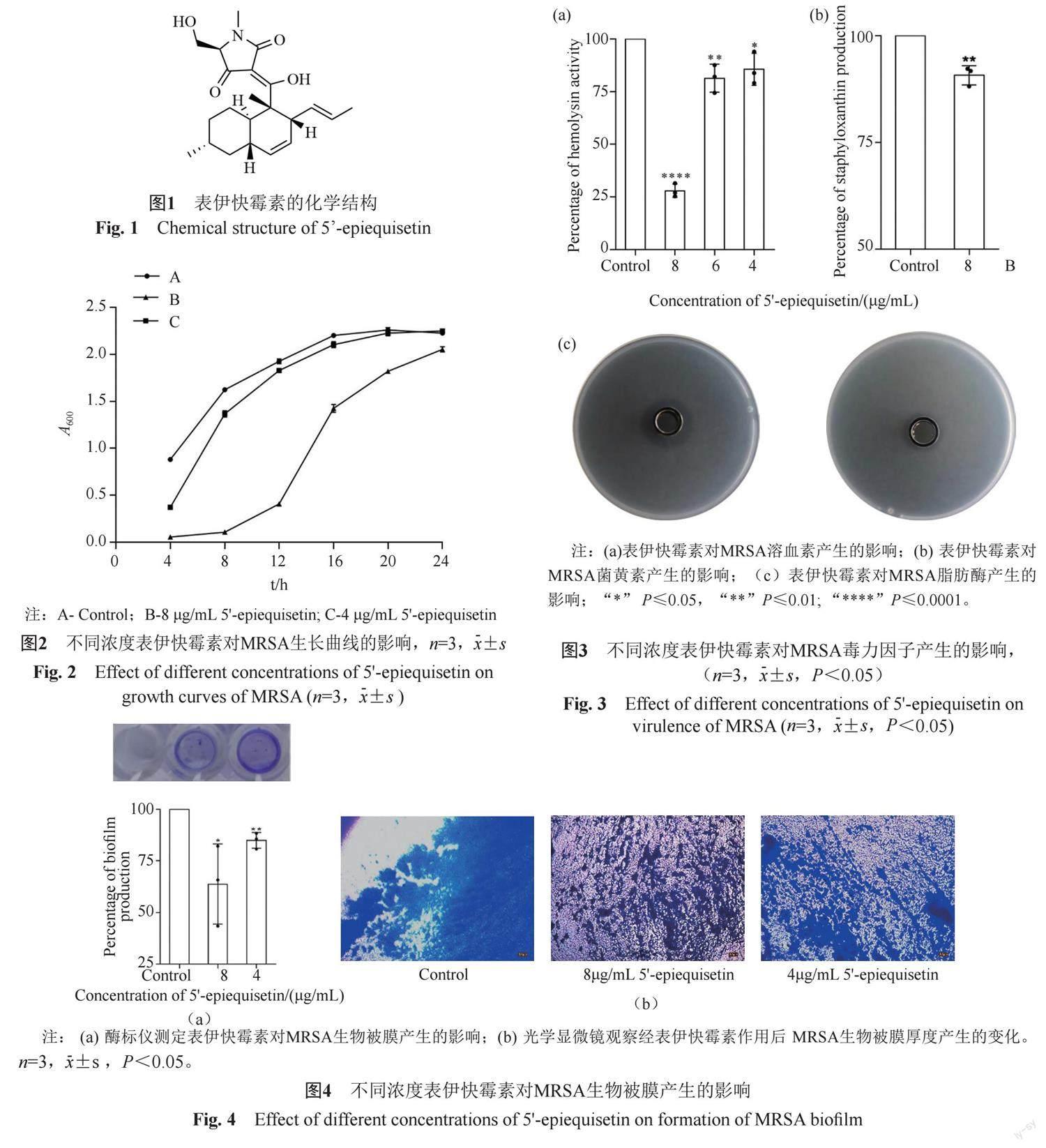

摘要:目的 研究表伊快霉素(5'-epiequisetin)对耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)毒力因子和生物被膜的抑制作用。方法 微量肉汤稀释法测定表伊快霉素对MRSA的最小抑菌浓度(minimum inhibitory concentration,MIC),绘制时间-抑菌曲线评估其持续抑菌效果;研究亚抑制浓度(sub-minimum inhibitory concentration, sub-MIC)的表伊快霉素对MRSA毒力因子溶血素、菌黄素和脂肪酶的影响。结晶紫染色法与光学显微镜观察评价表伊快霉素对MRSA生物被膜的作用;研究亚抑制浓度的表伊快霉素对MRSA运动性、胞外多糖产生的影响,通过扫描电镜观察其对MRSA细菌形态的影响。结果 表伊快霉素抑制MRSA的MIC为16 μg/mL。在sub-MIC濃度下,表伊快霉素可抑制MRSA毒力因子溶血酶、菌黄素、脂肪酶的产生;表伊快霉素对MRSA生物被膜形成有抑制作用,并可抑制胞外多糖的产生和MRSA的滑行运动;扫描电镜观察显示表伊快霉素可使MRSA排列疏松,菌体皱缩。结论 表伊快霉素能够显著抑制MRSA毒力因子和生物被膜形成,能够减少MRSA的致病性和耐药性,可作为抗MRSA药物研究的先导化合物。
关键词:表伊快霉素;MRSA;毒力因子;生物被膜
中图分类号:R981.1文献标志码:A
Effect of 5'-epiequisetin on virulence and biofilm of methicillin-resistant Staphylococcus aureus
Lu Chunju, Liang Lifen, Fu Chunqing, Zhang Gengsi, Li Haiyan,
Zhou Dongmei, Gao Chenghai, Liu Yonghong, and Xu Xinya
(Institute of Marine Drugs/Guangxi Key Laboratory of Marine Drugs, Guangxi University of Chinese Medicine, Nanning 530200)
Abstract Objective Investigation of the inhibition effect of 5'-epiequisetin against virulence and biofilm formation of methicillin-resistant Staphylococcus aureus (MRSA). Methods The microbroth dilution method was used to determine the MIC of MRSA. The effects of sub-MIC of 5'-epiequisetin against biofilm formation, and MRSA virulence factors including hemolysin, staphyloxanthin, and lipase production were explored. The exopolysaccharide production and motility of MRSA were also evaluated. The process of biofilm formation was observed by optical microscope and scanning electron microscopy. Results The MIC of 5'-epiequisetin was 16 μg/mL. 5'-epiequisetin suppressed the production of virulence factors hemolysin, staphyloxanthin and lipase. In addition, 5'-epiequisetin inhibited MRSA biofilm formation, exopolysaccharide production and motility. And the SEM exhibited that 5'-epiequisetin made MRSA loosely packed and shrink. Conclusion Sub-inhibitory concentrations of 5'-epiequisetin inhibited MRSA biofilm formation and virulence production. It demonstrates that 5'-epiequisetin is an anti-MRSA lead compound.
Key words 5'-Epiequisetin; MRSA; Virulence factor; Biofilm
金黄色葡萄球菌是临床常见的革兰阳性菌,通过分泌多种致病性毒力因子如溶血素、脂肪酶和菌黄素等,引起临床感染,威胁人类健康[1]。由于抗生素的大规模和不合理使用,出现了多种金黄色葡萄球菌耐药菌株,其中以耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)危害最大[2]。MRSA 致病性强、耐药发展迅速,目前MRSA感染已经和乙肝病毒感染、艾滋病感染并列为世界范围内3大难解决感染性疾病[3]。MRSA的致病性和耐药性与其产生的毒力因子(virulent factor)和生物被膜(biofilm,BF)密切相关。毒力表示病原体致病能力的强弱,构成细菌毒力的物质称为毒力因子,主要有侵袭力和毒素。细菌生物被膜是细菌黏附于非生物或生物表面,分泌多聚物基质并将自身包裹其中形成的一种有组织的细菌集团[4]。在不杀死细菌的情况下,减少毒力因子的产生,抑制生物被膜的形成,是抑制耐药致病菌的有效策略。
表伊快霉素(5'-epiequisetin)是镰刀菌属(Fusarium)真菌产生的类萜生物碱,是一种HIV-1整合酶抑制剂[5]。本课题组在寻找抗MRSA活性先导化合物的过程中,发现海洋嗜盐真菌F. incarnatum GXIMD00527中得到的表伊快霉素显示出较强的抗MRSA活性,与文献报道相符[6]。但表伊快霉素抑制MRSA的作用机理及对MRSA毒力因子和生物被膜的抑制作用未见报道。在本研究中,测定了表伊快霉素抗MRSA的时间-抑菌曲线,测定了表伊快霉素对MRSA毒力因子溶血素、菌黄素和脂肪酶的抑制活性,并考察了表伊快霉素对MRSA菌体结构、生物被膜结构、菌体运动性的影响,为抗MRSA新型抗生素的研究提供数据支持和先导化合物。
1 材料
1.1 药物来源及鉴定
表伊快霉素(化合物纯度≥98%)分离自北海竹林盐场来源嗜盐真菌Fusarium incarnatum GXIMD00527。菌株保存于广西中医药大学海洋药物研究院菌种保藏中心。
1.2 指示菌
耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus ATCC43300)由华南农业大学海洋学院张晓勇副教授惠赠,菌株保存于广西中医药大学海洋药物研究院菌种保藏中心。
1.3 培养基配制
使用的培养基均经121 ℃高温高压灭菌30 min 后使用。
大米培养基:大米80 g, 酵母提取粉0.4 g, 葡萄糖0.4 g, 人工海水120 mL。
LB:胰蛋白胨10.0 g,酵母提取粉5.0 g,氯化钠10.0 g,水1000 mL。
LB-g:含0.25%葡萄糖的LB培养基。
2 方法
2.1 表伊快霉素的提取分离
菌株F. incarnatum GXIMD00527于大米培养基中静置发酵35 d,乙酸乙酯提取得到粗浸膏。粗浸膏经正相硅胶柱色谱(200~300目正相硅胶)分离,采用梯度洗脱(二氯甲烷/甲醇,100:0~80:20,V/V),TLC色谱分析后,得到12个流分。Fr.10经反相ODS柱色谱(CH3CN/H2O, 20:80~80:20)分离得到17个流分。sFr.16采用半制备高效液相色谱(CH3CN/H2O, 72:28, 3 mL/min)纯化得到化合物。
2.2 最小抑菌浓度(MIC)测定
指示菌二次活化后,使用新鲜LB培养基调节菌悬液浓度为每毫升含有106个菌落形成单位(colony forming units, CFU)。使用微量肉汤稀释法测定MIC,于37 ℃培养箱中培养24 h,最后一个澄清孔即为药物MIC。
2.3 时间-生长曲线的测定
指示菌二次活化后,使用新鲜LB培养基调节菌悬液浓度为106 CFU/mL。加入样品液达到终浓度为0.25×MIC和0.50×MIC,在37 ℃、180 r/min下培养并每隔4 h测定1次A600。
2.4 表伊快霉素对 MRSA 毒力因子的影响
2.4.1 溶血素溶血活性测定
指示菌在含药或DMSO LB培养基中培养(37 ℃、180 r/min)16 h。离心后取上清液100 μL加入900 μL溶血缓冲液(0.145 mol/L NaCl, 0.02 mol/L CaCl2)中,再加入33 μL无菌去纤维兔血,混匀后于37 ℃培养箱中培养1 h,离心后取上清测定A543。
2.4.2 脂肪酶活性测定
指示菌在含药或DMSO LB培养基中培养(37 ℃、180 r/min)15 h。将牛津杯放置在含1%三丁酸甘油酯的LBA平板上,加入150 μL微孔滤膜过滤除菌后菌液,于37 ℃培养箱中培养16 h,观察透明圈大小。
2.4.3 菌黄素活性测定
指示菌在含药或DMSO LB培养基中培养(37 ℃、180 r/min)48 h。取5 mL菌液离心,保留菌体,无菌水清洗1次除去残留培养基。加入500 μL无水甲醇,55 ℃的水浴搅拌加热30 min。离心后保留上清,
60 ℃烘干,加入250 μL无水甲醇再次溶解,离心后取上清测定A450。
2.5 生物被膜形成抑制活性
指示菌二次活化后,使用新鲜LB-g培养基调节菌悬液浓度为106 CFU/mL。取195 μL稀释后菌液至96孔板,加入5 μL样品DMSO液,于37 ℃培养箱中培养24 h。吸出菌液, 水洗2遍,60 ℃烘干。200 μL 0.1%结晶紫染色30 min,洗去染液, 60 ℃烘干。200 μL 30%乙酸静置溶解30 min,于酶标仪振荡混匀,测定A540。
2.6 运动性测定
0.3%琼脂的LBA灭菌冷却后加入样品,等量DMSO为阴性对照。取过夜培养菌液5 ?L,含药LBA平板中间,于37 ℃培养箱中培养12 h,观察并记录菌落生长情况。
2.7 胞外多糖(exopolysaccharide)形成抑制
指示菌二次活化后,使用新鲜LB-g培养基调节菌悬液浓度为106 CFU/mL。取999 μL稀释后菌液至24孔板,加入1 μL样品DMSO液,于37 ℃培养箱中培养24 h。吸出菌液,PBS洗涤2遍, 60 ℃烘干。向24孔板加入0.25 mL 5%苯酚和1.25 mL浓硫酸, 室温下黑暗培养1 h, 测定A490。
2.8 光学显微镜观察MRSA生物被膜形成抑制效果
操作方法与“2.4”所述加入乙酸前所述一致,具体操作为:结晶紫染色干燥后,96孔板倒置于光學显微镜放大 400 倍下观察并获取图像。
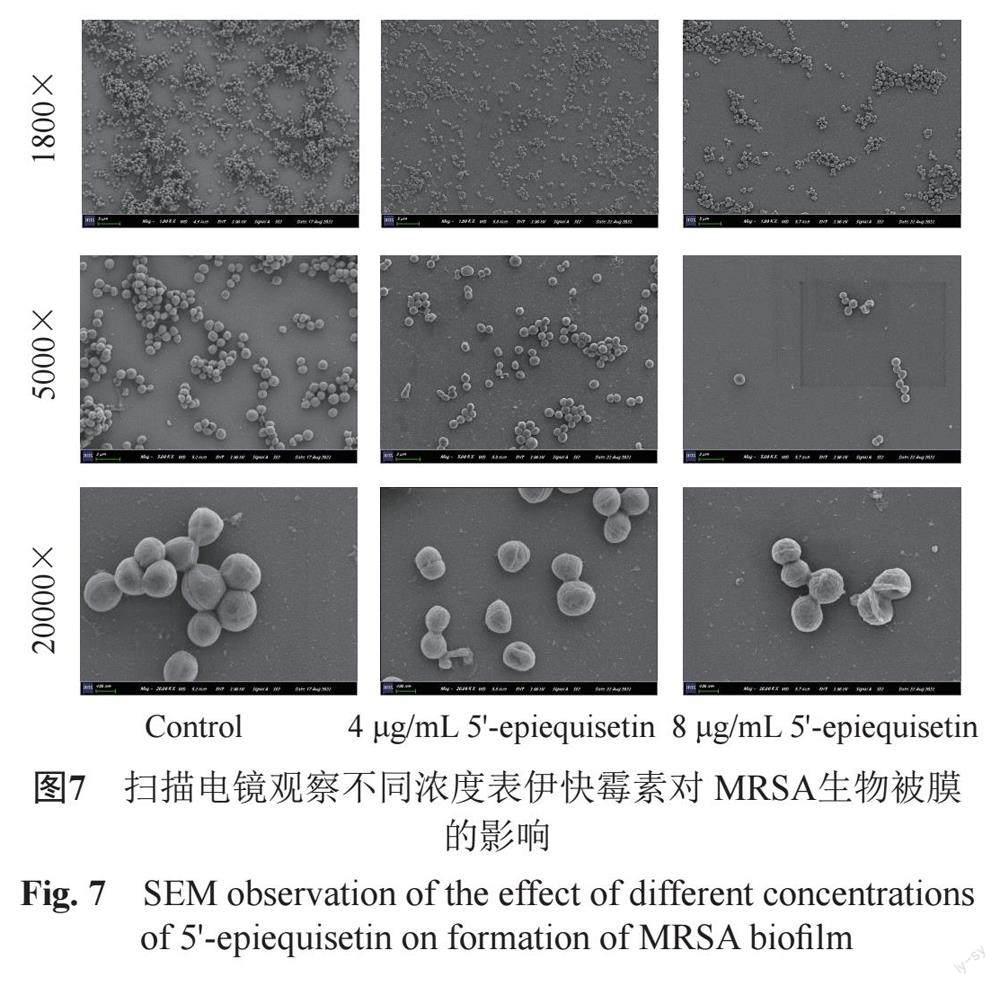
2.9 扫描电镜观察MRSA生物被膜形成抑制效果
于24孔板中加入无菌爬片后,操作方法与“2.6”所述烘干前所述一致,具体操作为:取出爬片,PBS洗涤2次,使用25%戊二醛于4 ℃冰箱固定过夜。使用PBS洗涤一次,后用乙醇低浓度至高浓度( 50%、60%、70%、80%、90%和100%)脱水各1次,15 min /次;100%叔丁醇置换1次,15 min/次。真空冷冻干燥后,喷金,扫描电镜观察并获取图像。
2.10 统计学分析
计量资料数据以(x±s)表示,采用GraphPad Prism 7作图,两组比较采用独立样本t检验,P<0.05认为差异有统计学意义。
3 结果
3.1 表伊快霉素的结构鉴定
浅黄色粉末。1H NMR (500 MHz, DMSO-d6), δH: 5.43~5.34 (2H, m), 5.24~5.10 (2H, m), 3.80 (1H, d, J = 11.6 Hz), 3.75 (1H, overlapped), 3.69 (1H, d, J = 11.6 Hz), 2.94 (3H, s), 1.91 (1H, m), 1.85-1.65 (4H, m), 1.49(3H, d, J = 4.8 Hz), 1.36 (3H, br s), 1.24 (2H, m), 1.02 (2H, m), 0.89 (3H, d, J = 6.5 Hz), 0.81 (1H, m). 13C NMR (126 MHz, DMSO-d6), δC: 201.4, 190.7, 176.4, 131.0, 130.9, 126.5, 126.4, 100.9, 67.6, 58.1, 48.1, 44.3, 41.8, 40.0, 38.2 35.4, 32.9, 29.1, 27.7, 26.8, 22.4, 17.8, 13.8. HRESIMS m/z 374.2329 [M+H]+, C22H32NO4+计算值374.2326;以上数据与文献[6]报道的基本一致,鉴定为表伊快霉素。
3.2 表伊快霉素對MRSA的体外抑制作用
表伊快霉素对MRSA的MIC值为16 μg/mL。时间生长曲线如图2所示,与对照组相比,培养时间0~20 h时,4 μg/mL对MRSA具有生长抑制作用;8 μg/mL表伊快霉素则进一步抑制MRSA生长,24 h持续有效。
3.3 表伊快霉素对MRSA毒力的影响
溶血酶活性实验结果如图3A所示,表伊快霉素具有降低MRSA溶血活性作用,并呈剂量依赖关系;其中8 μg/mL表伊快霉素可显著抑制MRSA溶血活性,抑制率达72.02%。菌黄素活性实验结果如图 3B所示,8 μg/mL表伊快霉素可抑制MRSA菌黄素的产生,平均抑制率分别为9.28%。脂肪酶活性实验结果如图3C所示,对照组产生的透明圈直径为1.39 ±0.01(x±s, n=3)mm,含药组产生的透明圈直径为1.08 ±0.08(x±s, n=3)mm,表明8 μg/mL 表伊快霉素可抑制MRSA脂肪酶的产生(P<0.05)。
3.4 表伊快霉素对MRSA生物被膜形成的影响
实验结果如图4所示,表伊快霉素对MRSA生物被膜形成具有抑制作用,并呈剂量依赖性。8 μg/mL和4 μg/mL的表伊快霉素对MRSA生物被膜形成的抑制率分别为36.26%和15.13%。由光学显微镜观察可见,与对照组相比,经表伊快霉素处理的MRSA生物被膜发育较差,生物被膜厚度减少。
3.5 表伊快霉素对MRSA运动性的影响
运动性实验结果如图5所示,表伊快霉素具有抑制MRSA运动活性,经8 μg/mL表伊快霉素处理后,MRSA运动距离明显缩短。
3.6 表伊快霉素对MRSA胞外多糖exopolysaccharide产生的影响
实验结果如图6所示,表伊快霉素以剂量依赖的方式抑制MRSA胞外多糖exopolysaccharide的产生;8和4 μg/mL的表伊快霉素对MRSA exopolysaccharide产生的抑制率分别为53.18%和14.45%。
3.7扫描电镜观察表伊快霉素对MRSA生物被膜结构的影响
扫描电子显微镜观察如图7所示,对照组细菌大部聚集成团,形成厚而致密的细胞膜,菌体形态饱满,表面光滑,个体正常;经4 μg/mL表伊快霉素处理后,生物被膜的产生受到抑制,少量菌体聚集,排列较疏松,菌体出现轻微皱缩;经8 μg/mL 表伊快霉素处理后,生物被膜的产生受到进一步抑制,形成的细胞膜可忽略不计,细菌呈单层分散于爬片表面,菌体塌陷,表面皱缩。
4 讨论
MRSA是医院感染的主要原因之一,可导致较高的感染发病率和死亡率,MRSA具有的耐药性限制了抗生素的使用。MRSA的致病性、免疫逃逸能力和耐药性都依赖胞外产生毒力因子和形成生物被膜。抑制毒力因子和生物被膜是治疗MRSA感染与解决耐药性问题的新策略。溶血素是金黄色葡萄球菌分泌的最重要的毒力因子之一,可导致多种人体细胞的溶解,包括红细胞、单核细胞、淋巴细胞、巨噬细胞和上皮细胞,还可诱导哺乳动物细胞的促炎性变化,进而引发严重的败血症[7]。溶血素也是金黄色葡萄球菌形成生物被膜的必需物质,溶血素缺乏的菌株在细胞间相互作用方面存在明显缺陷,在静态和流动条件下都不能形成生物被膜[8]。菌黄素是金黄色葡萄球菌体内重要的毒力因子,可通过其抗氧化特性保护细菌免受吞噬杀死,抑制菌黄素的产生,可有效地使病原体更容易被正常的宿主先天免疫所清除[9-10]。微生物表达脂肪酶,可将宿主来源的脂质分解为游离脂肪酸以获取营养,并通过灭活杀菌脂质和可能干扰粒细胞的吞噬作用和趋化性来规避先天免疫,进而导致金黄色葡萄球菌的感染和传播[11]。细菌性病原体利用运动(motility)进行宿主定殖,并在生物被膜形成中发挥关键作用,金黄色葡萄球菌的运动被定义为菌落扩散(colony spreading)[12]。EPS是生物被膜基质的重要组成部分,是生物被膜对抗生素耐受的主要来源,对EPS产生的任何干扰都可以抑制生物被膜的产生,并使细菌的附着力降低[13-14]。
本研究的结果显示,表伊快霉素对MRSA产生3种毒力因子均具有明显抑制作用,同时可以通过抑制细菌运动性与EPS的产生抑制细菌生物被膜的形成。因此,表伊快霉素可作为抗MRSA药物研究的先导化合物。
参 考 文 献
Otto M. MRSA virulence and spread[J]. Cell Microbiol, 2012, 14(10): 1513-1521.
Levy S B, Marshall B. Antibacterial resistance world wide: Causes, challenges and responses[J]. Nat Med, 2004, 10: 122-129.
李静静, 时凯悦, 徐丛慧, 等. 基于新型生物标志物的耐甲氧西林金黄色葡萄球菌静脉感染模型制作与治疗监测[J]. 滨州醫学院学报, 2019, 42(1): 55-57.
Stewart P S, Costerton J W. Antibiotic resistance of bacteria in biofilms[J]. Lancet, 2001, 358: 135-138.
Singh S B, Zink D L, Goetz M A, et al. Equisetin and a novel opposite stereochemical homolog phomasetin, two fungal metabolites as inhibitors of HIV-1 integrase[J]. Tetrahedron Lett, 1998, 39: 2243-2246.
陈春梅, 罗小卫, 李坤龙, 等. 一株海绵共附生真菌Fusarium equiseti SCSIO 41019的次级代谢产物及其抑菌活性研究[J]. 中国抗生素杂志, 2019, 44(9): 1035-1040.
Xiang H, Qiu J Z, Wang D C, et al. Influence of magnolol on the secretion of alpha-toxin by Staphylococcus aureus[J]. Molecules, 2010, 15(3): 1679-1689.
Caiazza N C, OToole, G A. Alpha-toxin is required for biofifilm formation by Staphylococcus aureus[J]. J Bacteriol, 2003, 185: 3214-3217.
Xue L, Chen Y Y, Yan Z, et al. Staphyloxanthin: A potential target for antivirulence therapy[J]. Infect Drug Resist, 2019, 12: 2151-2160.
Liu G Y, Essex A, Buchanan J T, et al. Staphylococcus aureus golden pigment impairs neutrophil killing and promotes virulence through its antioxidant activity[J]. J Exp Med, 2005, 202: 209-215.
Chen X, Alonzo F. Bacterial lipolysis of immune-activating ligands promotes evasion of innate defenses[J]. Proc Natl Acad Sci USA, 2019, 116(9): 3764-3773.
Tsompanidou E, Sibbald M J, Chlebowicz M A, et al. Requirement of the agr locus for colony spreading of Staphylococcus aureus[J]. J Bacteriol, 2011, 193(5): 1267-1272.
Al-Shabib N A, Husain F M, Ahmad I, et al. Rutin inhibits mono and multi-species biofilm formation by foodborne drug resistant Escherichia coli and Staphylococcus aureus[J]. Food Control, 2017, 79: 325-332.
Liu D, Huang Q, Gu W, et al. A review of bacterial biofilm control by physical strategies[J]. Crit Rev Food Sci Nutr, 2022, 62(13): 3453-3470.
