近平滑念珠菌复合群生物膜形成特点的研究
2023-03-14夏翠萍汪业梅王金宇王中新
夏翠萍 汪业梅 王金宇 王中新
摘要:目的 分析近平滑念珠菌、拟平滑念珠菌、似平滑念珠菌生物膜产量和代谢活性特点及氟康唑对其生物膜形成的影响。方法 收集111株临床分离的近平滑念珠菌、拟平滑念珠菌和似平滑念珠菌,通过结晶紫、甲基四氮盐、扫描电子显微镜方法分析近平滑念珠菌复合群之间生物膜产生特点,并观察氟康唑对近平滑念珠菌复合群生物膜形成不同时间段的影响。结果 在近平滑念珠菌复合群中,除了3株尿液分离的近平滑念珠菌外,其余108株(97.3%)均可产生生物膜,近平滑念珠菌的生物膜产量和代谢活性均最强,且生物膜代谢活性在不同培养时间段(6、12、24、48、72和96 h)逐渐升高,在72 h时达最高,96 h时反而降低。拟平滑念珠菌、似平滑念珠菌虽均可产生生物膜,但生物膜的代谢活性在各个培养时间段均较弱,且在各个时间段无明显差异。血液分离的近平滑念珠菌生物膜产量低于其他分离部位,生物膜代谢活性也最弱。氟康唑在不同培养时间段均可抑制生物膜的形成,48 h抑制作用最强。结论 近平滑念珠菌复合群中近平滑念珠菌的生物膜产量和代谢活性均最强,血液分离的近平滑念珠菌生物膜产量和代谢活性低于其他分离部位,氟康唑对近平滑念珠菌复合群生物膜形成有明显的抑制作用。
關键词:近平滑念珠菌复合群;毒力;生物膜产量;代谢活性;氟康唑
中图分类号:R446.5文献标志码:A
Study on the characteristics of biofilm formation of Candida parapsilosis complex
Xia Cuiping1, Wang Yemei2, Wang Jinyu1, and Wang Zhongxin1
(1 Department of Clinical Laboratory, The First Affiliated Hospital of Anhui Medical University, Hefei 230022;
2 Anhui Promotion Center for Technology Achievements Transfer, Hefei 230088)
Abstract Objective The yield of biofilm production and the metabolic activity of C. parapsilosis sensu stricto, C. orthopsilosis and C. metapsilosis were anlyzed to understand the effect of fluconazole on their biofilm formation. Methods 111 clinical isolates of C. parapsilosis sensu stricto, C. orthopsilosis and C. metapsilosis were collected, the differences in biofilm production characteristics among Candida parapsilosis complex were analyzed by crystal violet (CV) staining, tetrazolium salt (XTT) and scanning electron microscopy (SEM), and the effect of fluconazole on C. parapsilosis complex biofilm formation in the different periods was observed. Results In the C. parapsilosis complex, except for 3 isolates of C. parapsilosis sensu stricto from urine, which could not produce biofilm, the remaining 108 isolates (97.3%) could produce biofilm. The biofilm metabolic activity increased gradually at different incubation times (6, 12, 24, 48, 72 and 96 h) and reached its highest at 72 h but decreased at 96 h. Although both C. orthopsilosis and C. metapsilosis could produce biofilm, the biofilm metabolic activity was weak during each culture period, with no significant difference. Blood-isolated C. parapsilosis sensu stricto had a lower yield for biofilm production than other isolated resources, and the biofilm metabolic activity was also the weakest. In addition, fluconazole could inhibit biofilm formation at any time and the inhibition effect reached its strongest at 48 h. Conclusion C. parapsilosis sensu stricto was the strongest biofilm producer and had the highest metabolic activity among C. parapsilosis complex. Biofilm production and metabolic activities of C. parapsilosis sensu stricto isolated from blood were lower than those of other isolated resources. Fluconazole had a significant inhibitory effect on the biofilm formation of the C. parapsilosis complex.
Key words C. parapsilosis complex; Virulence; Biofilm production; Metabolic activity; Fluconazole
近平滑念珠菌是非白念珠菌感染的常见菌种之一,在一些国家和地区的感染率已超过白念珠菌的感染率[1-2],尤其是在留置导管、胃肠营养和植入生物材料等患者中感染率更高[3],当不注意手卫生的情况下也可通过医护人员的手造成近平滑念珠菌的暴发感染[4-5]。近平滑念珠菌对氟康唑耐药率上升最快,已超过其他念珠菌[6]。由于其逐渐增加的感染率和耐药率,引起了人们的广泛关注。虽然拟平滑念珠菌和似平滑念珠菌属于不常见念珠菌,但发现由似平滑念珠菌引起的念珠菌血症对抗真菌药物的敏感性更低,并且拟平滑念珠菌和似平滑念珠菌感染严重者已出现新生儿念珠菌血症死亡病例[7]。由于近平滑念珠菌复合群在形态学、生物化学和组织结构方面非常接近,并且研究发现近平滑念珠菌复合群各菌种之间可存在混合感染,常规方法不能区分,因此必须用分子水平的鉴定方法区别。目前通过分子鉴定技术将近平滑念珠菌复合群进一步分为近平滑念珠菌标准菌株、拟平滑念珠菌和似平滑念珠菌[8]。生物膜是近平滑念珠菌重要的毒力因子,不仅增强近平滑念珠菌的侵袭性播散,通过减少抗真菌药的渗透可促进耐药的发生[9-10]。尽管近平滑念珠菌的感染率逐年上升,但目前对近平滑念珠菌毒力的研究有限。因此,本研究目的是对比近平滑念珠菌复合群各菌种生物膜形成和代谢活性之间的差异。
1 材料
1.1 菌株来源
本研究收集安徽医科大学第一附属医院2021—2022年期间共111株近平滑念珠菌复合群临床菌株,并排除了重复菌株,其中:近平滑念珠菌86株,分离自血液9株,皮肤6株,静脉导管22株,尿液44株,痰液5株;拟平滑念珠菌12株,分离自血液3株,尿液6株,痰液3株;似平滑念珠菌13株,分离自血液4株,皮肤1株,尿液6株,痰液2株。所有的菌株用念珠菌显色培养基37 ℃培养24~48 h,通过菌落形态对菌株进行初步鉴定,再用MALDI-TOF MS(matrix-assisted laser-resolved ionization time-of-flight mass spectrometry, 基质辅助激光解吸电离飞行时间)技术方法确定。所有菌株用含20%甘油冻存液保存在-80 ℃备用。
1.2 试剂和仪器
培养基:念珠菌显色培养板(安徽合肥天达诊断试剂有限公司);沙氏固体培养基(sabouraud dextrose agar, SDA)(美国Oxiod公司);酵母蛋白胨葡萄糖培养基(yeast extract peptone dextrose,YEPD)(PH7.0):10 g酵母浸膏(美国Oxiod公司),20 g蛋白胨(美国Oxiod公司),20 g葡萄糖(上海生工)加水定容至1 L,高压灭菌,4 ℃保存;RPMI-1640液体培养基(不含碳酸氢钠):4 g RPMI-1640粉剂[Gibco,赛默飞世尔科技(中国)有限公司],37.2 g 2-羟基-3-(4-吗啡基)丙磺酸(M-morpholinepropanesulfonic acid,MOPS,上海生工)(0.165 mol/L)调制pH7.0,无菌过滤后4 ℃保存。
试剂:α-氰基-4-羟基肉桂酸(α-Cyano-4-hydroxycinnamic acid, CHCA)基質液[Biomerieux(上海)有限公司],甲基四氮盐(tetrazolium salt, XTT)钠盐(Aladdin,上海):XTT粉剂用磷酸盐缓冲液配置成0.5 mg/mL溶液,无菌过滤后-20 ℃保存;甲萘醌(上海生工):100%丙酮(上海麦克林生化科技有限公司)配制成100 mmol/L溶液储存浓度,实验时用XTT染液配置成1 ?mol/L;六甲基二硅胺烷和25%戊二醛溶液(上海麦克林生化科技有限公司);氟康唑(Aladdin,上海):用100%二甲基亚砜(DMSO)(上海麦克林生化科技有限公司)溶解,配置成128 ?g/mL储存浓度,-20 ℃保存;聚苯乙烯96孔微量培养板(广州洁特生物有限公司);12孔细胞培养板(Corning公司,美国);10 mm圆形盖玻片(江苏世泰实验器材有限公司)。
仪器:Vitek质谱仪(Biomerieux),KHBST-360酶标仪(上海科华生物工程股份有限公司),Infinite F50酶标仪(TECAN),场发射扫描电子显微镜Gemini SEM300(Carl Zeiss公司,由安徽医科大学科研实验中心提供支持)。
2 方法
2.1 生物膜形成准备
菌株-80 ℃复温,念珠菌显色培养基37 ℃培养24~48 h,SDA培养基37 ℃培养48 h;挑取少量单个菌落于含1 mL YEPD液体培养基的1.5 mL无菌离心管中,37 ℃摇床180 r/min震荡培养16 h;3500 g×5 min,无菌PBS清洗3遍,去除YEPD对生物膜形成的影响;10~15 mL RPMI1640培养液调节菌液浓度为1.0×106/mL;加入100 ?L菌液于聚苯乙烯96孔微量培养板37 ℃培养48 h,每个菌株设置3个复孔,RPMI1640培养液设置为阴性对照。阳性对照菌株为白念珠菌SC5314。
2.2 结晶紫(crystal violet,CV)染色法测定生物膜产量
近平滑念珠菌复合群在RPMI1640培养液中37 ℃培养48 h,去除培养液,PBS轻轻清洗3遍微孔板,加入200 ?L 1%CV溶液常温下避光处理10 min,PBS轻轻清洗3遍微孔板测定,加入200 ?L 33%冰乙酸溶解结晶紫,室温下避光处理10 min,聚苯乙烯96孔微量培养板在570 nm处测吸光度,在不同时间点实验重复3次。为消除背景颜色对吸光度的影响,样本孔A值均应减去阴性对照孔A值。生物膜产量是根据测得的A值:A样本孔
2.3 XTT法测定生物膜代谢活性
近平滑念珠菌复合群在RPMI1640培养液中37 ℃分别培养6、12、24、48、72和96 h,PBS轻轻清洗3遍微孔板,加入200 ?L 0.05mg/mL XTT染液37 ℃培养箱避光处理3 h,测定聚苯乙烯96孔微量培养板在492 nm处吸光度值,实验重复3次。生物膜代谢活性定义:A阴性对照
2.4 扫描电子显微镜下观察近平滑念珠菌复合群生物膜形成特点
按实验“2.1”方法进行生物膜形成的准备,12孔板中加入无菌直径为10 mm圆形盖玻片,每孔加入1 mL菌液37 ℃培养48 h,每24 h更换培养基,PBS贴壁加入清洗3遍,2.5%戊二醛室温固定16 h,用30%、40%、50%、60%、70%、80%、90%和100%无水乙醇梯度脱水各10 min,六甲基二硅胺烷干燥20 min,高真空离子溅射仪对样品表面30 mA,30 s进行镀金,在场发射扫描电子显微镜下观察近平滑念珠菌复合群生物膜形成特点。
2.5 标准浓度氟康唑对近平滑念珠菌复合群生物膜的影响
按“2.1”进行近平滑念珠复合群生物膜形成的准备,在96孔板中调整氟康唑浓度为标准浓度
1 ?g/mL,每孔加入100 ?L氟康唑溶液,对照孔中加入100 ?L RPMI1640培养液,后续再按实验方法“2.3”进行3次,测定近平滑念珠菌复合群在492 nm处吸光度,分析氟康唑对近平滑念珠菌复合群生物膜代谢活性的影响。
2.6 统计分析
由于测得的数据符合定量资料的非参数检验,因此选用秩和检验对结果进行分析。且生物膜的两种特性的相关性选择Pearson相关性分析,按P=0.05 可认为差异有统计学意义,数据分析使用SPSS 24.0软件。
3 结果
3.1 CV法分析近平滑念珠菌复合群生物膜产量的差异
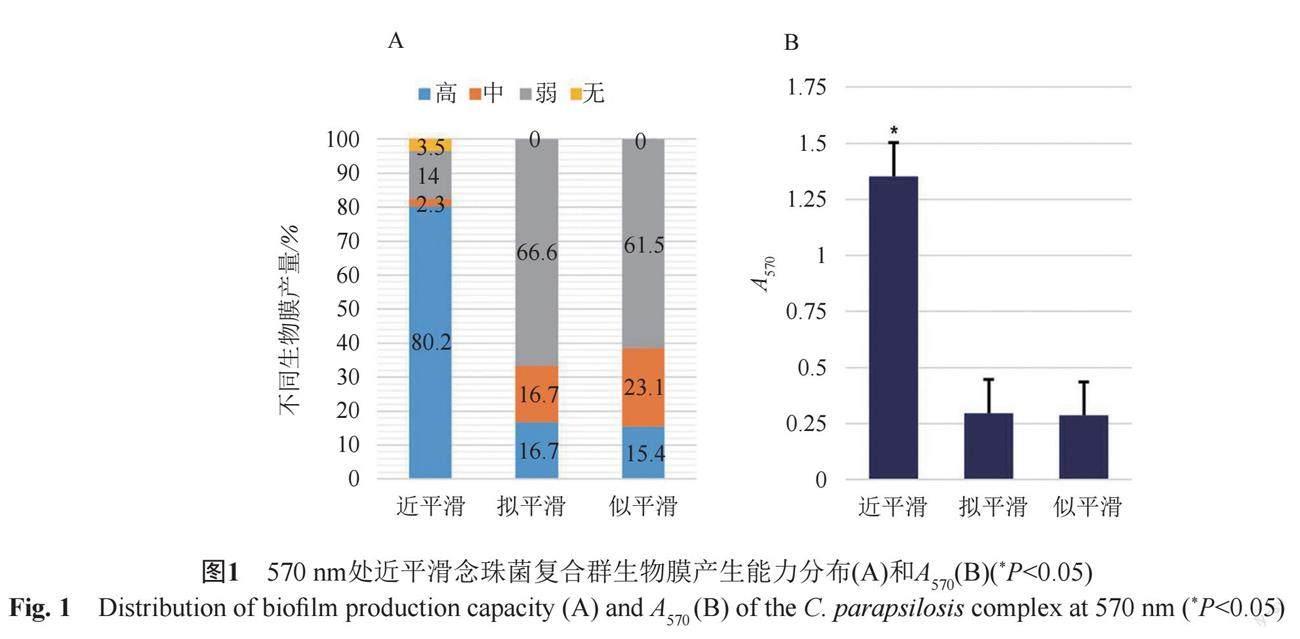
通过CV方法比较近平滑念珠菌复合群生物膜产量之间差异,111株近平滑念珠菌复合群中,73(65.8%)株为强生物膜产生者,8(7.2%)株为中生物膜产生者,27(24.3%)株为弱生物膜产生者,仅3(2.7%)株尿液分离来源近平滑念珠菌无生物膜产生,其余均可产生生物膜,如图1A。近平滑念珠菌复合群中,近平滑念珠菌的生物膜产生能力强于拟平滑念珠菌和似平滑念珠菌,差别有统计学意义(Z=30.555,P=0.000<0.05),如图1B。就不同分离部位而言,血液分离来源的近平滑念珠菌与其他分离来源的近平滑念珠菌比较,生物膜产生能力最弱(Z=-2.093,P=0.036<0.05),其他分离部位来源近平滑念珠菌之间无明显差异(P>0.05)。
3.2 XTT法分析近平滑念珠菌复合群之间生物膜代谢活性的差异
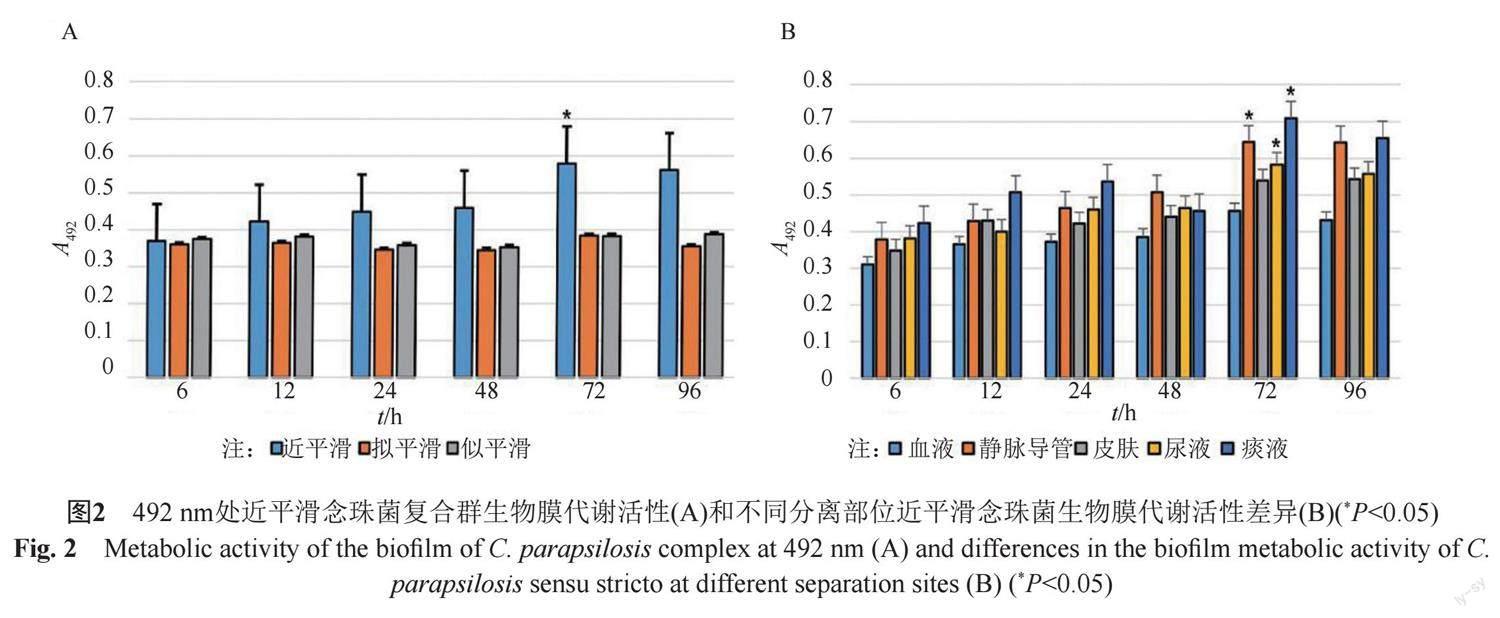
通过XTT法比较不同时间段近平滑念珠菌复合群生物膜代谢活性之间差异,拟平滑念珠菌和似平滑念珠菌在不同时间段(6、12、24、48、72和96 h)生物膜代谢活性均无明显差异(P>0.05)。近平滑念珠菌从6 h到72 h时吸光度值不断升高(P<0.05),近平滑念珠菌生物膜代谢活性在72 h达最高(P<0.05),96 h时近平滑念珠菌吸光度值反而降低(P>0.05)。近平滑念珠菌复合群在6 h时生物膜代谢活性差异无统计学意义(Z=3.571,P=0.168>0.05),从12 h到72 h时,近平滑念珠菌代谢活性高于拟平滑念珠菌和似平滑念珠菌(P<0.05),如图2A。血液分离来源的近平滑念珠菌吸光度在各个时间段均最低(P>0.05),除皮肤表面分离的近平滑念珠菌吸光度值在96 h达最高(P>0.05),其余分离部位近平滑念珠菌均在72 h时吸光度达最高(P<0.05),如图2B。拟平滑念珠菌和似平滑念珠菌的菌株数过少无法比较不同分离部位之间生物膜代谢活性的差异。近平滑念珠菌复合群生物膜产量和代谢活性之间的相关系数r=0.826(P<0.05)。
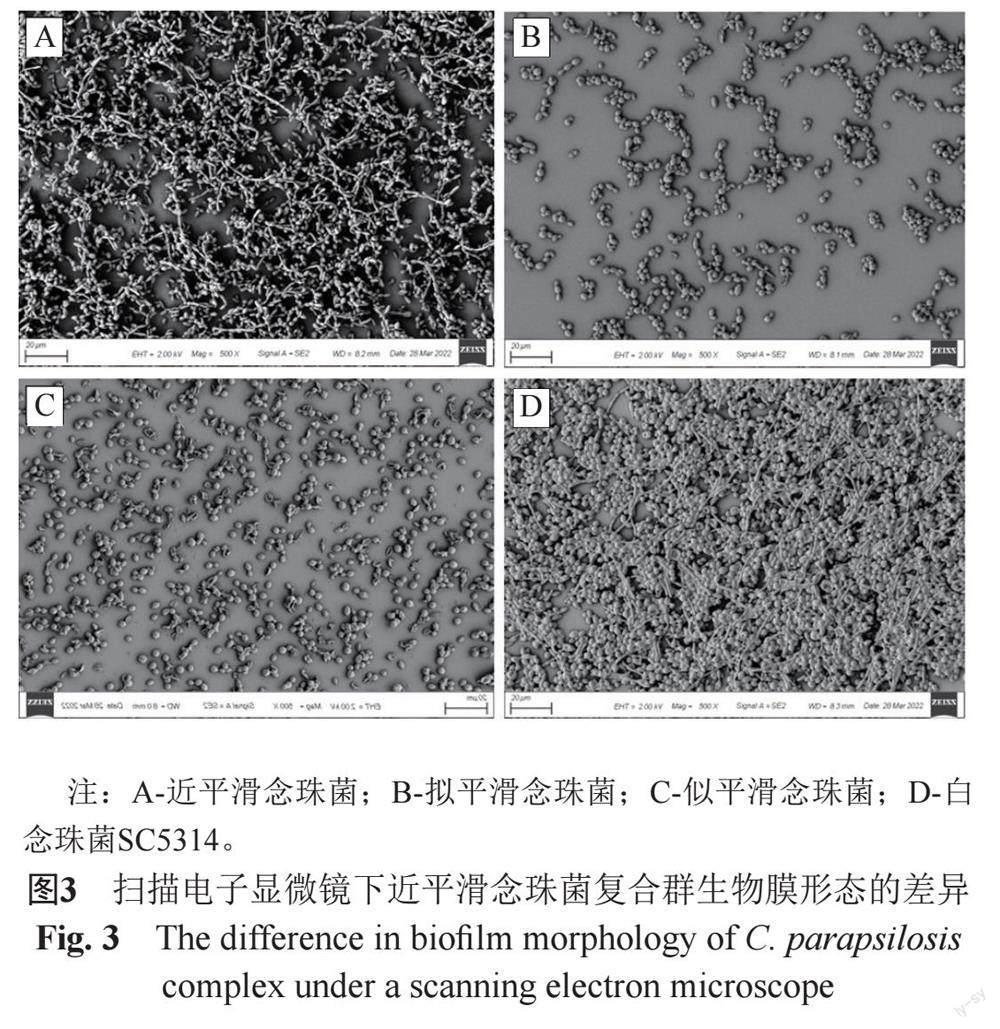
3.3 扫描电子显微镜下观察近平滑念珠菌复合群生物膜形成的差异
如图3所示,近平滑念珠菌复合群在12孔板中培养48 h后在扫描电子显微镜下呈现出不同的形态差异。近平滑念珠菌生物膜由多层厚厚的酵母细胞聚集而成,酵母细胞多为椭圆形、长条形,大小各异,表面发生轻微皱缩,呈疏松网织状生长,其间穿插着假菌丝,拟平滑念珠菌的酵母细胞呈现出堆积式生长,酵母细胞数量较少,由椭圆形、扁平状酵母细胞组成,细胞表面也发生了皱缩,似平滑念珠菌的生物膜表现为单层单个酵母细胞生长方式,扁平状细胞较拟平滑念珠菌增多,细胞表面皱缩明显,和近平滑念珠菌相比,拟平滑念珠菌和似平滑念珠菌生物膜的酵母细胞数量明显减少,并且无假菌丝形成,白念珠菌SC5314生物膜呈多层密集式生长,细胞数量多,形态饱满,近似圆形,较规则,表面光滑,菌丝较长,形成紧密连接的生物膜结构。
3.4 标准浓度氟康唑对近平滑念珠菌复合群不同阶段生物膜代谢活性的影响
本实验中使用氟康唑浓度为1 μg/ml,研究其对近平滑念珠菌复合群不同时间段生物膜代谢活性的抑制作用,如图3所示。1 μg/mL濃度氟康唑对近平滑念珠菌复合群不同阶段的生物膜代谢活性均可产生抑制作用(P<0.05),3种菌在生物膜形成的早期(6~12 h)时氟康唑的抑制作用较弱,48 h时抑制作用最强,当时间达72 h时吸光度值逐渐升高,对生物膜代谢活性的抑制作用开始减弱,对于近平滑念珠菌,氟康唑作用后48 h生物膜代谢活性最弱(χ2=39.5,P=0.00<0.05),差异有统计学意义,而拟平滑念珠菌和似平滑念珠菌在各时间段吸光度值在0.08~0.15范围内(χ2=-5.25,P=0.068>0.05),差异无统计学意义。
4 讨论
生物膜是侵袭性真菌或细菌重要的毒力因子,由酵母细胞和菌丝聚集的细胞外基质构成,真菌或细菌可黏附并定植于宿主黏膜或医疗生物材料表面后形成生物膜,当生物膜成熟后可播散,在宿主内形成侵袭性传播。同时,产生生物膜菌株可增强对宿主吞噬细胞和抗真菌药物的抵抗力。目前研究多为白念珠菌生物膜,但随着导管的长期置入,恶性肿瘤和免疫抑制剂等破坏患者的免疫调节能力,近些年来近平滑念珠菌复合群的临床感染率呈现逐年上升的趋势[13-14],而对近平滑念珠菌复合群的毒力特点研究较少。本研究收集了111株近平滑念珠菌复合群菌株,培养48 h后用CV法检测近平滑念珠菌复合群生物膜产量的差异,本研究发现除了3株(2.7%)尿液分离的近平滑念珠菌无生物膜产生,其余均可产生生物膜,其中近平滑念珠菌生物膜产生能力最强,拟平滑念珠菌和似平滑念珠菌生物膜产生能力无差异,通过扫描电子显微镜下观察同样发现近平滑念珠菌生物膜产量较拟平滑念珠菌和似平滑念珠菌高,与CV法具有协同意义。Pakshir等[15]的研究显示部分近平滑念珠菌无生物膜产生,和本实验一致,而Modiri等[16]的研究发现近平滑念珠菌复合群均可产生生物膜,拟平滑念珠菌比近平滑念珠菌生物膜产生速度更快,但近平滑念珠菌生复合群生物膜产量在48 h时无明显差异,但此研究未进一步说明不同分离部位之间产生生物膜特点的差异。Song等[17]研究发现分离自医护人员手表面的拟平滑念珠菌和似平滑念珠菌无生物膜产生,Ataides等[18]的研究发现分离自血液和指甲的近平滑念珠菌复合群中似平滑念珠菌的生物膜形成能力高于近平滑念珠菌和拟平滑念珠菌。Lattif等[19]的研究表明分离自硅胶表面的近平滑念珠菌复合群均可产生生物膜。血流感染是侵袭性念珠菌最严重的感染形式,其致死率最高[20],但本研究发现血液分离的近平滑念珠菌的生物膜产生能力最弱。考虑生物膜的形成必须先黏附于宿主黏膜或生物材料如静脉导管、导尿管等表面,因此血液中处于悬浮和流动状态下的近平滑念珠菌细胞不利于生物膜的形成。而Santos等[21]的研究显示分离自血液的近平滑念珠菌复合群均可产生生物膜,且在培养基中添加葡萄糖时近平滑念珠菌复合群生物膜的代谢活性增高,原因可能是与近平滑念珠菌复合群在高糖、高脂的环境下易形成生物膜同时血液流动减慢有关。
XTT是检测生物膜代谢活性的半定量方法,它进入活细胞内后,在活细胞内经过线粒体脱氢酶的还原后被DMSO溶解,通过测量570 nm处吸光度的变化间接反映生物膜的代谢活性[22]。由于XTT及还原产物的水溶性好,对生物膜的结构和代谢活性影响较小,可以达到简便快速检测生物膜的目的。生物膜的生长分为3个阶段,早期(0~12 h),中期(12~30 h),成熟期(31~72 h)[23],本研究发现近平滑念珠菌的生物膜代谢活性最强,在72 h时生物膜代谢活性达最高,96 h时代谢活性反而降低,而拟平滑念珠菌和似平滑念珠菌在各个时间段的代谢活性均弱,且两者无明显差异,无论是否是强生物膜产生菌株。而Modiri等[16]的研究表明拟平滑念珠菌的生物膜代谢活性在24 h达最高,并且大于近平滑念珠菌的代谢活性,而近平滑念珠菌的代谢活性在48 h达最高,似平滑念珠菌代谢活性最低。Trevi?o-Rangel等[24]的研究发现拟平滑念珠菌的代谢活性最高,而近平滑念珠菌和似平滑念珠菌的代谢活性均低,且两者无明显差异。本研究发现近平滑念珠菌中生物膜产生能力强者的代谢活性强,在72 h达最高(P<0.05),生物膜产生能力弱者各时间段的生物膜代谢活性均弱,在48 h达最高(P>0.05),但对于拟平滑念珠菌来说,无论生物膜产生能力强或者弱,生物膜代谢活性均弱。由此我们可知,不同菌株的生物膜产量和代谢活性不同,相同菌株在不同的生长条件下的生物膜产量和代谢活性也有差别,相同菌株在不同附着材料表面形成的生物膜也有差异。
氟康唑由于其抗菌效果好、价格便宜等优点成为临床最常用的抗真菌药物之一,生物膜利用其细胞外基质成分减少抗菌药物的渗透从而增强菌株的耐药性。本研究中氟康唑对不同时间段的近平滑念珠菌生物膜代谢活性均有抑制,但早期(6~12 h)抑制作用较弱,48 h达最强,生物膜成熟后期(72~96 h)抑制作用逐渐减弱,表明在生物膜形成中期时氟康唑的抑制作用最强,早期和成熟后期抑制作用较弱,可能的原因是氟康唑是抑菌药,并不能完全抑制生物膜的生长。Kaneko等[25]的研究發现氟康唑对白念珠菌生物膜的抑制作用在早期(5 h)时较弱,达10 h时抑制作用增强,对生物膜的抑制作用有延迟效果,和本研究一致,而Kawai等[26]的研究却表明氟康唑对非白念珠菌生物膜没有抑制作用,因此对于氟康唑对生物膜的抑制作用仍需进一步研究。
针对本研究中,CV法测定的是96孔板上近平滑念珠菌复合群所有细胞的生物膜,包括活细胞和死细胞,而XTT法仅测定活细胞的生物膜,因此CV法的敏感性更高,XTT法的特异性更强。本研究利用两种方法发现近平滑念珠菌复合群各菌种生物膜产量和代谢活性之间存在相关,差异有统计学意义性(r=0.826,P<0.05)。而在Ramage[27]的研究中发现两种方法表现的是近平滑念珠菌复合群生物膜的两种不同特性,两者不存在协同作用。本实验中的拟平滑念珠菌和似平滑念珠菌菌株数量较少,近平滑念珠菌各个分离部位的菌株量也有差异,这些均可能影响试验结果和重复试验的一致性。未来的试验将增大样本量进一步研究近平滑念珠菌复合群之间生物膜的特点,不同分离部位来源的菌株生物膜产生是否有区别以及产生这种差异的机制。
参 考 文 献
Nucci M, Queiroz-Telles F, Alvarado-Matute T, et al. Epidemiology of candidemia in Latin America: A laboratory-based survey[J]. PLoS One, 2013, 8(3): e59373.
Bustamante B, Martins M A, Bonfietti L X, et al. Species distribution and antifungal susceptibility profile of Candida isolates from bloodstream infections in Lima, Peru[J]. J Med Microbiol, 2014, 63(Pt 6): 855-860.
de Paula Menezes R, de Oliveira Melo S G, Bessa M A S, et al. Candidemia by Candida parapsilosis in a neonatal intensive care unit: Human and environmental reservoirs, virulence factors, and antifungal susceptibility[J]. Braz J Microbiol. 2020, 51(3): 851-860.
Haciseyito?lu D, ?a? Y. An outbreak of candidemia due to Candida parapsilosis in an adult intensive care unit[J]. Infez Med. 2019, 27(4): 403-409.
Qi L, Fan W, Xia X, et al. Nosocomial outbreak of Candida parapsilosis sensu stricto fungaemia in a neonatal intensive care unit in China[J]. J Hosp Infect. 2018, 100(4): e246-e252.
Mesini A, Mikulska M, Giacobbe D R, et al. Changing epidemiology of candidaemia: Increase in fluconazole-resistant Candida parapsilosis[J]. Mycoses. 2020, 63(4): 361-368.
Khan Z, Ahmad S, Al-Sweih N, et al. Changing trends in epidemiology and antifungal susceptibility patterns of six bloodstream Candida species isolates over a 12-year period in Kuwait[J]. PLoS One, 2019, 14(5): e0216250.
Tavanti A, Davidson A D, Gow N A. Candida orthopsilosis and Candida metapsilosis spp. nov. to replace Candida parapsilosis groups II and III[J]. J Clin Microbiol, 2005, 43(1): 284-92.
Potera C. Forging a link between biofilms and disease[J]. Science, 1999, 283(5409): 1837-1839.
Dongari-Bagtzoglou A, Kashleva H, Dwivedi P, et al. Characterization of mucosal Candida albicans biofilms[J]. PLoS One, 2009, 4(11): e7967.
OToole G A. Microtiter dish biofilm formation assay[J]. J Vis Exp, 2011, (47): 2437.
da Silva WJ, Seneviratne J, Parahitiyawa N, et al. Improvement of XTT assay performance for studies involving Candida albicans biofilms[J]. Braz Dent J, 2008, 19(4): 364-369.
Rajendran R, Sherry L, Nile C J, et al. Biofilm formation is a risk factor for mortality in patients with Candida albicans bloodstream infection-Scotland, 2012—2013[J]. Clin Microbiol Infect, 2016, 22(1): 87-93.
Zoppo M, Poma N, Di Luca M, et al. Genetic manipulation as a tool to unravel Candida parapsilosis species complex virulence and drug resistance: State of the art[J]. J Fungi (Basel), 2021, 7(6): 459.
Pakshir K, Ravandeh M, Khodadadi H, et al. Evaluation of exoenzyme activities, biofilm formation, and co-hemolytic effect in clinical isolates of Candida parapsilosis species complex[J]. J Glob Infect Dis, 2018, 10(3): 163-165.
Modiri M, Khodavaisy S, Barac A, et al. Comparison of biofilm-producing ability of clinical isolates of Candida parapsilosis species complex[J]. J Mycol Med, 2019, 29(2): 140-146.
Song J W, Shin J H, Shint D H, et al. Differences in biofilm production by three genotypes of Candida parapsilosis from clinical sources[J]. Med Mycol, 2005, 43(7): 657-661.
Ataides F S, Costa C R, Santos A S, et al. In vitro characterization of virulence factors among species of the Candida parapsilosis complex[J]. Rev Soc Bras Med Trop, 2020, 53: e20190336.
Lattif A A, Mukherjee P K, Chandra J, et al. Characterization of biofilms formed by Candida parapsilosis, C. metapsilosis, and C. orthopsilosis[J]. Int J Med Microbiol, 2010, 300(4): 265-270.
Mensa J, Pitart C, Marco F. Treatment of critically ill patients with candidemia[J]. Int J Antimicrob Agents, 2008, 32(2): S93-S97.
Santos F A G D, Leite-Andrade M C, Brand?o I S, et al. Anti-biofilm effect by the combined action of fluconazole and acetylsalicylic acid against species of Candida parapsilosis complex[J]. Infect Genet Evol, 2020, 84: 104378.
Ramage G, Vande Walle K, Wickes B L, et al. Standardized method for in vitro antifungal susceptibility testing of Candida albicans biofilms[J]. Antimicrob Agents Chemother, 2001, 45(9): 2475-2479.
Wall G, Montelongo-Jauregui D, Vidal Bonifacio B, et al. Candida albicans biofilm growth and dispersal: Contributions to pathogenesis[J]. Curr Opin Microbiol, 2019, 52: 1-6.
Trevi?o-Rangel Rde J, Rodríguez-Sánchez I P, Rosas-Taraco AG, et al. Biofilm formation and genetic variability of BCR1 gene in the Candida parapsilosis complex[J]. Rev Iberoam Micol, 2015, 32(3): 180-184.
Kaneko Y, Miyagawa S, Takeda O, et al. Real-time microscopic observation of Candida biofilm development and effects due to micafungin and fluconazole[J]. Antimicrob Agents Chemother, 2013, 57(5): 2226-2230.
Kawai A, Yamagishi Y, Mikamo H. In vitro efficacy of liposomal amphotericin B, micafungin and fluconazole against non-albicans Candida species biofilms[J]. J Infect Chemother, 2015, 21(9): 647-653.
Ramage G. Comparing apples and oranges: Considerations for quantifying candida biofilms with XTT [2,3-bis(2-methoxy-4-nitro-5-sulfo-phenyl)-2H-tetrazolium-5-carboxanilide] and the need for standardized testing[J]. J Med Microbiol. 2016; 65(4): 259-260.
