利福平致小鼠非酒精性脂肪性肝炎作用机理研究
2023-03-13曾青山赵丰娟张莉王淳李晓媛杜仕静华晓萍黄利张媛谭正怀
曾青山 赵丰娟 张莉 王淳 李晓媛 杜仕静 华晓萍 黄利 张媛 谭正怀
摘要:目的 利福平為一线抗结核药物,可诱导非酒精性脂肪性肝炎(NASH),但其相关作用机理有待进一步阐明。
方法 幼年小鼠在出生后第二天皮下注射谷氨酸钠(monosodium glutamate, MSG)5 g/kg以诱导肥胖、胰岛素抵抗的肥胖小鼠,用于考察利福平致小鼠NASH与胰岛素抵抗的相关性;采用静脉注射氯膦酸脂质体剔除小鼠肝脏Kupffer细胞,观察Kupffer细胞在利福平致小鼠NASH中的作用。结果 MSG小鼠在50 d龄时明显肥胖,Lees指数显著增加,肝脏脂质轻度堆积、肝功能轻度受损,肝脏组织病理出现轻微的炎症反应。连续灌胃利福平600、300和150 mg/kg 7 d可引起正常小鼠和肥胖小鼠肝功能受损,肝脏发生NASH样病理改变,对肥胖小鼠的作用明显强于正常小鼠。注射脂质体剔除肝脏Kupffer细胞小鼠体重降低并伴随着轻微的肝损伤,但未影响肝脏中TG和TC的含量;利福平可使Kupffer细胞剔除小鼠可使其体重降低,肝脏发生NASH样改变,但与正常小鼠相比并无明显差异。结论 研究结果表明利福平所致小鼠肝脏NASH变化与胰岛素抵抗及肝脏脂质堆积程度、肝组织功能状态密切相关,这些作用与Kupffer细胞无明显关联,提示利福平在临床用于结核病治疗时应加强检测患者肝功能及脂肪肝,有利于预防利福平所致的肝损伤。
关键词:利福平;胰岛素抵抗;小鼠;Kupffer细胞;氯膦酸脂质体;非酒精性脂肪性肝炎
中图分类号:R978.1文献标志码:A
Study on the mechanism of rifampicin induced non-alcoholic steatohepatitis in mice
Zeng Qingshan1,2, Zhao Fengjuan2,3, Zhang Li2, Wang Chun1,2, Li Xiaoyuan2,
Du Shijing2, Hua Xiaoping2, Huang Li2, Zhang Yuan2, and Tan Zhenghuai2
(1 Chengdu University of Traditionnal Chinese Medicine, Chengdu 610072; 2 Sichuan Academy of Chinese Medicine Science, Chengdu 610041; 3 Southwest Medical University, Luzhou 646000)
Abstract Objective Rifampicin is a first-line anti-tuberculosis drug, which can induce non-alcoholic steatohepatitis(NASH), but its mechanism remains to be further elucidated. Methods Juvenile mice were injected subcutaneously with monosodium glutamate (MSG) 5 g/kg on the second day after birth to induce obese and insulin-resistant obese mice, for examining the correlation between rifampicin-induced NASH and insulin resistance. the role of Kupffer cells in rifampicin-induced NASH in mice was observed using intravenous clodronate liposome excision of mouse liver Kupffer cells. Results At the age of 50 days, MSG mice were significantly obese, with a significant increase in Lees index, mild accumulation of liver lipids, mildly impaired liver function, and the liver pathology showed slight inflammatory reaction. Continuous gavage of rifampicin at 600, 300 and 150 mg/kg for 7 days could cause liver function damage and Nash-like pathological changes in the liver of normal and obese mice, and the effect on obese mice was significantly stronger than that in normal mice. Mice which Liposome knockout Kupffer cell decreased body weight and accompanied with mild liver injury, but did not affect the contents of TG and TC in the liver. Rifampicin could reduce body weight and NASH-like changes in the liver of Kupffer cell mice, but there was no significant difference compared with normal mice. Conclusion The results showed that the changes of liver NASH in mice caused by rifampicin were closely related to insulin resistance and the degree of hepatic lipid accumulation and functional status of liver tissues, and these effects were not significantly associated with Kupffer cells, It is suggested that rifampicin should be strengthened to detection of liver function and fatty liver when used clinically for tuberculosis treatment, which is beneficial to prevent rifampicin-induced liver injury.
Key words Rifampicin; Insulin resistance; Mice, Kupffer cells; Clodronate liposomes; Non-alcoholic steatohepatitis
据世界卫生组织估计,每年因结核病死亡的人数达到数百万,中国、印度是重灾区;近年来,我国因结核病死亡的人数在80万~120万,其主要流行病株为耐利福平菌株[1]。利福平(rifampicin,RFP)为利福霉素B衍生物,是抗结核一线药物,但长期大剂量服用可引起严重肝损伤,严重者不得不中断治疗,后者可引起耐药菌株出现[2-3]。前期本项目研究发现短期、大剂量给予利福平即可诱导肝损伤,肝脏发生明显的脂肪变,甚至发展成非酒精性脂肪肝炎(non-alcoholic steatohepatitis,NASH)[4],但其作用机理还没有完全阐明。
NASH是非酒精性脂肪性肝病 ( nonalcoholic fatty liver disease,NAFLD) 从脂肪变性发展到肝纤维化的进展阶段,主要病理特征表现为肝脏脂肪过度堆积、肝脏炎症,可伴有纤维化[5]。据统计,NAFLD发病率大多在25%以上[6]。从NAFLD发展到NASH的机理至今没有得到系统阐明。早期“二次”打击学说(two-hit hypothesis)认为胰岛素抵抗(IR)在NASH的发生、发展中起着非常重要的作用 [7]。但近年学术界更为认同多种平行打击假说(The multiple parallel hits hypothesis):炎症可以促进脂肪肝的形成,NASH反应了一种紧跟在炎症之后的脂肪肝性疾病,也可能NAFL是抗脂毒性失败的结果[8]。
胰岛素抵抗与三大物质代谢密切相关,但胰岛素抵抗是否参与了利福平致小鼠脂肪肝作用,目前未见相关报道。在小鼠出生时,皮下注射适量谷氨酸钠损伤大脑弓状核摄食中枢及产热中枢,可诱导小鼠产生代谢紊乱,逐渐肥胖并出现胰岛素抵抗[9]。为此,本文拟比较研究利福平致正常小鼠和肥胖小鼠NASH作用,以希从中阐明肝脏脂质堆积以及胰岛素抵抗在NASH发生、发展中的重要作用。
肝脏Kupffer细胞作为人体中最大的巨噬细胞储存库,在肝脏炎症以及纤维化形成中发挥着重要作用,但是否参与了利福平诱导小鼠NASH,目前还未见相关报道。为此,本文采用静脉注射氯磷酸钠脂质体以定向清除肝脏中的Kupffer细胞,以期发现Kupffer细胞在利福平诱导NASH中的作用。
1 材料和方法
1.1 实验药物和试剂
一水L-谷氨酸钠,批号20191008,BR(国药集团化学试剂有限公司),用生理盐水配制成所需浓度的溶液备用;利福平,胶囊剂,每粒0.15 g,批号211010(成都锦华药业有限责任公司),临用前将胶囊中粉末倒出研磨后,加入0.5% CMC-Na配制至相应浓度;生理盐水,批号B20093704(四川科伦药业股份有限公司);羧甲基纤维素钠(CMC-Na),批号2014102701,AR(成都市科龙化工试剂厂),临用前用超纯水配制成0.5%浓度的溶液备用;氯膦酸脂质体,SKU:C-105,浓度 5 mg/mL,规格 15 mL,批号 2022446(荷兰 Liposoma BV公司)。
1.2 生化检测试剂盒
肝组织检测:甘油三酯测定试剂盒(GPO-PAP法),批号2022001;胆固醇测定试剂盒(CHOD-PAP法),批号2022001(长春汇力生物有限公司)。
用于血清检测:丙氨酸氨基转移酶(ALT)测定试剂盒,批号0522022;天门冬氨酸氨基转移酶(AST)测定试剂盒,批号0322012;甘油三酯(TG)测定试剂盒,批号0122011;胆固醇(TC)测定试剂盒,批号1021031;总胆汁酸(TBA)测定试剂盒,批号1021041;直接胆红素(DBIL)测定试剂盒,批号0222012;总胆红素(TBIL)测定试剂盒,批号0222012;高密度脂蛋白胆固醇(HDL-C)测定试剂盒,批号1121041;低密度脂蛋白胆固醇(LDL-C)测定试剂盒,批号042031。以上试剂盒均购自新健康成生物股份有限公司。
1.3 实验仪器
电子天平(JA1003A,d=1 mg,e=10 d,上海龙腾电子仪器有限公司);电热鼓风干燥箱(TST101A-1B,成都特思特仪器有限公司);台式高速冷冻离心机(TGL-16,长沙湘仪离心机仪器有限公司);多功能酶标仪(Varioskan Flash ,美国Thermo公司);全自动生化分析仪(日立7180型,日本株式会日立高新技术)。
1.4 动物及环境
SPF级昆明种小鼠,由四川省中医药科学院实验动物中心提供,生产许可证号为SCXK(川)-2018-19,用于肥胖小鼠培育实验;由湖南斯莱克景达实验动物有限公司提供,生产许可证号为SCXK(湘)-2019-0004,用于Kupffer细胞缺乏实验。动物饲养于四川省中医药科学院实验动物中心屏障系统中,合格证号:SYXK(川)-2018-100,室温22 ℃~25 ℃,湿度50%±5%,明、暗各12 h,试验期间小鼠自由摄食和饮水。
1.5 方法
1.5.1 利福平诱导肥胖小鼠NASH作用研究
从乳鼠出生开始计为第1天,从第2天开始,一组乳鼠颈后皮下注射谷氨酸钠5 g/kg,另一組乳鼠颈后皮下注射生理盐水,注射体积均为0.2 mL/10 g。
隔天一次,连续给药3次。6~8周龄时用于实验研究。取正常小鼠,雌雄兼用,随机分为对照组、利福平600、300和150 mg/kg等实验组,每组数量分别为10、9、9和9只。另取肥胖小鼠,雌雄兼用,随机分为肥胖对照组、利福平600、300和150 mg/kg
等实验组,每组数量分别为10、9、9和10只。分别灌胃药物或等体积0.5%CMC-Na,1次/d,连续7 d。末次给药24 h并禁食不禁水16 h后,取血分离血清测谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、甘油三酯(triglyceride, TG)、 总胆固醇(serum total cholesterol, TC)、高密度脂蛋白胆固醇(high density liptein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low-density lipoproteins cholesterol, LDL-C)、总胆汁酸(total bile acid, TBA)、总胆红素(total bilirubin, TBIL)、直接胆红素(direct bilirubin, DBIL)水平; 取肝脏称湿重并计算其脏器指数,取部分肝脏组织置于-80 ℃冰箱中用于测定其 TC和TG含量。取肝大叶用10%甲醛固定进行组织病理学观察。
1.5.2 利福平诱导肝Kupffer细胞缺失小鼠NASH作用研究
选取体重为18~20 g的雄性KM小鼠,随机分为对照组、利福平300 mg/kg、脂质体、利福平300 mg/kg加脂质体,每组数量分别为10、8、9和9只。在实验开始第1天和第4天,各组动物分别静脉注射氯膦酸脂质体0.1 mL/10 g或等体积生理盐水。在第一次注射24 h后,分别灌胃药物或等体积0.5%
CMC-Na,1 次/d,连续7 d,末次给药后24 h并禁食不禁水16 h取血分离血清测ALT、AST、TG、TC、HDL、LDL、TBA、TBIL和DBIL的水平;取肝称湿重并计算脏器指数,取部分肝组织测TG和TC,另取肝大叶置于福尔马林中固定后进行组织学观察。
1.5.3 肝脏组织病理学评分
肝脏组织经10%福尔马林充分固定,梯度酒精脱水、石蜡包埋,制成3~5 μm病理切片,在光学显微镜下观察动物肝脏结构。参考文献[10]并结合本实验实际情况,拟定“肝细胞坏死”和“肝细胞脂肪变性”为观测指标。病变程度采用半定量分析[11]。
1.5.4 统计学方法
采用SPSS 22.0统计软件进行统计学分析,数据采用x±s表示,比较采用t检验和析因分析。
2 结果
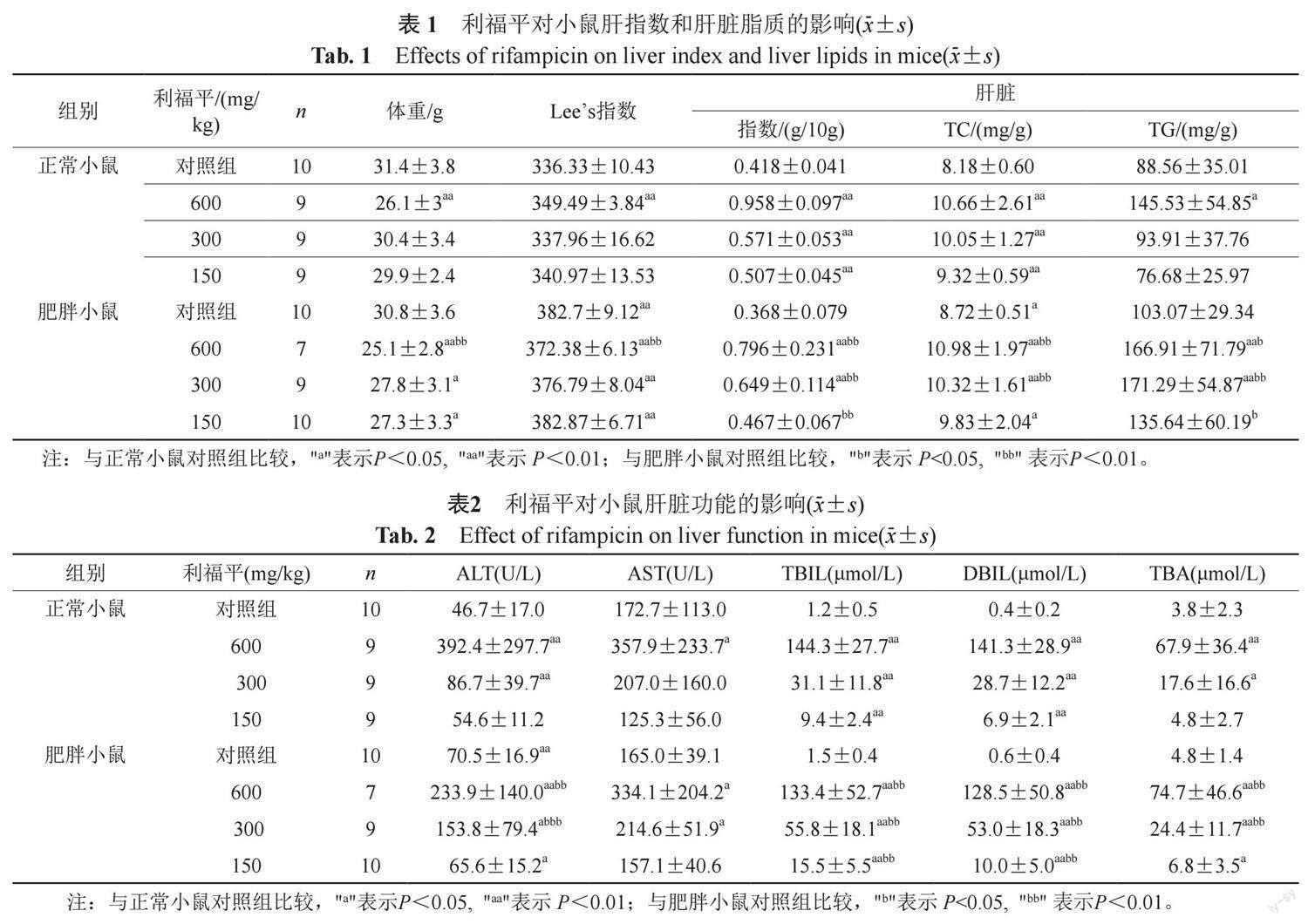
2.1 利福平对正常小鼠和肥胖小鼠肝指数和肝脏脂质的影响
肥胖小鼠在给予利福平600 mg/kg 3次后死亡了2只动物,其余各组动物在实验期间均未发生死亡。
由表1可见,肥胖小鼠Lees指数明显增加,肝脏指数有所减少,但肝脏脂质含量有所增加,利福平各剂量组均可程度相似地降低正常和肥胖小鼠体重,增加其肝脏脂质以及肝脏指数,其中利福平300和150 mg/kg增加肥胖小鼠肝脏TG的作用明显强于对正常小鼠的作用。与正常对照小鼠相比,肥胖小鼠各给药组小鼠Lee's指数、肝脏指数、肝脏TC和TG均明显增加,存在统计学差异。
2.2 利福平对正常小鼠和肥胖小鼠肝脏功能的影响
由表2可知,肥胖小鼠血清ALT水平升高,与正常小鼠比较差异具有统计学意义。利福平各剂量组均可损伤正常小鼠和肥胖小鼠肝脏功能,使其血清ALT、AST、TBIL、DBIL和TBA水平均显著升高,与各自的对照组存在明显的统计学差异。其中利福平300和150 mg/kg对肥胖小鼠的作用明显严重于正常对照组,组间比较差异具有统计学意义。
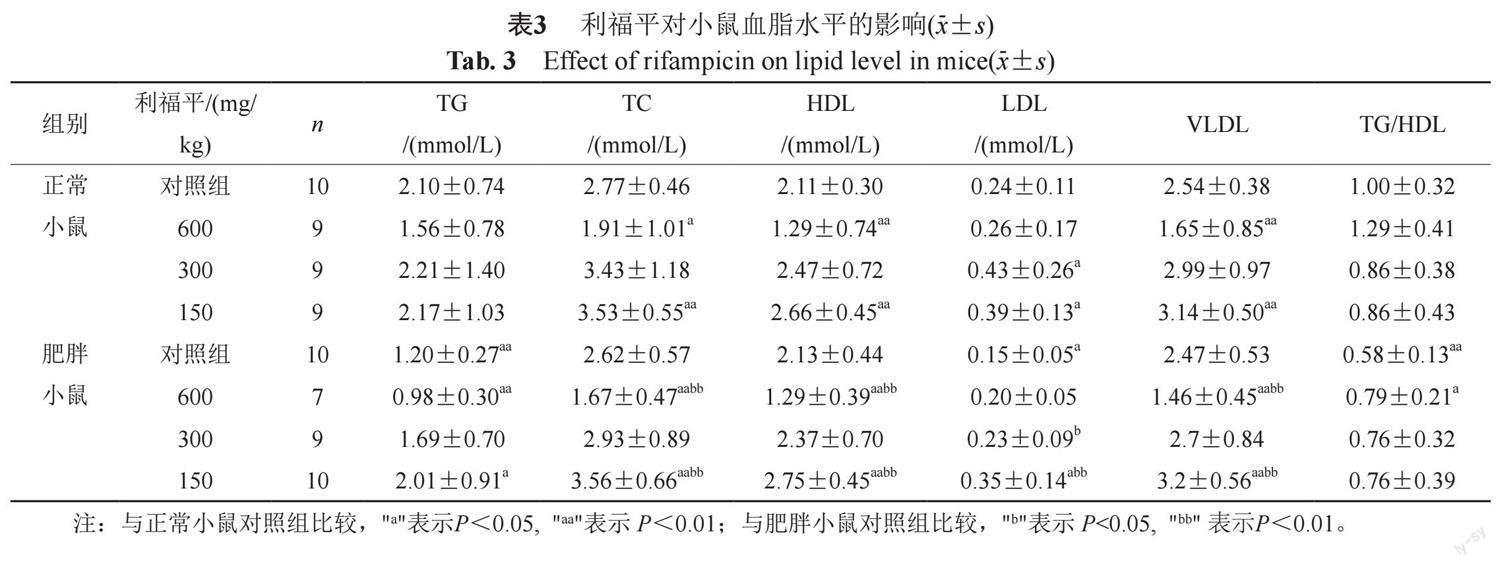
2.3 利福平对正常小鼠和肥胖小鼠血脂水平的影响
由表3可知,肥胖小鼠血清TG和LDL水平降低,TG/HDL比值降低,与正常小鼠比较差异具有统计学意义。利福平600 mg/kg可引起正常小鼠和肥胖小鼠血清TC、HDL和VLDL水平均降低,与各自的对照组存在明显差异。利福平150 mg/kg却可升高正常小鼠和肥胖小鼠血清TC、HDL、LDL和VLDL水平,与各自的对照组存在明显差异。
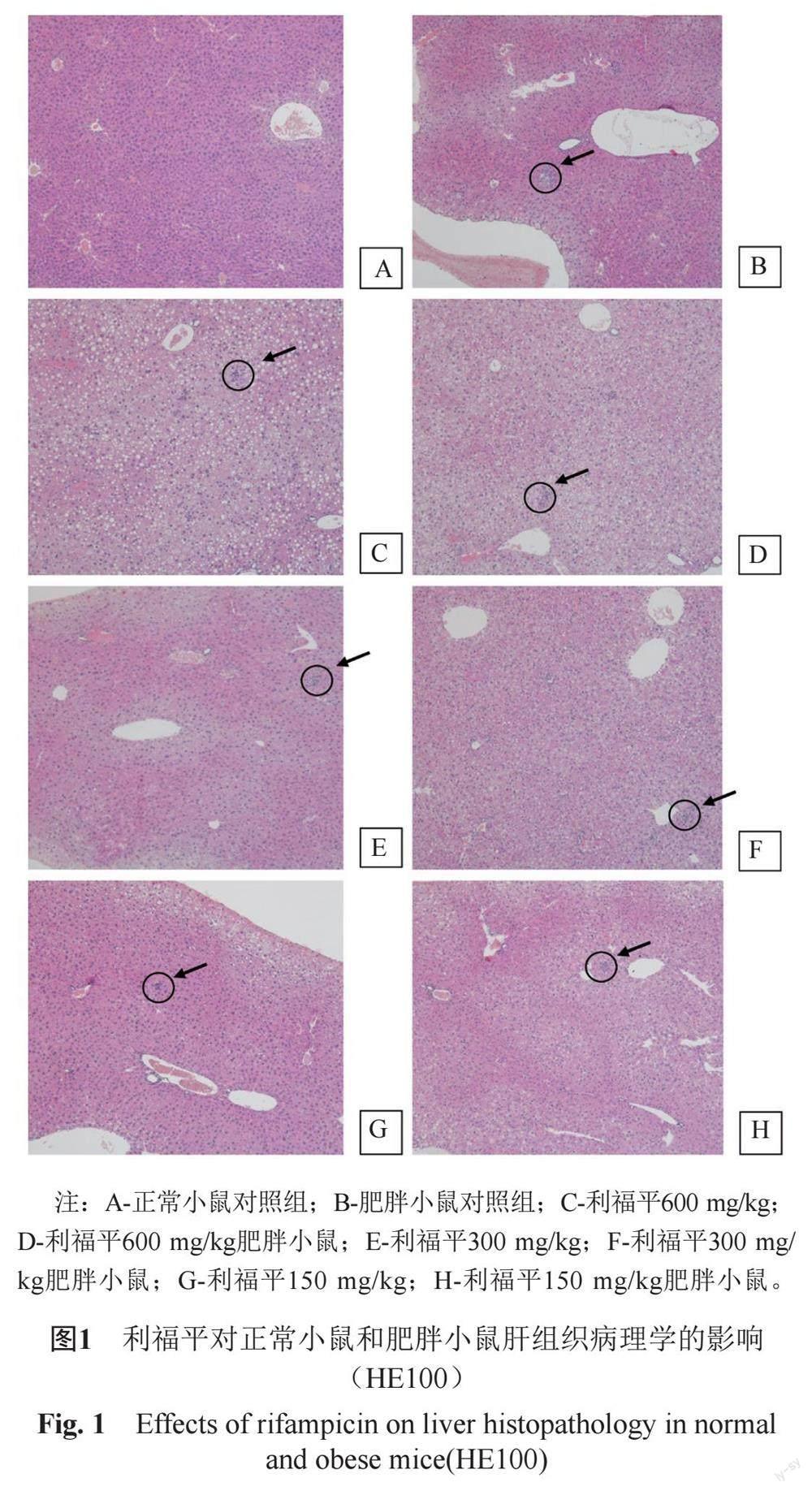
2.4 利福平对正常小鼠和肥胖小鼠肝脏病理组织学的影响
在显微镜下观察发现,对照组肝组织结构正常,肥胖组动物存在肝细胞轻度脂肪变性、少量肝细胞点状坏死伴炎细胞浸润,各给药组均可引起小鼠肝脏组织发生脂肪变性和肝细胞坏死,利福平对小鼠肝脏的损伤呈明显的剂量依赖性,相同剂量的利福平对肥胖小鼠肝脏的损伤作用明显强于正常小鼠(图1和表4)。
2.5 利福平与动物体质状态交互作用分析
从表5方差分析结果可以看出,肥胖小鼠在体重、肥胖指数、肝脏TG水平、血清ALT、TBIL、DBIL、TG、LDL以及TG/HDL水平起主要作用;利福平在肝脏指数、肝脏TC及TG水平、血清ALT、TBIL、DBIL、TBA、TC、HDL、LDL以及VLDL水平起主要作用;肥胖小鼠与利福平在肝脏指数、血清TBIL、DBIL水平存在明显的交互作用;而在肝脏TG水平、血清ALT水平存在明显的相加作用。
2.6 利福平对Kupffer细胞缺乏小鼠肝指数及肝脏脂质的影响
由表6可见,在注射脂质体、灌胃利福平,脂质体与利福平联用后,小鼠体重明显下降,与对照组比较差异具有统计学意义。灌胃利福平,可引起正常小鼠以及Kupffer细胞缺乏小鼠的小鼠肝指数、肝脏中的TG和TC明显升高,与对照组相比存在明显的差异。静脉注射脂质体引起小鼠Kupffer细胞缺乏对小鼠的肝脏指数、肝脏脂质均无明显影响,与对照组比较差异无统计学意义。
2.7 利福平對Kupffer细胞缺乏小鼠肝脏功能的影响
由表7可知,给药利福平1周后,小鼠ALT、AST、TBil、DBil和TBA含量均明显上升;静脉注射脂质体两次后,ATL、AST和TBA含量显著上升,DBil含量下降;脂质体和利福平联用后,小鼠ALT、AST、TBil、DBil和TBA含量均明显上升;与对照组比较差异具有统计学意义。
2.8 利福平对Kupffer细胞缺乏小鼠血脂水平的影响
由表8可知,给药利福平一周后,小鼠血清中TC含量和VLDL下降,LDL上升;静脉注射脂质体两次后,血清中TC、HDL和LDL含量显著上升,脂质体和利福平联用后,血清中LDL含量上升;与对照组比较差异具有统计学意义。
2.9 利福平对Kupffer细胞缺乏小鼠肝脏组织病理学的影响
小鼠灌胃利福平7 d后,可诱导肝细胞脂肪变性。小鼠尾静脉注射氯膦酸脂质体,可诱导轻度的肝细胞坏死伴炎细胞浸润。小鼠尾静脉注射氯膦酸脂质体后再给予利福平7 d,未见明确的肝细胞坏死,但肝细胞脂肪变性较单用利福平稍有加重。各组切片观察具体结果如图2。
2.10 利福平和脂质体对小鼠的交互作用分析
从表10方差分析结果可以看出,脂质体在小鼠体重、ALT、AST以及血脂水平变化起主要作用;而利福平在小鼠血脂TC、HDL以及VLDL水平、小鼠体重、肝脏指数、肝脏TG以及TC、肝脏功能指标上均起主要作用;脂质体与利福平在小鼠血清TG以及TG/HDL比值变化上存在明显的交互作用。
3 讨论
NASH的发病机理至今没有得到系统阐明,尽管NASH患者以肥胖者居多,但仍有大约25%的患者为“瘦子”;同样肝脏脂肪堆积以及血脂水平提高,在NASH的发生、发展中作用和地位所起的作用如何,至今无定论。本研究发现:初生小鼠皮下注射谷氨酸钠后50 d,其体型变得肥胖,Lees指数显著增加,其血清TG及LDL水平显著低于同年龄正常小鼠,肥胖小鼠肝脏少量肝细胞轻度脂肪变性、少量肝细胞点状坏死伴炎细胞浸润,肝脏生化检测发现其TG、TC含量显著增加,但其血中TG水平降低,TG/HDL比值显著降低,肝功能受損,肝脏处理TG的能力显著下降。利福平大剂量可引起小鼠血清脂质(TG和TC)降低(对正常小鼠或肥胖小鼠),显著增加肝脏脂质特别是TG水平,肝脏组织及功能受损,对肥胖动物的作用明显强于正常小鼠,在利福平300 mg/kg表现最为明显(高剂量的敏感性可能与其有动物死亡有关),说明胰岛素抵抗以及肝脏脂肪堆积在利福平所致NASH中发挥了重要作用。
Kupffer细胞作为人体中最大的巨噬细胞储存库,当肝脏受损伤时,Kupffer细胞活化,具有吞噬活性并分泌促炎症细胞因子和活性氧,致使肝脏形成最早的肝脏脂质沉积和肝损伤。因此耗竭Kupffer细胞可引起炎症细胞因子的表达减少,炎症和肝细胞死亡(坏死性炎症)减弱[12]。但在一项对喂养高脂奶粉的小鼠的研究中,Kupffer细胞的耗竭减少肝脏内前列腺素E2(PGE2)的释放,减弱了对胰岛素的反应,导致肝脏脂质合成增加,增强了肝脏中脂肪的含量[13]。
氯膦酸盐(Cl2MBP)是一种亲水性分子,当氯膦酸盐包裹在脂质体中时,巨噬细胞通过胞吞摄取脂质体,随后在磷脂酶介导下破坏脂质体双层,并在细胞内释放C12MDP,将不可逆地损伤诱导巨噬细胞凋亡[14]。
本次实验中,有两只肥胖小鼠在灌胃利福平600 mg/kg3次后出现死亡,解剖后发现气管、胃和肺组织均未出现损伤,但肝组织存在严重的损伤效果。后期其他同组动物血清和切片检测也发现利福平600 mg/kg组小鼠存在严重肝损伤,ALT和AST含量远高于肥胖小鼠其他给药组,推测死亡小鼠可能是肝损伤过于严重,加上多次给药加重了损伤效果导致了死亡,提示利福平对肥胖动物的敏感性高于正常小鼠,与肝损伤结果一致,可进一步佐证研究结论。
本文研究发现注射氯膦酸脂质体后,小鼠体重下降,其血清ALT、AST和TBA水平显著升高,肝组织炎症反应加重,但对肝脏中脂质含量无影响,提示注射氯膦酸脂质体这种剔除Kupffer细胞的方法会对肝组织以及功能造成一定的影响,但没有参与NASH早期阶段的发生和发展;利福平用于Kupffer细胞剔除小鼠,同样会引起肝脏发生相似程度的NASH样改变,且其程度有明显加重的趋势,这种作用趋势可能与氯膦酸脂质体清除Kupffer细胞所引起的肝损伤有关,也表明利福平致小鼠NASH变化与肝脏Kupffer细胞无明显关联。
综上所述,利福平所致NASH作用与胰岛素抵抗、肝脏脂质堆积程度密切相关,与肝组织功能状态密切相关,但与Kupffer细胞无明显关联。提示利福平在临床用于结核病治疗时应增加检测患者肝功能以及脂肪肝,对于预防利福平所致的肝损伤具有重要的参考价值。
参 考 文 献
卢春容, 房宏霞, 陆普选,,等. WHO 2021年全球结核病报告: 全球与中国关键数据分析[J]. 新发传染病电子杂志, 2021, 6(4): 368-372.
张刚, 陈磊, 陈静, 等. 不同剂量利福平致小鼠肝损伤特点的研究[J]. 局解手术学杂志, 2017, 26(4): 244-247.
金兆鑫, 宋雪云. 利福平耐药结核病患病率和危险因素的纵向分析[J]. 中国现代医生, 2022, 60(1): 54-57.
赵科, 向菊芳, 周雪, 等. 析因设计优化利福平诱导小鼠肝损伤模型研究[J]. 中药药理与临床, 2019, 35(2): 144-148.
Schuster S, Cabrera D, Arrese M, et al. Triggering and resolution of inflammation in NASH[J]. Nat Rev Gastroenterol Hepatol, 2018, 15(6), 349-364.
Negro F. Natural history of NASH and HCC[J]. Liver Int, 2020, 40(1): 72-76.
Buzzetti E, Pinzani M, Tsochatzis E A. The multiple-hit pathogenesis of non-alcoholic fatty liver disease (NAFLD)[J]. Metabolism, 2016, 65(8): 1038-1048.
Tilg H, Moschen A R. Evolution of inflammation in nonalcoholic fatty liver disease: The multiple parallel hits hypothesis[J]. Hepatology, 2010, 52(5): 1836-1846.
張旭, 陈朝银, 董珺琳, 等. 没食子酸对谷氨酸钠诱导的肥胖小鼠的降脂作用[J]. 中成药, 2017, 39(6): 1115-1119.
吕超, 石清兰, 覃倩, 等. 小鼠实验性肝损伤模型的研究进展[J]. 中国比较医学杂志, 2019, 29(1): 107-113.
Shanckelford C, Long G, Wolf J. Qualitative and quantitative analysis of nonneoplastic lesions in toxicology studies[J]. Toxicol Pathol, 2002, 30 (1): 93-96.
Neyrinck A M, Cani P D, Dewulf E M, et al. Critical role of Kupffer cells in the management of diet-induced diabetes and obesity[J]. Biochem Biophys Res Commun, 2009, 385(3): 351-356.
Clementi A H, Gaudy A M, van Rooijen N, et al. Loss of Kupffer cells in diet-induced obesity is associated with increased hepatic steatosis, STAT3 signaling, and further decreases in insulin signaling[J]. Biochim Biophys Acta, 2009, 1792(11): 1062-1072.
van Rooijen N, van Kesteren-Hendrikx E. “In vivo” depletion of macrophages by liposome-mediated “suicide”[J]. Methods Enzymol, 2003, 373: 3-16.
