蒙特卡洛模拟评价万古霉素治疗金黄色葡萄球菌和表皮葡萄球菌引起血流感染的给药方案
2023-03-13金丹婷杨晋茆海丰喻玮嵇金如应超群刘志盈邹秀珍肖永红
金丹婷 杨晋 茆海丰 喻玮 嵇金如 应超群 刘志盈 邹秀珍 肖永红
摘要:目的 利用蒙特卡洛模擬评价万古霉素治疗金黄色葡萄球菌和表皮葡萄球菌引起血流感染的合理性。方法 由全国血流感染细菌耐药监测联盟(BRICS)收集全血标本中分离的1438株金黄色葡萄球菌和409株表皮葡萄球菌,采用微量肉汤稀释法对分离的菌株进行最低抑菌浓度(minimum inhibitory concentration,MIC)的测定。万古霉素4种给药方案分别为500mg q6 h、1000 mg q12 h、1500 mg q12 h和2000 mg q12 h。通过蒙特卡洛模拟10000例次后,获得4种给药方案的fAUC/MIC达标概率 (probability of target attainment,PTA)和累计反应分数(cumulative fraction of response,CFR)。CFR≥90%时的给药方案是经验性用药的最佳选择。结果 当对葡萄球菌MIC≤0.5 mg/L时,万古霉素4种给药方案fAUC/MIC均可达到满意的抗菌活性(PTA=100%),当MIC=1 mg/L时,1500 mg q12 h和2000 mg q12 h两种给药方案可达到目标PTA。万古霉素给药剂量500 mg q6 h、1000 mg q12 h、
1500 mg q12 h、2000 mg q12 h对金黄色葡萄球菌的fAUC/MIC CFR分别为83%、83%、87%和98%;对应表皮葡萄球菌的CFR分别为53%、53%、59%和92%。结论 万古霉素用于因金黄色葡萄球菌和表皮葡萄球菌引起的血流感染时,应根据MIC值的不同而选择不同的给药剂量进行治疗,经验性选择万古霉素进行抗感染治疗时,给药剂量需达到2000 mg q12 h方能达到较好的抗菌效果。
关键词:蒙特卡洛模拟;万古霉素;累计反应分数
中图分类号:R978.1文献标志码:A
Monte Carlo simulation to evaluate vancomycin dosing regimens in the
treatment of bloodstream infection caused by Staphylococcus aureus
and Staphylococcus epidermidis
Jin Danting1, Yang Jin1, Mao Haifeng1, Yu Wei2, Ji Jinru2, Ying Chaoqun2, Liu Zhiying2,
Zou Xiuzhen1, and Xiao Yonghong2
(1 The First Affiliated Hospital of Kangda College, Nanjing Medical University The First People's Hospital of Lianyungang, Lianyungang 222002; 2 State Key Laboratory for Diagnosis and Treatment of Infectious Diseases, National Clinical Research Center for Infectious Diseases, Collaborative Innovation Center for Diagnosis and Treatment of Infectious Diseases,
The First Affiliated Hospital, Zhejiang University, Hangzhou 310003)
Abstract Objective To evaluate the appropriateness of vancomycin regimens in the treatment of bloodstream infection caused by Staphylococcus aureus and Staphylococcus epidermidis by Monte Carlo simulation(MCS). Method 1,438 strains of S. aureus and 409 strains of S. epidermidis isolated from blood samples were collected in the Blood Bacterial Resistant Investigation Collaborative System (BRICS) were examined for the minimum inhibitory concentration(MIC) of vancomycin with microbroth dilution method. The four regimens of vancomycin (500 mg q6 h, 1000 mg q12 h, 1500 mg q12 h and 2000 mg q12 h) were evaluated with MCS of 10,000 simulations, the probability of target attainment (PTA) and cumulative fraction of response (CFR) of fAUC/MIC of the regimens were obtained. CFR > 90% is the best choice for empiric administration. Results All the four vancomycin regimes could achieve satisfactory antibacterial PK/PD target (PTA=100%) when MIC ≤0.5 mg/L, and 1500 mg q12 h and 2000 mg q12 h
could achieve satisfactory targets when MIC=1 mg/L. The CFR against S. aureus after 500 mg q6 h, 1000 mg q12 h, 1500 mg q12 h and 2000 mg q12 h administration were 83%, 83%, 87% and 98%, respectively; The CFR against
S. epidermidis were 53%, 53%, 59% and 92%, respectively. Conclusion Treatment of bloodstream infections caused by S. aureus and S. epidermidis with vancomycin should be used in regimen referring to different MIC. Empiric therapy with vancomycin should be in the regimen of 2000 mg q12 h.
Key words Monte Carlo simulation; Vancomycin; Cumulative fraction of response
万古霉素(vancomycin, VAN)目前主要用于治疗耐甲氧西林的葡萄球菌属、青霉素非敏感的肺炎链球菌等引起的呼吸系统感染、中枢神经系统感染以及血流感染等[1]。作为革兰阳性球菌重症感染的一线治疗药物,万古霉素具有治疗窗口窄、个体间差异较大等特点[2-5]。随着临床广泛使用,虽然我国尚无万古霉素耐药葡萄球菌,但细菌对万古霉素敏感性发生改变 ,既往所设定的给药方式是否符合现阶段临床实际需要进一步研究。本研究借助全国血流感染细菌耐药监测联盟(Blood Bacterial Resistant Investigation Collaborative System,BRICS)所收集成人血培养中分离的金黄色葡萄球菌和表皮葡萄球菌,将万古霉素的药动学参数与最低抑菌浓度(minimum inhibitory concentration,MIC)相结合,利用蒙特卡洛模拟评估万古霉素给药方案,为临床选择合理治疗方案提供参考的依据。
1 材料与方法
1.1 细菌与万古霉素的MIC测定
收集全国血流感染细菌耐药监测联盟(BRICS)全国50余家医院成人血培养中分离的1847株葡萄球菌,其中金黄色葡萄球菌1438株,表皮葡萄球菌409株(表皮葡萄球菌来自于同一患者两套血培养均报阳分离的菌株),由浙江大学附属第一医院传染病诊治国家重点实验室采用CLSI推荐微量肉汤稀释法测定MIC,万古霉素微量肉汤稀释法药敏测定板购于温州康泰生物科技有限公司。金黄色葡萄球菌ATCC25923质控菌株。
1.2 万古霉素的药动学参数及PK/PD参数
万古霉素的药动学参数均来自于已发表文献[6],AUC24/MIC为万古霉素有效PK/PD参数,目标靶值为AUC24/MIC≥400,AUC24=D/{[(CLCr×0.79)+15.4]×0.06},D为24h剂量(mg),CLcr为肌酐清除率,MIC为最低抑菌浓度。
1.3 万古霉素的给药方案与蒙特卡洛模拟
本研究共选择4种给药方案,分别为500 mg q6 h、1000 mg q12 h、1500 mg q12 h、2000 mg q12 h[7-8];给药方式均为静脉滴注。
模拟使用Oracle Crystal Ball 11.1.2.4软件,根据万古霉素PK/PD参数对上述四种给药方案分别进行模拟。模拟中的CL服从的是对数正态分布,MIC为自定义分布,模拟得到万古霉素不同给药方案的PTA和CFR。一般认为CFR≥90%是临床经验性抗感染治疗的最优选择,CFR≥80%为次优方案[9]。
2 结果
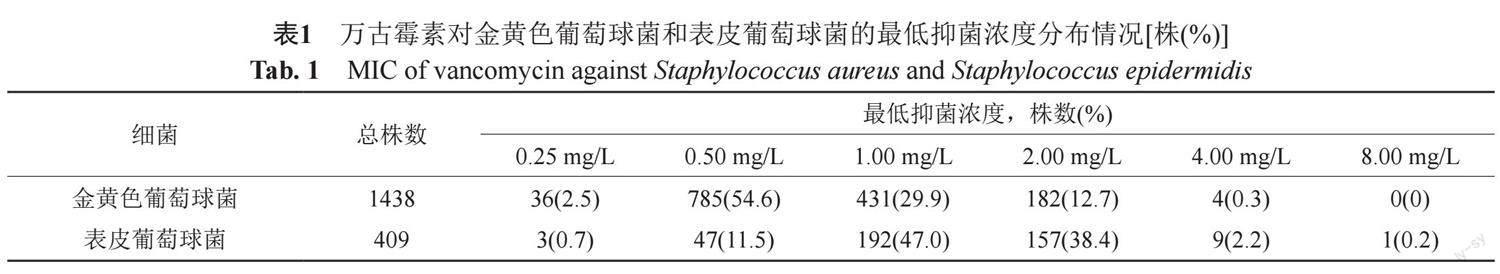
2.1 万古霉素对葡萄球菌的最低抑菌浓度分布情况(表1)
共分离4株金黄色葡萄球菌对万古霉素中介,1株表皮葡萄球菌对万古霉素中介,未检测出对万古霉素耐药的菌株。金黄色葡萄球菌的MIC50为0.50 mg/L、MIC90为2.00 mg/L,敏感率为99.72%。表皮葡萄球菌的MIC50为1.00 mg/L,MIC90为2.00 mg/L,敏感率为99.75%。
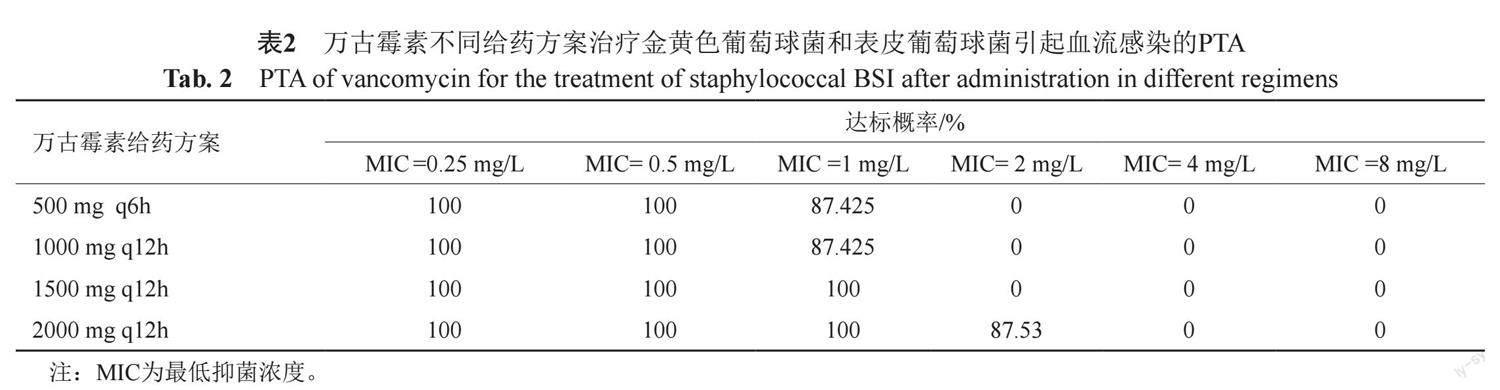
2.2 万古霉素不同给药方案对葡萄球菌血流感染的达标概率(PTA)(表2)
经蒙特卡洛模拟,当MIC≤0.5 mg/L时,4种给药方案对葡萄球菌均可达到满意的目标值(PTA=100%);当MIC=1 mg/L时,1500 mg q12 h、2000 mg q12 h 2种给药方案可达到满意的目标值。当MIC=2 mg/L时,模拟的4种给药方案均达不到满意的PK/PD靶值。
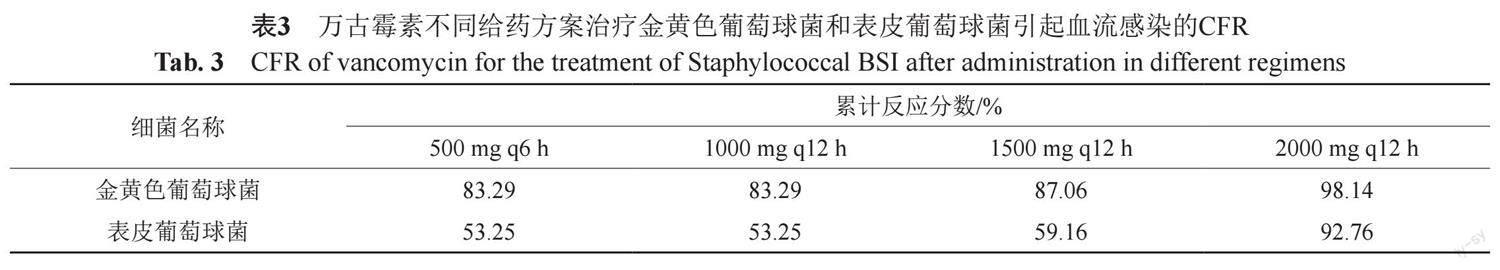
2.3 万古霉素不同给药方案对葡萄球菌血流感染的累积反应分数(CFR)(表3)
经模特卡洛模拟结果显示,万古霉素选择四种给药方案对金黄色葡萄球菌的CFR均>80%。对表皮葡萄球菌时,只有给药剂量达到2000 mg q12h时其CFR>90%,其与三种给药方案对应的CFR均<80%。
3 讨论
金黄色葡萄球菌是最重要的致病菌之一,有較强的侵袭力和致病性,既可引起伤口、毛囊及手术切口部位等局部感染,又可引起全身性的感染。表皮葡萄球菌是人体皮肤正常定植菌,以往观点认为表皮葡萄球菌不会引起机体的感染,但随着科技的进步,植入性医疗设备被越来越多地用于临床,如假体,导管和心脏瓣膜等,目前表皮葡萄球菌已成为院内感染常见的病原菌之一[10]。2021年全国血流感染细菌检测报告显示[11],金黄色葡萄球菌占血流感染分离菌9.8%,是引起血流感染的主要革兰阳性球菌,其次是凝固酶阴性葡萄球菌,占比为6.3%。目前国际治疗指南和国内专家共识[1,12-15]均推荐万古霉素为治疗革兰阳性球菌引起葡萄球菌重症血流感染的首选药物。但临床上在使用万古霉素的过程中,因为其治疗窗口窄且无法及时获得细菌的MIC值等原因,临床在治疗方面常出现给药剂量不足情况,导致治疗失败。临床需要利用细菌的MIC值和万古霉素的体内药动学/药效学参数,可指导临床合理使用万古霉素。抗菌药物PK/PD研究表明[16],万古霉素属于具有抗菌药物后效应的时间依赖性抗菌药物, AUC24/MIC与抗感染治疗效果有显著的相关性,当AUC24/MIC≥400时可获得满意的临床治疗效果。
蒙特卡洛模拟是一种以概率为基础的模拟方法,该方法利用某种抗菌药物在体内的药动学参数结合特定细菌的MIC值,模拟临床患者达到一定数量(5000~10000次),得到该抗菌药物不同给药剂量下的达标概率,用于优化抗菌药物的给药方案[17-20]。关于蒙特卡洛模拟万古霉素用于金黄色葡萄球菌和表皮葡萄球菌感染的治疗给药方案在国内外也有相关文献报道,但菌株来源的标本种类多样,有分泌物、脓液、血液以及痰液等,模拟结果与临床效果往往有较大差异,而本次研究选择血流感染金黄色葡萄球菌和表皮葡萄球菌,其结果更贴近于临床实际情况。模拟结果显示,当MIC≤0.5 mg/L时,4种给药剂量均可达到满意的抗菌效果(PTA=100%);当MIC=1 mg/L时,给药剂量需要增加为1500 mg q12 h方可达到有效目标值(PTA=100%);当MIC=2 mg/L时,即使细菌对万古霉素在敏感范围内[21],但模拟结果显示,2000 mg q12 h的给药剂量都无法达到目标AUC24/MIC。CFR的模拟也发现,无论金黄色葡萄球菌還是表皮葡萄球菌,均需要在2000 mg q12 h时才可能达到90%以上。可见,对于一些重症患者,临床在未获得MIC值时,经验性选择万古霉素进行治疗因金黄色葡萄球菌和表皮葡萄球菌引起的血流感染时,给药剂量需达到2000 mg q12 h,方可使患者获得最佳治疗效果[22-24],同样,对敏感性低的细菌感染也需要较高剂量预期才能获得较好疗效。
本研究尚存在一些不足之处,首先在模拟过程中使用的是正常人群体药动学参数,未考虑患者肾功能情况[25],其次未充分考虑临床药物的安全性,对于一些重症且治疗困难的患者,需要临床密切观察,以保证患者用药的安全性。
万古霉素作为革兰阳性球菌引起重症感染的一线药物,如何更好地发挥作用,尽量避免因给药不足导致临床治疗失败的可能并防止细菌耐药性的产生,建议实验室可定期结合本地区MIC值进行蒙特卡洛的模拟,用于指导临床合理使用万古霉素,防止因给药剂量不足导致治疗失败,从而延误患者病情并导致患者治疗费用的增加。
致谢:本研究数据来源于全国血流感染细菌耐药监测联盟(BRICS)成员单位2018-2019年监测数据。特此鸣谢BRICS成员单位(排名按实际分析菌株):浙江大学医学院附属第一医院传;浙江省丽水市中心医院;山东省滨州医学院附属医院;江苏省连云港市第一人民医院;安徽医科大学第一附属医院;安徽省皖南医学院弋矶山医院;安徽省立医院;湖北省武汉市普仁医院;湖北省荆州市第一人民医院;宁夏回族自治区人民医院;河南省安阳地区医院;云南省第二人民医院;浙江省中医院;安徽省黄山市人民医院;福建省宁德市闽东医院;山东省济宁医学院附属医院;甘肃省庆阳市人民医院;山东省滕州市中心人民医院;安徽省六安市人民医院;新疆犁州友谊医院;江西省宜春市人民医院;江西省九江市第一人民医院;山东第一医科大学附属省立医院;湖北省荆州市中心医院;江西省赣南医学院附属第一医院;福建省莆田市第一医院;浙江省海宁市人民医院;山东省胜利油田中心医院;黑龙江省牡丹江医学院附属红旗医院;宁波大学医学院附属医院;浙江大学医学院附属妇产科医院;安徽医科大学第四附属医院;安徽省天长人民医院;陕西省人民医院;河南科技大学第一附属医院;湖北省荆州市第二人民医院;安徽省六安世立医院;安徽省蚌埠医学院第二附属医院;河南大学淮河医院;山东大学齐鲁儿童医院;四川省自贡市第三人民医院;山西医科大学第二医院;安徽庐江县人民医院;甘肃省嘉峪关市第一人民医院;安徽省合肥市第三人民医院;中国人民解放军北部战区总医院;江西省新余市新钢医院;西安医学院第一附属医院;甘肃省中医院;湖南省郴州市第一人民医院。
参 考 文 献
万古霉素临床应用中国专家共识(2011版)[J]. 中国新药与临床杂志, 2011, 30(8): 561-573.
胡佳丽, 范亚新, 郭蓓宁, 等. 去甲万古霉素临床药理学的研究综述[J]. 中国感染与化疗杂志, 2021, 21(6): 745-751.
夏凡, 黄春燕, 谢诚, 等. 血液病患者万古霉素血药浓度特点及影响因素[J]. 医药导报, 2023, 42(5): 738-741.
马雪, 刘富越, 龚发敏, 等. 肿瘤患者万古霉素血药浓度达标的影响因素分析[J]. 中国感染与化疗杂志, 2023, 23(2): 167-172.
林良沫, 符祥俊, 吴琼诗等. 不同病理状态人群万古霉素群体药代动力学模型的研究进展[J]. 中南药学, 2021, 19(11): 2365-2371.
Moise-Broder P A, Forrest A, Birmingham M C, et al. Pharmacodynamics of vancomycin and other antimicrobials in patients with Staphylococcus aureus lower respiratory tract infections[J]. Clin Pharmacokinet, 2004; 43(13): 925-942.
万古霉素临床应用剂量专家组. 万古霉素临床应用剂量中国专家共识[J]. 中华传染病杂志, 2012, 30(11): 641-646.
周义正, 黄晨, 嵇金如, 等. 基于蒙特卡洛模拟优化万古霉素与替考拉宁治疗耐甲氧西林葡萄球菌血流感染的给药方案[J]. 医药导报, 2022, 41(7): 1026-1032.
潘爱军, 梅清, 杨田军, 等. 多黏菌素E对重症患者的有效性及安全性分析: 一项基于蒙特卡罗模拟的体外研究[J]. 中华危重病急救医学, 2017, 29(5): 385-389.
郭宇, 魏莹, 刘颖, 等. 人工关节假体感染中表皮葡萄球菌的毒力及耐药基因研究[J]. 临床和实验医学杂志, 2021, 20(13): 1433-1437.
陈云波, 嵇金如, 刘志盈, 等. 全国血流感染细菌耐药监测(BRICS)2021年度报告[J]. 中华临床感染病杂志, 2023, 16(1): 33-47.
Matsumoto K, Oda K, Shoji K, et al. Clinical practice guidelines for therapeutic drug monitoring of vancomycin in the framework of model-informed precision dosing: A consensus review by the Japanese Society of Chemotherapy and the Japanese Society of Therapeutic Drug Monitoring. Pharmaceutics, 2022, 23, 14(3): 489.
Liu C, Bayer A, Cosgrove S E, et al. Clinical practice guidelines by the Infectious Diseases Society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children[J]. Clin Infect Dis, 2011, 52(3): 18-55.
He N, Su S, Ye Z K, et al. Evidence-based guideline for therapeutic drug monitoring of vancomycin: 2020 update by the Division of Therapeutic Drug Monitoring, Chinese Pharmacological Society[J]. Clin Infect Dis, 2020,71 (Suppl): S363-S371.
何娜, 蘇珊, 翟所迪, 等. 《中国万古霉素治疗药物监测指南(2020 更新版)》解读[J]. 临床药物治疗杂志, 2021, 19(1): 12-16.
范亚新, 张箐. 万古霉素药动学/药效学及个体化给药[J]. 中国感染与化疗杂志, 2019, 1(3): 323-330.
何婕, 虎淑妍, 嵇金如, 等. 抗菌药物治疗链球菌的蒙特卡洛模拟研究[J]. 中国感染控制杂志. 2022, 21(2): 128-133.
钱震雯, 戈宁宁, 韩亮, 等. 产超广谱β-内酰胺酶肠杆菌科细菌对碳青霉烯类药物的蒙特卡洛模拟研究[J]. 中华临床感染病杂志, 2021, 14(4): 297-302.
Dai Y, Chang W, Zhou X, et al. Evaluation of ceftazidime/avibactam administration in Enterobacteriaceae and Pseudomonas aeruginosa bloodstream infections by Monte Carlo simulation[J]. Drug Des Devel Ther, 2021, 15: 2899-2905.
Wu X, Huang C, Wang H, et al. Optimal empiric polymyxin B treatment of patients infected with Gram-negative organisms detected using a Blood Antimicrobial Surveillance Network in China[J]. Drug Des Devel Ther, 2021,15: 2593-2603.
Clinical and laboratory Standards Insitute. M100 Performance standards for antimi-crobial susceptibility testing, 30th informational supplement[S]. Wayne, PA: Clinical and Laboratory Standards Institute, 2020: 63.
纵帅, 徐银海, 丁兴龙, 等. 万古霉素对徐州地区2015-2019年MRSA最低抑菌浓度值飘移特征[J]. 中国感染控制杂志, 2021, 20(11): 991-995.
孙芳. 应用蒙特卡洛模拟法优化利奈唑胺、替考拉宁和万古霉素在 ICU患者治疗MRSA感染的给药方案[J]. 中国抗生素杂志, 2016, 41(10): 796-799.
石璐, 钟桥, 唐莲, 等. 应用蒙特卡罗模拟优化肾功能亢进患者万古霉素给药方案的研究[J]. 中华临床感染病杂志, 2020, 13(4): 295-301.
Charoensareerat T, Chaijamorn W, Boonpeng A, et al. Optimal vancomycin dosing regimens for critically illpatients with acutekidney injury during continuous renal replacement therapy: A Monte Carlo simulation study[J]. J Crit Care, 2019, 54: 77-82.
