内蒙古地区手参根际土壤真菌群落组成及多样性
2023-03-13阿拉坦存布尔曹乌吉斯古楞包金花查苏娜胡红霞王秀兰
阿拉坦存布尔, 曹乌吉斯古楞, 包金花, 查苏娜, 胡红霞,王秀兰
(1. 内蒙古民族大学蒙医药学院,内蒙古 通辽 028000;2. 内蒙古民族大学/蒙医药研发工程教育部重点实验室,内蒙古 通辽 028000;3.内蒙古民族大学农学院,内蒙古 通辽 028000)
【研究意义】手参[Gymnadeniaconopsea(L.) R. Br.]是兰科(Orchidaceae)手参属(Gymnadenia)地生多年生草本植物[1],蒙药名为额日和藤乃嘎日,异名为旺拉嘎。手参入药部位为块茎,主要含有天麻素、手参多糖等成分[2-3],在蒙药中具有补肾益精、生津止咳等功效[4]。在中药中具有止咳平喘、益肾健脾、理气和血等功效[5]。现代药理学研究表明,手参具有改善记忆、神经保护等药理作用[2]。手参分布较广,但由于手参药材资源主要依赖野生资源,加之其自然繁殖效率低、乱采挖和自然生境被破坏等因素导致手参野生资源急剧减少,甚至面临枯竭,目前已被《濒危野生动植物种国际贸易公约》列为二级珍稀濒危植物[6]。植物的生长与土壤环境因素密切相关,且受土壤微生物菌落影响,尤其是根际土壤微生物对植物的生长发育起重要作用[7-9]。因此,植物的分布与根际土壤微生物群落结构密切相关,进一步研究不同分布区手参根际土壤微生物群落结构及其与土壤环境因子的相关性为全面掌握手参生长特性具有重要意义。【前人研究进展】植物根际是微生物最活跃的栖息地之一,也是微生物、植物和土壤相互作用和影响的重要场所[10]。根际微生物能促进土壤中有机质分解和养分转化[11-14],从而进一步调控药用植物生长,影响其分布[15-17]。目前,已有西藏林芝、吉林长白山、河北五台山地区分布的手参根际土壤微生物多样性研究的报道。据统计,手参根际土壤真菌涵盖栓菌属(Trametes)、曲霉属(Aspergillus)、镰刀菌属(Fusarium)、青霉菌属(Penicillium)等43属,不同地区手参根际土壤真菌群落结构均存在明显差异[18-22],并且每个地区的优势类群各不同。粉褶菌科(Entolomataceae)为西藏手参根际土壤优势类群[20]。耙齿菌属(Irpex)为吉林手参根际土壤真菌优势类群,镰刀菌属(Fusarium)为河北手参根际土壤真菌优势类群[18]。导致地区间手参根际土壤内生真菌的差异可能与该植物生长环境因素相关。例如,西藏手参根际土壤内生真菌特有属较多,这可能与西藏地区高海拔有关,另外河北小五台山地区土壤碱化程度高,而吉林长白山地区手参生境土壤偏酸性,除了海拔和土壤pH之外,与土壤理化性质、土壤酶活性、土壤含水量、坡度和雨水量都有密切相关[18,21]。现已初步明确西藏、吉林、河北地区分布的手参根际土壤微生物中的优势类群,为揭示手参生长特性与土壤微生物群落结构相互关系奠定了一定的基础[20,23]。【本研究切入点】通过 Illumina MiSeq 高通量测序技术,以内蒙古不同分布区手参的根际土壤为研究对象,对根际微生物的群落组成和分布规律进行分析比较。【拟解决的关键问题】进一步探究手参根际土壤真菌组成与土壤环境因子的相关性,为掌握手参生长特性及其人工栽培、生态种植等资源保护及可持续利用提供科学依据。
1 材料与方法
1.1 手参根际土壤的采集
于2022年7月,从内蒙古阿鲁科尔沁旗(A1)、翁牛特旗(W2)、东乌珠穆沁旗(D3)3个分布区采集手参根际土壤样本(表1)。随机选取不同手参植株根际10~20 cm 土层处土壤,每间隔10~50 m选择1株手参,共取6株手参土壤样品,过孔径为2 mm筛去除杂草根系,装入无菌袋中,3个分布区共收集18份样品,带回实验室用于土壤理化性质检测和高通量测序。

表1 手参根际土壤采样地点及信息
1.2 手参根际土壤的理化性质测定
根据鲍士旦[24]的方法测定土壤总氮、总磷、总钾、速效钾、有效磷、有机质、水分、pH和碱解氮9项理化性质。每个样品重复6次。
1.3 方法
1.3.1 手参根际土壤微生物DNA提取 选用PowerSoilDNAIsolationKit试剂盒,根据说明书提取手参根际土壤微生物总DNA,利用NanoDropOne检测DNA的浓度和纯度。
1.3.2 手参根际土壤微生物总DNA的PCR扩增和高通量测序 以提取的手参根际土壤微生物总DNA为模板,对基因组ITS1~ITS2区域进行扩增。采用真菌ITS区的特异性引物(ITS1F:5’-CTTGGTCATTTAGAGGAAGTAA-3’; ITS2:5’-GCTGCGTTCTT CATCGATGC-3’)进行 PCR扩增,反应程序为:94 ℃ 3 min;94 ℃ 30 s,45 ℃ 20 s,65 ℃ 30 s,5 个循环;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,20 个循环;72 ℃ 5 min;10 ℃保存。PCR扩增产物经1%的琼脂糖凝胶电泳检测,合格产物用天根胶回收试剂盒进行回收纯化后进行Illumina MiSeq高通量测序。
1.4 数据分析
1.4.1 测序数据处理及OTU特征分析 利用overlap将双端数据进行拼接,并进行质控、嵌合体过滤,获得高质量的CleanData。QIIME2修正扩增子的测序,获得单碱基精度的代表序列,使用ASVs (Amplicon sequence variants)的概念构建类OTU(Operational taxonomic units)表,获得最终的OTUs特征表以及特征序列,进一步进行多样性分析、物种分类注释和差异分析等。
1.4.2 手参根际土壤真菌群落多样性和结构分析 基于OTUs特征序列统计结果,使用QIIME2软件包中的各种脚本进行Alpha多样性和Beta多样性分析,其中Alpha多样性通过Chaol指数、Observed species指数、Goods_coverage指数、Shannon指数、Simpson指数来反映样品多样性和丰富度。Beta多样性分析通过非加权组平均法(Unweighted pair-group method with arithmetic,UPGMA)获得聚类树和主坐标分析(Principal coordinates analysis,PCoA)。再利 用 R 软 件 的 冗 余 分 析(Redundancy analysis,RDA)对手参根际土壤真菌、土壤环境因子以及分布区三者间进行分析,同时用Spearman相关性对根际土壤真菌群落丰度与土壤环境因子进行分析。
2 结果与分析
2.1 手参根际土壤的理化性质
从表2可知,手参根际土壤pH在各分布区无显著差异,均呈酸性,pH 5.97~6.06。依据全国第二次土壤普查养分分级标准[25],有机质含量在阿鲁科尔沁和翁牛特分布区达Ⅲ级,为最适水平;全鳞含量在翁牛特分布区达Ⅰ级,为极丰富水平;全钾含量在东乌珠穆沁分布区处于Ⅰ级,为极丰富水平;碱解氮和速效钾含量在阿鲁科尔沁和翁牛特分布区均达到Ⅰ或Ⅱ级,为极丰富或丰富水平;有效磷含量在3个分布区均处于Ⅱ级,为丰富水平;全氮含量在3个分布区均处于Ⅵ,为极缺乏水平。表明,3个分布区的手参根际土壤具有不同的理化性质特征。

表2 不同分布区手参根际土壤的理化性质
2.2 手参根际土壤真菌测序数据
经 Illumina Miseq 高通量测序后,3个分布区的土样中共生1495 852条优化序列,有效数据中数据质量≥Q20的数据平均比例为99.28%,有效数据中数据质量≥Q30的数据平均比例为97.44%,有效数据中数据GC平均含量为50.13%(表3)。基于97%相似度水平下,共聚成5125个OTUs。从图 1可知,3个分布区A1、W2和D3共有OTUs数目为203;每个样品存在不同数量的特有 OTUs,其中A1特有OTUs数目为1796,W2特有OTUs数目为1125,D3特有OTUs数目为1427。说明东乌珠穆沁旗手参根际土真菌组成与另两个地区相比特有群落更明显。
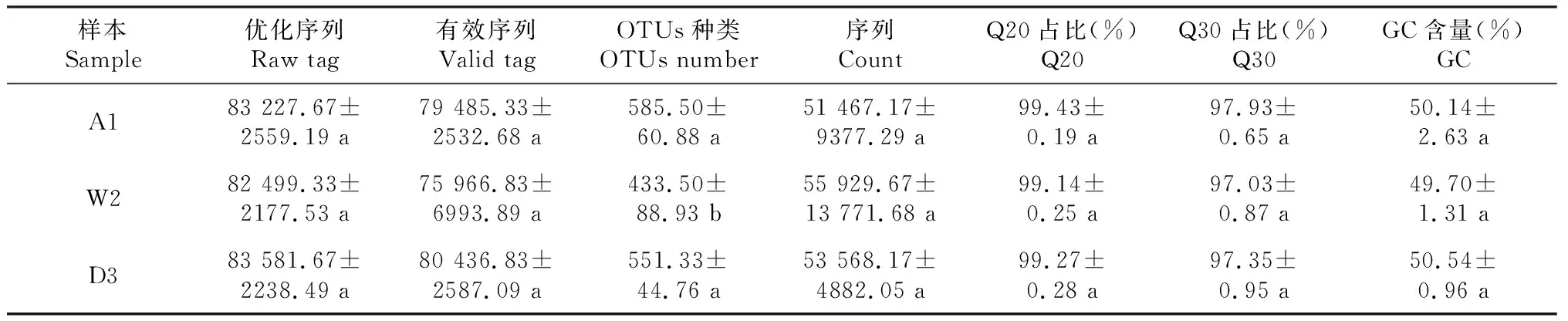
表3 手参根际土壤真菌ITS测序结果

图1 不同分布区手参根际土壤样品OTUsFig.1 OTUs of rhizosphere soil samples of G.conopsea from different distribution areas
2.3 不同分布区手参根际土壤真菌Alpha多样性
从图 2可知,随着A1、W2和D3的3组18个样品测序数量的增多,Alpha 多样性指数值变化越来越缓慢,当达到足够数量后,曲线逐渐趋于平缓,表明测序深度能够覆盖样品根际土壤中的所有真菌微生物。

图2 手参根际土壤样品的稀释曲线Fig.2 Dilution curve of rhizosphere soil sample of G.conopsea
从表4可知,A1、W2、和D3的3组18个样品的覆盖度均为 1.0,表明测序结果达到饱和状态,能够覆盖所有真菌类群。在所有样品中,阿鲁科尔沁旗手参根际土壤的OTUs指数、Chao1 指数、Shannon指数、Simpson指数均最高,其次为东乌珠穆沁旗,翁牛特旗中所有指数均最低,表明阿鲁科尔沁旗的手参根际土壤真菌群落多样性和丰度最高,翁牛特旗中的最低。A1和D3的Chao1 指数均与W2的显著差异,表明阿鲁科尔沁旗和东乌珠穆沁旗的手参根际土壤真菌物种数量均与翁牛特旗显著差异。

表4 手参根际土壤真菌群落Alpha多样性分析
2.4 不同分布区手参根际土壤真菌Beta多样性分析
基于各样品的OTUs分析结果,UPGMA 层次聚类分析(图 3)显示,翁牛特旗(WD)和东乌珠穆沁旗(DW)分布区的根际土壤真菌群落组成较相似,阿鲁科尔沁旗(AQ)的根际土壤真菌群落组与其他2个分布区的土壤真菌组成差异较大。NMDS分析表明,不同分布区的土壤样品具有一定的分组意义。ANOSIM分析(图4)表明,组间的差异显著大于组内差异(R=0.601,P=0.001)。基于非加权Unifrac距离算法下手参根际土壤真菌在属水平上的PCoA (Principal co-ordinates analysis)结果(图5)显示,3个分布区的样品均能被明显区分,说明3个分布区手参的根际土壤真群落组成存在一定差异。

图3 基于非加权unifrac距离算法下手参根际土壤真菌在ASV分析上的UPGMA聚类树Fig.3 UPGMA cluster tree of G. conopsea rhizosphere soil fungi on ASV analysis based on unweighted unifrac distance algorithm
2.5 不同分布区手参根际土壤真菌的群落组成
3个分布区手参根际土壤真菌测序所获得的5125个OTUs隶属于11门、31纲、65目、161科、158属(表5)。从门水平看,在丰度前30的物种分类中,除未能分类到属的真菌类群外,3个分布区有10个共有门,其中被孢霉菌门(Mortierellomycota)为阿鲁科尔沁旗(A1)的特有门(图6)。子囊菌门和担子菌门在阿鲁科尔沁旗(A1)中的相对丰度分别为45.3%和31.77%,在翁牛特旗(W2)中的相对丰度分别为24.4%和62.06%,在东乌株穆沁旗(D3)中的相对丰度分别为61.23%和24.91%,认为是手参根际土壤真菌优势门。
在属水平上,在丰度前30的属中,被孢霉属(Mortierella)、湿伞属(Hygrocybe)、珊瑚菌属(Clavaria)、毛舌菌属(Trichoglossum)、外瓶霉属(Exophi-ala)、隐球酵母属(Cryptococcus)、拟锁瑚菌属(Cla-vulinopsis)、肉座菌属(Hypocrea)、小菇属(Mycena)等29属是3个分布区的共有属,只有Myxarium是阿鲁科尔沁旗(A1)的特有属(图7)。其中,被孢霉属、湿伞属、毛舌菌属、外瓶霉属和珊瑚菌属等5个属丰度最高(图8),并且不同分布区的丰度最高的属各不相同,例如,阿鲁科尔沁旗(A1)丰度最高的属为被孢霉属(18.81%),翁牛特旗(W2)丰度最高的属为湿伞属(23.68%),东乌旗(D3)丰度最高的属为毛舌菌属(15.29%)。

图4 基于非加权unifrac距离算法下手参根际土壤真菌在属水平上的NMDS分析Fig.4 NMDS analysis of G. conopsea rhizosphere soil fungi at genus level

图5 基于非加权unifrac距离算法下手参根际土壤真菌在属水平上的主坐标分析Fig.5 PCoA analysis of G. conopsea rhizosphere soil fungi at genus level based on unweighted unifrac distance alogorithm

表5 手参根际土壤真菌在不同分类水平上的数目
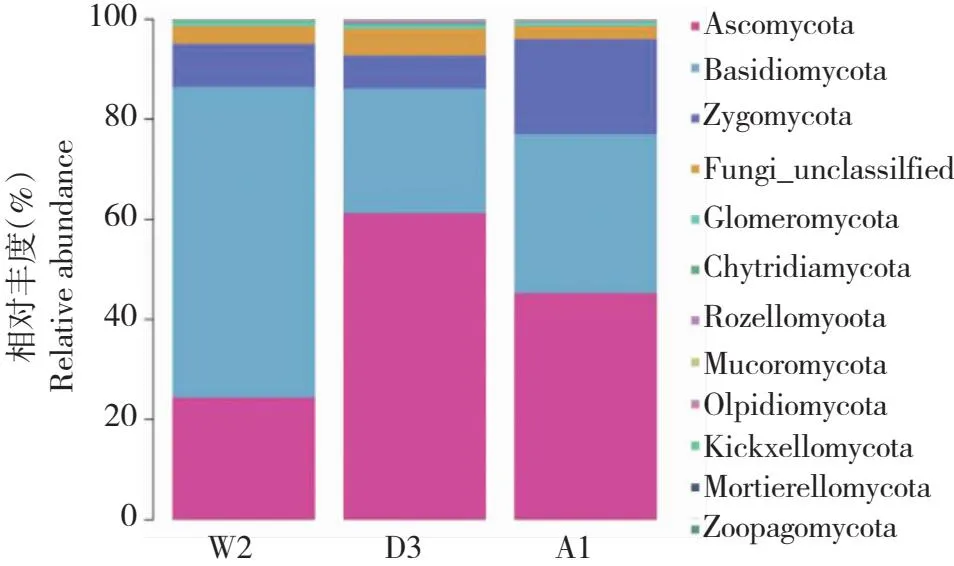
图6 手参根际土壤真菌在门水平上的群落组成Fig.6 The composition of the producing area of G. conopsea rhizosphere soil fungi at the phylum level
2.6 不同分布区手参根际土壤真菌的物种差异
对属水平的所有物种进行差异分析,筛选P值小于0.05的前15物种绘制柱状图(图9),除未能分类到属的真菌类群外,在阿鲁科尔沁旗(A1)中Cladophialophora、Neonectria、隐球酵母属、Gibberella、镰刀菌属、Camarophyllopsis、Glomerella属类的丰富度显著高于其他分布区;在翁牛特旗(W2)中湿伞属、拟锁瑚菌属、Hymenogaster属的丰富度显著高于其他分布区:在东乌珠穆沁旗(D3)中,毛舌菌属、土赤壳属、Nectria、Hemileucoglossum、Cylindrocarpon、Paraconiothyrium、Minutisphaera、Scutellinia、Cosmospora等属的丰富度显著高于A1和W2。

图7 手参根际土壤真菌在属水平上的组成Fig.7 The composition of producing area of G. conopsea rhizosphere soil fungi at genus level

图8 手参根际土壤真菌丰度前10的属Fig.8 The top 10 genera of fungi abundance in rhizosphere soil of G. conopsea

图9 手参根际土壤真菌的物种差异分析Fig.9 Differential species analysis of fungi in the rhizosphere soil of G. conopsea
2.7 不同分布区手参根际土壤真菌与土壤环境因子的相关性分析
对手参根际土壤样品中相对丰度前 15 位的真菌菌属与土壤环境因子(图10)进行RDA分析,第1和第2轴的解释率分别为21.59%和13.40%,累计总解释率达 33.99%,表明该结果能够反映真菌群落与土壤环境因子之间的相互关系。土壤环境因子对手参根际土壤真菌群落的影响依次为:全磷>全钾>速效钾>土壤水分>全氮>pH>碱解氮>有效磷。Spearman相关分析(图11)表明,Knufia、外瓶霉属、锁瑚菌属、Cladophialophora与速效钾呈正相关;被孢霉属和镰刀菌属与碱解氮呈正相关;肉座菌属、外瓶霉属、锁瑚菌属、Cladophialophora与有效磷呈正相关;湿伞属、外瓶霉属、锁瑚菌属与有机质呈正相关,而肉座菌属、外瓶霉属、锁瑚菌属、Cladophialophora与有机质呈负相关;镰刀菌属与全氮呈负相关;湿伞属和锁瑚菌属与全磷呈正相关,而镰刀菌属与全氮呈负相关;湿伞属、外瓶霉属、锁瑚菌属与土壤水分呈正相关。Myxarium属与速效钾和有效磷呈正相关;毛舌菌属与pH和全钾呈正相关,而与有效磷、速效钾、全磷、有机质、土壤水分呈负相关。综上所述,土壤全磷、全钾、全氮及水分可能是影响手参根际土壤真菌群落组成的主要因子。

OM:有机质;TN:全氮;TP:全磷;TK:全钾;AN:碱解氮;AP:有效磷;AK:速效钾;PH:酸碱度;W:水分。箭头长短代表其与真菌的关联程度;箭头间夹角为锐角代表正相关,夹角为钝角代表负相关性,夹角为直角表示无相关性。OM:Organic matter;TN:Total nitrogen;TP:Total phosphorus;TK:Total potassium;AN:Alkali hydrolyzed nitrogen;AP:Available phosphorus;AK:Available potassium;W:Moisture content;The length of the arrow represents the degree of association with fungi;The acute angle,obtuse angle and right angle between the arrows represent the positive correlation,negative correlation and no correlation,respectively.

*表示相关在P<0.05水平显著。* mean significant correlation at P<0.05 level.
3 讨 论
本研究基于高通量测序对内蒙古3个分布区手参根际土壤真菌群落组成及多样性进行研究,并与土壤环境因子进行相关性分析。内蒙古不同分布区手参根际土壤真菌群落丰富度和多样性指数总体趋势表现为 A1>D3>W2,表明不同分布区手参根际土壤真菌群落存在一定差异;在门水平上,子囊菌门和担子菌门是手参根际土壤真菌优势类群,这与大多数兰科植物优势类群研究一致[26-27],说明子囊菌门和担子菌门真菌在一些兰科植物的土壤中具有普遍性。子囊菌门的群落构成主要为腐生菌,分泌多种不同酶,将土壤中难降解的有机质分解为二氧化碳、无机盐和简单有机物等,在土壤养分循环中起重要作用[28]。在属水平上,3个分布区中被孢霉属、湿伞属、毛舌菌属为丰富度最高的共有属,Myxarium属为阿鲁科尔沁旗特有属,认为被孢霉属、湿伞属、毛舌菌属是手参根际土壤真菌优势类群。本研究发现的内蒙古分布区手参根际土壤真菌优势类群与其他分布区明显不同[20,23]。
Knufia、外瓶霉属、锁瑚菌属、Cladophialophora与速效钾呈正相关;被孢霉属和镰刀菌属与碱解氮呈正相关;肉座菌属、外瓶霉属、锁瑚菌属、Cladophialophora与有效磷呈正相关;湿伞属、外瓶霉属、锁瑚菌属与有机质呈正相关,而肉座菌属、外瓶霉属、锁瑚菌属、Cladophialophora呈负相关;镰刀菌属与全氮呈负相关;湿伞属和锁瑚菌属与全磷呈正相关,而镰刀菌属呈负相关;湿伞属、外瓶霉属、锁瑚菌属与土壤水分呈正相关。Myxarium属与速效钾和有效磷呈正相关,是阿鲁科尔沁分布区的特有属,该分布区中的土壤速效钾和有效磷含量显著大于其他分布区,表明Myxarium属的丰富度大小与土壤理化条件有关系。另外,毛舌菌属是东乌旗丰富度最高的属,毛舌菌属与pH和全钾呈正相关;而与有效磷、速效钾、全磷、有机质、土壤水分呈负相关,在东乌旗中土壤pH和全钾含量与其他分布区相比较高;而土壤有效磷、速效钾、全磷、有机质、土壤水分的含量相比较低,说明土壤营养元素含量程度会影响毛舌菌属在手参根际土壤中的丰富度高低程度。湿伞属是翁牛特旗丰富度最高的属,湿伞属与全磷、有机质和水分呈正相关,但翁牛特旗的土壤全磷、有机质和水分含量与其他分布区相比较高;被孢霉属是阿鲁科尔沁旗丰富度最高的属,它与碱解氮呈正相关,但该分布区的土壤碱解氮含量相比较高,说明被孢霉属和湿伞属在手参根际土壤真菌群落中的丰富度不受土壤营养元素含量大小变化。本研究中,3个分布区的手参生长地理位置不同,海拔和生境等环境也不同,其主要分布在海拔891~1260 m的草甸、山坡林下、林间草地中。陈冉等[29]研究发现,根际微生物群落多样性不仅与土壤条件有关也与地区因素关系密切,主要受生态区的气候和地理位置影响[18,26]。肉座菌属和镰刀菌属是土壤中常见的致病菌[30-31],土壤中长期并大量存在以上菌属时,导致植物养分获取不足,生长力及抗病性下降,引起土壤中病原菌的侵害[32],表明这2个属在手参根际土壤真菌群落中的丰富度大小对手参生长发育具有潜在影响。镰刀菌属与碱解氮呈正相关,与全磷和全氮呈负相关;肉座菌属与有效磷呈正相关,与有机质呈负相关。因此,及时关注土壤营养元素变化、调控土壤中有机质及氮磷元素含量可能成为影响手参生长及预防病害的有效途径。
4 结 论
土壤全磷、全钾、全氮及水分可能是影响手参根际土壤真菌群落组成的驱动因子。本研究结果初步了解到内蒙古地区分布的手参生长土壤条件,根际土壤真菌群落特征,为手参根际土壤真菌与土壤环境因子相关性研究提供了新的结论,并可通过调控土壤环境因子进行人工栽培、生态种植等资源保护及可持续利用奠定了科学研究基础。
