西藏湿生扁蕾根际土壤微生物群落结构特征分析
2023-03-13张二豪达瓦秋宗徐雨婷禄亚洲
张二豪,达瓦秋宗,徐雨婷,尹 秀,禄亚洲,蔡 皓
(西藏农牧学院,西藏 林芝 860000)
【研究意义】根际是植物根系、土壤和微生物三者紧密结合、相互影响的微区域[1]。根际土壤作为植物营养吸收、生长发育的重要场所,其微生物群落结构组成及土壤理化因子直接或间接影响药用植物产量和品质[2-3]。湿生扁蕾[Gentianopsispaludosa(Hook. f.) Ma]藏药名“机合斗”,是一种传统藏药材,其味苦、性寒,富含丰富的口山酮类、黄酮类和三萜类化合物[4],具有利胆消黄、清热解毒,治疗胆囊炎、肝炎、肾炎、肠胃炎、腹泻和流感等功效[5],有重要的开发应用价值。因此,研究药用植物根际土壤微生物群落组成与土壤理化因子间的相关性对指导湿生扁蕾人工种植和筛选益生微生物类群具有重要意义。【前人研究进展】根际土壤微生物在土壤物质循环、能量代谢、植物生长发育、抗病和抗逆境等方面扮演重要角色[6]。江美彦等[7]研究表明,根际土壤细菌芽孢杆菌(Bacillus)和克雷伯氏菌(Klebsiellagrimont)对白芷的生长和产量均有显著的促进作用。柴加丽等[8]研究表明,根际土壤细菌华西肠杆菌(Enterobacterhuaxiensis)和假单胞菌属(Pseudomonas)对牧草具有多种促生特性。根际土壤益生微生物不仅能促进植物生长,还能促进植物中有效活性成分的合成和积累,如圆褐固氮菌(Azotobacterchroococcum)和印度梨状芽孢杆菌(Piriformosporaindica)能显著提高黄花蒿的生物量及活性成分青蒿素的含量[9];丛枝菌根真菌能促进薄荷植物中薄荷醇及罗勒植物中香精油的合成[10-11];嗜麦芽寡养单胞菌(Stenotrophomonasmaltophilia)和荧光假单胞菌(Pseudomonasfluorescens)能激发贯叶连翘次生代谢能力,进而提高其药用成分的产量[12]。根际土壤微生物群落的改变与土壤理化因子密切相关。研究表明,土壤全氮、全磷、全钾、速效磷和有机质是影响4种豆科植物根际土壤真菌群落组成的主要环境因素[13];土壤pH、氮和磷含量影响喜马拉雅紫茉莉根际土壤细菌群落结构组成[14];环境因子和植物种类是影响药用植物根际细菌群落多样性的主要驱动因素[15]。【本研究切入点】湿生扁蕾作为传统藏药材,相关研究主要集中在对其有效化学成分及药理学特性等方面,而有关其根际土壤微生物群落结构特性的研究尚未见报道。【拟解决的关键问题】本研究采用高通量测序技术对西藏3个地区的湿生扁蕾根际土壤微生物群落组成进行分析,探明其根际土壤微生物群落结构与土壤理化因子间的相关性,旨在为指导湿生扁蕾人工种植及益生微生物菌群的筛选提供理论依据。
1 材料与方法
1.1 研究区概况
本试验样地位于西藏林芝市的工布江达县、巴宜区和察隅县,各采样点的地理位置、气候类型和生态系统类型如表1所示。
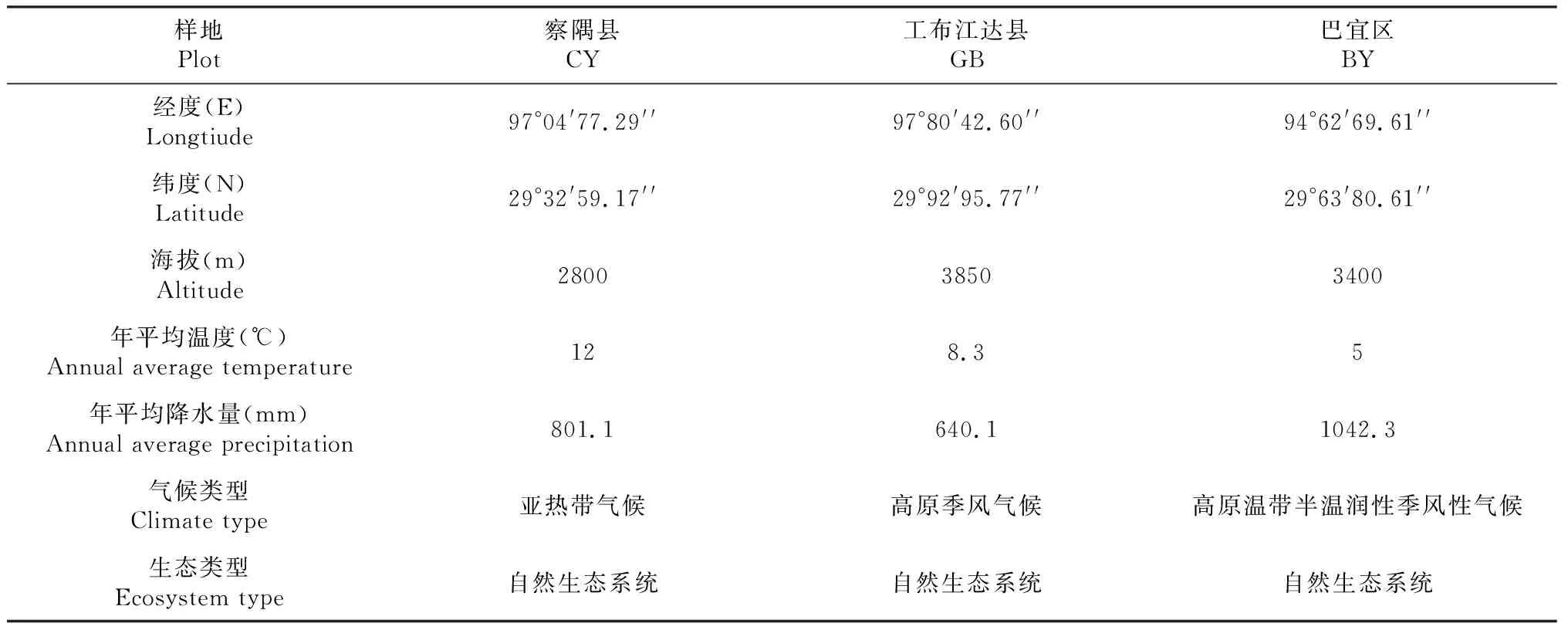
表1 样地基本概况
1.2 样品采集
2020年8月在每个试验样地按照随机多点混合的原则,选择健康、生长一致、处于花期的湿生扁蕾植株9株,采用抖根法收集湿生扁蕾根际土壤样品,并过直径2 mm滤筛,将混匀的根际土壤装入无菌袋中,并置入液氮中带回实验室,每个采样地3个样品重复,-80 ℃保存备用。
1.3 根际土壤理化性质测定
参考鲍士旦[16]的方法测定根际土壤理化性质,其中,pH采用酸度电位法进行检测,土壤总磷含量测定采用钼锑显色法,速效磷含量测定采用盐酸-氟化铵法,总氮含量测定采用凯氏定氮法,速效氮含量测定采用氯化钾浸提-分光光度法,总钾含量测定采用火焰光度法,速效钾含量测定采用醋酸铵浸提-火焰光度计法,土壤有机质含量测定采用高温外热重铬酸钾氧化-容量法。
1.4 根际土壤样品总DNA提取及PCR扩增
采用土壤基因组DNA提取试剂盒(天根生化科技(北京)有限公司,DP336)对土壤样品总DNA进行提取,0.8%琼脂糖凝胶电泳检测总DNA质量,用NanoDrop ND-2000(Thermo Scientific, Wilmington,USA)紫外分光光度计测定DNA浓度和纯度。细菌16S rRNA基因V3~V4区利用通用引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)进行扩增,真菌内源转录间隔区(Internally transcribed spacer,ITS)利用通用引物ITS1F(CTTGGTCATTTAGAGGAAGTAA)和ITS2R(GCTGCGTTCTTCATCGATGC)进行扩增。PCR扩增条件参考接伟光等[17]的方法进行。PCR扩增产物经1%琼脂糖凝胶电泳检测和胶回收后送至上海美吉生物医药科技有限公司进行测序。
1.5 生物信息学分析
基于QIIME2(2019.4)分析平台对高通量测序所得的原始数据进行去噪、去嵌合体、拼接和质控处理以获得高质量有效序列;在97%相似度水平下,利用Uparse(7.0.1090)对OTU(Operational Taxonomic Units)进行聚类分析,采用RDP classifier(2.11)贝叶斯算法基于细菌Greengenes数据库(Release 13.8, http://greengenes.secondgenome.com/)和真菌UNITE数据库(Release 8.0,https://unite.ut.ee/)对代表OTU序列进行分类学分析,利用Mothur(1.30.2)进行Alpha多样性分析,基于QIIME2(2019.4)分析平台和R语言(3.3.1)进行物种组成、Beta多样性和环境因子关联分析。基于Spearman相关系数(|r|>0.6,P<0.05),利用Gephi软件(V0.9.7)计算根际土壤微生物群落网络共现性和拓扑特性[18-20],利用SPSS 25.0软件对数据进行单因素方差分析。
1.6 核心微生物类群的界定
核心微生物类群可以从菌群共存、OTU丰度、功能冗余和系统发育等多个角度考虑,本研究参考许国琪等[21]的方法将3个样地中共存的微生物菌群定义为核心微生物菌群。基于R语言(3.3.1)绘制Venn图来展示样本间存在或不存在密切相关的分类单元,以实现对核心微生物菌群的探索[22]。
2 结果与分析
2.1 根际土壤理化性质
从表2可知,3个样地根际土壤pH在6.457~7.530,CY样品pH最低,偏酸性,而GB和BY样品偏碱性;CY样品中总磷和总氮含量最高,显著高于BY和GB样品,GB样品中总磷和总氮含量最低;GB样品中总钾含量最高,CY样品次之,BY样品最低;CY样品中速效氮和速效磷含量最高,显著高于BY和GB样品,但BY和GB样品间无显著差异;CY样品中速效钾含量最高,但与GB样品无显著差异,BY样品中速效钾含量最低,且显著低于CY和GB样品;3个样地根际土壤样品中有机质含量无显著差异。以上结果表明,3个样地根际土壤理化因子存在差异。

表2 湿生扁蕾根际土壤理化因子特征
2.2 根际土壤微生物样品测序结果及多样性分析
由表3可知,3个样地根际土壤细菌共获得42 924条有效序列,GB、CY和BY样品中的有效序列数均为14 308条,其测序平均长度分别为377、377和376 bp,测序覆盖度在97.29%~98.02%;3个样地根际土壤真菌共获得144 852条有效序列,GB、CY和BY样品中的有效序列数均为48 284条,其测序平均长度分别为232、237和238 bp,测序覆盖度在99.53%~99.87%,说明测序结果能反映样品中真实微生物群落结构组成和多样性。在97%相似度水平下,3个样地根际土壤共检测到4738个细菌OTUs,其中GB、CY和BY样品中分别检测到1369、1637和1732个OTUs;真菌共检测到3600个真菌OTUs,其中GB、CY和BY样品中分别检测到916、1367和1317个真菌OTUs。总体而言,GB样品中检测到的OTUs数最少,BY样品中检测到的细菌OTUs数最多,CY样品中检测到的真菌OTUs数最多。从图1可知,GB、CY和BY样品中共存803个细菌OTUs和170个真菌OTUs,分别占总数的16.95%和4.72%,GB、CY和BY样品特有的细菌OTUs数分别为158、239和451个,特有的真菌OTUs数分别为521、753和762个,说明不同地区湿生扁蕾根际土壤微生物群落组成存在差异。从图2可知,BY样品根际土壤细菌和真菌丰富度指数最高,显著高于GB样品,但与CY样品无显著差异;CY样品根际土壤细菌和真菌多样性指数最高,显著高于GB样品,CY与BY样品中根际土壤细菌多样性无显著差异,但其真菌多样性差异显著,说明不同地区湿生扁蕾根际土壤微生物多样性存在差异。主成分分析结果如图3所示,PC1和PC2对根际土壤细菌的差异解释率分别为63.42%和29.60%,累计贡献率达93.02%,GB、CY和BY样品位于不同象限中且距离较远,说明3个样地湿生扁蕾根际土壤细菌群落组成差异较大;PC1和PC2对根际土壤真菌的差异解释率分别为59.71%和32.55%,累计贡献率达92.26%,GB、CY和BY样品位于不同象限中且距离较远,说明3个样地湿生扁蕾根际土壤真菌群落结构组成差异较大。以上结果表明,不同地区湿生扁蕾根际土壤微生物群落结构组成差异较大。
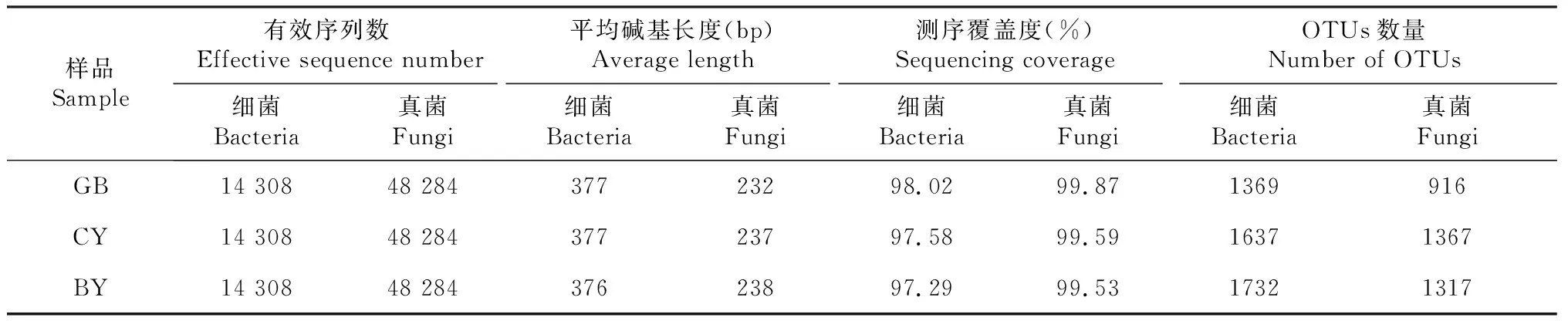
表3 湿生扁蕾根际土壤微生物OTUs及相关序列指数
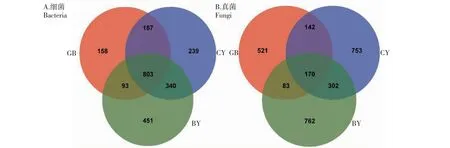
图1 湿生扁蕾根际土壤微生物OTUs韦恩图Fig.1 Venn diagrams of microbial OTUs detected in the rhizosphere soil of G. paludosa

图2 湿生扁蕾根际土壤微生物Alpha多样性指数Fig.2 Alpha diversity indexes of microbial community in rhizosphere soil of G. paludosa
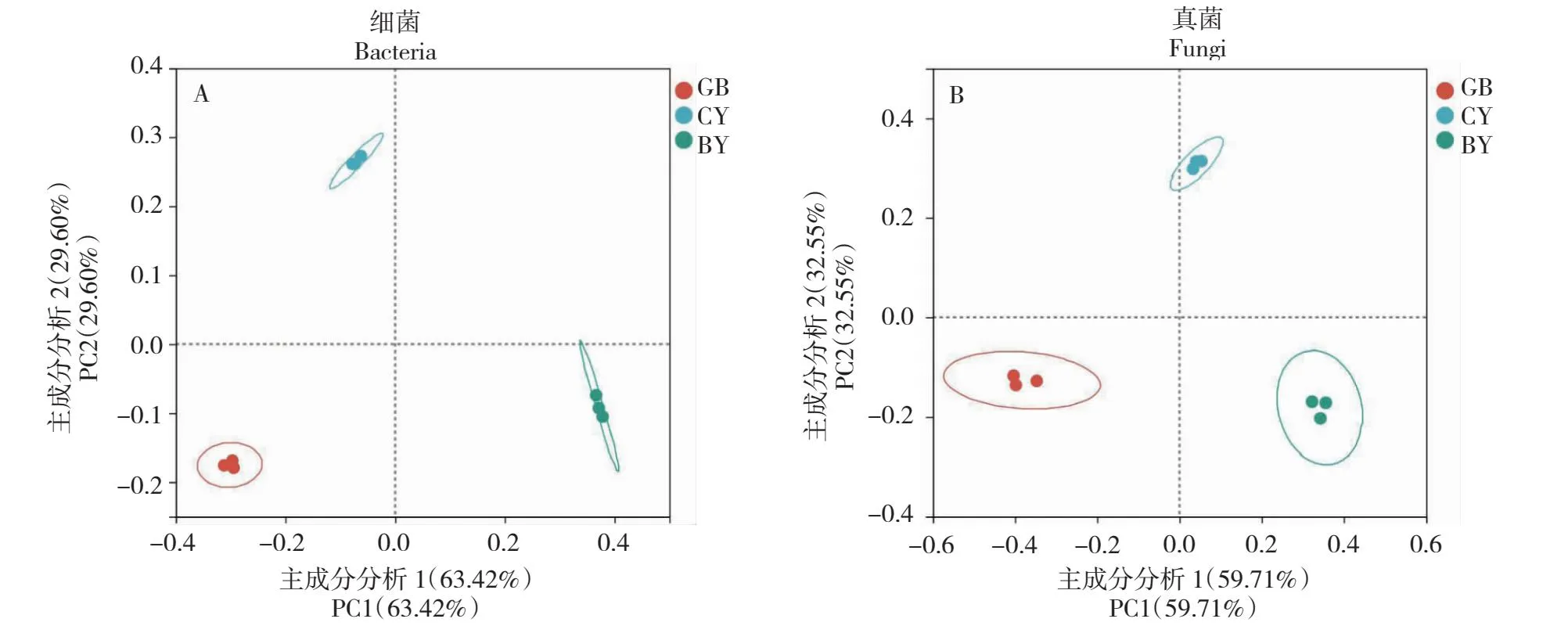
图3 湿生扁蕾根际土壤微生物主成分分析Fig.3 Principal component analysis of microbial community in the rhizosphere soil of G. paludosa
2.3 根际土壤微生物群落结构组成
根据根际土壤微生物基因组DNA测序结果,4738个细菌OTUs隶属30门78纲188目308科593属,3600个真菌OTUs隶属15门51纲133目295科634属。在门分类水平,由图4-A可知,在相对丰度>1%条件下,GB、CY和BY样品细菌共注释到7个门,分别是放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteriota)、粘球菌门(Myxococcota)和芽单胞菌门(Gemmatimonadota)。在相对丰度>1%条件下,GB样品细菌共注释到4个门,分别是放线菌门(55.21%)、变形菌门(20.07%)、厚壁菌门(20.24%)和芽单胞菌门(1.25%);CY样品细菌共注释到7个门,分别是放线菌门(41.70%)、变形菌门(32.28%)、厚壁菌门(12.06%)、绿弯菌门(3.83%)、酸杆菌门(3.41%)、粘球菌门(1.20%)和芽单胞菌门(1.79%);BY样品细菌共注释到6个门,分别是放线菌门(37.70%)、变形菌门(28.68%)、厚壁菌门(14.19%)、绿弯菌门(10.99%)、酸杆菌门(1.50%)和粘球菌门(2.32%)。以上结果表明,3个样地湿生扁蕾根际土壤细菌的第一优势菌门相同,均为放线菌门,但其相对丰度差异较大,且次优势菌门类型和相对丰度存在差异。由图4-B可知,在相对丰度>1%条件下,GB、CY和BY样品真菌共注释到6个门,其中能准确分类的有5个门,分别是子囊菌门(Ascomycota)、被孢菌门(Mortierellomycota)、担子菌门(Basidiomycota)、罗兹菌门(Rozellomycota)和球囊菌门(Glomeromycota)。在相对丰度>1%条件下,GB样品真菌共注释到5个门,其中能准确分类的有4个门,分别是子囊菌门(33.89%)、被孢菌门(29.25%)、担子菌门(28.86%)和罗兹菌门(4.40%);CY样品真菌共注释到4个门,其中能准确分类的有3个门,分别是子囊菌门(70.42%)、被孢菌门(13.85%)和担子菌门(13.93%);BY样品真菌共注释到6个门,其中能准确分类的有5个门,分别是子囊菌门(58.99%)、被孢菌门(8.32%)、担子菌门(5.63%)、罗兹菌门(16.31)和球囊菌门(2.74%)。以上结果表明,3个样地湿生扁蕾根际土壤第一优势真菌门相同,均为子囊菌门,但其相对丰度差异显著,且次优势菌门类型和相对丰度存在明显差异。综上所述,3个地区湿生扁蕾根际土壤微生物群落组成存在差异。
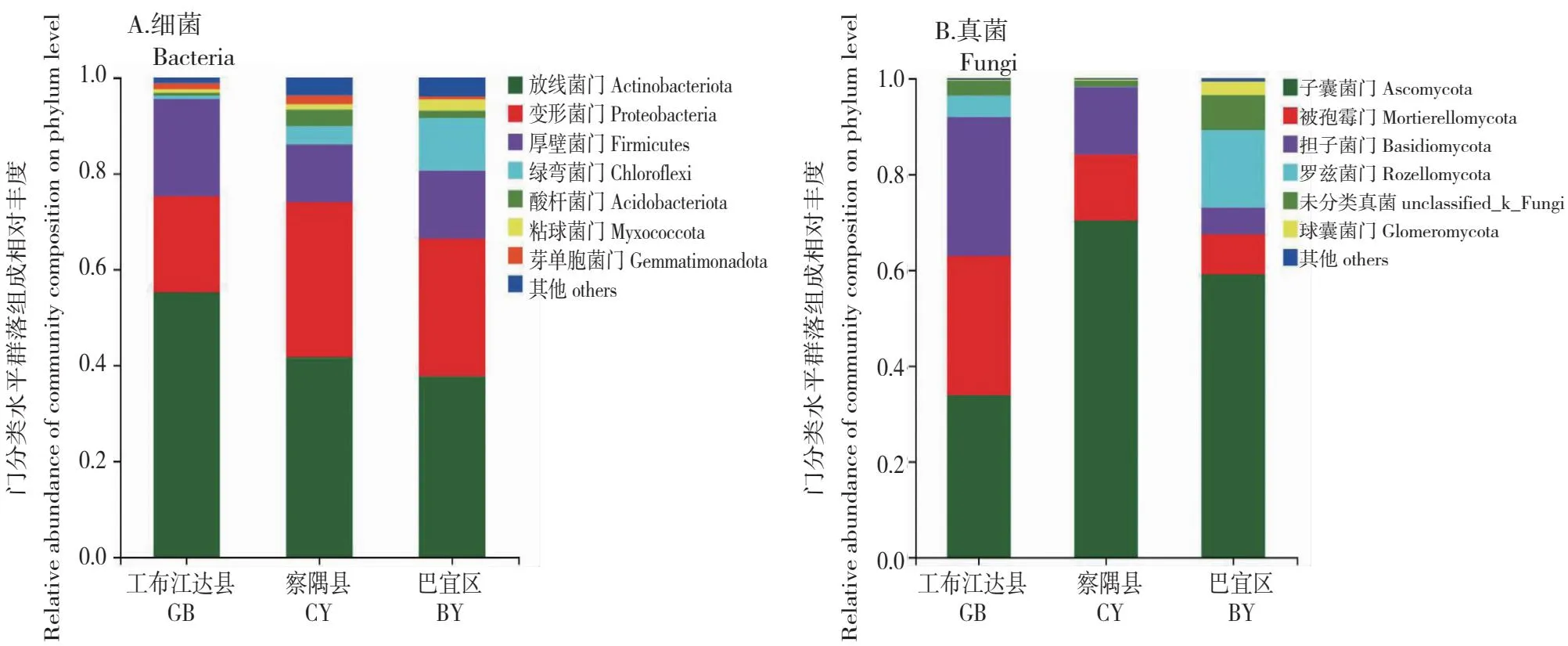
图4 基于门分类水平湿生扁蕾根际土壤微生物群落结构组成Fig.4 Composition of microbial community in the rhizosphere soil of G. paludosa at phylum level
由图5-A可知,在GB样品中,norank_f_67-14是第一优势细菌属,其相对丰度为9.80%,土壤红杆菌属(Solirubrobacte)、短芽孢杆菌属(Brevibacillus)和固定杆菌属(Conexibacter)是次优势细菌属,其相对丰度分别为8.17%、7.74%和7.66%;芽孢杆菌属(Bacillus)是CY样品中的第一优势菌属,其相对丰度为9.47%,链霉菌属(Streptomyces)和慢生根瘤菌属(Bradyrhizobium)是次优势细菌属,其相对丰度分别为4.40%和4.22%;罗姆布茨菌属(Romboutsia)是BY样品中的第一优势细菌,其相对丰度为7.21%,norank_f_67-14和固定杆菌属是次优势菌属,其相对丰度分别为5.77%和4.33%。由图5-B可知,在GB样品中,被孢霉属(Mortierella)是第一优势菌真属,其相对丰度为29.26%,产油菌属(Solicoccozyma)、青霉菌属(Penicillium)和担子菌酵母属(Naganishia)是次优势真菌属,其相对丰度分别为11.01%、6.18%和4.41%;在CY样品中,被孢霉属是第一优势菌属,其相对丰度为13.84%,烧瓶状霉属(Lecythophora)、赤霉菌属(Gibberella)和截盘多毛孢属(Truncatella)是次优势真菌属,其相对丰度分别为5.33%、5.23%和5.09%;在BY样品中,未分类罗兹菌门(unclassified_p_Rozellomycota)是第一优势菌属,其相对丰度为15.85%,被孢霉属和截盘多毛孢属是次优势菌属,其相对丰度分别为8.17%和6.19%。以上结果表明,不同地区湿生扁蕾根际土壤优势微生物菌群及其相对丰度存在明显差异。
2.4 样品根际土壤核心微生物菌群分析
由图6-A可知,在属分类水平,3个样地中共存的核心细菌属有322个,占总数的59.74%,其相对丰度前10的有norank_f_67-14、固定杆菌属、芽孢杆菌、土壤红杆菌属、Gaiella属、norank_f_norank_o_Gaiellales、链霉菌属、短芽孢杆菌属、罗姆布茨菌属和慢生根瘤菌属。由图6-B可知,3个样地中共存的核心真菌属有175个,占总数的27.60%,其相对丰度前10的有被孢霉属、unclassified_p_Rozellomycota、产油菌属、截盘多毛孢属、赤霉菌属、unclassified_p_Ascomycota、古根菌属(Archaeorhizomyces)、青霉菌属、茎点霉属(Phoma)和烧瓶状霉属。
基于Pearson算法对根际土壤理化因子与相对丰度前20的核心微生物菌群进行相关性分析,由图7-A可知,AK含量与链霉菌属、慢生根瘤菌属和假诺卡氏菌属(Pseudonocardia)等5个属的相对丰度呈显著正相关,与罗姆布茨菌属、分枝杆菌属(Mycobacterium)和类诺卡氏菌属(Nocardioides)等5个属呈显著负相关;AP含量与慢生根瘤菌属、假诺卡氏菌属和芽孢杆菌属等4个属的相对丰度呈显著正相关;pH与芽孢杆菌属、链霉菌属、慢生根瘤菌属和假诺卡氏菌属等5个属的相对丰度呈显著负相关,而与分枝杆菌属的相对丰度呈显著正相关;TK含量与固定杆菌属、土壤红杆菌属、链霉菌属和短芽孢杆菌属等9个属的相对丰度呈显著正相关,与罗姆布茨菌属(Romboutsia)、分支杆菌属和类诺卡氏菌属等5个属的相对丰度显呈著负相关;TN和TP含量与类芽孢杆菌属(Paenibacillus)、固定杆菌属和norank_f_67-14等5个属的相对丰度呈显著负相关,而与芽孢杆菌属和慢生根瘤菌属的相对丰度呈显著正相关;AN含量与固定杆菌属和norank_f_67-14的相对丰度呈显著负相关,与慢生根瘤菌属和norank_f_norank_o_norank_c_MB-A2-108的相对丰度呈显著正相关;但SOM含量与相对丰度前20的核心细菌菌群间无显著相关性。由图7-B可知,AK含量与Tausonia属的相对丰度呈显著正相关,而与Ramophialophora属、unclassified_k_Fungi和unclassified_p_Rozellomycota的相对丰度呈显著负相关;赤霉菌属和烧瓶状霉属等4个属的相对丰度与AP含量显著正相关;pH与烧瓶状霉属和unclassified_p_Ascomycota的相对丰度呈显著负相关,而与unclassified_p_Rozellomycota和unclassified_k_Fungi呈显著正相关;TK含量与被孢霉属、产油菌属、青霉菌属和担子菌酵母属(Naganishia)等7个属的相对丰度呈显著正相关,而与截盘多毛孢属(Truncatella)、古根菌属和Ramophialophora属等5个属的相对丰度呈显著负相关;TN和TP含量与赤霉菌属、烧瓶状霉菌属和光黑壳属等6个属的相对丰度呈显著正相关,而与青霉菌属、茎点霉属、unclassified_o_GS11和担子菌酵母属的相对丰度呈显著负相关;AN含量与光黑壳属、烧瓶状霉菌属和unclassified_p_Ascomycota的相对丰度呈显著正相关,而与茎点霉属的相对含量呈显著负相关。以上结果表明,SOM含量不影响根际土壤微生物的相对丰度,但其它环境因子与微生物的相对丰度密切相关。
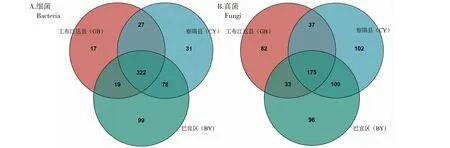
图6 基于属分类水平湿生扁蕾根际土壤微生物韦恩图Fig.6 Venn diagrams of microbial genus detected in the rhizosphere soil of G. paludosa
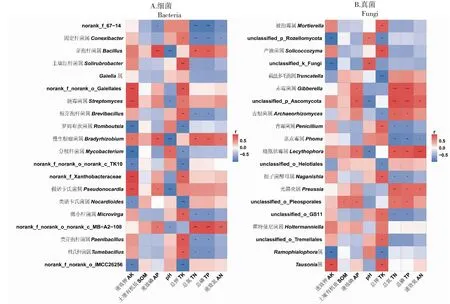
*表示P<0.05, **表示P<0.01,***表示P<0.001。下同。* represents P<0.05, ** represents P<0.01, and *** represents P<0.001.The same as below.
2.5 根际土壤微生物相关性网络分析
从图8-A可知,3个样地根际土壤细菌相关性网络结构中存在696个节点和8950条边,平均度为25.718,网络直径为13,平均路径长度为4.38,平均聚类系数为0.493,模块化指数为0.541,网络具有模块化结构,根际土壤细菌菌群相对聚集,其正相关关系占比68.22%,负相关关系占比31.78%,说明网络中细菌属的协同作用大于拮抗作用。根际土壤细菌以变形菌门(35.63%)、放线菌门(34.91%)、绿弯菌门(6.47%)、厚壁菌门(5.46%)、酸杆菌门(5.32%)和粘球菌门(4.45%)为主。由图8-B可知,3个样地根际土壤真菌相关性网络结构中存在230个节点和1737条边,平均度为15.104,网络直径为16,平均路径长度为5.703,平均聚类系数为0.579,模块化指数为0.587,网络具有模块化结构,其正相关关系占比79.97%,负相关关系占比20.03%,说明网络中真菌属的协同作用大于拮抗作用。根际土壤真菌以子囊菌门(69.13%)、担子菌门(14.78%)和被孢霉门(6.52%)为主。
由图9-A可知,核心细菌与普通细菌相关性网络结构中存在526个节点和4378条边,平均度为16.646,网络直径为12,平均路径长度为4.343,平均聚类系数为0.627,模块化指数为0.699,网络具有模块化结构,核心细菌属相对分散,但与普通细菌间的相互作用较高,占网络总边数的49.863%,根际土壤细菌菌群间以正相关关系为主,占比76.31%。从整个网络结构图来看,根际土壤核心细菌属中的隐孢囊菌属(Cryptosporangium)、贪噬菌属(Variovorax)、长孢菌属(Longispora)、酸杆菌属(Acidibacter)和Candidatus等处于关键地位。由图9-B可知,核心真菌与普通真菌相关性网络结构中存在567个节点和4360条边,平均度为13.379,网络直径为13,平均路径长度为4.399,平均聚类系数为0.755,模块化指数为0.858,网络具有模块化结构,核心真菌属相对分散且与普通真菌间的相互作用较低,占网络总边数的15.688%,根际土壤真菌菌群间以正相关关系为主,占比90.41%。从整个网络结构图来看,根际土壤核心真菌中的Dactylonectria属、黑星菌属(Venturia)、Paracylindrocarpon和担子菌酵母属(Naganishia)等处于关键地位。

绿色连线表示负相关,红色连线表示正相关,节点大小与平均度呈正比。下同。The green line indicates the negative correlation, the red line indicates the positive correlation, and the size of node is proportional to the degree.The same as below.

A.核心细菌-普通细菌互作分析;B.核心真菌-普通真菌互作分析。A. Interaction analysis of core bacteria-common bacteria; B. Interaction analysis of core fungi-common fungi.
2.6 根际土壤微生物群落结构与土壤理化因子相关性分析
由图10-A可知,根际土壤细菌群落结构组成与pH、AK、TK、TP、TN和AN含量呈显著正相关,但与SOM含量无显著相关性;根际土壤细菌α多样性与TK、TP和TN含量呈显著正相关,但与其它环境因子无显著相关性。由图10-B可知,根际土壤真菌群落结构组成与SOM含量无显著相关性,但与其它环境因子呈显著正相关,根际土壤真菌α多样性与TK、TP 、TN和AN含量呈显著正相关,但与其它环境因子无显著相关性。以上结果表明,SOM含量不影响根际土壤微生物群落结构组成和α多样性,TK、TP 和TN含量是影响根际土壤微生物多样性的关键因子。
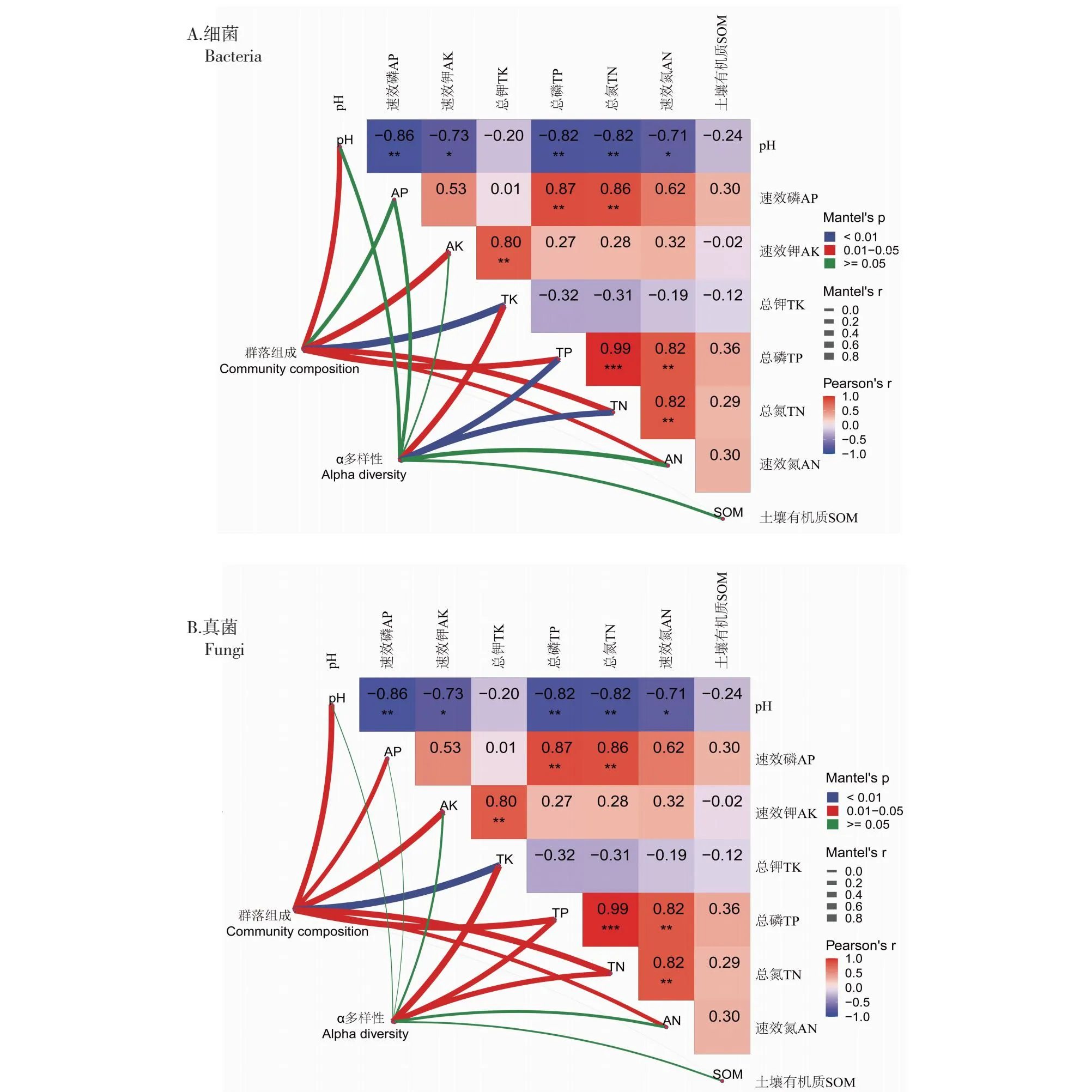
图10 根际土壤微生物群落结构组成和α多样性与土壤理化因子相关性Fig.10 Correlation between physical and chemical properties and composition and alpha of microbial community in the rhizosphere soil
3 讨 论
根际土壤微生物作为土壤生态系统的重要组成部分,在土壤物质循环、能量代谢、植物生长发育、抗病和抗逆境等方面扮演重要角色[6]。微生物多样性有利于维持微生物群落结构稳定性和功能多样性,而微生物群落结构组成调控土壤行使不同的生态功能,进而影响土壤质量[23-24]。研究表明,根际土壤微生物群落组成和多样性与植物类型、产地、海拔和生态区气候等因素密切相关[25-26]。本研究结果表明,3个产地湿生扁蕾根际土壤微生物群落结构组成和多样性存在差异,共有的细菌OTUs和真菌OTUs分别为803和170个,仅占总数的16.95%和4.72%,BY样品根际土壤细菌和真菌丰富度指数最高,而CY样品根际土壤细菌和真菌多样性指数最高。根际土壤理化因子是影响土壤微生物群落结构组成和多样性的关键因素。李茜等[27]研究表明,全钾含量是影响3年生人参根际土壤细菌群落组成的主要环境因子;李思等[28]研究表明pH和全磷影响白木香根际土壤细菌群落丰度和多样性;苏贝贝等[13]研究表明,全氮、全磷、全钾、速效磷和有机质是影响4种豆科植物根际土壤真菌群落组成的主要环境因子。本研究发现,3个产地湿生扁蕾根际土壤理化因子存在差异,且TK、TP和TN含量影响根际土壤微生物群落结构和多样性。在群落结构组成上,3个产地湿生扁蕾根际土壤中的优势微生物类群主要集中在放线菌门、变形菌门、厚壁菌门、子囊菌门、被孢霉门和担子菌门,但其相对丰度差异较大。说明根际土壤理化因子和空间因素是导致不同产地湿生扁蕾根际土壤微生物群落结构和多样性差异的关键因素。
有研究表明,核心微生物类群在维持土壤生态功能稳定性和抵御病原菌入侵中扮演重要角色[29-31]。目前,有关核心微生物组的研究主要集中在属及属以上分类水平[32],本研究将3个产地湿生扁蕾根际土壤中共有的微生物属定义为核心微生物菌群,从微生物类型上来看,湿生扁蕾根际土壤核心细菌菌群种类明显多于核心真菌菌群。norank_f_67-14、固定杆菌属、芽孢杆菌、土壤红杆菌属、Gaiella属、norank_f_norank_o_Gaiellales、链霉菌属、短芽孢杆菌属、罗姆布茨菌属和慢生根瘤菌属等是湿生扁蕾根际土壤中的核心细菌菌群;被孢霉属、unclassified_p_Rozellomycota、产油菌属、截盘多毛孢属、赤霉菌属、unclassified_p_Ascomycota、古根菌属(Archaeorhizomyces)、青霉菌属、茎点霉属(Phoma)和烧瓶状霉属等是湿生扁蕾根际土壤中的核心真菌菌群。有研究表明,固定杆菌属有助于提高土壤可溶性有机碳含量[33];芽孢杆菌能促进植物生长和药用成分的合成[34-35];土壤红杆菌属与土壤质量提升密切相关[36];慢生根瘤菌属是禾本科植物中重要的联合固氮菌[37];链霉菌对番茄生长和抗性有促进作用[38];青霉菌属能够抑制植物病害,并促进樱桃和玉米等植物的生长[39-40]。以上结果表明,湿生扁蕾根际土壤核心微生物菌群可能在促进植物生长、药用成分合成及增强植物抗逆性和抗病性中扮演重要角色。
微生物网络互作分析已被广泛用于各种环境微生物间的潜在相互作用研究,通过网络的拓扑特性可以反映微生物群落组成的多样性和复杂性,探索微生物群落中的关键类群;关键类群是指生态功能与相对丰度不呈正比但在群落中有巨大影响的微生物类群[41-42]。有研究表明,微生物互作对植物生长发育和抵御病原微生物入侵等具有重要意义[43-44]。本研究结果表明,湿生扁蕾根际土壤微生物具有较强的模块化结构且以协同作用为主,根际土壤细菌关键类群包括变形菌门、放线菌门、绿弯菌门、厚壁菌门、酸杆菌门和粘球菌门,其中变形菌门和放线菌门中的关键类群最多,根际土壤真菌关键类群包括子囊菌门、担子菌门和被孢霉,其中子囊菌门中的关键类群最多,这与Wang等[45]的研究结果相似。变形菌门和放线菌门具有固氮、生防、促进植物生长等功能[46-47],子囊菌门是参与土壤有机质分解的主要真菌群落,与植物根际氮循环、植物菌根的形成和植物的生长发育息息相关[48],说明这些关键类群在根际土壤中扮演着重要的生物学功能。核心微生物菌群相对分散,其核心微生物关键类群主要包括相对丰度较低的隐孢囊菌属、贪噬菌属、长孢菌属、Dactylonectria属、黑星菌属(Venturia)、Paracylindrocarpon和担子菌酵母属等,说明这些相对丰度较低的核心微生物菌群在根际土壤中发挥着重要的生态功能[41-42]。有研究表明,生物和非生物因子直接作用于核心微生物菌群,通过微生物群落之间的相互作用将影响传递给整个微生物群落[44],微生物群落间的互作是生态系统物质循环、能量流动和信息传递的基础[49]。本研究发现,根际土壤核心微生物与普通微生物间具有典型的模块化结构且以协同作用为主,这与许国琪等[21]的研究结果一致。湿生扁蕾根际土壤核心细菌与普通细菌间的互作程度高于核心真菌与普通真菌间的互作程度,说明根际土壤细菌比真菌更加活跃,这可能与根际细菌参与真菌群落结构塑造有关[45]。
4 结 论
不同产地湿生扁蕾根际土壤细菌和真菌群落组成及多样性存在差异;总钾、总磷和总氮含量是影响根际土壤微生物群落组成及多样性的关键因子;湿生扁蕾根际土壤微生物菌群具有模块化结构且以协同作用为主,其关键类群主要包括变形菌门、放线菌门、子囊菌门和担子菌门。本研究阐明了湿生扁蕾根际土壤微生物群落结构特征,分析了根际土壤理化因子与微生物群落组成、α多样性和核心微生物菌群间的相关性,对充分挖掘益生微生物资源和指导湿生扁蕾人工种植具有重要理论意义。
