基于转录组分析高温胁迫下云南山茶抗氧化酶相关基因变化规律
2023-03-13林先玉
柏 松,张 冰,林先玉,屈 燕
(西南林业大学园林园艺学院/国家林业和草原局西南风景园林工程技术研究中心/云南省功能性花卉资源及产业化技术工程研究中心,昆明 650224)
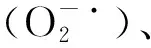
1 材料与方法
1.1 供试材料
供试材料为野生云南山茶1年生实生苗,种子采自四川省盐边县格桑拉园艺场(101°35′96″E、27°08′76″N,海拔2445 m),播种于18 cm×13 cm×16 cm的塑料盆中,生长环境为西南林业大学后山树木园温室大棚。选取的云南山茶幼苗长势一致,生长状况良好且无病虫害。
1.2 试验方法
1.2.1 试验设计 将苗木放置于25 ℃、湿度70%的人工气候培养箱中缓苗7 d,每天7:00—19:00光照强度为4000 Lux,其余时间关闭光照系统。缓苗7 d后将温度设置为40 ℃,其他条件不变。将0 h的试验材料作为对照,40 ℃的试验材料作为高温处理组。
在高温处理0、24、72、re48 h(恢复48 h)、re72 h(恢复72 h)后,对试验材料进行随机取样,每个时间点取3个重复,所取叶片洗净剪碎混匀后,用锡箔纸迅速包裹好,放置于液氮中速冻,后装于填写有样品信息的塑封袋中,然后放置于超低温-80 ℃冰箱中保存待用,用于测定各项生理指标和转录组测序。
1.2.2 生理指标的测定 生理指标的测定方法均参照李合生[12]的试验方法:丙二醛(MDA)活性采用硫代巴比妥酸(TBA)显色法测定,超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光还原法测定,过氧化物酶(POD)活性采用愈创木酚法测定,过氧化氢酶(CAT)活性采用紫外吸收法测定。
1.2.3 转录组测序 预试验发现,云南山茶在40 ℃的高温胁迫下,抗氧化酶活性会发生显著变化,且在0、24、72和re48 h抗氧化酶的变化显著,故选择云南山茶在40 ℃胁迫下的0、24、72、re48 h 4个时间节点进行转录组测序,每组3个重复共21个样品,由武汉迈维生物科技有限公司进行转录组测序。
Illumina测序平台测序后获得Raw data,使用fastp软件对Raw data过滤、筛选、检查后获得clean reads,然后用Trinity软件拼接Clean reads、Corset层次聚类后获得Unigene,随之将Unigene分别与KEGG、NR、Swiss-Prot、GO、KOG等数据库进行比对,获得注释信息,之后使用DESeq2进行样品差异表达分析,获得差异表达基因集;以“|log2Fold Change|≥1,且FDR<0.05”为标准筛选差异基因。最后统计不同时间点处理组中的差异表达基因,并对其进行注释和富集分析。
从差异基因中筛选出被KEGG注释到的抗氧化酶基因,分析其所在的KEGG通路,对这些基因的表达量进行聚类分析,筛选出与抗氧化酶活性变化规律一致的基因,并进一步对筛选出的基因与抗氧化酶活性进行相关性分析。
Total RNA提取采用TIANGEN RNAprep Pure多糖多酚植物总RNA提取(DP441)试剂盒;cDNA合成采用GoldenstarTMRT6 cDNA Synthesis Kit试剂盒;qRT-PCR引文设计使用软件Premier Premier 6.0(引物序列见表1),荧光定量仪器为LightCycler480实时荧光定量PCR仪,使用擎科生物2×T5 Fast qPCR Mix(SYBR Green I)反应体系,程序设定为95 ℃/2 min;95 ℃/30 s,56 ℃/15 s,72 ℃/30 s,35个循环,以Actin基因为内参基因,表达量计算采用2-ΔΔCt法。

表1 qRT-PCR 验证差异表达基因引物序列
1.2.4 数据统计与分析 采用Microsoft Excel 2017记录统计试验数据;采用R语言软件(4.1.3版本)对抗氧化酶活性进行多重比较并绘制柱形图,对抗氧化酶基因进行聚类分析并绘制热图和聚类趋势图,对抗氧化酶与相关基因进行Pearson相关性的显著性检验并绘制相关性图。
2 结果与分析
2.1 高温胁迫对云南山茶丙二醛(MDA)含量及抗氧化酶活性的影响
如图1-A所示,随着高温处理的进行,MDA含量在高温胁迫24 h时,比0 h显著降低(P<0.05),在胁迫72 h时,MDA含量维持着相对较低的水平,在re48 h时,MDA含量显著上升(P<0.05),在re72 h时,MDA含量到达最高值,为22.65 mmol/g。
如图1-B所示,云南山茶叶片的POD活性在40 ℃高温胁迫下呈先上升后下降,在恢复期间呈显著上升趋势(P<0.05)。72 h时,POD活性最低,而re72 h时,POD活性达到最高,为83.33 U/(g·min);如图1-C所示,SOD活性高温胁迫24 h比0 h时显著升高(P<0.05),呈先上升后下降趋势,并且在re48 h时达到最大值,为2676.76 U/(g·h);如图1-D所示,与0 h时相比,CAT活性在胁迫24 h时呈较低水平,并且显著低于0 h时,在高温胁迫至72 h时,CAT活性大幅上升,在re48 h时,CAT活性显著降低,而在re72 h时,CAT活性显著升高(P<0.05),达到最高水平,为12.78 U/(g·min)。
不同小写字母表示同一指标不同时间点差异显著(P<0.05)。Different lowercases indicate significant differences for the same indicator at different time points(P<0.05).
2.2 转录组测序结果分析及荧光定量验证
经过组装过滤得到的高质量reads的碱基数为150.84 Gb,GC比例为43.97%~45.10%,碱基组成均衡。各样品碱基质量值达到Q20以上水平的碱基数目占比均大于97%,达到Q30以上水平的占比均大于94%,说明各样品测序质量高。
随机选取9个基因进行q-PCR验证,9个基因的表达趋势与RNA-seq结果一致,表明RNA-seq结果可信度较高。
2.3 抗氧化酶差异基因筛选
通过KEGG功能注释对Unigene进行初步筛选,在40 ℃胁迫下,与0 h时对比, 24 h时与POD相关的差异基因有49条,其中下调表达有35条,上调表达有14条, 72 h时与POD相关的差异基因有60条,其中26条下调表达,34条上调表达;24 h时与SOD相关的差异基因有19条,其中下调表达有8条,上调表达有11条,72 h时与SOD相关的差异基因有13条,其中下调表达有7条,上调表达有6条;24 h时与CAT相关的差异基因有10条,其中下调表达有9条,上调表达有1条,72 h时与CAT相关的差异基因有9条,其中下调表达有8条,上调表达有1条。
2.4 抗氧化酶相关基因相对表达量变化规律
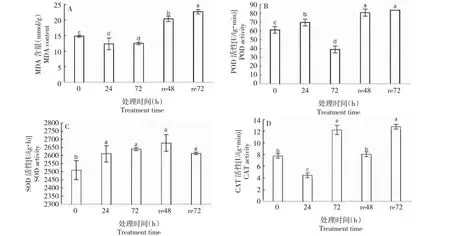
2.4.1 POD相关基因 云南山茶在40 ℃高温胁迫下,筛选出POD相关的基因76条。如图2所示,聚类热图结果将基因划分为8个类型(Cluster 1,Cluster 2,Cluster 3,……Cluster 8)。Cluster 8中基因表达量变化趋势和POD活性的变化趋势相同(图1-B,图2);而Cluster 2中基因的表达量变化趋势与POD活性的变化趋势相反。通过表2相关性分析发现,Cluster 8中CrPOD51的表达量与POD活性存在极显著强正相关(P<0.01,r=0.727),Cluster 2中CrPOD2等27条基因与POD活性呈极显著强负相关(P<0.01,|r|>0.8),4条基因呈显著强负相关(0.01
2.4.2 SOD相关基因 如图3所示,22条与SOD相关的基因根据聚类结果可大致分为4个类型(Cluster 1,Cluster 2,……Cluster 4),Cluster 1包含CrSOD1等5条基因,在24 h时均上调表达,在re48 h时下调表达,变化趋势与SOD活性变化趋势一致(图1-C,图3);类型4包含CrSOD5等8条基因,在24 h时下调表达,在re48 h时上调表达,变化趋势与SOD活性变化趋势相反。如表3所示,将Cluster 1和Cluster 4中的基因与SOD活性进行相关性分析,CrSOD10与SOD活性呈极显著正相关(P<0.01,r=0.71),CrSOD20与SOD活性呈极显著正相关(P<0.01,r=0.9),CrSOD17与SOD活性呈显著负相关(P<0.05,r=-0.67)。
0h-1,0h-2,0h-3……re48h-3,表示从0 h至re48 h不同时间点的不同样本;Cluster 1,Cluster 2,……Cluster 8 表示根据基因表达量变化趋势分类的不同类别。彩色热图表示相关基因在不同时期的相对表达量,从红色到蓝色表示相对表达量从高到低。下同。0h-1,0h-2,0h-3...... re48h-3 represent different samples at different time points from 0 h to re48 h; Cluster 1, Cluster 2,...... Cluster 8 represents different groups classified according to trends in gene expression.The color heat map represents the relative expression levels of related genes at different times, and the relative expression levels from red to blue indicate from high to low. The same as below.
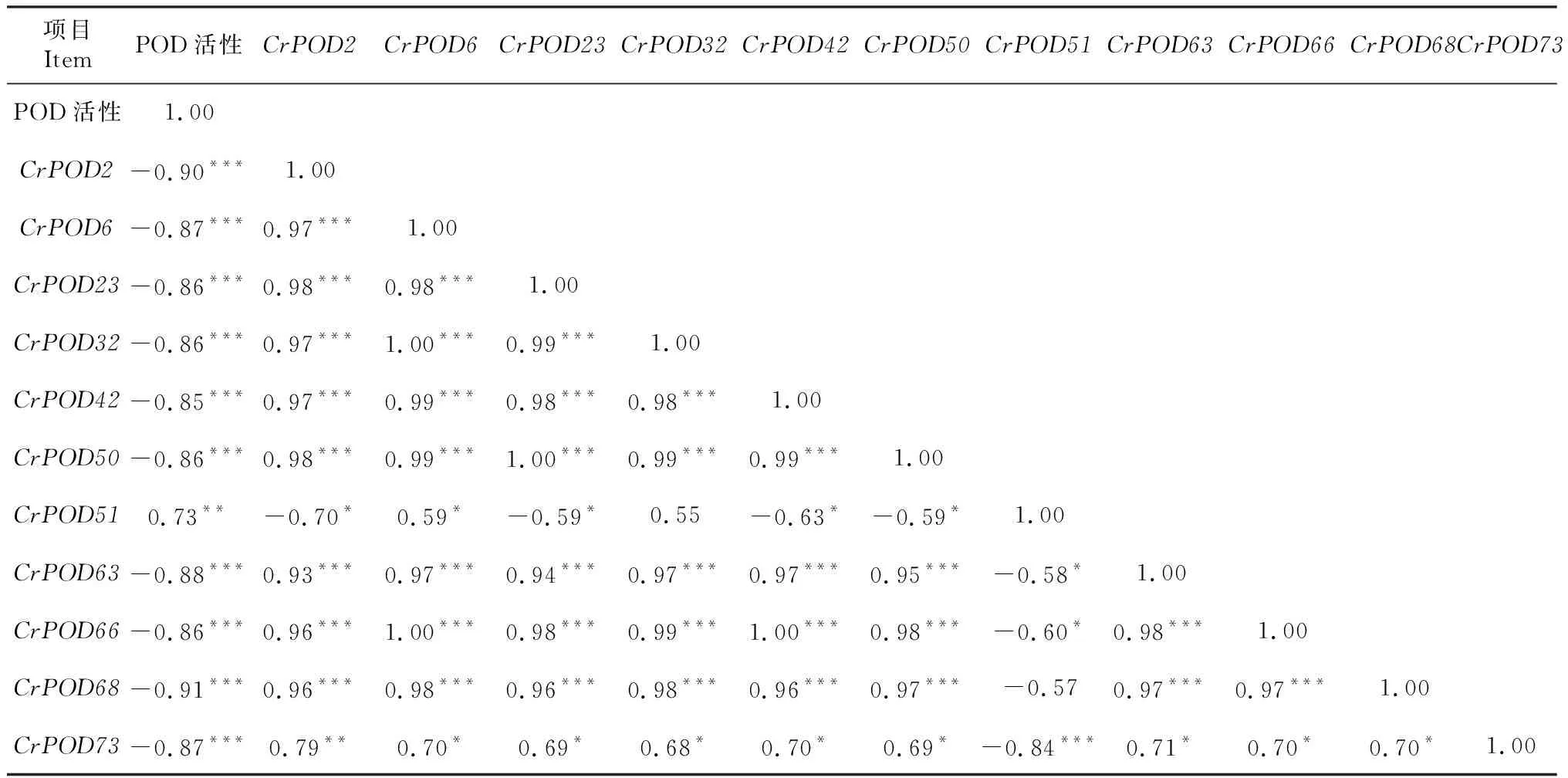
表2 相关基因与POD活性的相关性分析
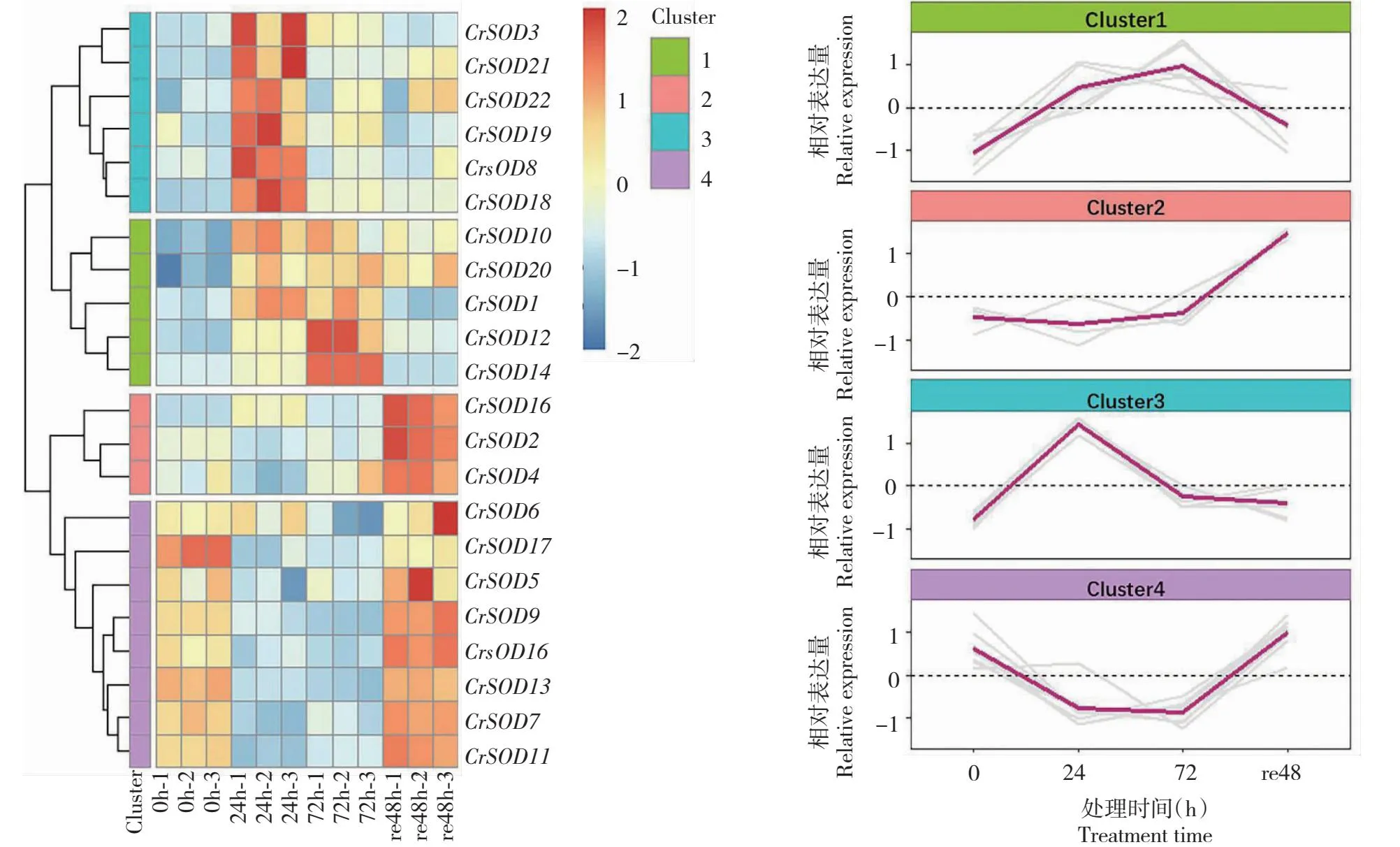
图3 SOD相关基因表达热图及聚类趋势图Fig.3 Heat map and cluster trend map of SOD-related gene expression

表3 相关基因与SOD活性的相关性分析
2.4.3 CAT相关基因 云南山茶在40 ℃的高温处理下,筛选与CAT相关的基因10条。如图4所示,Cluster 1包含CrCAT1等9条基因,在24 h时下调表达,在re48 h时上调表达;CrCAT9基因在24 h时上调表达,在72 h时和re48 h时均下调表达。在这些基因当中,未发现与CAT酶活性变化规律一致的基因。
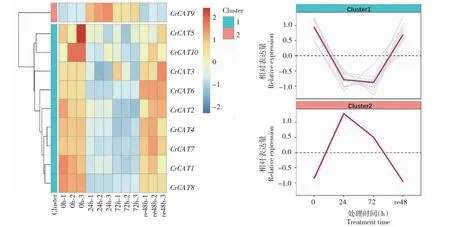
图4 CAT相关基因表达热图及聚类趋势图Fig.4 Heatmap and cluster trend map of CAT-related gene expression
3 讨 论
高温胁迫下,植物会通过提高抗氧化酶活性来抵御高温胁迫对植株产生危害[13-18]。本研究中,云南山茶在高温胁迫下抗氧化酶活性总体呈升高趋势。高温处理过程中,云南山茶通过增强SOD活性清除活性氧,对高温胁迫做出响应。POD活性和CAT活性在高温胁迫期间分别在24和72 h时显著上升,两者协调发挥作用,清除云南山茶体内过多的H2O2,这与傅巧娟等[18]研究的高温胁迫下帝王等品种的一串红抗氧化酶活性的变化趋势相同。
对基因富集的KEGG通路分析发现,SOD和CAT的差异基因主要集中于过氧化物酶体通路中。在过氧化物酶体中,活性氧的稳态很大程度上通过清除系统调节[19]。非生物胁迫过程中,过氧化物酶体通过靶向信号(PTS)指引核基因编码的酶分子前体进入体内,从而合成过氧化氢酶、脂肪酸β-氧化酶等酶[20]。高温胁迫可能会刺激云南山茶体内定位信号PTS1产生,指引合成SOD、CAT分子前体,然后转运到过氧化氢酶体,促进SOD、CAT基因上调表达,从而提高SOD、CAT含量及其表达活性,进而清除活性氧,这与朱晨璐等[11]的研究结果一致。POD相关的差异基因主要集中在苯丙烷生物合成通路中,POD参与木制素的合成过程,对于植物抵御非生物胁迫有重要意义[21]。在高温胁迫下,云南山茶POD相关基因表达量上调,参与合成木质素,增强云南山茶对高温的抵御能力。这与尹丽兴[22]的研究结果一致。
非生物胁迫会引起植物体内抗氧化酶相关基因发生变化,从而调控抗氧化酶SOD、POD、CAT含量及其表达活性,抵御高温胁迫对植物体的危害[23-24]。本研究中,在高温胁迫期间,CrPOD51、CrSOD10等基因表达量上调,调控POD和SOD活性上升,在后续试验过程中与POD和SOD活性变化趋势保持一致,并有着显著相关性。对突变体杂交组合水稻在高温下抗氧化酶基因的研究发现,CAT和POD相关基因的表达量呈上下波动趋势,本研究中的CrPOD51等基因有相同的情况,从分子角度寻找抗氧化酶基因表达量降低的原因有待于进一步研究[25]。本研究未发现与CAT活性变化规律一致的CAT相关基因,但CrCAT9基因在胁迫期间表达量上调。此外,还有部分抗氧化酶基因表达量的变化趋势和SOD、POD活性变化趋势相反且显著负相关,CAT大部分基因在胁迫期间表达量下调,这部分基因是否参与了抗氧化酶的调节过程还有待于进一步研究。
4 结 论
40 ℃高温胁迫下,云南山茶能够通过提高POD、SOD、CAT活性来抵御高温胁迫,CrSOD1、CrSOD10等基因在SOD活性调控过程中发挥了重要作用,CrPOD51、CrPOD58等基因则与POD活性有关。这些基因可能在云南山茶遭受高温胁迫时发挥重要作用。
