LncRNA NALT通过调控Notch信号通路对H2O2诱导的人晶状体上皮细胞损伤的影响
2023-03-09王妍茜康海军周娟陈颖杨涛王敏赵越越康刚劲
王妍茜 康海军 周娟 陈颖 杨涛 王敏 赵越越 康刚劲
1西南医科大学附属医院眼科(四川泸州 646000);2遂宁市中心医院眼科(四川遂宁 629000)
白内障是一种由多种因素引起的晶状体蛋白质变性产生混浊而导致严重的可逆性视力损害和失明的眼部疾病,是全世界最常见的致盲原因。据有关数据分析显示,我国70 ~79 岁人群白内障患病率为55.5%,而80 岁以上人群白内障患病率高达71.1%[1],其严重危害老年人身心健康。晶状体上皮细胞(lens epithelial cells,LECs)是位于晶状体前表面的功能性细胞,由于其是光线入眼的必经通道,极易遭受氧化损伤,进而促进晶状体混浊,故该过程被认为是白内障发生的分子基础[2-4]。众多研究[5-8]显示,靶向调控氧化平衡能够显著抑制LECs 氧化损伤,提高细胞活性,并改善白内障的发生发展。因此,改善LECs 氧化应激损伤可能是预防、延缓甚至逆转晶状体混浊及治疗白内障的潜在策略。
长链非编码RNA(long noncoding RNAs,lncRNAs)是一类不编码蛋白质、长度大于200 nt 的非编码RNA,具有调控细胞增殖、周期、代谢、凋亡、分化等多种生物学功能[9]。有研究[10]表明,老年性白内障晶状体中LncRNAs 的表达谱与透明晶状体不同,存在大量差异性表达的LncRNAs,提示LncRNAs 异常表达可能参与白内障的形成。LncRNA NALT(Notch1 associated lncRNA in T cell acute lymphoblastic leukemia,NALT,简称NALT)位于Notch1 基因上游,长度为546 nt,位于9q34.3,可作为转录调控因子激活Notch1 信号通路的转导[11]。Notch1 信号通路的激活可以促进细胞存活,抵抗氧化应激损伤[12-13]。NALT 是否可通过调控Notch1 信号通路促进H2O2暴露下LECs 的存活目前尚不明确。本研究采用H2O2刺激人LECs建立体外氧化损伤细胞模型,探讨NALT 过表达对LECs 氧化损伤的影响,并探讨其可能作用机制,旨在为临床预防、延缓白内障提供更多的理论基础。
1 材料与方法
1.1 主要试剂人晶状体上皮细胞株SRA01/04 来源于中国医科大学附属第四医院眼科晶状体实验室;DMEM 低糖培养基、胎牛血清购于美国Gibco公司;NALT 过表达质粒(pVAX1-NALT)及其空载质粒(Vector)由汉恒生物科技(上海)有限公司提供;Lipofectamine 3000 试剂购自美国Thermo Fisher Scientific 公司;双氧水(H2O2)购自上海阿科玛双氧水有限公司;Notch 抑制剂DAPT 购自购自美国MedChemExpress 公司;LncRNA cDNA 第一链合成试剂盒和LncRNA 荧光定量检测试剂盒均购自天根生化科技(北京)有限公司;CCK-8 试剂盒购于北京安必奇生物科技有限公司;活性氧(ROS)检测试剂盒、Annexin V-FITC/PI 细胞凋亡检测试剂盒均购于上海碧云天生物技术有限公司;丙二醛(MDA)含量检测试剂盒、超氧化物歧化酶(SOD)试剂盒购自南京建成生物工程研究所;Notch1 抗体、Hes1 抗体和GAPDH 抗体购自美国Cell Signaling Technology 公司。
1.2 细胞培养及H2O2 浓度筛选将复苏后的SRA01/04 细胞置于含有体积分数为10%胎牛血清的DMEM 培养基的培养皿中混合均匀,再置于5%CO2、37℃的常规培养箱中培养,每2 d 换液1次,细胞铺满皿底时进行传代培养。取对数生长期SRA01/04 细胞,按照2 000 个/孔的密度接种于96 孔板中,待细胞贴壁后达到70%汇合度时,采用不同浓度(0、25、50、100、200、400 μmol/L)H2O2干预SRA01/04 细胞24 h,随后采用下述CCK-8 实验检测细胞增殖活性以确定本研究中H2O2最佳干预浓度。
1.3 细胞转染及分组处理取对数生长期SRA01/04 细胞,按照5 × 104个/孔的密度接种于6 孔板中,待细胞生长至70%汇合度时,按照试剂盒说明书将NALT 过表达质粒(pVAX1-NALT)及其空载质粒(Vector)经Lipofectamine 3000 试剂分别转染至SRA01/04细胞中,分为pVAX1-NALT组和Vector组,另设置空白对照组(blank 组)。转染48 h 后,采用qRT-PCR 检测各组细胞中NALT 表达水平。再根据实验需要分为对照组(Control 组,不经任何处理)、H2O2组(采用100 μmol/L H2O2干预24 h 建立细胞损伤模型)、H2O2+Vector 组(转染空载质粒的SRA01/04 细胞经100 μmol/L H2O2干预24 h)、H2O2+NALT组(转染NALT 过表达质粒的SRA01/04 细胞经100 μmol/L H2O2干预24 h)和H2O2+NALT+DAPT 组(转染NALT 过表达质粒的SRA01/04 细胞,再经10 μmol/L Notch 抑制剂DAPT 和100 μmol/L H2O2干预24 h)。
1.4 CCK-8 法检测细胞增殖活力将对数生长期的各组细胞按照2 000 个/孔的密度接种于96 孔板中,设置空白孔和对照孔,待细胞贴壁后达到70%汇合度时进行分组处理24 h。随后每孔中加入10 μL CCK-8 溶液,于37 ℃避光孵育4 h,采用酶标仪于450 nm 波长处检测各孔吸光度(A)值,细胞增殖活力=[(A实验-A空白)/(A对照-A空白)]×100%。
1.5 qRT-PCR 检测细胞中NALT 表达水平采用不同浓度H2O2(0、25、50、100、200、400 μmol/L)干预SRA01/04 细胞24 h 或SRA01/04 细胞转染后,收集细胞沉淀,采用Trizol 法提取细胞总RNA,采用分光光度计测定总RNA 浓度及纯度。按照LncRNA cDNA 第一链合成试剂盒说明进行去基因组DNA,并将总RNA 逆转录成cDNA,再以cDNA为模板按照LncRNA 荧光定量检测试剂盒说明书进行实时荧光定量PCR 反应。引物序列:NALT,上游引物5′-GTCATCCAGTAGGCTCAAG-3′,下游引物5′-ATAAGTGGAGAAAGGCAGAT-3′;GAPDH,上游引物5′-GGAGCGAGATCCCTCCAAAAT-3′,下游引物5′-GGCTGTTGTCATACTTCTCATGG-3′。PCR 扩增反应条件:95 ℃预变性3 min,然后95 ℃变性5 s、60 ℃退火10 s、72 ℃延伸15 s,共40 个循环。以GAPDN 为内参,采用2-ΔΔCt法计算NALT 相对表达水平。
1.6 DCFH-DA 荧光探针标记法检测细胞内ROS水平 将各组细胞接种于6 孔板中,分组干预后,采用0.25%胰酶消化细胞后收集细胞,加入1 mL终浓度为10 μmol/L 的荧光探针DCFH-DA 重悬细胞,并于37 ℃下避光孵育20 min,每隔5 min 颠倒混匀1 次,用无血清培养基洗涤细胞3 次,采用流式细胞仪进行检测。
1.7 化学法检测细胞中MAD含量及SOD活性将各组细胞接种于6 孔板中,分组干预后,弃细胞培养液,收集细胞沉淀,根据试剂盒说明书分别采用比色法和WST-1 法检测细胞中MDA 含量和SOD活性。
1.8 Annexin V-FITC/PI 法检测细胞凋亡水平将各组细胞接种于6 孔板中,分组干预后,收集细胞并转移至1.5 mL Doff 管中,1 000g离心5 min,弃上清,用PBS 轻轻重悬细胞并计数,取5 × 104个细胞1 000g离心5 min,弃上清后加入195 μL Annexin V-FITC 结合液轻轻重悬细胞,加入5 μL Annexin V-FITC 和10 μL 碘化丙啶(PI)染色液,充分混匀,并于室温避光条件下孵育15 min,采用流式细胞仪进行检测。
1.9 Western blot 检测细胞内Notch1 和Hes1 蛋白表达水平分组干预后收集各组细胞沉淀,加入RIPA 裂解液于冰上裂解细胞,4 ℃条件下12 000g离心25 min,取上清蛋白溶液,采用BCA 法测定蛋白浓度。取30 μg 蛋白经沸水浴变性后配置上样体系,行10%SDS-PAGE 凝胶电泳分离蛋白,采用湿转法将蛋白转移至PVDF 膜上,取出PVDF 膜TBST 洗涤3 次,再经5%脱脂奶粉室温封闭1 h,TBST 洗涤3 次,分别加入Notch1 抗体(1∶1 000)、Hes1 抗体(1∶1 000)和GAPDH 抗体(1∶1 000),于4 ℃条件下孵育过夜。TBST 洗涤3 次,加入HRP标记的山羊抗兔IgG 二抗,室温封闭1.5 h,TBST 洗涤3 次,滴加ECL 显影液,曝光显影。蛋白相对表达量=目的蛋白条带灰度值/内参GAPDH 条带灰度值。
1.10 统计学方法采用GraphPad Prism 5 进行柱形图的绘制,其CCK-8 和qRT-PCR 实验数据以对照组结果作为量化标准,被定义为100%或1,对不同试验组结果数据进行标化。采用SPSS 22.0 软件进行统计学分析,均符合正态分布,多组间数据比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 H2O2干预对SRA01/04细胞存活率及NALT表达水平的影响见图1A,不同浓度H2O2干预24 h后,SRA01/04 细胞增殖活力随着H2O2浓度的增加而逐渐降低,差异有统计学意义(F= 93.670,P<0.001)。与0 μmol/L 比较,100 μmol/L H2O2干预可将SRA01/04 细胞增殖活力降低至60%左右,故后续选择100 μmol/L H2O2干预24 h 作为细胞损伤造模条件。如图1B 所示,随着H2O2浓度的增加,SRA01/04 细胞中NALT 表达水平逐渐降低,差异有统计学意义(F= 85.323,P<0.001)。
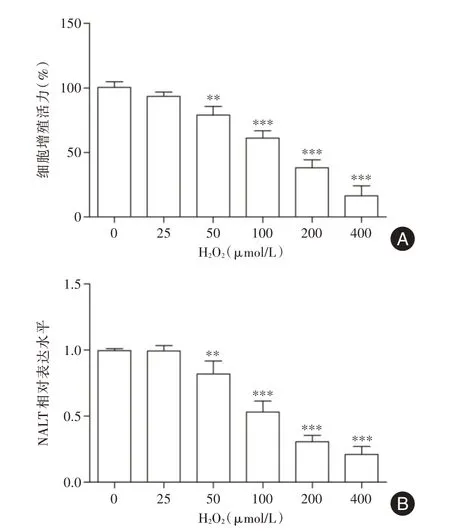
图1 H2O2干预对SRA01/04 细胞存活率及NALT 表达水平的影响Fig.1 Effect of H2O2 intervention on the survival rate of SRA01/04 cells and the expression level of NALT
2.2 过表达NALT 对H2O2 干预下SRA01/04 细胞存活率的影响见图2A,转染NALT 过表达质粒后,与blank 组或Vector 组比较,pVAX1-NALT 组SRA01/04 细胞中NALT 表达水平显著升高(P<0.001)。见图2B,与Control 组比较,H2O2组SRA01/04 细胞增殖活力显著降低(P<0.001);与H2O2组比较,H2O2+NALT 组SRA01/04 细胞增殖活力显著升高(P<0.001),而H2O2+Vector 组差异无统计学意义(P>0.05);与H2O2+NALT 组比较,H2O2+NALT+DAPT 组SRA01/04 细胞增殖活力又显著降低(P<0.001)。
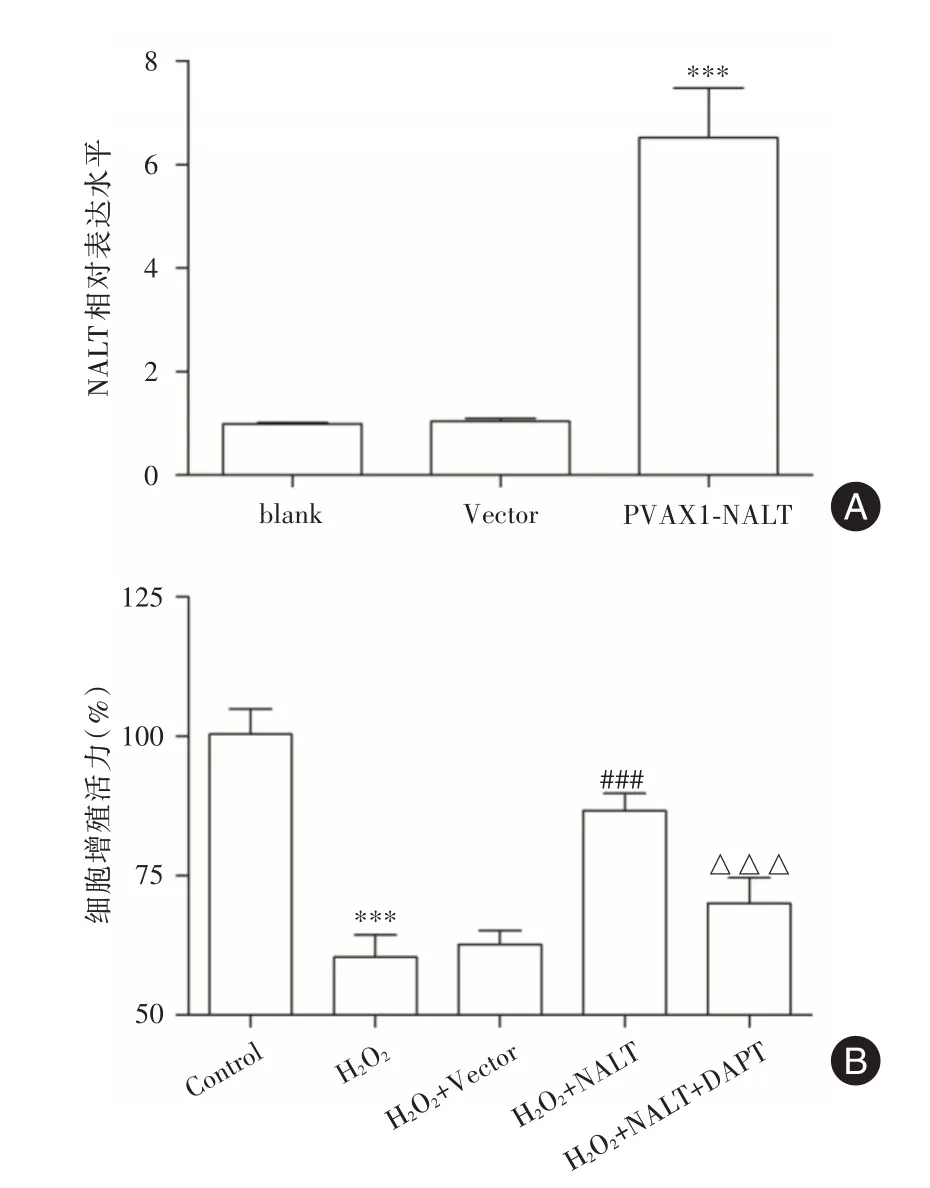
图2 NALT 过表达对H2O2干预下SRA01/04 细胞存活率的影响Fig.2 Effect of NALT overexpression on the survival rate of SRA01/04 cellsexposed to H2O2
2.3 过表达NALT 对H2O2 干预下SRA01/04 细胞氧化应激水平的影响见图3,与Control 组比较,H2O2组SRA01/04 细胞中ROS 水平显著升高(P<0.001);与H2O2组比较,H2O2+NALT 组SRA01/04细胞中ROS 水平显著降低(P<0.001),而H2O2+Vector 组差异无统计学意义(P>0.05);与H2O2+NALT 组比较,H2O2+NALT+DAPT 组SRA01/04 细胞中ROS 水平又显著增加(P<0.001)。见图4,与Control 组比较,H2O2组SRA01/04 细胞中MDA 含量显著升高(P<0.001),而SOD 活性显著下降(P<0.001);与H2O2组比较,H2O2+NALT 组SRA01/04 细胞中MDA 含量显著降低(P<0.001),SOD 活性显著升高(P<0.001),而H2O2+Vector 组差异无统计学意义(P>0.05);与H2O2+NALT 组比较,H2O2+NALT+ DAPT 组SRA01/04 细胞中MDA 含量又显著增加(P<0.001),而SOD 活性又显著降低(P<0.001)。

图3 各组细胞中ROS 水平比较Fig.3 Comparison of ROS levels in cells of each group

图4 各组细胞中MDA 含量及SOD 活性比较Fig.4 Comparison of MDA content and SOD activity in cells of each group
2.4 过表达NALT 对H2O2 干预下SRA01/04 细胞凋亡的影响见图5,与Control 组比较,H2O2组SRA01/04 细胞凋亡水平显著增加(P<0.001);与H2O2组比较,H2O2+NALT 组SRA01/04 细胞凋亡水平显著降低(P<0.001),而H2O2+Vector 组差异无统计学意义(P>0.05);与H2O2+NALT 组比较,H2O2+NALT+DAPT 组SRA01/04 细胞凋亡水平又显著增加(P<0.001)。

图5 各组细胞凋亡水平比较Fig.5 Comparison of apoptosis levels in each group
2.5 过表达NALT 对H2O2 干预下SRA01/04 细胞Notch 信号通路的影响见图6,与Control 组比较,H2O2组SRA01/04 细胞中Notch1 和Hes1 蛋白表达水平显著降低(P<0.01);与H2O2组比较,H2O2+NALT 组SRA01/04 细胞中Notch1 和Hes1 蛋白表达水平显著增加(P<0.001),而H2O2+Vector 组差异无统计学意义(P>0.05);与H2O2+NALT 组比较,H2O2+NALT+DAPT 组SRA01/04 细胞中Notch1 和Hes1 蛋白表达水平又显著降低(P<0.001)。

图6 各组细胞中Notch1 和Hes1 蛋白表达水平比较Fig.6 Comparison of the expression levels of Notch1 and Hes1 proteins in each group of cells
3 讨论
lncRNAs 在白内障中的作用越来越受关注。ZHANG 等[14]通过高通量测序技术进行对比分析发现,在健康志愿者及老年白内障患者晶状体前囊膜中存在7 000 多种差异表达的lncRNAs。且多项研究[15-17]显示,lncRNAs 的异常表达可导致晶状体发育异常、LECs 凋亡及晶状体透明度降低。本研究通过体外培养SRA01/04 细胞,采用H2O2处理模拟LECs 氧化应激损伤模型,结果显示,H2O2可呈现剂量依赖性抑制SRA01/04 细胞增殖活性,并且100 μmol/L H2O2干预可提高SRA01/04 细胞内ROS水平及MDA 含量,降低SOD 活性,诱导细胞凋亡,表明LECs 氧化应激损伤体外模型构建成功。进一步研究发现,在不同浓度H2O2刺激后的SRA01/04 细胞中NALT 的表达逐渐下调,说NALT 可能参与调控LECs 氧化应激损伤。
NALT,又称LINC01573,是一种长度为546 nt的lncRNA,由WANG 等[11]于2015年在T 细胞急性淋巴细胞白血病中首次发现,并证实其可通过顺式调控作用调控Notch1 基因的表达。PIAO 等[18]研究证实,NALT 在胃癌组织中高表达,并促进胃癌细胞的侵袭与转移,其作用机制也是通过调控Notch1 表达从而激活Notch 信号通路的转导。然而,目前暂无更多有关NALT 的功能研究报道。因此,为了进一步探讨NALT 在H2O2诱导的LECs 氧化应激损伤中作用与功能,本研究将NALT 过表达质粒转染至SRA01/04 细胞中,构建NALT 过表达的SRA01/04 细胞株,再进一步采用H2O2干预,结果发现NALT 过表达可以提高H2O2暴露下SRA01/04 细胞的增殖活性,降低胞内ROS 水平及MDA 含量,提高SOD 活性,抑制细胞凋亡,同时还可提高细胞中Notch1 和Hes1 等蛋白的表达水平,说明NALT 过表达可以改善H2O2诱导的SRA01/04 细胞损伤,其作用机制也可能与激活Notch 信号通路的转导有关。
Notch 信号通路是一个进化上相对较为保守的细胞与细胞之间的信号转导通路,决定着哺乳动物发育过程中细胞的命运。Notch 受体(包括Notch1~4)及其配体(包括DLL1、DLL3、DLL4、Jagged1 和Jagged2)均是具有较大胞外结构域的跨膜蛋白,二者结合后受体发生蛋白水解裂解,释放出Notch 胞内活化片段(Notch intracellular domain,NICD),NICD 进入细胞核内并与转录因子CSL 相结合,聚集核转录激活蛋白MAML 家族,形成NICD-CSL-MAML 转录复合物,激活下游靶基因的转录,如Hes 和Hey 家族基因等,从而调控细胞增殖、分化、凋亡、黏附、周期等[19]。LE 等[20]研究显示,Notch 信号通路的正常转导是正常小鼠晶状体发育的必要组成部分。有研究表明,Notch 信号通路的激活可以抵抗H2O2诱导的细胞凋亡,并促进细胞存活。此外,鉴于NALT 可通过顺式调控作用调控Notch1 基因的表达[11],且本研究显示,NALT过表达可上调H2O2暴露下SRA01/04 细胞中Notch1和Hes1 蛋白表达,推测NALT 过表达对H2O2诱导的SRA01/04 细胞损伤的改善作用可能与激活Notch 信号通路有关。为了进一步证实该推测,本研究使用Notch 抑制剂DAPT 进行联合干预,结果发现联合DAPT 干预可逆转NALT 过表达对H2O2诱导的SRA01/04 细胞损伤的改善作用,提示NALT过表达可能通过激活Notch 信号的转导改善H2O2诱导的SRA01/04 细胞损伤。
综上所述,NALT 在H2O2诱导的LECs 中表达下调,其过表达可通过促进Notch 信号通路的转导促进H2O2暴露下LECs 的存活,抑制H2O2诱导的氧化损伤和细胞凋亡,对H2O2暴露下的LECs 具有保护作用。然而,本研究仅为体外细胞实验,对白内障临床治疗的指导价值有限,下一步将着重开展体内动物实验及临床试验进一步验证NALT 对白内障的防治作用,以期为基于LECs 防治白内障提供新的思路。
【Author contribution】WANG Yanxi and ZHOU Juan:Performed the experiments and wrote the article. WANG Min,CHEN Yin,YANG Tao and ZHAO Yueyue:Performed the experiments.KANG Haijun and KANG Gangjin:Revised the article. KANG Gangjin:Designed the study and reviewed the article. All authors read and aplproved the final manuscript as sub-mitted.
