长链非编码RNA TUG1对鼻咽癌细胞生物学行为及放射敏感性的影响
2023-03-09廖志伟朱建曼周同冲郑荣辉
廖志伟 朱建曼 周同冲 郑荣辉
广州医科大学附属肿瘤医院放疗科(广州 510095)
鼻咽癌放射抗拒的机制尚不清楚,对放射抗拒鼻咽癌的识别和治疗成为一个悬而未决的问题。预后评估对鼻咽癌患者做出更好的治疗选择至关重要,TNM 分期系统是决定鼻咽癌患者预后的关键因素。然而,相同疾病分期的患者在接受类似治疗后,其临床结果往往具有相当大的差异,这表明TNM 分期仍远不能作为一个完美的预测指标。因此,寻找鼻咽癌潜在的预后分子生物标志物和放疗相关的新靶点,对于发展有效的治疗手段是必不可少的。
近年来,LncRNAs 及其在鼻咽癌发展中的作用备受关注[1]。其中一些lncRNA,如PVT1[2]、HOTAIR[3]和ANRIL[4],被认为在鼻咽癌发生发展中起重要作用。TUG1(taurine upregulated 1)最早是在用牛磺酸处理小鼠视网膜细胞时发现的一种新的上调lncRNA[5]。越来越多的证据表明TUG1 在肿瘤发生和发展过程中起着重要的调节作用[6-8]。最近的一项研究[9]发现TUG1 参与了鼻咽癌细胞的生长和侵袭。然而,其在鼻咽癌放射敏感性调节中的作用尚未完全明确。
本研究利用TCGA 数据库综合分析了TUG1 在33 种人类癌症中的表达特征和预后价值。随后,通过检测TUG1 在患者临床标本中的表达,以及采用MTS 法、transwell 实验和划痕实验、细胞克隆形成等实验,进一步探讨TUG1 在鼻咽癌中的作用及其潜在的预后价值。
1 材料与方法
1.1 基因表达分析本研究33 种癌症的基因组和临床病理信息来自癌症基因组图谱数据库(https://portal.gdc.cancer.gov/)和Xena 数据库(https://xenabrowser.net/datapages/)。采用wilcox 检验检测各种癌症中TUG1 的表达水平。
1.2 泛癌中TUG1 生存预后分析使用TCGA 数据库进行单因素Cox 回归分析,研究TUG1 表达与总体生存(OS)、无病生存(DFS)、疾病特异性生存(DSS)、无进展生存(PFS)的关系。
1.3 病人资料和组织样本本研究使用的鼻咽癌组织和相应的癌旁组织来源于2010-2012年广州医科大学附属肿瘤医院。所有鼻咽癌标本均在接受根治性放射治疗(伴或不伴化疗)前采集。本组鼻咽癌患者包括65 例男性和28 例女性,表1总结了他们的临床病理特征。平均随访时间为74 个月(中位数为77 个月;范围9 ~233 个月)。所有患者的疾病分期按照美国国际癌症控制联盟癌症联合委员会第八版分期进行重新分类。在这些临床材料被用于研究之前,已经得到了广州医科大学附属肿瘤医院医学伦理委员会的批准。
1.4 细胞培养和寡核苷酸转染人鼻咽癌细胞株(5-8F,6-10B,CNE-1,CNE-2)和人永生化鼻咽上皮细胞系NP69,按常规方法采用含有10% 胎牛血清的RPMI-1640(Gibco)培养基,37 ℃,5%CO2培养箱中静置培养。用于敲除TUG1 的siRNA 及其阴性对照siRNA 购自Ambion 公司。siRNA 由Lipofectamine 2000 试剂(Invitrogen,Carlsbad,USA)按照说明书进行转染。转染48 h 后,检测TUG1 表达水平。siRNA 的目标序列如下:
TUG1-siRNA sense 5′-GGGAUAUAGCCAGAGAACAAUUCUA-3′,antisense 5′-UAGAAUUGUUCUCUGGCUAUAUCCC-3′
1.5 RNA 提取和qPCR 分析使用TRIzol 试剂(Invitrogen)从组织或培养细胞系中提取总RNA。用M-MLV 逆转录酶试剂盒(Promega,M1705)从总RNA 中合成cDNA。在MiniOpticonTM实时PCR 检测仪器(Bio-Rad Laboratories,Inc.,Hercules,CA,USA)上进行qPCR 和数据收集。以GAPDH 作为TUG1 表达分析的内参。
引物序列:正向引物:5“-TAGCAGTTCCCCAATCCTTG-3”,反向引物:5“-CACAAATTCCCATCATTCCC-3”。
1.6 细胞增殖实验细胞增殖试剂盒(Cell proliferation Reagent Kit,MTS)检测细胞在12、24、48、72 h 的增殖情况。按照生产商的方案,将转染后的细胞置于96 孔板中(3 000 细胞/孔),每孔加入10 μL MTS 试剂,37 ℃孵育4 h,酶标仪检测490 nm吸光值。绘制增殖速度变化曲线。
1.7 细胞侵袭迁移试验为了进行基质入侵实验,在聚碳酸酯过滤器的上端涂上Matrigel 基质。下室灌满含血清培养基(600 μL)作为趋化剂。细胞被添加到Transwell 上室。培养48 h 后,用甲醇固定细胞,用结晶紫溶液染色。用棉签擦去未侵入的细胞。随机计数显微镜下6 个视野中的细胞数目,以侵袭细胞数目表示肿瘤侵袭能力。
1.8 细胞划痕实验实验前1 d 将细胞接种于6 孔板形成单层细胞。用无菌200 μL 吸管头损伤单层细胞形成人工划痕,PBS 冲洗细胞,在5% CO237 ℃培养基中培养。分别于损伤后0、24、48 h 拍照观察迁移情况。
1.9 细胞克隆形成实验采用细胞克隆形成实验测定放射敏感性。将细胞接种在6 孔板上,将细胞按照不同的照射剂量(2 ~10 Gy)分别进行射线照射。照射方法:使用6 MVX 射线(广州医科大学附属肿瘤医院放疗中心西门子PRIMUS 直线性加速器),剂量率为2 Gy/min。培养10 ~14 d 后,用甲醇固定、结晶紫染色。然后使用显微镜计数克隆数(>50 细胞的群体)。采用GraphPad Prism 5软件将数据拟合到线性二次模型。
1.10 细胞周期和细胞凋亡分析si-TUG1或对照转染细胞24 h 后行细胞周期分析。胰酶消化细胞,培养基中和后离心细胞,用PBS 洗涤。用Annexin V 和7-AAD 染色,置于4 ℃暗室中15 min,使用流式细胞仪检测细胞周期分布情况。细胞凋亡分析用胰酶法收集细胞,PBS 洗涤3 次。收集细胞于4 ℃70%乙醇中固定过夜。转染48 h 后收集细胞,用凋亡检测试剂盒进行染色。流式细胞仪测定细胞凋亡百分率。
1.11 统计学方法统计分析使用R v4.1.2 和SPSSv18.0 进行。实验数据用GraphPad Prism 5 软件计算后以平均值±标准差表示。实验组和对照组的比较采用Student′t检验或单因素方差分析。TUG1 的表达与临床病理特征参数的关系采用χ2检验。采用Kaplan-Meier 法和Log-rank 检验进行生存分析,比较TUG1 高表达和低表达两组生存率的差异。以P<0.05 为差异有统计学意义。
2 结果
2.1 TCGA 数据库中TUG1 的表达差异利用TCGA 在线数据库发现,较正常组织来说,TUG1在广泛肿瘤组织中水平升高(图1A),包括BLCA、CHOL、COAD、ESCA、HNSC、KICH、KIRP、LIHC、LUAD、LUSC、STAD 和THCA(图1A)。TUG1 在TCGA 数据库中的33 种癌症类型中差异高表达;其中ESCA 最高,LIHC 表达最低(图1B)。

图1 TUG1 在TCGA 数据库多种肿瘤的表达水平Fig.1 TUG1 in different cancers in TCGA database
2.2 TCGA 数据库中TUG1 的表达与预后的相关性分析利用TCGA 在线数据库,单变量cox 回归分析发现:在ACC 和LIHC 中,TUG1 的高表达与较差的OS 呈正相关,而在BLCA 和LGG 中与较好的OS 相关(图2A)。对于DFS,在ACC 中,TUG1 的高表达与较差的生存率显著相关(图2B)。对于DSS,ACC、LIHC 中TUG1 高表达与较差的预后显著相关,而LGG 和THYM 与较好的预后相关(图2C)。对于PFS,在ACC、LIHC 和UVM 中,TUG1 的高表达与较差的PFS 呈正相关,而在GBM 和LGG 中与较好的PFS 相关(图2D)。

图2 使用单变量COX 比例风险模型,TUG1 在TCGA 数据库不同癌症中的预后价值Fig.2 Prognostic value of TUG1 in different cancers in TCGA database using univariate COX proportional hazard model
2.3 TUG1 在鼻咽癌细胞系和组织中表达上调qRT-PCR 结果表明与非致瘤性NP69 细胞系相比,TUG1 的表达水平在5-8F、6-10B、CNE-1、CNE-2 四个鼻咽癌细胞系都明显增加(图3A)。进一步我们使用qRT-PCR 检测TUG1 在鼻咽癌患者组织的表达水平。与配对的癌旁组织相比,TUG1在鼻咽癌原发组织标本中的表达均显著上调(图3B)。为了评估TUG1 在鼻咽癌细胞的功能作用,选择TUG1 表达相对高水平的CNE-1 CNE-2 细胞,转染si-TUG1后qRT-PCR 检测发现TUG1 在CNE-1 和CNE-2 细胞明显减少(图3 C)。

图3 TUG1 在鼻咽癌细胞系和临床标本中表达情况Fig.3 TUG1 expression in nasopharyngeal carcinoma cell lines and clinical specimens
2.4 TUG1 高表达与鼻咽癌不良预后相关利用qRT-PCR 技术检测了93 例鼻咽癌患者TUG1 的表达情况。相关性分析表明,TUG1 表达与pTNM 分期显著相关(表1)。随后的生存分析结果显示,TUG1 高表达与总生存期(P= 0.02,图4A)和无进展生存期(P= 0.02,图4B)相关。

表1 TUG1 表达与鼻咽癌患者临床病理参数的关系Tab.1 Relationship between TUG1 expression and clinicopathological parameters in patients with nasopharyngeal carcinoma 例
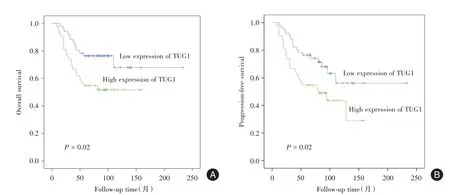
图4 TUG1 的表达与鼻咽癌患者的预后关系.Fig.4 Relationship between expression of TUG1 and prognosis of patients with nasopharyngeal carcinoma
2.5 下调TUG1 抑制鼻咽癌细胞增殖、侵袭和迁移为了确定下调TUG1 对鼻咽癌细胞增殖的影响,进行了MTS 实验。下调TUG1 后12、24、48 和72 h 检测细胞活力,结果表明下调TUG1 显著抑制CNE1 和CNE-2 细胞增殖(图5A)。随后通过Transwell 实验检测下调TUG1 对鼻咽癌细胞侵袭能力的影响。结果表明,下调TUG1 降低了CNE-1 和CNE-2 细胞的侵袭能力(图5B)。伤口愈合实验则显示,下调TUG1 抑制了CNE-1 和CNE-2 的迁移能力(图5C)。
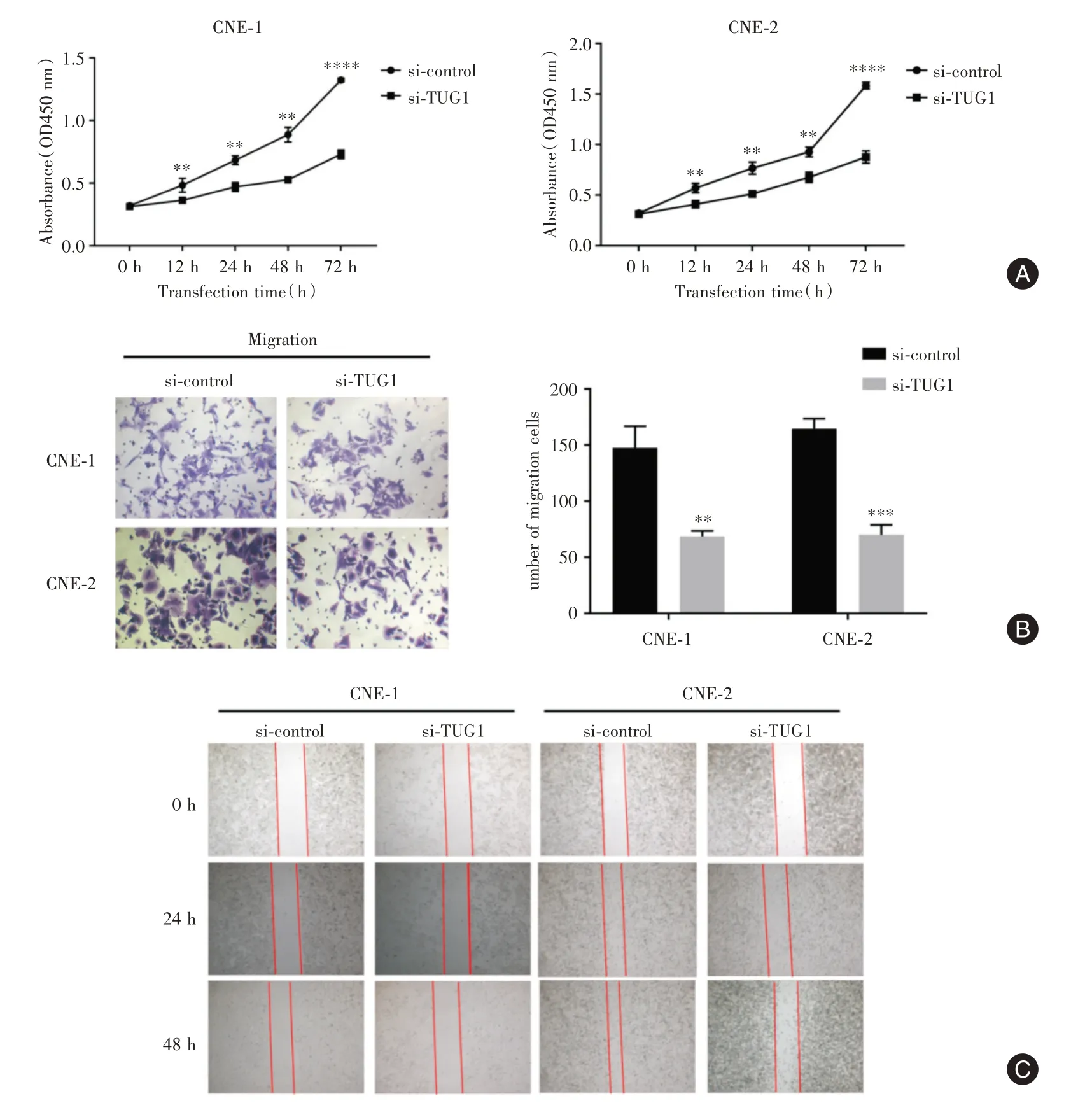
图5 TUG1 对鼻咽癌细胞的增殖、迁移和侵袭能力的影响Fig.5 TUG1 on the proliferation,migration and invasion of nasopharyngeal carcinoma cells
2.6 下调TUG1 诱导鼻咽癌细胞凋亡但不影响细胞周期分布为检测下调TUG1 对CNE-1、CNE-2细胞凋亡的影响,采用流式细胞术检测细胞凋亡百分率。结果表明与未转染的CNE-1、CNE-2 细胞相比,转染si-TUG1 后CNE-1、CNE-2 细胞凋亡率明显高于转染了scramble siRNA 的CNE-1、CNE-2 细胞(si-control 组)(图6A)。随后使用流式细胞术检测下调TUG1 是否改变细胞周期分布。与si-control组相比,转染si-TUG-1 的CNE-1、CNE-2 细胞处于S 期的比例与对照组大致相同(图6B)。
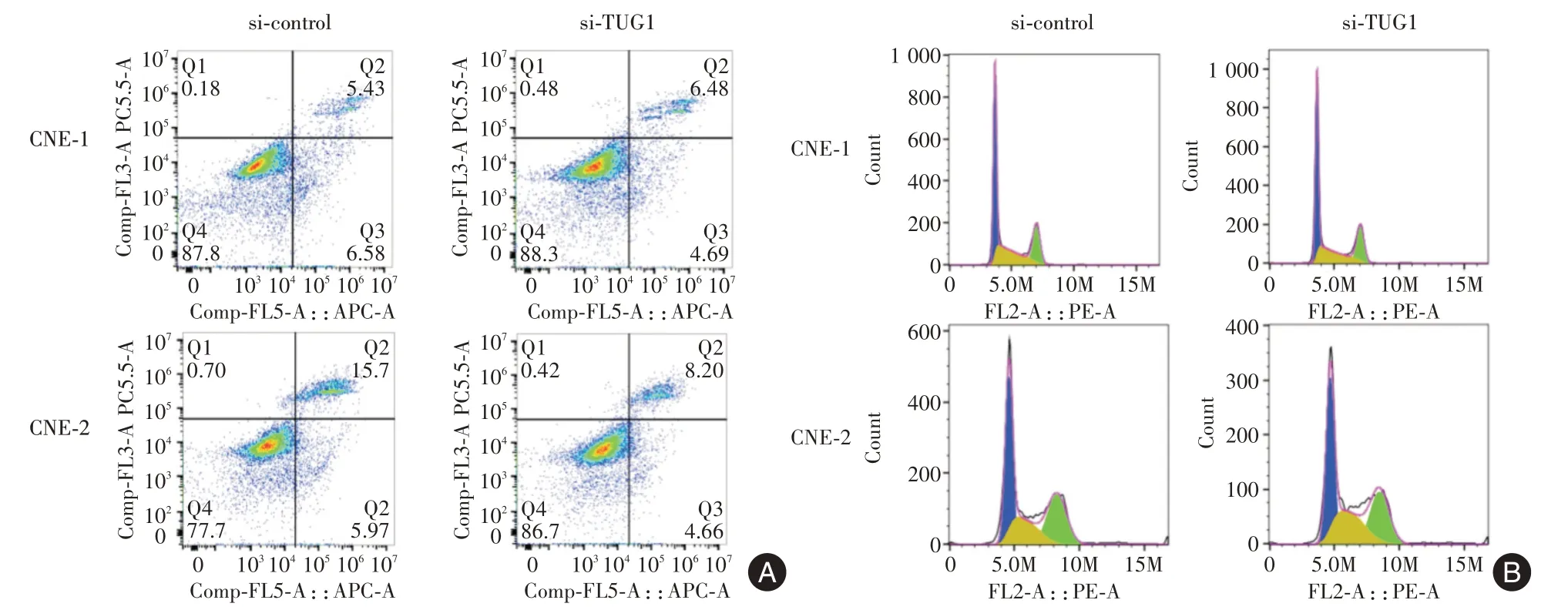
图6 采用流式细胞术分析TUG1 对鼻咽癌细胞凋亡和细胞周期的影响Fig.6 TUG1 on apoptosis and cell cycle of nasopharyngeal carcinoma cells was analyzed by flow cytometry
2.7 下调TUG1 增加鼻咽癌细胞放射敏感性为了明确TUG1 对鼻咽癌细胞放射敏感性的作用,进行了克隆形成实验。见图7,与对照组相比,转染si-TUG1 后,CNE1 和CNE-2 细胞的存活率随着辐射剂量的增加显著降低。
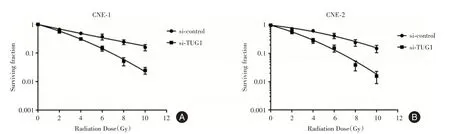
图7 采用集落形成实验检测TUG1 对CNE1 和CNE2 细胞放射敏感性影响Fig.7 TUG1 on radiosensitivity of CNE1 and CNE2 cells was detected by colony formation test
3 讨论
越来越多的研究表明,lncRNA 可能在调控基因表达、细胞应激反应、DNA 修复和代谢等环节发挥重要作用[10]。近年来,lncRNA 与鼻咽癌发生发展的相关研究受到了人们的关注,如HOTAIR[11-12]、MALAT1[13]、NEAT1[14]等已被证实参与鼻咽癌的发生。既往研究表明TUG1 可以促进乳腺癌[15]、卵巢癌[16]、前列腺癌[17]和黑色素瘤[18]等多种肿瘤的发生发展。然而,TUG1 在鼻咽癌中的表达模式和功能作用尚未得到全面的研究。泛癌分析结果显示,TUG1 的表达在大多数癌症中显著上调,且其高表达在多种癌症中预后较差,表明TUG1 在肿瘤的发生和发展中具有重要作用。临床相关性试验结果显示,TUG1 在鼻咽癌组织和细胞系中显著上调;与QIAN 等[9]最近的一项研究一致。然而,有研究发现TUG1 在非小细胞肺癌[19]和胶质瘤[20]组织中表达下调。TUG1 表达水平的差异反映了TUG1可能具有组织特异性,其在不同肿瘤发生发展中的作用及其表达调控机制尚未明确,有待于进一步研究探讨。
本研究进一步分析了TUG1 在鼻咽癌中的临床意义,结果表明TUG1 在鼻咽癌中的高表达与肿瘤T 分期、N 分期、远处转移及临床分期密切相关。此外,我们发现组织中TUG1 的高表达可能预示着鼻咽癌患者预后较差。这些发现表明TUG1 可能是鼻咽癌诊断和个性化治疗的潜在标记物。推测TUG1 低表达的局部晚期鼻咽癌患者也许可以选择减免化疗的低毒治疗方式。相反,TUG1 高表达的局部晚期鼻咽癌患者可能需要更高强度的治疗。
为深入研究TUG1 对鼻咽癌细胞恶性生物学行为的影响,进行了MTS 实验、Transwell 实验和伤口愈合实验,与既往报道类似[21-23],本研究发现TUG1 能够显著促进鼻咽癌细胞株的增殖、侵袭和迁移活性。表明TUG1 的表达与鼻咽癌的恶性程度相关,并参与了该疾病的发生和进展。后续有必要深入探讨TUG1 参与鼻咽癌细胞癌侵袭转移的分子调控机制。
放射治疗是鼻咽癌的主要治疗方式。肿瘤细胞对放射治疗的敏感性对疾病局部控制至关重要。在过去的十年中,大量研究表明lncRNA 参与调节细胞放射敏感性[24-26]。国内刘秀玲等[27]的研究表明,下调TUG1 表达可增强宫颈癌细胞放射敏感性。为研究TUG1 对鼻咽癌细胞放射敏感性的影响,照射转染si-TUG1 或阴性对照的鼻咽癌细胞后进行细胞克隆形成实验。实验数据显示,下调TUG1 表达可以有效增加鼻咽癌细胞的放射敏感性。
细胞对放射线的反应与细胞周期和凋亡有关[28]。此前有研究报道下调TUG1 所致的放射敏感性增加与凋亡信号的激活相关[29]。本研究结果与以上研究结果相类似,流式细胞术分析显示下调TUG1 后人鼻咽癌细胞凋亡增加。然而流式细胞术分析显示,转染si-TUG1 抑制CNE-1 和CNE-2细胞中TUG1 表达均不影响细胞周期分布。可见TUG1 在人鼻咽癌发病中潜在的致癌功能有待进一步研究,其直接获益的确切机制仍有待探索。
尽管本研究提高了我们对TUG1 在鼻咽癌中作用的认识,但仍存在一些局限性。首先,样本量相对较小,可能产生一定的偏差,后续评估TUG1与鼻咽癌预后关系,应该通过更多数据集进行交叉验证。其次,公共数据库中缺乏临床因素,如患者用药和(或)手术治疗的具体细节,也会影响患者的预后。第三,没有构建TUG1 过表达载体,并进一步探讨TUG1 过表达对鼻咽癌细胞增殖、侵袭和迁移的调控作用。第四,TUG1 在鼻咽癌进展和转移中的直接作用有待于体外实验进一步验证,其在鼻咽癌生长、转移中的分子机制和作用有待进一步研究。虽然本研究存在一定的局限性,但确实为研究TUG1 在鼻咽癌中的作用提供了线索,提示TUG1 在鼻咽癌发生发展过程中发挥重要作用,靶向TUG1 可能为鼻咽癌患者的临床治疗提供一种新的策略。
【Author contribution】LIAO Zhiwei:Conceptualization,Methodology,Writing-Original Draft,Funding Acquisition;ZHU Jianman:Formal Analysis,Writing-Original Draft;ZHOU Tongchong:Resources,Supervision;ZHENG Ronghui:Conceptualization,Writing-Review & Editing. All authors read and approved the final manuscript as submitted.
