基于补体C3及TGFβ1/Smad信号通路探究七氟烷麻醉对老龄小鼠突触可塑性及工作记忆力损伤的机制
2023-03-09郄晓娟李清开刘颖冯雪妍霍修林张秀宁霍佳李志华于海磊徐贯杰
郄晓娟 李清开 刘颖 冯雪妍 霍修林 张秀宁 霍佳 李志华 于海磊 徐贯杰
河北医科大学第三医院1麻醉科,2骨病科(石家庄 050051);3 河北医科大学法医学院(石家庄 050011)
围术期神经认知紊乱(perioperative neurocognitive disorders,PND)是老年患者术后常见的中枢系统并发症之一,严重影响患者的恢复和生存质量[1]。七氟烷是目前常用的吸入性麻醉药,文献表明七氟烷可引起老龄大鼠持续的工作记忆障碍[2]。工作记忆作为一种高级的认知功能,依赖于神经元突触间的复杂联系,突触连接是脑功能的结构基础,其发生着持续、动态的变化,表现为在发育、应激、学习等过程中的可塑性[3-4]。突触可塑性改变与七氟烷造成的认知能力下降有关[5],但七氟烷造成突触可塑性改变及工作记忆下降的机制尚不清楚。
补体系统是体内重要的免疫效应系统,由活化级联反应中的血浆蛋白、膜调节蛋白和受体蛋白组成。大量证据表明补体系统在神经系统的发育及功能调节方面有重要作用[6]。补体分子C3 是补体级联反应中的核心蛋白。海马补体C3 信号通路的上调与手术后小鼠的认知功能受损相关[7]。研究发现C3 的激活与TGFβ1/smad 通路表达上调有关。TGFβ1/smad 通路表达上调,在多种中枢神经系统疾病中参与了认知功能的下降过程[8]。关于补体C3 介导TGFβ1/Smad 信号通路调控七氟烷引起小鼠认知功能下降的作用尚未明确,因此本研究旨在评估补体C3 及TGFβ1/Smad 信号通路在七氟烷麻醉对老龄小鼠突触可塑性及工作记忆力损伤中的作用,为明确其机制提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物清洁级雄性C57BL/6 小鼠90 只,16 ~18月龄,体质量27 ~30 g,购自北京维通利华实验动物技术有限公司[许可证编号SCXK(京):2021-0006]。室温22 ~28 ℃,相对湿度40%~60%,昼夜循环,自由进食水。适应性喂养1 周后开展实验。实验得到我院的实验动物伦理委员会批准(伦理号:KSD2022-042-1)。
1.1.2 主要试剂Trizol 购自美国英杰生命技术有限公司,反转录试剂盒购自美国伯乐公司,SYBR Green qPCR Master Mix 试剂盒购自宝生生物技术有限公司。RIPA 裂解液、BCA 试剂盒购自北京索莱宝公司,TGFβ1 抗体购自美国Abcam 公司,Smad3 抗体购自美国Abcam 公司,GAPDH 抗体购自武汉三鹰生物技术有限公司,二抗兔IgG 购自武汉爱博泰克生物科技有限公司。
1.2 方法
1.2.1 动物分组将90 只C57BL/6 小鼠随机分为3 组,对照组(C 组)、七氟烷麻醉组(S 组)和七氟烷麻醉+补体分子C3 抑制剂组(S+antiC3 组),每组30 只。
S 组和S+antiC3 组参照参考文献[9]和预实验结果制备七氟烷麻醉致小鼠工作记忆障碍模型。小鼠置于麻醉箱中,出气端连接5350 型麻醉气体监测仪监测七氟烷、氧气和二氧化碳浓度,进气端以纯氧为载体连接七氟烷挥发罐(Drager 公司,德国)。箱底铺垫少量钠石灰防止二氧化碳蓄积。S组和S+antiC 3组吸入2%七氟烷(批号:21070531,上海恒瑞医药有限公司)2 h,C 组吸入纯氧2 h。S+antiC 3 组参照文献和课题组前期实验在吸入七氟烷前30 min 腹腔注射0.25 mg CR2-Crry(靶向补体C3 抑制剂)。吸入七氟烷结束后,待其完全苏醒后放回笼中。
1.2.2 Y 迷宫行为学测试正式实验开始前4 d进行适应性训练,将小鼠放入迷宫中央区任其自由活动8 min,连续3 d,每只小鼠活动结束后用75%消毒酒精喷洒迷宫以消除小鼠气味。在麻醉前1 d、麻醉后3 d 和7 d 每组取10 只进行Y 迷宫行为学测试。正式实验时,将小鼠头部朝向起始臂末端挡板,将其放入起始臂自由探索8 min,同时记录进臂总次数;计算小鼠正确自发交替率,小鼠身体完全进入宫臂记为有效进臂次数,连续3 次进入不同的臂则记为一次正确的自发交替,自发交替率=[正确进臂次数/总进臂次数-2)]×100% 。
1.2.3 长时程增强(long-term potentiation,LTP)将每组中随机选取5 只小鼠,给予1%戊巴比妥钠100 mg/kg 麻醉后固定在立体定向装置中,局部注射2%利多卡因,安置刺激电极和记录电极。刺激电极位于:bregma 后1.5 mm,中线右侧旁开2 mm,记录电极位于:bregma 后2.2 mm,中线右侧旁开1.2 mm。给予0.033 Hz,0.1 ms 的电刺激,调试刺激强度直至得到最大幅度的群体峰电位(population spike,PS)幅度,波形稳定后逐步下调刺激强度使PS 振幅降至最大PS 的50%左右,持续记录30 min为基线。然后给予高频刺激(high frequency stimulation,HFS)(200 Hz 的20 个脉冲刺激),每隔5 min记录PS 振幅,共记录60 min。用PS 增幅作为评测LTP 的指标,PS 增幅=[(HFS 后PS 幅度-HFS 前PS幅度)/HFS 前PS 幅度]×100%。
1.2.4 RT-PCR每组随机选取5 只小鼠处死取海马组织。使用引物见表1。采用Trizol 法提取RNA,PCR 仪上42 ℃加热2 min,冰浴1 min。加入反应液置于37 ℃,15 min;85 ℃,5 s,取出反应液作为荧光定量的模板。单个RT-PCR 反应体系由5 μL SYBR Green Mix、1 μL 引物、1 μL cDNA 和3 μL DEPC水组成。扩增条件如下:95 ℃变性10 min,95 ℃10 s,60 ℃20 s,72 ℃25 s,40 个循环。反应结束后获取循环阈值(Ct 值),使用2-ΔΔCt法进行相对定量分析。
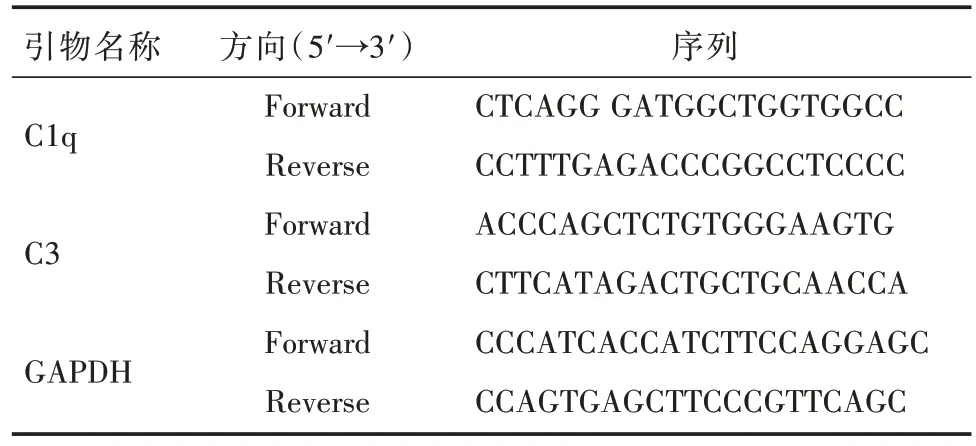
表1 RT-PCR 引物序列Tab.1 RT-PCR Primer sequences
1.2.5 Western blot行为学实验结束后,每组随机选取5 只小鼠处死取海马组织。加入RIPA 裂解液提取组织蛋白,BCA 试剂盒进行蛋白浓度定量,上样,SDS-PAGE 电泳转到PVDF 膜后,脱脂牛奶封闭。加入TGFβ1(1∶1 000,批号GR3412442-14)、Smad3(1∶1 000,批号GR169548-7)、GAPDH 抗体(1∶10 000,批号10494-1-AP),4 ℃冰箱过夜,次日取出,TBST 洗涤后加入二抗兔IgG(1∶3 000,批号10312942),室温下放置2 h,使用凝胶成像系统扫描,Image J 软件分析扫描结果。
1.3 统计学方法采用IBM SPSS 27.0 软件进行数据统计分析,正态分布的计量资料以均数±标准差表示,组内比较采用重复测量方差分析,组间比较应用单因素方差分析,两两比较采用独立样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 3组小鼠的工作记忆能力指标的变化在麻醉前1 d、麻醉后3 d 和麻醉后7 d,3 组间进臂总次数差异无统计学意义(P>0.05)。与麻醉前1 d 比较,S 组麻醉后各时间点的自发交替率下降(P<0.001);与C 组比较,S 组麻醉后各时间点自发交替率下降(P<0.001);与S 组比较,S+antiC3 组麻醉后各时间点自发交替率增加(P<0.001)。见表2。
表2 3 组小鼠不同时间点Y 迷宫实验指标比较Tab.2 Comparison of Y maze text indexes at different time points of mice in three groups±s

表2 3 组小鼠不同时间点Y 迷宫实验指标比较Tab.2 Comparison of Y maze text indexes at different time points of mice in three groups±s
组别C 组S 组S+antiC3 组F 值P 值进臂总次数(次)自发交替率(%)麻醉前1 d 33.42 ± 2.71 31.35 ± 2.21 32.98 ± 2.22 3.119 0.055麻醉后3 d 32.42 ± 2.53 34.12 ± 2.66 33.26 ± 2.78 0.769 0.470麻醉后7 d 32.52 ± 2.76 33.62 ± 2.61 32.48 ± 2.59 0.891 0.418麻醉前1 d 0.73 ± 0.13 0.74 ± 0.16 0.72 ± 0.15 0.0923 0.912麻醉后3 d 0.72 ± 0.12 0.47 ± 0.06 0.68 ± 0.13 23.252<0.001麻醉后7 d 0.73 ± 0.14 0.55 ± 0.13 0.71 ± 0.11 9.012<0.001
2.2 3 组小鼠海马PS 增幅百分比的变化在麻醉后7 d 行LTP 水平检测(根据参考文献[10]和前期实验的结果,选择此时间点),发现给予HFS 后,5 ~60 min 记录显示,S 组和S+antiC3 组PS 增幅低于C 组,其中第60分钟(HFS后30 min)时,C 组、S组和S+antiC3 组PS 增幅分别为(175.18 ± 8.62)%、(112.62±5.79)%和(162.60±6.73)%(F=109.567,P<0.001),S组的PS增幅显著低于C组(t=13.451,P<0.001),S+antiC3 组的PS 增幅明显高于S 组(t= 12.616,P<0.001)。见图1。
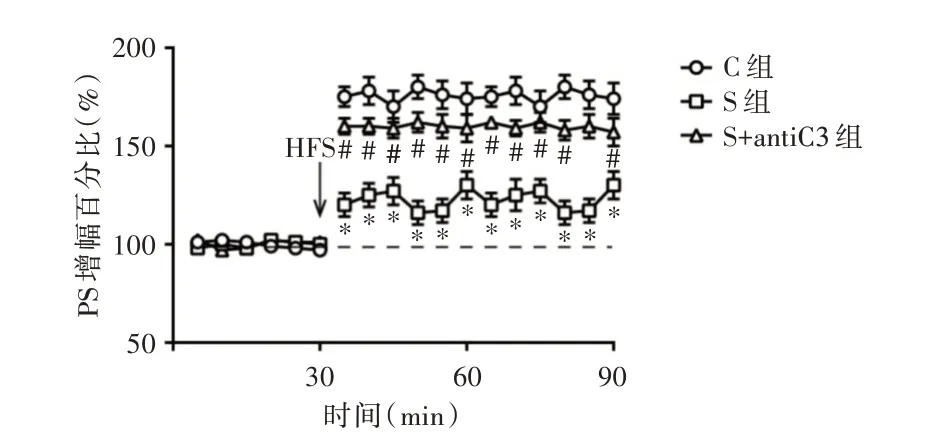
图1 3 组小鼠海马区LTP 水平的比较Fig.1 Comparison of LTP levels in hippocampal of mice in three groups
2.3 3 组小鼠海马补体分子C1q 和C3 的mRNA的变化与麻醉前1 d 比较,S 组和S+antiC3 组的麻醉后各时间的C1q 和C3 的mRNA 明显升高,差异有统计学意义(P<0.001);与C 组比较,S 组麻醉后各时间点C1q 和C3 的mRNA 升高(P<0.05),与S 组比较,S+antiC3 组麻醉后各时间点C1q 和C3的mRNA 降低(P<0.001)。见表3。
表3 3 组小鼠不同时间点补体C1q 和C3 的mRNA 表达量比较Tab.3 Comparison of complement C1q and C3 mRNA expression at different time points of mice in three groups ±s
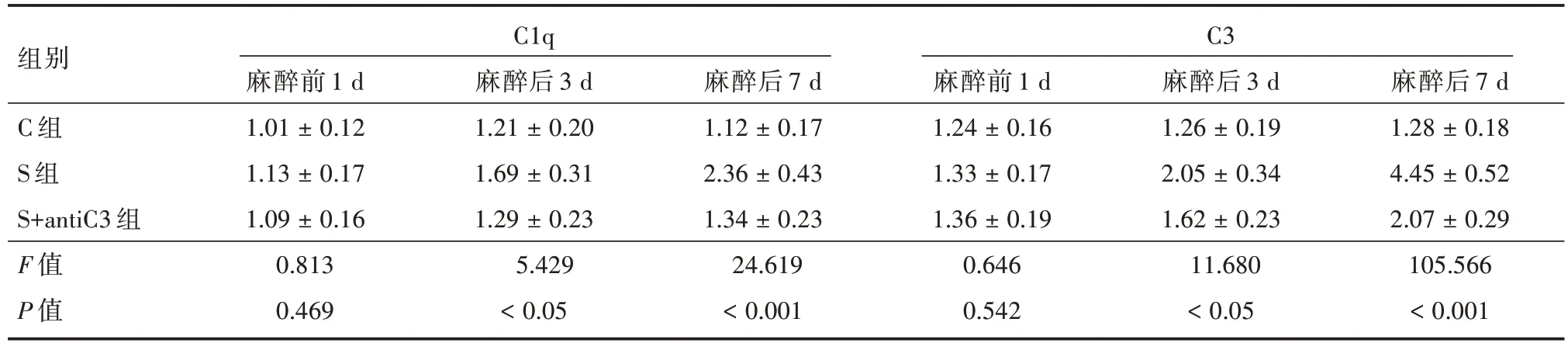
表3 3 组小鼠不同时间点补体C1q 和C3 的mRNA 表达量比较Tab.3 Comparison of complement C1q and C3 mRNA expression at different time points of mice in three groups ±s
组别C 组S 组S+antiC3 组F 值P 值C1q C3麻醉前1 d 1.01 ± 0.12 1.13 ± 0.17 1.09 ± 0.16 0.813 0.469麻醉后3 d 1.21 ± 0.20 1.69 ± 0.31 1.29 ± 0.23 5.429<0.05麻醉后7 d 1.12 ± 0.17 2.36 ± 0.43 1.34 ± 0.23 24.619<0.001麻醉前1 d 1.24 ± 0.16 1.33 ± 0.17 1.36 ± 0.19 0.646 0.542麻醉后3 d 1.26 ± 0.19 2.05 ± 0.34 1.62 ± 0.23 11.680<0.05麻醉后7 d 1.28 ± 0.18 4.45 ± 0.52 2.07 ± 0.29 105.566<0.001
2.4 3 组小鼠海马TGFβ1、Smad3 蛋白的变化在麻醉后7 d 行TGFβ1/Smad3 通路蛋白水平检测(根据前期实验[11]和参考文献,选择此时间点)。与C 组比较,S 组和S+antiC3 组的TGFβ1 和Smad3蛋白表达明显升高,差异有统计学意义(P<0.001);与S 组比较,S+antiC3 组TGFβ1 和Smad3 蛋白表达明显下降(P<0.001)。见表4 和图2。
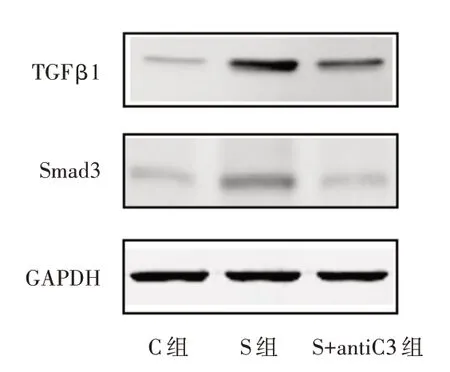
图2 3 组小鼠TGFβ1/Smad3 通路的变化Fig.2 Changes in TGFβ1/Smad3 pathway of mice in three groups
表4 3 组小鼠TGFβ1/Smad3 通路蛋白表达的比较Tab.4 Comparison of TGFβ1/Smad3 pathway protein expression of mice in three groups±s
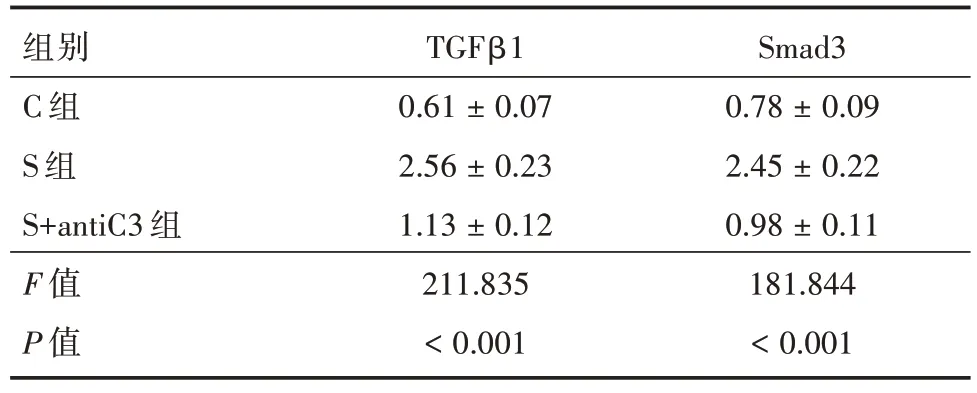
表4 3 组小鼠TGFβ1/Smad3 通路蛋白表达的比较Tab.4 Comparison of TGFβ1/Smad3 pathway protein expression of mice in three groups±s
组别C 组S 组S+antiC3 组F 值P 值TGFβ1 0.61 ± 0.07 2.56 ± 0.23 1.13 ± 0.12 211.835<0.001 Smad3 0.78 ± 0.09 2.45 ± 0.22 0.98 ± 0.11 181.844<0.001
3 讨论
本研究中采用2%的七氟烷麻醉2 h 制备小鼠认知功能障碍模型,发现采用Y 迷宫实验评价啮齿类动物工作记忆,自发交替率越低,说明工作记忆能力下降,进臂总次数差异无统计学意义,排除小鼠体力及视力对小鼠探索迷宫的影响,结果显示,各组与C 组比较,S 组麻醉后各时间点自发交替率增加同时进臂总次数差异无统计学意义,提示老龄小鼠认知功能障碍模型制备成功。在七氟烷麻醉影响小鼠认知功能的文献中[2],对老龄小鼠使用2% ~3%七氟烷麻醉后1、3、7 d 出现持续的工作记忆下降,与上述研究结果一致。
吸入麻醉药广泛用于临床麻醉,与PND 的发生有关[12]。海马作为学习记忆的重要中枢,其突触可塑性与学习记忆密切相关[13]。LTP 是评估海马区突触可塑性的关键指标,HFS 后PS 的增高幅度越大说明突触可塑性越好[14]。LTP 在脑损害模型中呈迟发性抑制[10],与其研究结果一致,在前期研究发现PS 增幅在七氟烷麻醉后1 d 抑制不明显,故本研究选择麻醉后7 d 的时间点进行LTP 试验。本研究发现与C 组比较,S 组的PS 增幅显著低于C 组,提示七氟醚引起海马LTP 下降,海马突触可塑性减退。
大量的临床研究结果表明,补体级联通路的激活是中枢神经系统炎症[15]、突触功能障碍[16]、抑郁、认知功能障碍[17]等多种神经系统疾病的基础。C1q 是补体级联反应中的第一个分子,起到“识别”的作用[18]。C3 是下游的补体蛋白,是补体级联反应中的核心蛋白[19]。在神经炎症的阿尔茨海默病患者中,我们发现脑组织、脑脊液和血浆中的C1q 表达增高[20]。在本研究中结果显示,与C 组比较,S 组C1q 和C3 的mRNA 升高,提示七氟烷引起了海马区补体级联反应的激活。补体C3是补体级联通路的关键蛋白,抑制C3 可缓解冠状病毒肺炎[21]、治疗牙周炎[22]和阵发性睡眠性血红蛋白尿[23]等。在阿尔茨海默病中补体C3 的缺失可减少tau 病变,缓解神经炎症、突触缺陷和神经变性[24]。CR2-Crry 是改良的靶向补体C3 的抑制剂,在多种疾病中起治疗作用[9]。研究表明,与S组比较,S+antiC3 组海马C1q 和C3 的mRNA 降低、PS 增幅明显增高和麻醉后各时间点自发交替率增加,提示七氟烷通过补体C3 通路致海马突触可塑性下降进而导致工作记忆水平下降。在小鼠胫骨骨折手术后海马星形胶质细胞和小胶质细胞中C3水平表达明显升高、突触数量减少,引起认知功能下降,给外源性C3 加重了术后认知能力的下降,阻断C3 可明显改善海马依赖的认知功能[7],与本研究结果一致。
TGFβ1/smad 通路是细胞内多种病理过程中的共同信号通路,认为其过度激活参与了神经胶质瘤[25]和脑积水[26]等脑部疾病的发生。研究[27]表明TGFβ1 可诱导糖尿病脑病,抑制C3 可减少TGFβ1/smad 通路激活,缓解糖尿病小鼠海马区神经元凋亡、突触丢失以及认知功能下降的发生发展。由于补体C3 调控TGFβ1 通路,且PCR 实验中,与C组比较,S 组在七氟烷麻醉后1 d,C1q 和C3 mRNA升高(P<0.05);在7 d,C1q 和C3 的mRNA 明显升高(P<0.001),故选取七氟烷麻醉后7 d 时间点行Western blot 实验。本研究发现,与C 组比较,S 组的TGFβ1 和Smad3 蛋白表达明显升高;与S 组比较,S+antiC3 组TGFβ1 和Smad3 蛋白表达明显下降,提示七氟烷通过补体C3 介导的TGFβ1/samd 信号通路导致老年小鼠突触可塑性和工作记忆水平的下降。
本研究尚存在不足之处在于:(1)仅做了补体C3 抑制的相关研究,未做补体C3 过表达的研究;(2)补体C3 介导TGFβ1/samd 信号通路的具体分子生物学机制有待进一步研究。
综上所述,七氟烷麻醉可导致老龄小鼠工作记忆水平下降,其机制可能与补体C3 介导TGFβ1/smad 信号通路导致突触可塑性下降有关。
【Author contributions】QIE Xiaojuan performed the experiments and wrote the article; LI Qingkai,LIU Ying,FENG Xueyan and HUO Xiulin collected and analyzed data and critically reviewed the intellectual content of articles; HUO Jia,YU Hailei,ZHANG Xiuning and LI Zhihua designed and performed the experiments, collected and analyzed data; XU Guanjie designed the study and reviewed the article, obtained research funding. All authors read and approved the final manuscript as submitted.
