结核分枝杆菌Rv3737抑制巨噬细胞自噬促进耻垢分枝杆菌在巨噬细胞内的存活
2023-03-09付雪峰娄思玉彭章丽
付雪峰 娄思玉 彭章丽
遵义医科大学附属医院呼吸与危重症医学科结核病区(贵州遵义 563000)
结核病(tuberculosis,TB)是目前十大致死性疾病之一,据2021年WHO 最新报告显示:2020年约有987 万结核病患者,其中以印度(26%)、中国(8.5%)和印度尼西亚(8.4%)占比较高,128 万人左右死于结核病[1]。结核病是由结核分枝杆菌(mycobacterium tuberculosis,Mtb)感染所致的慢性传染病。
Mtb 感染宿主后,宿主会启动一系列免疫防御反应,如自噬、凋亡和炎症等,通过清除入侵病原体而增强宿主防御功能[2-3],同时,Mtb 通过一系列的机制逃逸宿主免疫系统的攻击[4-6],其中自噬扮演着重要的角色。目前越来越多的研究发现Mtb 的相关蛋白通过抑制巨噬细胞自噬来促进Mtb 在巨噬细胞内的存活。如Eis(N-乙酰转移酶)[7]、PE_PGRS47[8]、CpsA[9]等分子通过不同的信号通路抑制巨噬细胞自噬来促进Mtb 在巨噬细胞内的存活。然而仅部分蛋白发现与巨噬细胞自噬有关,是否还存在其他Mtb 相关蛋白调控巨噬细胞自噬,需进一步研究。
Rv3737 是Mtb 第3737 位编码的蛋白,据预测,其可能的作用是一个跨膜蛋白调节苏氨酸的代谢。有研究提出与Rv3737 高度同源的Thr 主要涉及苏氨酸的转运,而苏氨酸的缺乏抑制了炎症细胞因子的释放及棒状杆菌的生长,同时促进雷帕霉素的释放,调控自噬的mTOR 信号通路[10-11],但在Mtb 感染宿主过程中,Rv3737 具体发挥的作用及机制有待进一步研究。
本课题组前期研究结果表明Mtb 跨膜蛋白Rv3737 在临床菌株中高表达,且与肺部病变严重程度及Mtb 在巨噬细胞内的复制存在一定的相关性,提示Rv3737 可能作为Mtb 的一种毒力因子而发挥作用,但具体机制尚不清楚。由于Mtb 是毒力菌株,需在生物级别P3 实验室进行操作,且Mtb生长缓慢,给研究Mtb 相关毒力分子在巨噬细胞内的作用带来一定的影响。随着1998年Mtb 基因组测序成功,许多研究致力于研究Mtb 相关基因的作用及其机制。与Mtb 高度同源的耻垢分枝杆菌(Mycobacterium smegmatis,MS),因无致病性、繁殖速度快,故常作为研究慢速分枝杆菌、致病性常用及等菌株的模式菌[12-13]。本研究主要通过构建过表达Mtb Rv3737 的耻垢分枝杆菌,探讨Mtb Rv3737 对于耻垢分枝杆菌在巨噬细胞内存活的影响及具体机制,为结核病的治疗提供潜在的药物靶点。
1 材料与方法
1.1 材料与试剂DMEM 培养基购自gibco 公司,TritonX-100、琼脂糖凝胶DNA 回收试剂盒、Western Blot 制胶液和4×蛋白上样缓冲液购自Solarbio公司,DNA marker 和质粒小提试剂盒购自TIANGEN 公司,7H9 培养基和7H10 培养基购自BD 公司,TransStartFastPfu Fly DNA Polymerase 购自北京全式金生物技术有限公司,Beta tubulin rabbit poly-Ab、Coralite488-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)和辣根过氧化物酶(HRP)标记的IgG二抗均购自Proteintech 公司,LC3B(D11)XP(R)购自Cell signaling 公司,4%多聚甲醛通用型组织固定液购自biosharp 公司。
1.2 实验方法
1.2.1 构建pMV261-Rv3737 融合表达质粒采用酚-氯仿(CTAB)法提取Mtb H37Rv 全基因组DNA,并通过设计合成含有pFlag 标签的Rv3737 相关引物pMV261-Rv3737-ECORI-F(CCGGAATTCCGGATGGACTACAAAGACGATGACGACAAGGATCAAGATCGATCGGACAACAC)和pMV261-Rv3737-HindIIIR(CCCAAGCTTGGGCTAGCGCACCTCGGTCGCG)扩增Mtb Rv3737 基因。将质粒pMV261 和目的基因Rv3737 经过双酶切、连接、转化进大肠杆菌,在含Kana(25 μg/mL)抗性的LB 固体平板上挑取单克隆点,扩大培养16 ~18 h 后提取菌液的DNA,并经双酶切及测序验证pMV261-Rv3737 融合表达质粒。
1.2.2 构建过表达MSRv3737 的耻垢分枝杆菌(MS::pMV261-Rv3737)培养耻垢分枝杆菌至生长对数期,即OD6000.6 ~1.0,并制备耻垢分枝杆菌感受态细胞,将验证成功的重组质粒pMV261-Rv3737 和空载质粒pMV261 通过电转化技术电转至感受态细胞中,在无抗性的7H9 液体培养基中复苏细菌2 ~3 d,再转至含Kana 抗性的7H10 固体平板中培养1 周后提取单克隆生长菌落,并将单隆菌落在7H9 培养基中扩大培养,并通过PCR 和Western blot 技术验证耻垢分枝杆菌中Rv3737 的表达,PCR 引物为(F:CTCAGTATCCTGCTGACCG;R-CCAGCCTCGCCAGCGCCGAC)。
1.2.3 MS::Rv3737 及MS::pMV261 的存活试验MS::Rv3737 过表达菌株和MS::pMV261 的胞外存活试验:将MS::Rv3737 过表达菌株和MS::pMV261 在含有卡那霉素的7H9 液体培养基中生长,通过OD600检测耻垢分枝杆菌生长处于对数生长期,取适量菌液加入到100 mL 的7H9 培养基中,将菌液的初始OD值调至0.02,于37 ℃250 r/min恒温摇床中培养,每间隔6 h 测定1 次OD值,并记录。MS::pMV261pMV261Rv3737 过表达菌株和MS::pMV261 的胞内存活试验:准备RAW264.7 细胞铺板于六孔板中(5 × 105/孔),10 %DMEM 37 ℃培养12 ~18 h,将MS::Rv3737 及MS::pMV261菌株以MOI=10 感染RAW264.7 细胞4 h,用1×PBS清洗2~3 遍,用阿米卡星(1∶2 000)药杀0 、6、12、24、48、72 h 等不同时间,在不同时间点弃细胞上清,并用1×PBS 清洗细胞2 ~3 遍,用1 mL 0.1%Triton X-100 裂解巨噬细胞,将裂解液稀释至10-5和10-7倍数,并取25 μL 涂板于7H10 固体平板中,1 ~2 周后观察细菌生长情况并计数。
1.2.4 Western blotMS::pMV261-Rv3737及MS::pMV261 感染RAW264.7 细胞8 h 后,用1xPBS 洗涤细胞2 ~3 遍,每孔中加入150 μL 的RIPA 组织裂解液及PMSF(1∶100),置于冰上裂解30 min 后,加入4×loading 蛋白上样缓冲液,在100 ℃沸水中处理15 min 使蛋白变性。用12%SDS-PAGE 分离胶及5%浓缩胶进行电泳(电泳条件:80 V、30 min 出孔,100 V,2 h 蛋白分离),将分离的蛋白经电转至PVDF 膜上(电转条件:150 V、0.4 A、2 h),再用5%脱脂奶粉于室温下封闭90 min,用5%脱脂奶粉将一抗LC3Ⅱ(cell signaling technology)稀释2 000倍后于4 ℃条件下孵育PVDF 膜过夜,0.1%的PBST洗涤3 遍,再以抗兔IgG 二抗(1∶5 000)于室温下孵育2 h,0.1%的PBST 洗涤3 遍后,加入适量的ECL发光液,在Amersham Imager600曝光机下曝光,Image J 进行灰度扫描分析结果。
1.2.5 激光共聚焦培养RAW264.7 细胞,并将细胞铺板于八孔皿中(3 × 104/孔)后过夜处理;将MS::pMV261-Rv3737 及MS::pMV261 感染巨噬细胞4 h;弃掉培养上清,用1 × PBS 清洗3 遍后,每孔加入200 μL 4%多聚甲醛,放置于37 ℃孵箱中固定30 min;吸掉4%多聚甲醛,用1 × PBS 清洗3 遍,加入200 μL的0.1%TritonX-100于室温下穿膜5 min;弃掉0.1 %TritonX-100,用1 × PBS 清洗3 遍,并加入200 μL 的3 %BSA 封闭液于室温下封闭1 h;封闭完成后,再用1 × PBS 清洗3 遍,按1∶200 的比例加入一抗(anti-LC3B)(注意避光条件下操作),于4 ℃条件下过夜处理;用1 × PBS 清洗3 遍后,用1 %BSA 溶液按1∶500 比例稀释二抗(Dylight 488-labeledAntibody To Rabbit IgG),并加入100 μL 二抗于室温条件下孵育1 h(避光操作);孵育结束后,用1 × PBS 避光迅速清洗3 遍,加入Hoechst 33342,室温条件下染色15 min(避光操作);染核结束后,用1 × PBS 避光清洗5 次,并加入300 μL 的1×PBS,于激光共聚焦显微镜下观察拍照并记录。
1.3 统计学方法所有实验均采用3 个及以上独立样本数据的均值进行比较,使用GraphpadPrism 8.0 软件进行统计分析,两组间行t检验确定组间的统计学显著性,3 组及3 组以上采取Two-Way ANOVA 进行比较,当P<0.05 时,则认为差异具有统计学意义。
2 结果
2.1 成功构建过表达Mtb Rv3737 的耻垢分枝杆菌菌株为研究Rv3737 在Mtb 感染巨噬细胞过程中的作用,通过PCR 扩增Mtb Rv3737 全基因组序列,并与穿梭质粒pMV261 构建融合表达质粒pMV261-Rv3737,并将pMV261-Rv3737 融合表达质粒电转至MS 感受态细胞中,以建立过表达Mtb Rv3737 的MS,即MS::pMV261-Rv3737,并通过PCR(图1A)及Western blot(图1B)鉴定目的基因Rv3737 及pFlag 的表达,结果表明成功构建过表达Mtb Rv3737 的MS 菌株。
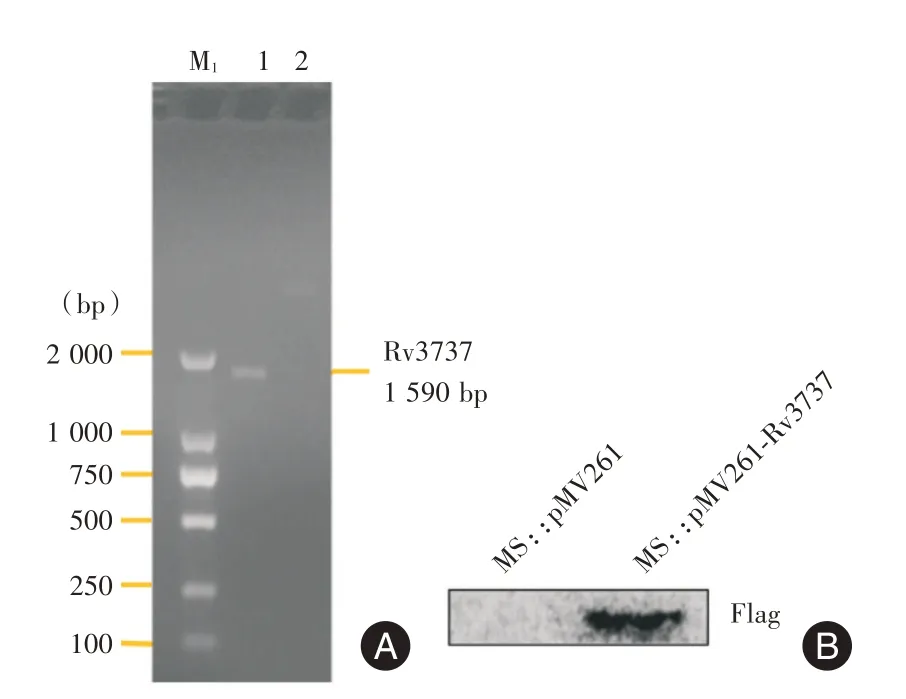
图1 PCR 和Western blot 验证过表达Rv3737 的耻垢分枝杆菌菌株Fig.1 Verified the over-expressed Rv3737 in the Mycobacterium smegmis through PCR and Western blot
2.2 Rv3737 不影响MS 的胞外生长,但能促进MS在巨噬细胞内的存活由于Mtb 与宿主细胞长期共存的过程中,Mtb 通过一系列机制逃逸宿主免疫系统的攻击从而促进Mtb 在巨噬细胞内的存活,本课题组前期研究也发现Rv3737 可能作为毒力因子参与Mtb 菌在巨噬细胞内的存活。因此,本研究MS::pMV261-Rv3737 和MS::pMV261 通过检测OD600及菌落计数的方法进一步探讨Rv3737对MS 在体外及巨噬细胞内存活的影响。首先,MS::pMV261-Rv3737 和MS::pMV261 在含有卡那霉素的7H9 液体培养基中生长,检测OD600,绘制生长曲线图,结果(图2A)表明过表达Mtb Rv3737 不影响MS 的体外生长。其次,将MS::Rv3737 和MS::pMV261 以MOI=10 感染RAW264.7 细胞后,通过菌落计数检测菌落数的改变,结果(图2B)显示Rv3737 促进了MS 在巨噬细胞内的存活。
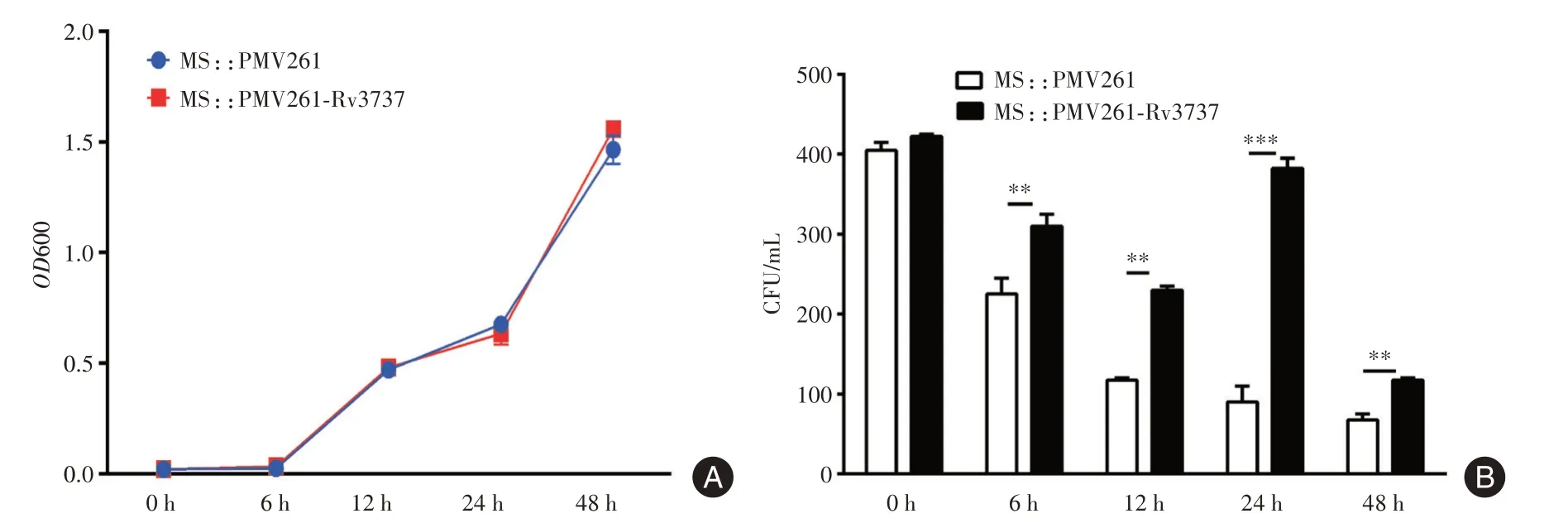
图2 Rv3737 对于Ms 的体外生长及巨噬细胞胞内存活的影响Fig.2 The survival of Rv3737 in vitro and Mycobacterium smegmis-infected macrophages
2.3 Rv3737 抑制MS 感染巨噬细胞的自噬越来越多的研究认为,Mtb 相关毒力基因通过抑制巨噬细胞自噬从而促进Mtb 在巨噬细胞内的存活,且既往研究认为与Rv3737 高度同源的ThrE 可能通过影响mTOR 信号通路调控棒状杆菌的存活[10],为进一步探讨Rv3737 是否通过影响巨噬细胞自噬从而促进Ms 在巨噬细胞内的存活。将MS::pMV261-Rv3737 和MS::pMV261 菌株感染巨噬细胞8 h,通过Western blot 检测自噬相关蛋白LC3II的变化及激光共聚焦检测LC3 自噬点的改变,结果(图3A、B)表明MS::pMV261-Rv3737 组与MS::pMV261 组相比,MS::pMV261-Rv3737 感染巨噬细胞组LC3II 表达量明显降低;激光共聚焦结果表明过表达Rv3737 组感染巨噬细胞后,巨噬细胞内绿色荧光标记的自噬点明显减少,表明Rv3737 抑制了MS 感染巨噬细胞自噬点的产生。综上所述,Rv3737 抑制了MS 感染巨噬细胞的自噬信号通路。

图3 Rv3737 抑制耻垢分枝杆菌感染巨噬细胞的自噬Fig.3 Rv3737 inhibited the autophagy of Mycobacterium smegmis-infected macrophages
3 讨论
Mtb 的不断蔓延,尤其是耐药结核分枝杆菌的出现,给结核病的治疗带来了严重的威胁。Mtb 与巨噬细胞长期共存的过程中,Mtb 在宿主细胞内表现出强大的生存能力,这主要是由于Mtb 产生了许多毒力因子,从而抵抗宿主免疫系统的攻击。本课题组前期研究发现,作为Mtb 跨膜蛋白的Rv3737 在临床菌株中呈高表达趋势,且与肺部严重程度及Mtb 的复制存在一定的相关性,表明Rv3737 可能是Mtb 的重要毒力因子。且既往研究认为,与Rv3737 高度同源的ThrE 涉及苏氨酸的转运[10],而自噬信号通路中的主要因子mTOR(雷帕霉素)作为一种丝氨酸/苏氨酸激酶来影响细胞的生存和繁殖[14]。由于目前尚无相关文献报道Mtb跨膜蛋白Rv3737 的功能及其机制,因此本研究旨在探索Rv3737 对Ms 与宿主之间相互作用的影响。
Ms 具有无致病性、繁殖速度快等优点,常作为研究Mtb 功能及其作用机制的模式菌[12-13]。本研究主要通过将Mtb 的Rv3737 转入MS 中,构建过表达Rv3737 的菌株模型,以探索Rv3737 对MS 与巨噬细胞之间相互作用的影响。本研究通过MS感染刺激巨噬细胞后检测其胞内MS 的存活情况,发现过表达Rv3737 可促进MS 在巨噬细胞内的存活,通过胞外生长实验发现Rv3737 对MS 体外生长并无明显影响,表明Rv3737 的表达确实促进了MS 在巨噬细胞内的存活。YANG 等[15]发现Mtb 表面相关蛋白Rv1515c 在MS 中过表达促进了MS 在胞内的存活,且GONG 等[16]报道的Rv3717 蛋白也可通过靶向凋亡通路以促进MS 在胞内的存活,而ALI 等[17]的研究发现Rv1523 可能通过干预细胞壁脂质的组成而促进Mtb 在巨噬细胞内的生存。
自噬是一种复杂的胞内降解过程,其主要通过吞噬降解外来入侵的病原体,增强宿主细胞的免疫防御功能,自噬在Mtb 的发病机制中扮演者重要角色[18]。然而,Mtb 在被巨噬细胞吞噬后,长期暴露在缺氧、酸性及营养缺乏的环境中,逐渐形成了抵抗宿主杀伤的免疫逃避机制[19]。为进一步探讨Rv3737 促进MS 内存活是否通过调节巨噬细胞自噬发挥效应,本研究将过表达Rv3737 的MS感染刺激巨噬细胞,结果表明Rv3737 明显抑制了巨噬细胞的自噬。因此,我们初步推测,跨膜蛋白Rv3737 可能通过抑制巨噬细胞自噬而促进MS 在巨噬细胞内的存活。PADHI 等[20]的研究发现Mtb的毒力蛋白LprE 也可通过抑制自噬通路来促进分枝杆菌的存活,其具体机制在于干扰了自噬通路中自噬体-溶酶体的融合阶段。此外,Eis[21-22]、ESAT6[23]、PE_PGRS41[24]、pknG[25]及PPE51[26]等Mtb 相关蛋白也可通过调控自噬途径而有利于Mtb 的持续存在。但就Rv3737 抑制巨噬细胞自噬的具体机制有待进一步研究。
综上所述,本研究将Rv3737 转入MS 中以构建Rv3737 过表达菌株,发现Rv3737 并不影响MS的体外生长,但能促进MS 在巨噬细胞内的存活,且Rv3737 抑制了巨噬细胞的自噬,由此推测Mtb Rv3737 可能通过抑制巨噬细胞的自噬从而促进MS 在巨噬细胞内的存活,为结核病的治疗提供潜在的靶点[27]。
【Author contributions】FU Xuefeng performed the experiments andwrote the article. LOU Siyu performed the experiments. FU Xuefeng and PENG Zhangli revised the article. PENG Zhangli designed the study and reviewed the article. All authors read and aplproved the final manuscript as sub-mitted.
