分化型甲状腺癌患者术后131I治疗前细胞免疫状态与临床病理特征的相关性研究
2023-03-07卢承慧李娇刘新峰王国强王增华张莹莹韩娜司增梅王叙馥
卢承慧 李娇 刘新峰 王国强 王增华 张莹莹 韩娜 司增梅 王叙馥,2
(1 青岛大学附属医院核医学科,山东 青岛 266003; 2 卫生部核医学重点实验室)
甲状腺癌是最常见的内分泌系统恶性肿瘤,其中分化型甲状腺癌(differentiated thyroid cancer,DTC)的发病率约占全部甲状腺癌的90%[1-2]。有研究表明,肿瘤患者的免疫功能(尤其是细胞免疫功能)与肿瘤的发生发展密切相关[3-4],而T细胞和自然杀伤(NK)细胞是反映细胞免疫功能的最为重要的指标。研究发现DTC患者术后肿瘤细胞的侵袭性与细胞免疫功能密切相关[5],但目前尚未有针对细胞免疫与肿瘤TNM分期及患者预后等相关性分析的研究。本研究综合分析了DTC术后131I治疗前细胞免疫状态与患者临床病理特征的关系,旨在为DTC的免疫治疗干预提供依据。
1 资料与方法
收集2018年3月—2019年2月在我院接受过甲状腺全切除术及颈部淋巴结清扫术,术后1~3个月行131I治疗的155例DTC患者的临床资料。纳入标准:①根据指南标准[1-2],DTC患者131I治疗前复发风险评估均为中高危者;②近1月内无使用免疫抑制剂及糖皮质激素史者。患者排除标准:①合并有其他原发或继发免疫系统疾病者;②合并有其他肿瘤者;③血清抗甲状腺球蛋白抗体(TgAb)≥115 kU/L者。
收集所有的患者的一般资料(年龄、性别、肿瘤最大径、是否侵犯邻近组织、复发风险分层、肿瘤NM分期、是否BRAFV600E基因突变)、131I治疗前1 d的血清刺激性甲状腺球蛋白(Tg)水平。收集患者131I治疗前1 d的细胞免疫指标(外周血NK细胞、T细胞亚群)。将所有患者按照性别、年龄(<55岁、≥55岁)、肿瘤最大径(≤2 cm、>2 cm)、侵犯邻近组织情况(否、是)、复发风险分层(中危、高危)、N分期(N0、N1a、N1b期)、M分期(M0、M1期)、刺激性Tg水平(<10 μg/L、≥10 μg/L)、BRAFV600E基因突变情况(否、是)进行分组,比较各组患者间细胞免疫各项指标的差异。
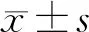
2 结 果
155例患者中,男性组患者的外周血CD4+T细胞水平显著低于女性组(t=-2.120,P<0.05),两组外周血NK细胞、CD3+T细胞、CD8+T细胞水平、CD4/CD8比值比较差异无显著性(P>0.05);年龄≥55岁组患者的外周血NK细胞水平显著高于<55岁组,外周血CD3+T细胞与CD8+T细胞水平显著低于<55岁组(z=-2.344、-2.681,t=2.266,P<0.05),两组患者的外周血CD4+T细胞、CD4/CD8比值比较差异无显著性(P>0.05);肿瘤最大径>2 cm组患者的外周血CD3+T细胞水平、CD4+T细胞水平以及CD4/CD8比值显著低于≤2 cm组(z=2.595、-2.652,t=3.861,P<0.05),两组患者的外周血NK细胞、CD8+T细胞水平比较差异无显著性(P>0.05);M1组患者外周血CD4+T细胞水平显著低于M0组(t=4.035,P<0.05),两组患者的外周血NK细胞、CD3+T细胞、CD8+T细胞水平及CD4/CD8比值差异无显著性(P>0.05);在侵犯邻近组织分组、复发风险分层分组、N分期分组、刺激性Tg分组以及BRAFV600E基因突变分组中,各组患者的外周血NK细胞、CD3+T细胞、CD4+T细胞、CD8+T细胞水平及CD4/CD8比值比较均无显著性差异(P>0.05)。见表1。
3 讨 论
近年来,人群中DTC发病率呈逐年增高的趋势,其病因与发病机制越来越引人关注。研究表明,机体免疫状态与恶性肿瘤的诱发、病情的发展密切相关,在机体免疫功能低下或免疫功能被抑制时,肿瘤的发生率会显著增高,同时在肿瘤进行性生长时患者的免疫功能往往会受肿瘤的影响,其中外周血T淋巴细胞亚群各项指标的变化最为明显[6-8]。因此患者自身的免疫状态对于肿瘤的发展与转归有着显著影响[9-11]。机体的免疫功能中发挥抗肿瘤作用的主要是细胞免疫,即经特异性细胞(T细胞亚群)及非特异性细胞(巨噬细胞、NK细胞)介导的免疫反应。外周血中成熟的T细胞,即CD3+T细胞,根据CD4与CD8的表达不同又分为CD4+T细胞和CD8+T细胞。CD4+T细胞可辅助B细胞分化产生抗体,CD8+T细胞则抑制抗体的合成、分泌及T细胞的增殖,两者的稳态维持着机体正常的免疫应答[12]。NK细胞在抗肿瘤免疫及遏制肿瘤扩散方面起着重要的作用[13],能够对侵犯、转移的肿瘤细胞产生强大的杀伤作用,从而阻止肿瘤的早期扩散。正常情况下机体T细胞及各亚群数目相对稳定,在人体抗肿瘤免疫反应中起着重要作用[14-15]。研究显示,甲状腺癌患者CD4+T细胞、CD4/CD8比值及NK细胞活性明显低于正常人,而CD8+T细胞活性增高,且该现象随TNM分期进展更趋明显[16]。CD4+T细胞和CD4/CD8比值的持续下降可能与甲状腺癌复发有关[17]。这些结果提示,细胞免疫在甲状腺癌患者中可能发挥一定作用。
罗全勇等[18]研究发现,DTC患者术后及131I治疗后48~72 h需要补充左甲状腺素片进行TSH抑制治疗,补充左甲状腺素片后3个月,与治疗前甲状腺功能减退状态相比,其外周血中总T细胞、NK细胞、CD4+T细胞、CD8+T细胞亚群水平均无显著变化;韩婷等[5]研究也分析了DTC患者术后及131I治疗前的细胞免疫指标与肿瘤侵袭性间的关系,指出当DTC患者免疫指标出现异常时,肿瘤侵犯甲状腺包膜和远处转移风险增高。由此推测131I治疗前短暂的甲状腺功能减退应该不会导致细胞免疫状态发生改变,此时对131I治疗前患者的细胞免疫状态与临床病理特征进行相关性分析也应该是可行的。本研究对各分组DTC患者的外周血CD4+T细胞水平进行分析,结果显示,男性显著低于女性,肿瘤最大径>2 cm组患者显著低于≤2 cm组,M1组患者显著低于M0组。CD4+T细胞主要为辅助性T细胞,可通过多种途径促进抗肿瘤免疫:①辅助记忆性细胞毒性T淋巴细胞(CTL)发挥细胞毒性效应:CD4+T细胞被活化后可以产生一系列细胞因子,进而激活了肿瘤特异性CTL参与免疫反应[19-20];②活化其他效应细胞:CD4+T细胞可通过直接或间接作用活化B细胞、巨噬细胞以及NK细胞,共同发挥抗肿瘤作用[20]。③直接或间接杀伤靶细胞:CD4+T辅助细胞通过Fas-FasL途径介导肿瘤细胞凋亡,还可分泌细胞因子如干扰素-γ介导对肿瘤细胞的间接杀伤作用[21];④参与肿瘤免疫记忆[20]。有研究探讨了DTC中最常见的病理类型,即甲状腺乳头状癌(PTC)与T淋巴细胞亚群的关系,发现CD4+T细胞为PTC中主要的肿瘤相关T细胞亚型,CD4+T细胞极化可能在PTC的免疫调节中起重要作用[22-23]。FRENCH等[23]观察到外周血CD4+T细胞百分比与PTC原发灶大小呈负相关,外周血CD4+T细胞不仅抑制肿瘤免疫反应,而且通过TGFβ诱导的肿瘤环境中强血管生成因子(如VEGF)表达促进肿瘤进展,即外周血CD4+T细胞的百分比下降提示肿瘤侵袭性更强或预后不佳,这与对宫颈癌、肝细胞癌的相关研究报道结果一致[24]。而本研究显示,患者外周血CD8+T细胞、NK细胞水平在不同肿瘤分期中均无明显差异,可能原因:①CD4+T细胞为PTC中主要的肿瘤相关T细胞亚群,原发灶越大,肿瘤基质中的CD4+T细胞数越多,且CD4+T细胞对PTC基质的浸润与疾病分期有关,而CD8+T细胞、NK细胞在不同疾病分期中变化不明显[22-23];②也许受本研究的样本量较少的影响;③以往研究主要针对的是甲状腺癌的其他病理类型,如未分化癌、髓样癌,这几种甲状腺癌的恶性程度较高,而对于DTC这种恶性程度较低的类型,研究较少,而恶性程度不同的甲状腺癌患者体内淋巴细胞亚群变化可能不完全一致。
综上所述,DTC患者术后的细胞免疫状态与肿瘤的临床病理特征存在一定相关性,尤其是外周血CD4+T细胞水平,在男性、肿瘤最大径>2 cm、M1分期中水平更低,因此监测淋巴细胞亚群有助于临床从免疫角度对患者进行诊疗干预。但该结论还需增大样本量和进行前瞻性的研究进一步验证。
伦理批准和知情同意:本研究涉及的所有试验均已通过青岛大学附属医院医学伦理委员会的审核批准(文件号QYFYWZLL27846)。受试对象或其亲属已经签署知情同意书。
作者声明:卢承慧、王增华、张莹莹、韩娜、司增梅、王叙馥参与了研究设计;卢承慧、李娇、刘新峰、王国强参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
