酸浆宿萼中酸浆苦素的提取工艺及降糖活性
2023-03-06李成华付艳艳薛长松陈建宇朱芳娆
李成华,付艳艳,薛长松*,陈建宇,朱芳娆
(1.通化师范学院长白山优势生药资源开发与利用实验室,吉林 通化 134001;2.长春中医药大学附属医院肾病科,吉林 长春 130021)
酸 浆 [Physalis alkekengi L.var.franchetii(Mast.)Makino]别名红姑娘、灯笼草、菇蔫儿、姑娘儿、挂金灯,原产于我国,主要分布在吉林、辽宁、黑龙江、内蒙古、四川、西藏等地[1],是药食两用植物[2]。酸浆宿萼(果萼)性味甘、酸、性寒,有清凉、消肿、利尿等功效,糖尿病患者常用其代茶饮,能对血糖调节起到较好效果[3]。酸浆苦素是酸浆中一类重要的生物活性物质。酸浆苦素A通过遏制信号转导和抑制转录激活因子相关通路起到抗肺部肿瘤作用[4]。酸浆苦素A可以激活Nrf2以及靶基因来诱导醌还原酶的表达,而具有预防肝病以及癌症的潜能[5]。酸浆苦素B能明显抑制人乳腺癌细胞增殖、改变线粒体的膜电位和细胞活性氧水平、促进细胞凋亡[6]。酸浆苦素B、D、J和P能抑制和杀灭枯草芽孢杆菌等,具有较好的抗菌作用[7]。酸浆提取物能够抑制高血糖标准的人脐静脉内皮细胞的炎症反应和凋亡,而具有明显的抗糖尿病活性[8]。
低共熔溶剂[9](deep eutectic solvents,DESs)作为新型共熔混合溶剂,具有制备方法简单、毒性低或无毒、生物相容性、生物可降解、可回收等多种优点,逐渐成为一种新型的离子液体取代剂。DESs的相关研究还是新兴领域,正处在初步发展的阶段。DESs通过与溶剂形成氢键可以表现出极其强大的溶解性。DESs的特殊溶解性为提取活性物质提供了新鲜的有效途径。DESs提取的银杏萜烯内酯[10]、核桃青皮多酚[11]、黄芩苷[12]均证明了该提取条件的切实可行性。超声辅助提取(ultrasonic-assisted extraction,UAE)是一种高效的萃取技术,能够减少溶剂及能量损耗,缩减提取时间[13]。超声波辅助提取菊芋花青素[14]、七叶莲多酚[15]均取得了较好的提取效果。因此,DESs-UAE提取植物中功能性成分成为新颖的高效提取手段。
甲醇提取是酸浆苦素的传统提取方法[16-17],甲醇有毒性,而DESs是一种新类型绿色溶剂。DESs-UAE提取酸浆宿萼中酸浆苦素提取工艺参数匮乏且有关酸浆苦素降糖活性研究甚少。本研究以酸浆宿萼为原料,采用DESs-UAE将酸浆苦素从原料组织中释放出来,利用响应面法优化提取工艺,通过对α-葡萄糖苷酶、α-淀粉酶的抑制能力评价酸浆苦素体外降糖活性,为进一步开发酸浆活性成分提供有益参考。
1 材料与方法
1.1 材料与试剂
酸浆宿萼:采自通化市,30℃低温烘干,粉碎过60目筛,备用。
β-谷甾醇对照品:中国食品药品检定研究院;α-淀粉酶≥10 000 U/g、α-葡萄糖苷酶、磷酸盐缓冲溶液(phosphate buffered saline,PBS)≥50 U/mg:上海伊卡生物技术有限公司;尿素、葡萄糖、甲醇(均为分析纯):天津市百世化工有限公司。
1.2 仪器与设备
UV1900紫外可见分光光度计:上海菁华科技仪器有限公司;JA5003N型电子天平:上海菁海仪器有限公司;RE-52AA旋转蒸发器:上海亚荣生化仪器厂;Thermo Forma酶标仪:美国Bio-Rad公司。
1.3 方法
1.3.1 酸浆苦素的提取
标准曲线的绘制:甲醇超声溶解β-谷甾醇对照品1.0 mg并定容于5 mL容量瓶中,得0.2 mg/mL β-谷甾醇对照品贮备液,于波长200 nm~1 000 nm扫描,优选386 nm 为测定波长[18]。用甲醇定容,配制 0、0.1、0.2、0.4、0.6、0.8、1.0 mg/mL系列浓度对照品溶液于容量瓶中,于优选的波长处测量吸光度,甲醇作参比,以吸光度A对浓度C做回归方程得A=0.791 7C-0.051 2,R2=0.999 3。结果显示,β-谷甾醇对照品溶液在0.1 mg/mL~1.0 mg/mL具备良好线性关系。
低共熔溶剂的制备及其低共熔溶剂体系的选择:氯化胆碱参考司悦悦[19]的方法测定,分别与乳酸、尿素、1,4-丁二醇、柠檬酸、葡萄糖按一定摩尔比混合,置于85℃水浴中长时间搅拌至混合物清澈透明。具体低共熔溶剂的分类及摩尔比例见表1。

表1 低共熔溶剂的种类及比例Table 1 Types and ratios of deep eutectic solvents
样品中酸浆苦素的含量测定:取酸浆宿萼粉末1.0g于烧瓶中,料液比按照1∶20(g/mL)加入含水率20%的低共熔溶剂(低共熔溶剂16 mL+蒸馏水4 mL),80℃下超声30 min,萃取液用微孔膜过滤,即得酸浆苦素提取液。准确吸取酸浆苦素样品溶液2 mL于离心管中,加入石油醚2 mL,涡旋10 min,去石油醚层,加入乙酸乙酯2 mL,涡旋10 min,取乙酸乙酯层吹干,加入甲醇完成纯化于与5mL容量瓶中定容,在波长386nm处测吸光度[20],求出浓度,计算出酸浆苦素提取量(mg/g)。
1.3.2 单因素试验
在超声功率200 W、含水量30%、超声时间40 min的条件下,考察料液比[1 ∶5、1 ∶10、1 ∶15、1 ∶20、1∶25(g/mL)]对酸浆苦素提取量的影响;在料液比1∶10(g/mL)、含水量 30%、超声时间 40 min的条件下,考察超声功率(150、200、250、300、350 W)对酸浆苦素提取量的影响;在料液比1∶10(g/mL)、超声功率300 W、超声时间40 min的条件下,考察含水量(10%、20%、30%、40%、50%)对酸浆苦素提取量的影响;在料液比1∶10(g/mL)、超声功率300 W、含水量20%的条件下,考察超声时间(10、20、30、40、50 min)对酸浆苦素提取量的影响。每组均进行3次平行试验。
1.3.3 优化超声辅助低共熔溶剂提取条件
依据单因素试验结果,选择料液比(A)、超声功率(B)、超声时间(C)、含水量(D)4个因素,利用响应面法优化超声辅助低共熔溶剂提取酸浆苦素工艺条件。以样品酸浆苦素提取量为响应值(Y)进行试验设计,因素水平见表2。

表2 因素水平设计Table 2 Factors and levels of test design
1.3.4 降糖活性测定
制备 0.062 5、0.125、0.25、0.5、1 mg/mL 的酸浆苦素样品溶液,0.031 25、0.062 5、0.125、0.25、0.5 mg/mL 的阿卡波糖阳性对照溶液,进行酸浆苦素体外降糖活性研究。
1.3.4.1 对α-葡萄糖苷酶的抑制能力测定
抑制α-葡萄糖苷酶试验设计见表3。
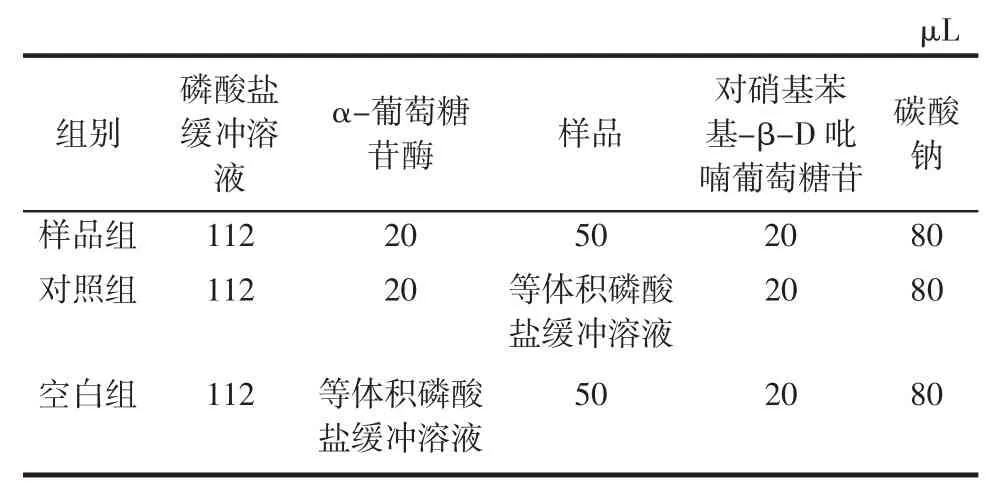
表3 抑制α-葡萄糖苷酶试验设计Table 3 Experimental design for α-glucosidase inhibition
参照表3完成相关试验,其中加入样品和对硝基苯基-β-D吡喃葡萄糖苷后分别在37℃反应15 min,加入碳酸钠终止反应后,于540 nm处检测吸光度,计算IC50值。
α-葡萄糖苷酶的抑制率/%=[A对照-(A样品-A空白)]/A对照×100
式中:A对照为对照组吸光度;A样品为样品组吸光度;A空白为空白组吸光度。
1.3.4.2 对α-淀粉酶的抑制能力测定
抑制α-淀粉酶试验设计见表4。

表4 抑制α-淀粉酶试验设计Table 4 Experimental design for α-amylase inhibition
参照沈鹏等[21]的方法制备3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)溶液。参照表4进行相关试验,其中加入α-淀粉酶后在37℃反应10 min,加入DNS后,于540 nm处检测吸光度,计算IC50值。α-淀粉酶的抑制率计算公式如下。
α-淀粉酶的抑制率/%=[(A对照-A空白对照)-(A样品-A样品对照)]/(A对照-A空白对照)×100
式中:A对照为对照组吸光度;A样品为样品组吸光度;A空白对照为空白对照组吸光度;A样品对照为样品对照组吸光度。
1.4 数据处理
采用 Design-Expert 8.0.6、Excel、SPSS13.0 软件处理数据。
2 结果与分析
2.1 最优低共熔溶剂的筛选
氯化胆碱和有机酸、胺、糖和多元醇按相应的摩尔比配制5种类型的DESs。常温下,DESs均呈清澈透明状,考虑DESs黏度对提取物的作用效果,酸浆苦素提取所选取的DESs含水量为20%。以75%乙醇做参比[22],不同DESs对酸浆苦素提取量的影响如图1所示。
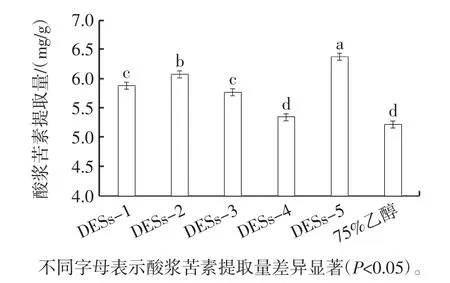
图1 不同溶剂对酸浆苦素提取量的影响Fig.1 Effect of different solvents on physalin yield
由图1可知,在5种DESs中,氯化胆碱∶葡萄糖=2∶1(摩尔比)合成的DESs-5提取效果最好,酸浆苦素提取量为(6.37±0.19)mg/g。这可能是由于氯化胆碱、葡萄糖合成的DESs-5与酸浆苦素的极性更接近。DESs组酸浆苦素提取量高于75%乙醇组可能由于DESs能与酸浆苦素之间形成更强烈的氢键作用[23]。优选氯化胆碱∶葡萄糖=2∶1(摩尔比)制备的DESs-5用于后续的提取工艺优化。
2.2 单因素试验结果
2.2.1 料液比对酸浆苦素提取量的影响
料液比对酸浆苦素提取量的影响见图2。
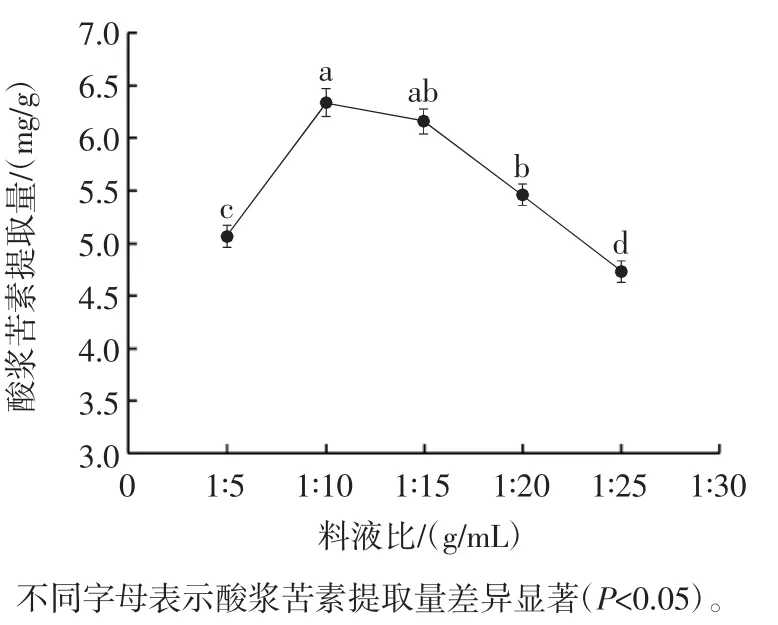
图2 料液比对酸浆苦素提取量的影响Fig.2 Effect of solid-to-liquid ratio on physalin yield
由图2可知,一定范围内酸浆苦素提取量随着DESs体积的增加而增加,提取溶剂量的增加,能够增加酸浆宿萼和溶剂之间酸浆苦素的浓度差,从而提升传质推动力,有益于酸浆苦素的溶出[24]。DESs体积过大导致酸浆苦素提取量下降,可能是随着提取溶剂的增加,酸浆苦素被充分浸提,当料液比达到1∶10(g/mL)而继续增加溶剂体积时,超声波能量作用在物料上相对减少,在溶剂上相对增加,从而导致酸浆苦素提取量下降[25]。因此,选择料液比 1 ∶5、1 ∶10、1 ∶15(g/mL)进行后续试验。
2.2.2 超声功率对酸浆苦素提取量的影响
超声功率对酸浆苦素提取量的影响见图3。
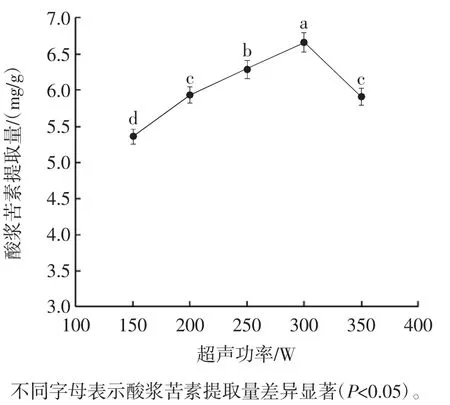
图3 超声功率对酸浆苦素提取量的影响Fig.3 Effect of ultrasonic power on physalin yield
由图3可知,酸浆苦素提取量随着超声功率的增加呈先上升后下降的趋势。超声功率为300 W时,酸浆苦素提取量达到最高,随后开始下降。这可能与超声振动能产生空化和剪切效应有利于内容物释放有关,但超声功率过大,反而破坏内容物结构[26]。因此,选择超声功率为250、300、350 W进行后续试验。
2.2.3 低共熔溶剂含水量对酸浆苦素提取量的影响
低共熔溶剂含水量对酸浆苦素提取量的影响见图4。
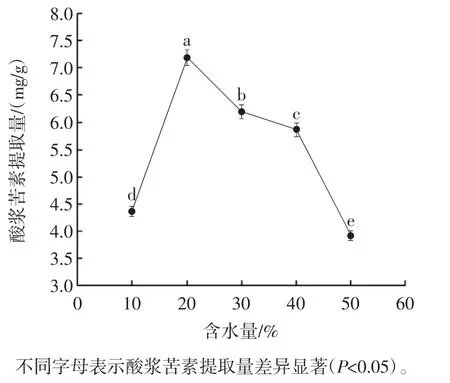
图4 含水量对酸浆苦素提取量的影响Fig.4 Effect of water content on physalin yield
由图4可知,含水量为20%时,酸浆苦素提取量达到最高。DESs含水量的多少与DESs的黏度和极性有关,进而影响DESs的提取性能[27]。分析原因可能是水的加入降低了DESs的黏度。适当降低黏度能够有效提升传质速率,增进内容物的溶出。当含水量大于20%时,酸浆苦素提取量走势下降。DESs含水量过大会削弱甚至损害氢键供体和氢键受体之间的氢键作用,进而损坏DESs的超分子结构,使有效溶剂DESs的含量减低,从而导致酸浆苦素得率降低[25]。因此,选择含水量15%、20%、25%进行后续试验。
2.2.4 超声时间对酸浆苦素提取量的影响
超声辅助提取工艺耗时短、效率高,适用于DESs等溶剂提取中药成分[28]。超声时间也是影响酸浆苦素提取量的重要因素。超声时间对酸浆苦素提取量的影响见图5。
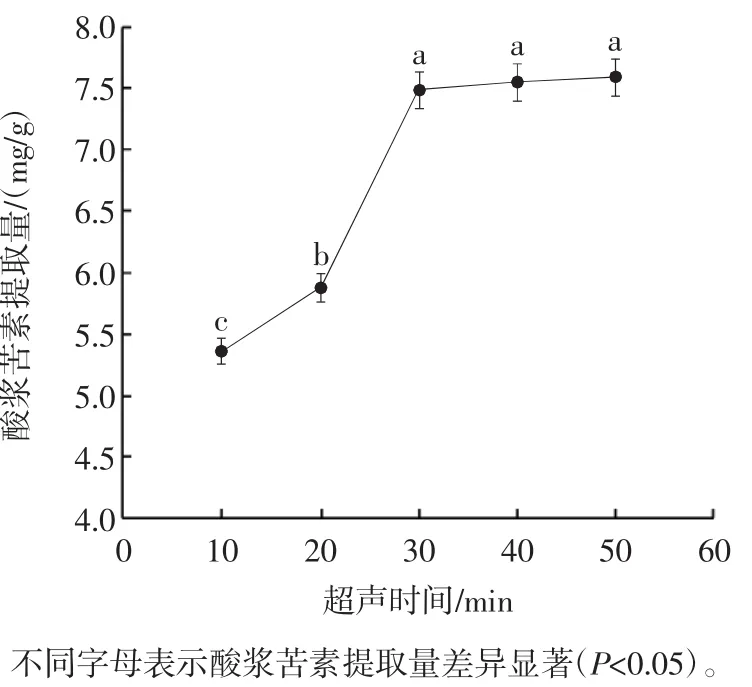
图5 超声时间对酸浆苦素提取量的影响Fig.5 Effect of ultrasound time on physalin yield
由图5可知,超声时间为10 min~30 min时,酸浆苦素提取量呈上升趋势,继续延长超声时间,提取量趋于平缓。30 min的提取时间能够将大部分的酸浆苦素从酸浆宿萼中提取出来,考虑到节能问题,选择超声时间为25、30、35 min进行后续试验。
2.3 响应面法优化酸浆苦素提取工艺试验结果
试验设计方案与结果见表5。
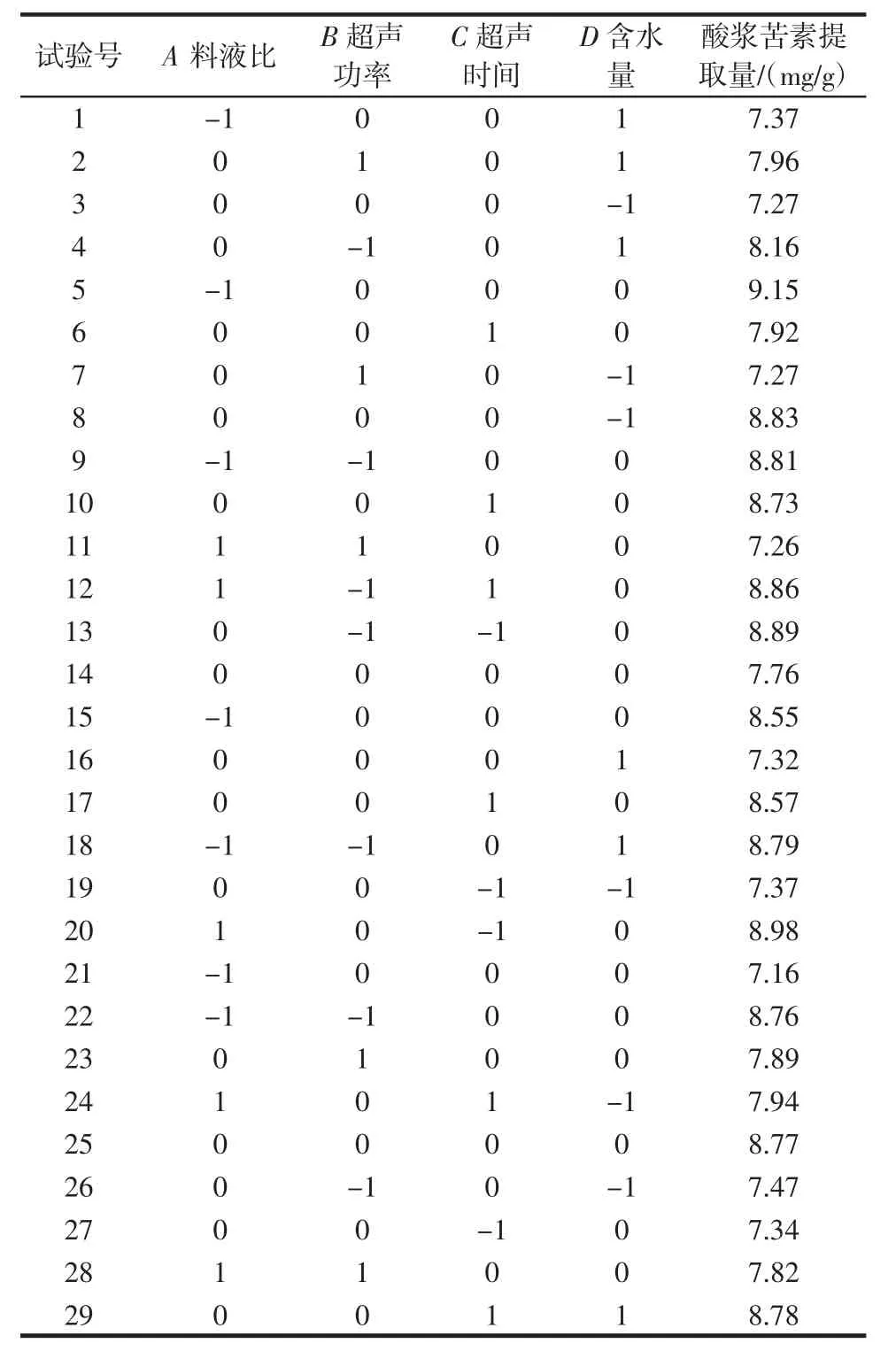
表5 拟合设计试验方案及结果Table 5 Results of fitting test
采用响应面分析法分析试验结果,以酸浆苦素提取量为响应值,对试验数据进行二次多项式回归拟合,得回归方程:酸浆苦素提取量=8.77-0.23A+0.093B+0.057C-0.12D-0.35AB+0.11AC-0.18AD+0.64BC+0.048BD+0.25CD-0.87A2-0.37B2-0.11C2-0.020D2,R2=0.991 5。响应面法对酸浆苦素提取量的方差分析见表6。
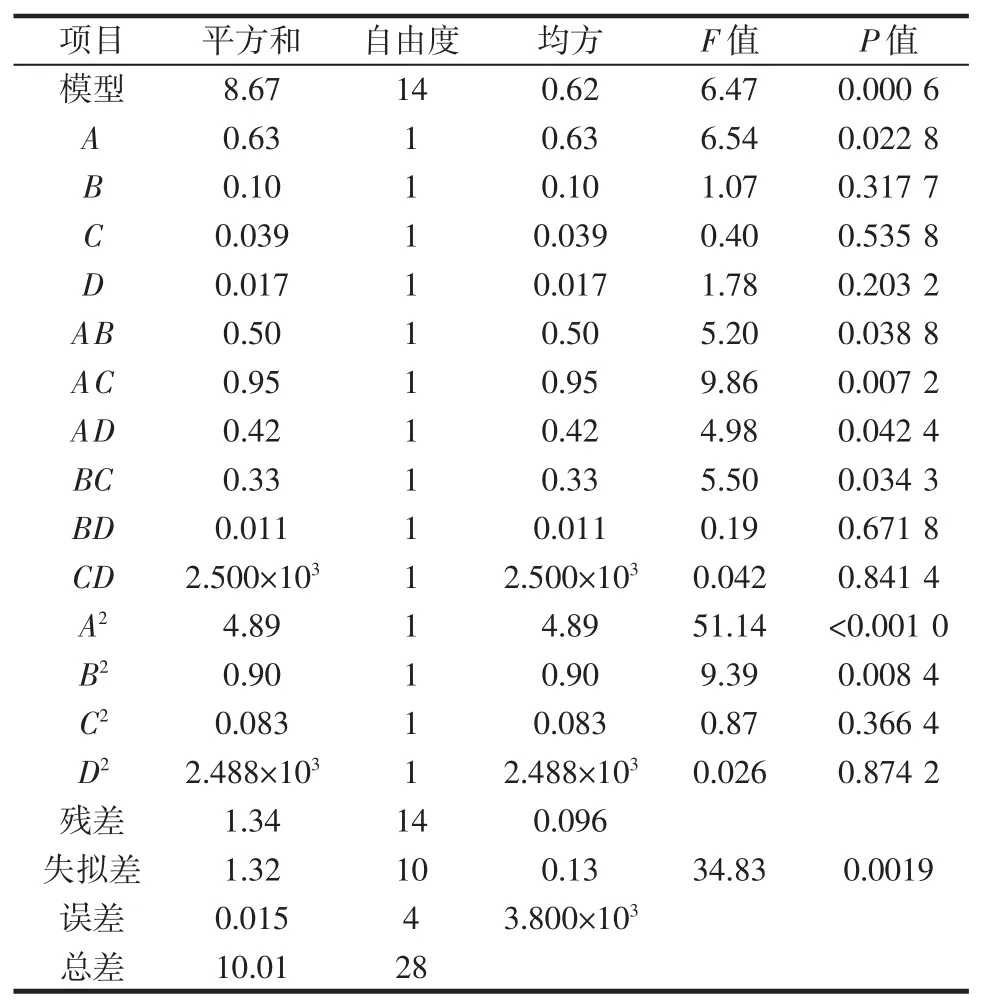
表6 响应面法对酸浆苦素提取量的方差分析Table 6 Analysis of variance of orthogonal test
由表6可知,回归方程显著性检测P=0.000 6,表明该二次方程模型显著(P<0.05),回归方程模型与实际拟合性较好,试验误差小,证明可用该模型对酸浆苦素的提取量进行分析与预测。各因素对酸浆苦素提取量的影响能力大小依次为A(料液比)>D(含水量)>B(超声功率)>C(超声时间)。
将表6中的数据进行响应曲面分析,考察2个工艺参数对酸浆苦素提取量的交互作用。依照回归方程,考察响应曲面和相应的等高线的形状,分析4个因素对酸浆苦素提取量的影响,结果见图6。

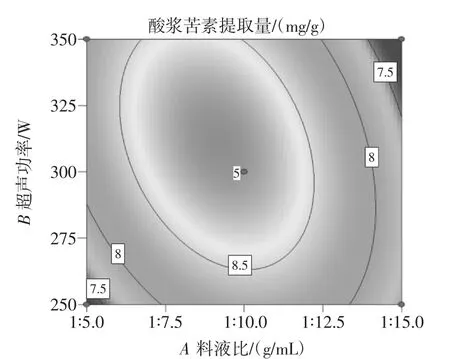
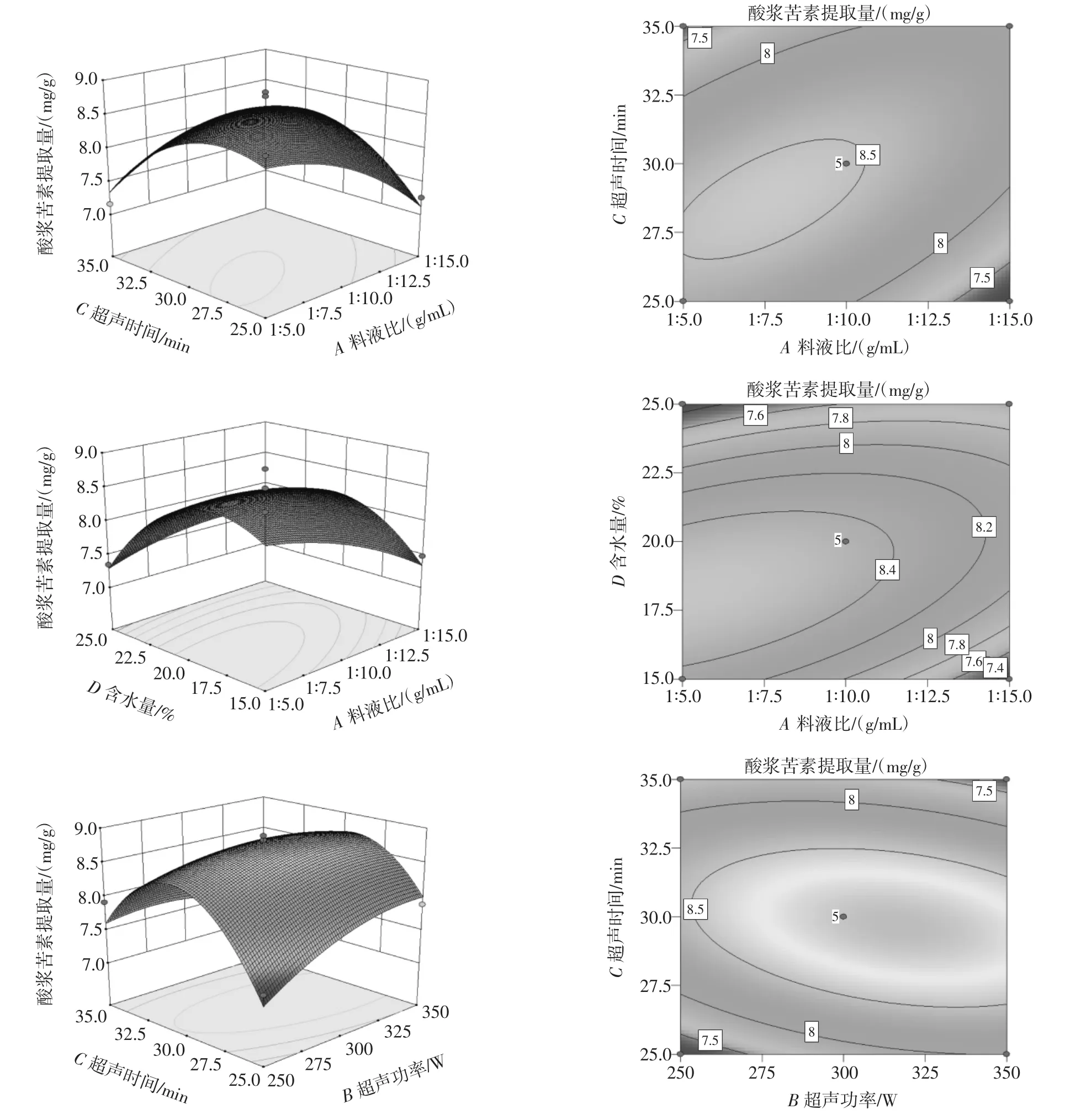
图6 酸浆各因素交互作用对多糖提取影响的响应面Fig.6 Response contour plots and surface plots showing the effect of factor interaction on physalin yield
3D响应曲面图和热图可以直观反映各因素交互作用对酸浆苦素提取量影响的显著程度。在3D图中,曲面的坡度越大,曲面顶端颜色越深,交互作用越显著。在等高线图中,等高线形状越接近椭圆则两个工艺参数之间的交互作用越显著。由图6可知,与其它考察因素比较,A料液比和B超声功率、A料液比和C超声时间、A料液比和D含水量、B超声功率和C超声时间分别与酸浆苦素提取量所形成的三维曲面图形较陡,响应值波动较明显,且等高线图为椭圆形,交互作用对酸浆苦素提取量影响相对大[29],与表6方差分析结果相符合。
2.4 验证试验结果
由Design-Expert 8.0.6软件分析,得出酸浆苦素提取的最佳条件。结果显示,酸浆苦素提取的最佳条件为料液比 1∶10(g/mL)、超声功率 322 W、超声时间30.45 min、含水量15.35%,此时得到的酸浆苦素提取量为9.070 77 mg/g。结合试验操作性,试验条件优化为料液比 1∶10(g/mL)、超声功率 320 W、超声时间 30 min、含水量15%。在此优化工艺条件下,进行3次验证,酸浆苦素提取量平均值为(8.96±0.15)mg/g,与模型预期值的误差为1.22%,说明该方程与酸浆苦素提取试验情况拟合较好。
2.5 酸浆苦素降糖活性结果
酸浆苦素降糖活性结果见表7。
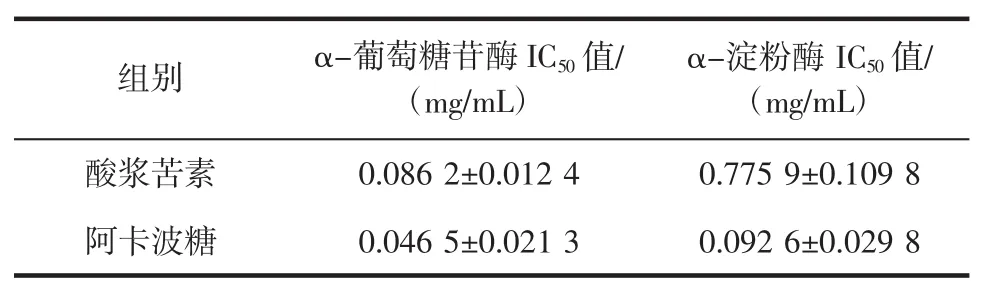
表7 酸浆苦素降糖活性结果Table 7 Sugar-lowering activity of physalin
由表7可知,酸浆苦素与阿卡波糖对照品均有降糖活性,两者对α-葡萄糖苷酶、α-淀粉酶的抑制结果进行两样本T检验,两者对α-葡萄糖苷酶的抑制能力差异不显著(t=3.599、P=0.069),对 α-淀粉酶的抑制能力差异显著(t=8.477、P=0.014)。
3 结论
DESs-UAE提取酸浆宿萼中的酸浆苦素,以氯化胆碱∶葡萄糖=2∶1(摩尔比)合成的DESs-5为最佳提取溶剂。响应面分析法使得试验优选工艺参数明确,通过回归方程拟合几种试验考察因素间的函数关系寻得各交互考察因素的最确切组合以及响应值的最佳值。本文运用DESs提取酸浆宿萼中的酸浆苦素,结合响应面分析法优化了DESs-UAE提取酸浆苦素的工艺。相比传统甲醇提取酸浆苦素,DESs-UAE提取酸浆苦素绿色环保、酸浆苦素提取量高,高于75%乙醇组。α-淀粉酶、α-葡萄糖苷酶抑制剂,能降低2型糖尿患者升糖指数和餐后高血糖。医治2型糖尿病的常规药物阿卡波糖等容易引起如胃肠胀气、腹泻等不良副作用,将常规药物与具备生物效用的天然活性产物联合使用是减少药物副作用的可行途径。酸浆苦素有很好的降糖活性,可以与医治2型糖尿病的常规药物联合使用。本试验为酸浆苦素的进一步分离纯化、调节血糖、创造经济价值等深化研究奠定了基础。
