银杏外种皮提取物对苹果链格孢霉的抑制作用
2023-03-06聂文琦王琛郴孙浩叶淑红
聂文琦,王琛郴,孙浩,叶淑红
(大连工业大学食品学院,辽宁 大连 116034)
银杏外种皮是银杏仁外的多汁表皮,其含有银杏酚酸、多糖、黄酮、内酯、矿物元素等多种成分,与银杏叶和种核的成分类似,具有抗肿瘤转移、抑菌、杀菌、抗氧化等作用,开发前景良好[1]。目前对银杏外种皮的研究鲜有报道,银杏外种皮占整个种子质量的70%左右,我国每年生产1.2万吨~1.4万吨种核,约有3.6万吨~4.2万吨的银杏外种皮遭到废弃,这不仅造成了银杏资源的巨大浪费,而且造成了环境的严重污染[2]。
我国苹果生产总量虽然较大,但我国苹果品质相对较差,主要表现为果形不整齐、成色较差、风味不足且不耐贮藏和运输。并且在果实生长前期、采收前、贮藏期的主要病害苹果霉心病危害很大,严重影响了果农的经济收入[3]。有数据显示,果蔬采后腐烂占20%以上,其中大部分是由微生物感染引起,而链格孢霉菌是果蔬采后病害的主要致病菌[4]。
近年来包括我国在内的许多国家对高毒、高残留的农药实施了禁用的政策。与化学合成农药相比,植物源农药具有选择性高、低毒、易降解等优点。为此,开发高效、低毒、绿色环保型的植物源抑菌剂成为当前解决农业生产中病害的新途径之一。深入开展银杏外种皮的研究和开发利用,不但可做到废物利用,变废为宝,还可防止环境污染,从而获得较大的经济效益和社会效益。本研究以银杏外种皮为原料探究其对苹果链格孢霉的抑制作用,为新型植物源农药的开发提供参考。
1 材料与方法
1.1 材料与试剂
银杏外种皮:大连工业大学校园内收集;苹果链格孢霉菌:大连工业大学食品学院303实验室保藏。
考马斯亮蓝G-250、三氯乙酸、硫代巴比妥酸、愈创木酚、柠檬酸、邻苯二酚、30%过氧化氢、丙酮(均为分析纯):天津市科密欧化学试剂有限公司;无水乙醇、磷酸氢二钠、磷酸二氢钠、四氯化钛(均为分析纯):天津大茂化学试剂厂;氨水(分析纯):广州市浩盈化工科技有限公司。
1.2 仪器与设备
PH-070A型电热恒温干燥箱:上海一恒科学仪器有限公司;JYL-CO2DE多功能破壁料理机:九阳股份有限公司;N-1200BV型旋转蒸发仪:上海爱朗仪器有限公司;Scientz-18N型真空冷冻干燥机:宁波新芝生物科技有限公司;ME204型分析天平:梅特勒-托利多仪器(上海)有限公司;SW-CJ-2FD型超净工作台:苏州安泰空气技术有限公司;ZHWY-211B型恒温冷冻摇床:上海智城分析仪器制造有限公司;SX-500型压力蒸汽灭菌器:日本TOMY公司;SHP-150型生化培养箱:上海森信实验仪器有限公司;CX31型光学显微镜:日本OLYMPUS公司;TGL-16M型高速冷冻离心机:湖南湘仪离心机仪器有限公司;SHZ-Ⅲ型循环水真空泵:上海亚荣生化仪器厂;雷磁DDS-307型电导率仪:上海仪电科学仪器股份有限公司;UV2400型紫外可见分光光度计:上海舜宇恒平科学仪器有限公司。
1.3 试验方法
1.3.1 苹果链格孢霉菌菌饼及菌丝体的制备
苹果链格孢霉接种于马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基中央,28℃培养 5 d,用无菌打孔器在培养基边缘取直径为6 mm菌饼,即为试验所用菌饼。取适量苹果链格孢霉菌丝体接种于100 mL马铃薯葡萄糖(potato dextrose,PD)培养基中,28℃、150r/min培养3 d。用磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗,4层无菌纱布过滤培养液,无菌滤纸吸干菌丝体表面水分,即为试验所用的湿菌丝体。
1.3.2 银杏外种皮提取物的提取
银杏外种皮清洗、烘干、粉碎,过40目筛,制得银杏外种皮粉,用80%乙醇在70℃~75℃和去离子水在100℃回流下,将风干粉状的银杏外果皮(1 kg)提取3次,每次3 h,然后抽滤得到提取物上清液,将上清液浓缩、冻干得到银杏外种皮水提取物和乙醇提取物(Ginkgo biloba exocarp extract,GBEE)。
1.3.3 银杏外种皮提取物对苹果链格孢霉的抑制作用
将水和乙醇提取物按 0、200、400、600、800、1 000、1 200 mg/L浓度等量添加到PDA培养基中。将1周龄的链格孢菌饼(直径6.0 mm)置于90 mm培养皿的中心,然后将板密封并放置在28℃的培养箱中。每个处理重复3次。3 d后,采用十字交叉法测定链格孢霉菌落直径,菌丝生长抑制率计算公式如下。
式中:D0为对照组菌落直径,mm;D1为处理组菌落直径,mm。
将孢子悬浮液(1×106孢子/mL)接种到含有2 mL 0、200、400、600、800、1 000、1 200 mg/L 乙醇提取物的马铃薯葡萄糖肉汤(potato glucose broth,PDB)中。然后将40 μL的每种混合物分别逐滴添加到血细胞计数器中,并置于28℃的培养箱中。12 h后,记录孢子萌发情况。
使用光学显微镜研究提取物对苹果链格孢霉菌丝形态的影响。将孢子悬浮液接种在具有不同乙醇提取物浓度(0、200 mg/L)的PDB培养基中,然后150 r/min、28℃培养3 d。3 d后,收集菌丝在光学显微镜下观察。
1.3.4 电导率的测定
采用雷磁DDS-307型电导率仪测定孵育培养基的电导率来评估来自菌丝体的胞质泄漏[5]。将孢子悬浮液接种到PDB培养基中,然后在150 r/min、28℃下孵育。3 d后,用PBS冲洗3次,用无菌吸水纸收集菌丝体。将每0.5 g菌丝体悬浮在不同浓度(0、100、200 mg/L)GBEE中,在相同条件下继续培养,然后分别在培养 0、2、4、6、8、10、12 h 时测定电导率。测定重复3次。
1.3.5 丙二醛(malondialdehyde,MDA)、H2O2含量的测定
采用硫代巴比妥酸比色法进行测定[6]。将孢子悬浮液接种到PDB培养基中,然后在150 r/min和28℃下孵育。3 d后,用PBS冲洗3次,用无菌吸水纸收集菌丝体。将每0.5 g菌丝体悬浮在不同浓度(0、100、200 mg/L)GBEE中,在相同条件下进一步孵育,然后分别在 0、2、4、6、8、10、12 h 将菌体用 PBS 冲洗,滤纸吸干表面水分,放入研钵中研磨,加入20%三氯乙酸10 mL、0.6%硫代巴比妥酸3 mL,混匀,95℃水浴30 min,冰水浴冷却10 min。转移至离心管中,4℃、12 000 r/min离心20 min。收集上清液,分别在波长532、450、600 nm处测定吸光度,设置3组平行。MDA含量计算公式如下。
式中:N为上清液体积,mL;W为菌丝体鲜重,g。
将每0.5 g菌丝体悬浮在不同浓度(0、100、200 mg/L)GBEE中,在相同条件下进一步孵育,然后分别在0、2、4、6、8、10、12 h 将菌体用 PBS 冲洗,滤纸吸干表面水分,放入研钵中研磨,加入丙酮在4℃、12 000 r/min离心10 min。取1 mL上清液与100 μL的20%四氯化钛反应,用17 mol/L氨水沉淀,然后加入1 mol/L硫酸重悬沉淀,在410 nm处测定吸光度,设置3组平行。
1.3.6 蛋白质、核酸泄漏量的测定
采用考马斯亮蓝G-250比色法测定[7]。将孢子悬浮液接种到PDB培养基中,然后在150 r/min、28℃下孵育。3d后,用PBS冲洗3次,用无菌吸水纸收集菌丝体。将每0.5 g菌丝体悬浮在不同浓度(0、100、200 mg/L)GBEE中,在相同条件下进一步孵育,然后分别在0、2、4、6、8、10、12 h取 1 mL 培养液加 5 mL 考马斯亮蓝 G-250试剂,振荡、混匀,静置2 min,每组设置3组平行,于波长595 nm处测定蛋白质的含量。
将孢子悬浮液接种到PDB培养基中,然后在150 r/min、28℃下孵育。3 d后,用PBS冲洗3次,用无菌吸水纸收集菌丝体。将每0.5 g菌丝体悬浮在不同浓度(0、100、200 mg/L)GBEE 中,在相同条件下进一步孵育,然后分别在 0、2、4、6、8、10、12 h 取 1 mL 培养液通过测定260 nm的光密度来定量核酸。
1.3.7 抗性相关酶活性的测定
1.3.7.1 过氧化物酶活性的测定
过氧化物酶(peroxidase,POD)活性参考文献[8]测定。酶活性定义:以1 min内470 nm处吸光度降低0.01为一个酶活性单位,活性单位为U/(g·min)。
将孢子悬浮液接种到PDB培养基中,然后在150 r/min、28℃下孵育。3 d后,用PBS冲洗3次,用无菌吸水纸收集菌丝体。将每0.5 g菌丝体悬浮在不同浓度(0、100、200 mg/L)GBEE 中,在相同条件下进一步孵育,然后分别在 0、2、4、6、8、10、12 h 将菌体用 PBS 冲洗,滤纸吸干表面水分,放入研钵中,加入10 mL PBS,研磨至匀浆状态,4℃、10 000 r/min离心10 min,上清液即为所得粗酶液。取2.9 mL 0.05 mol/L pH6.8的PBS,加入1 mL 0.05 mol/L愈创木酚和0.1 mL酶提取液,迅速置于水浴锅37℃水浴保温10 min。立即加入2%过氧化氢1 mL,停止反应,从加入开始计时,每20 s记录1次470 nm下吸光度,持续2 min~3 min,以煮沸失活的酶液为对照。酶的比活力计算公式如下。
式中:X为酶的比活力,U/(g·min);ΔA为反应时间内吸光度的变化;D为稀释倍数即提取的总酶液为反应系统内酶液体积的倍数;t为反应时间,min;W为菌丝体质量,g。
1.3.7.2 多酚氧化酶活性的测定
多酚氧化酶活性参考文献[9]测定,将孢子悬浮液接种到PDB培养基中,然后在150 r/min和28℃下孵育。3d后,用PBS冲洗3次,用无菌吸水纸收集菌丝体。将每0.5 g菌丝体悬浮在不同浓度(0、100、200 mg/L)GBEE中,在相同条件下进一步孵育,然后分别在0、2、4、6、8、10、12 h 将菌体用 PBS 冲洗,滤纸吸干表面水分,放入研钵中,加入10 mL PBS,研磨至匀浆状态,4℃,10 000 r/min离心 10 min。取 3.9 mL 0.05 mol/L pH7.8的PBS,然后加入0.1mol/L儿茶酚1mL和0.8mL酶提取液。水浴锅37℃水浴保温10 min。保温结束迅速放入冰浴中加入2 mL 20%的三氯乙酸终止反应。在420 nm下测定吸光度,对照组采用煮沸失活同体积酶液。计算公式同过氧化物酶的计算公式。
1.3.7.3 过氧化氢酶活性的测定
过氧化氢酶活性参考文献[10]测定,将孢子悬浮液接种到PDB培养基中,然后在150 r/min和28℃下孵育。3 d后,用PBS冲洗3次,用无菌吸水纸收集菌丝体。将每0.5 g菌丝体悬浮在不同浓度(0、100、200 mg/L)GBEE中,在相同条件下进一步孵育,然后分别在 0、2、4、6、8、10、12 h 将菌体用 PBS 冲洗,滤纸吸干表面水分,放入研钵中,加入10 mL PBS,研磨至匀浆状态,4℃、10 000 r/min离心10 min,上清液即为酶提取液。上清液用生理盐水定容至10mL。取0.2mL上清液(酶液)加入2.8mL30mmol/L的H2O2(采用pH7.8,浓度50 mmol/L的PBS配制)中。反应10 s后于240 nm处测定其吸光度,至少连续测定3 min。保持每隔1 min记录1次吸光度,直至数值没有明显变动。酶活性单位标准:以1 min内240 nm处吸光度降低0.01为1个酶活性单位。结果以U/(g·min)表示。对照组采用煮沸失活同体积酶液。计算公式同过氧化物酶的计算公式。
1.4 数据分析
所有样品均重复分析,取平均值。平均值和标准差用Microsoft Office Excel 2016计算。采用SPSS统计软件进行单因素方差分析。p<0.05为差异有统计学意义。所有的图表分别使用Origin 8.0创建。
2 结果与分析
2.1 银杏外种皮提取物对苹果链格孢霉的抑制作用
银杏外种皮水提物对苹果链格孢的抑制效果见图1。

图1 银杏外种皮水提物对苹果链格孢的抑制效果Fig.1 Inhibitory effect of Ginkgo biloba exocarp water extract on Alternaria alternata in apples
由图1可知,银杏外种皮水提物浓度为200mg/L时,对苹果链格孢霉基本没有抑制效果,浓度为1 200 mg/L时,抑菌率为16.94%。
银杏外种皮乙醇提取物对苹果链格孢的抑制效果见图2。

图2 银杏外种皮乙醇提取物对苹果链格孢的抑制效果Fig.2 Inhibitory effect of Ginkgo biloba exocarp ethanol extract on Alternaria alternata in apples
由图2可知,GBEE浓度为1 200 mg/L时,抑菌率为61.39%,抑菌效果为水提物的3.6倍,并以剂量依赖的方式明显抑制了链格孢霉菌丝体的生长。银杏外种皮乙醇提取物的抑制效果更好。用SPSS分析得到IC50值为 744.074 mg/L。
2.2 乙醇提取物对链格孢霉孢子萌发和芽管伸长的影响
银杏外种皮乙醇提取物对苹果链格孢霉菌孢子萌发率和芽管伸长的影响见图3。
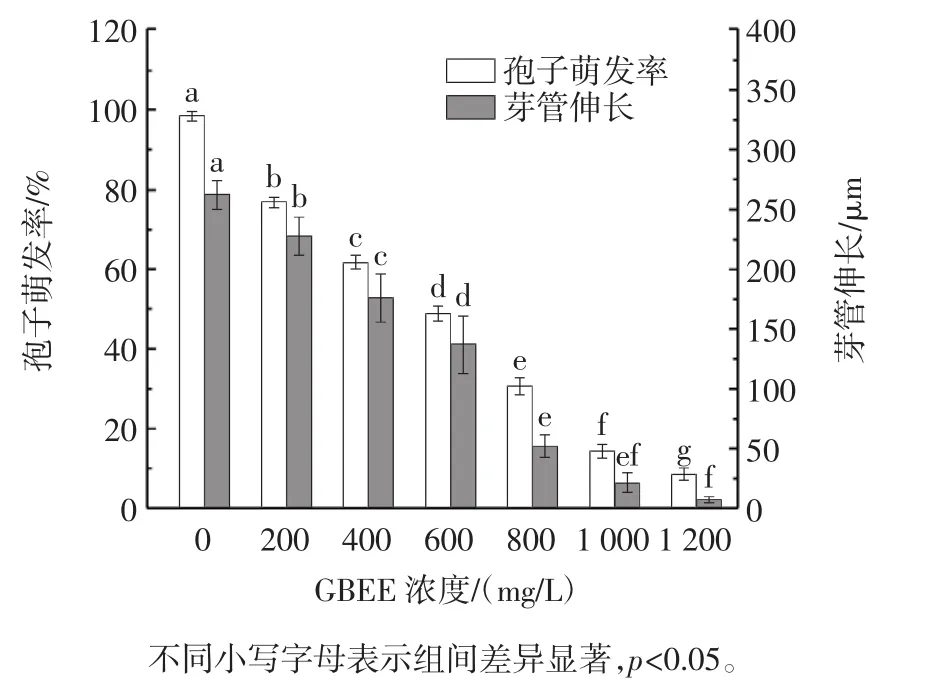
图3 银杏外种皮乙醇提取物对苹果链格孢霉菌孢子萌发率和芽管伸长的影响Fig.3 Effect of ethanol extract of Ginkgo biloba exocarp on spore germination and germ tube elongation of Alternaria alternata in apples
由图3可知,不同浓度的GBEE对链格孢霉孢子萌发率和芽管伸长具有显著的抑制作用(p<0.05),孵育12 h后,对照组中的所有链格孢霉孢子均发芽,萌发率达98.63%。而1 000 mg/L和1 200 mg/L GBEE处理组的孢子萌发率分别为14.28%和8.37%,链格孢霉孢子萌发被显著抑制(p<0.05)。此外,链格孢霉芽管伸长对GBEE敏感,GBEE浓度的增加抑制了芽管的伸长。孵育12 h后,对照中的芽管长度为262 μm,1 000 mg/L GBEE处理组的芽管长度为21 μm。
2.3 乙醇提取物处理链格孢霉菌形态学观察
银杏外种皮乙醇提取物处理苹果链格孢霉菌形态学观察结果见图4。

图4 银杏外种皮乙醇提取物处理苹果链格孢霉菌形态学观察结果Fig.4 Morphological observation of Alternaria alternata in apples treated with ethanol extract of Ginkgo biloba exocarp
如图4所示,用光学显微镜观察发现GBEE对苹果链格孢霉菌细胞壁具有明显破坏作用,改变了细胞膜结构和其通透性:GBEE处理的链格孢霉菌菌丝出现断裂、变细、变形且无细胞壁间隔。因此判断GBEE能破坏链格孢霉细胞壁和细胞膜的完整性[11],使胞内物质渗出,菌丝体和分生孢子变形,从而使链格孢霉生长代谢受到影响。
2.4 银杏外种皮乙醇提取物对苹果链格孢霉细胞膜通透性的影响
银杏外种皮乙醇提取物对苹果链格孢霉细胞膜通透性的影响见图5。
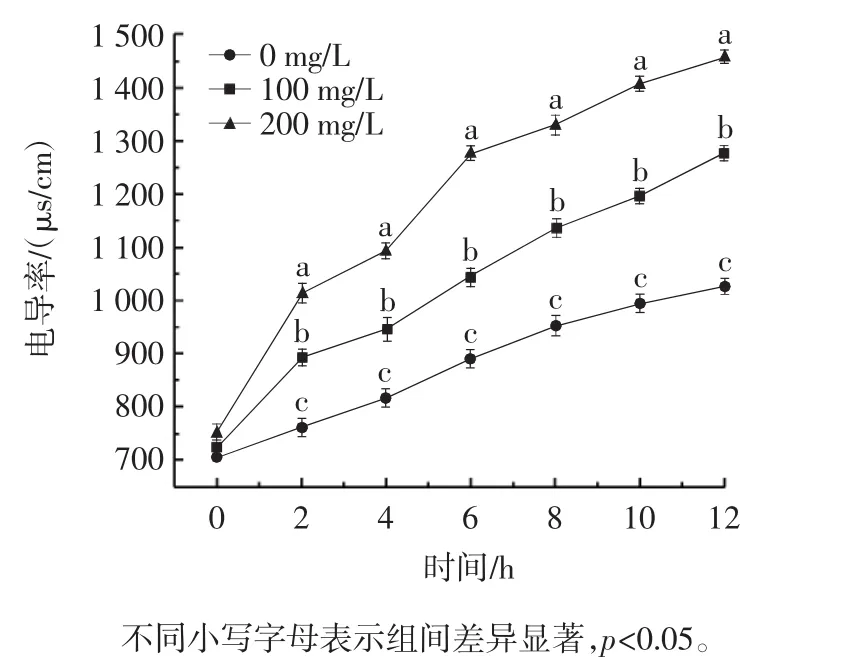
图5 银杏外种皮乙醇提取物对苹果链格孢霉细胞膜通透性的影响Fig.5 Effect of Ginkgo biloba exocarp ethanol extract on cell membrane permeability of Alternaria alternata in apples
细胞膜对维持细胞内环境的稳定和机体新陈代谢发挥着重要作用。细胞膜可以将细胞与外界环境分隔,维稳胞内环境并选择控制物质进出细胞。膜系统被破坏的一个重要指标是细胞膜的通透性增大[12],菌体生长繁殖的时候,会大量吸收培养液中的无机盐等营养物质。一般情况下,电导率指标随时间推移逐渐下降,代表营养物质被吸收。而当菌体遭到逆境迫害时[13],首先作用于菌体细胞膜,使其通透性变大,胞内物质外泄,导致细胞破裂死亡。因此,膜透性的大小可用电解质渗透率即电导率的变化来衡量,以佐证细胞膜系统是否遭到损伤和破坏[14]。由图5可知,GBEE处理明显提高了胞外电导率,所有处理组都随着处理时间的延长而增加。然而,用100 mg/L或200 mg/L GBEE处理的链格孢霉菌的电导率高于对照(0 mg/L)。孵育2 h,用200 mg/L GBEE处理的链格孢霉菌的电导率迅速增加,说明链格孢霉受到GBEE的刺激,对细胞膜破坏较严重,胞内物质泄漏,使培养液电导率升高[15]。
2.5 银杏外种皮乙醇提取物对苹果链格孢霉细胞膜损伤的影响
生物体发生器官衰老时或逆境条件时,细胞内活性氧代谢平衡被破坏。活性氧积累与膜上受体、酶等反应生成丙二醛(MDA)。生物膜上发生的膜脂过氧化反应,破坏了细胞膜通透性,不利于细胞与外界进行稳定的物质交换。MDA和H2O2作为产物,其含量高低表示膜脂过氧化程度。同时也反映细胞对逆境条件耐受的强弱,正常的脂质过氧化反应对机体的新陈代谢有着重要的作用[16]。MDA和H2O2是细胞膜损伤的主要指标,脂质过氧化和氧化应激是造成杀真菌作用的主要机制。MDA和H2O2含量反映了对细胞膜的损伤程度,具体见图6和图7。
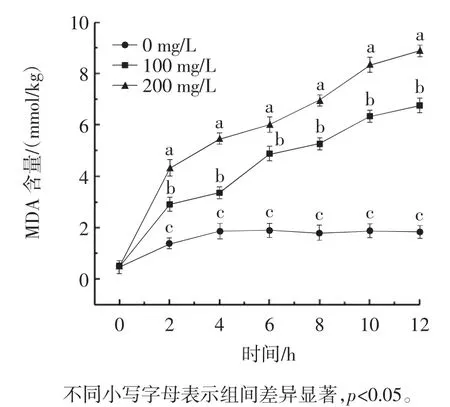
图6 银杏外种皮乙醇提取物对苹果链格孢霉MDA含量的影响Fig.6 Effect of Ginkgo biloba exocarp ethanol extract on the MDA content of Alternaria alternata in apples
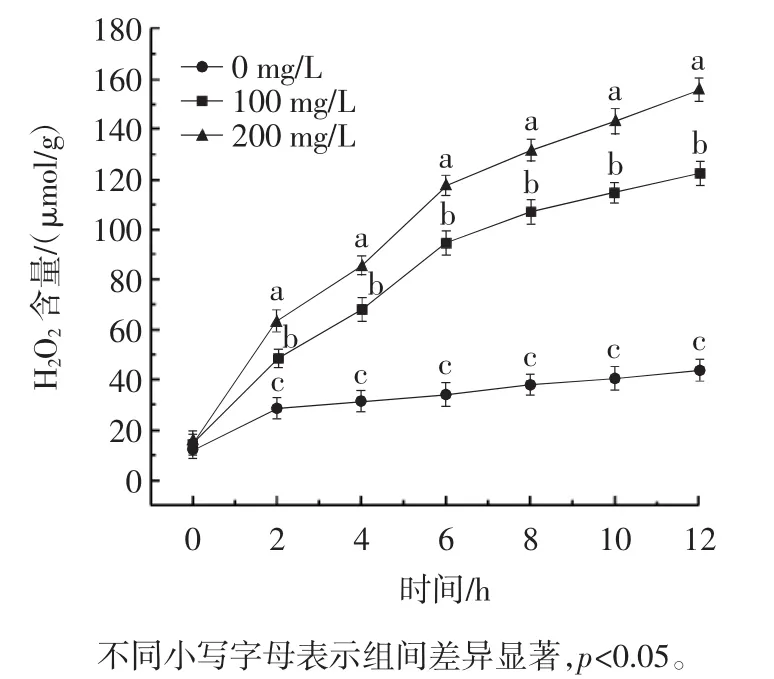
图7 银杏外种皮乙醇提取物对苹果链格孢霉H2O2含量的影响Fig.7 Effect of Ginkgo biloba exocarp ethanol extract on the H2O2content of Alternaria alternata in apples
由图6和图7可知,GBEE可增加链格孢霉MDA和H2O2含量。200 mg/L GBEE处理12 h后,链格孢霉菌丝中的MDA和H2O2含量显著高于对照组(MDA为8.896 mmol/kg,是对照组的4.86倍,而H2O2为155.794 μmol/g,是对照组的3.51倍),表明银杏外种皮醇提物有效地损伤了苹果链格孢霉菌细胞膜,加剧了链格孢霉菌膜脂过氧化进程。
2.6 银杏外种皮乙醇提取物对苹果链格孢霉蛋白质、核酸泄漏量的影响
培养液中蛋白质、核酸含量可以反映抑菌剂对菌体细胞膜的破坏程度和细胞膜通透性的变化,还可以反映对蛋白质、核酸的渗漏情况[17]。银杏外种皮乙醇提取物对苹果链格孢霉蛋白质、核酸泄漏量的影响见图8和图9。

图8 银杏外种皮乙醇提取物对苹果链格孢霉蛋白质泄漏量的影响Fig.8 Effect of ethanol extract of Ginkgo biloba exocarp on the leakage of protein of Alternaria alternata in apples
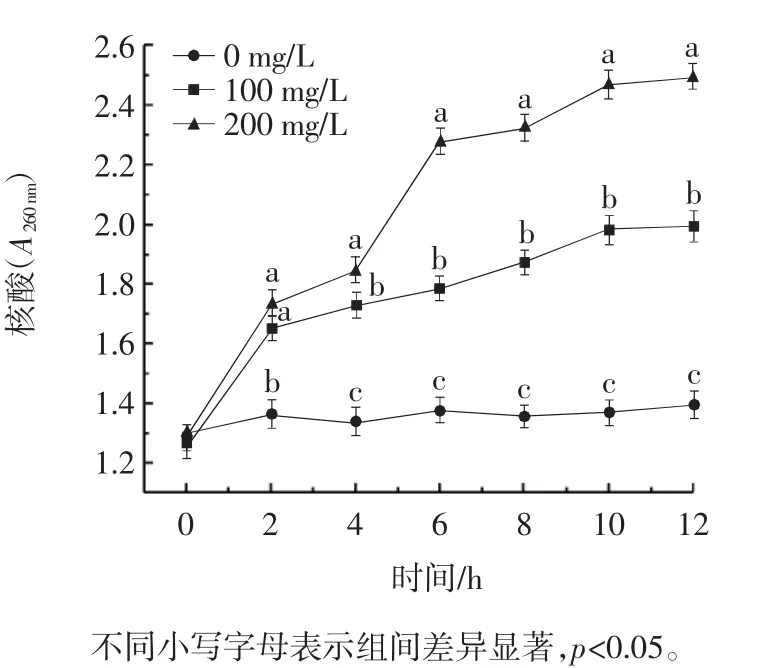
图9 银杏外种皮乙醇提取物对苹果链格孢霉核酸泄漏量的影响Fig.9 Effect of ethanol extract of Ginkgo biloba exocarp on the leakage of nucleic acid of Alternaria alternata in apples
由图8和图9可知,GBEE以剂量依赖的方式诱导链格孢霉菌丝体的大量蛋白质和核酸渗漏。0~2 h,试验组蛋白质、核酸含量迅速升高,是因为加入GBEE对细胞膜破坏程度加剧,细胞与外界进行物质交换的选择性丧失,导致蛋白质、核酸渗漏,蛋白质、核酸透过细胞膜渗透到培养液中致使溶液中蛋白质、核酸含量迅速攀升。
2.7 银杏外种皮乙醇提取物对苹果链格孢霉POD酶活性的影响
银杏外种皮乙醇提取物对苹果链格孢霉POD酶活性的影响间图10。
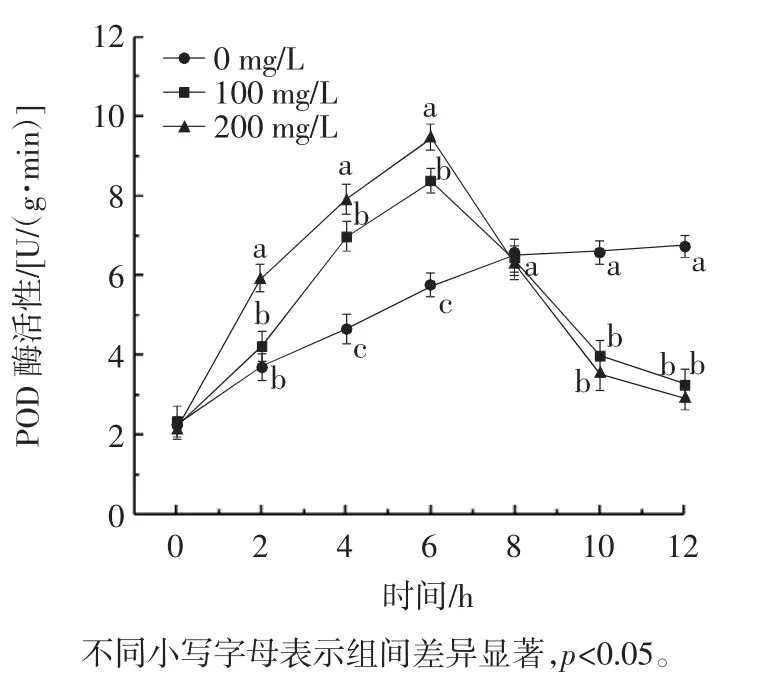
图10 银杏外种皮乙醇提取物对苹果链格孢霉POD酶活性的影响Fig.10 Effect of ethanol extract of Ginkgo biloba exocarp on POD enzyme activity of Alternaria alternata in apples
由图10可知,GBEE处理后链格孢霉菌的POD酶活性呈先上升后下降的趋势,但随着培养时间的延长,8 h后处理组明显低于对照组POD酶活性,0~6 h内,处理组酶活性上升,高于对照组,这可能是因为链格孢霉出现对外界的应激反应,机体对细胞的保护作用使得产生的过氧化物含量升高,机体POD酶合成水平提高[18]。6 h后,POD酶活力开始下降,表明链格孢霉菌在逆境环境中遭到严重破坏,部分POD酶失活,降低了H2O2等活性氧的清除能力,从而对链格孢霉产生抑制作用[19]。
2.8 银杏外种皮乙醇提取物对苹果链格孢霉多酚氧化酶活性的影响
多酚氧化酶(polyphenoloxidase,PPO)是一类与植物的抗病性和微生物的抗逆性密切相关的酶类,能够催化酚类物质形成对病原菌有抑制作用的醌类物质[20]。银杏外种皮乙醇提取物对苹果链格孢霉PPO酶活性的影响见图11。

图11 银杏外种皮乙醇提取物对苹果链格孢霉PPO酶活性的影响Fig.11 Effect of ethanol extract of Ginkgo biloba exocarp on PPO enzyme activity of Alternaria alternata in apples
如图11所示,GBEE处理后链格孢霉菌的PPO酶活性呈先下降后上升的趋势,12 h后处理组酶活性显著低于对照组(p<0.05),0~6 h处理组链格孢霉 PPO酶活性迅速降低。6 h后,PPO酶活性出现小幅度的恢复,但仍远低于正常条件下的酶活水平,说明链格孢霉在逆境胁迫下,机体做出应激反应,但其抗逆性较差。
2.9 银杏外种皮乙醇提取物对苹果链格孢霉过氧化氢酶活性的影响
过氧化氢酶(catalase,CAT)是一种酶的清除剂,也被称为过氧化氢酶,它是一种以铁卟啉为辅料的结合酶。银杏外种皮乙醇提取物对苹果链格孢霉CAT酶活性的影响见图12。

图12 银杏外种皮乙醇提取物对苹果链格孢霉CAT酶活性的影响Fig.12 Effect of ethanol extract of Ginkgo biloba exocarp on CAT enzyme activity of Alternaria alternata in apples
由图12可知,GBEE处理后链格孢霉菌的CAT酶活性呈先上升后下降的趋势,但随着培养时间的延长,6 h后处理组明显低于对照组CAT酶活性。0~2 h内,处理组CAT酶活性明显上升,明显高于对照组CAT酶活性,说明链格孢霉出现对外界逆境环境的应激反应,机体对细胞的保护作用,使CAT酶活性升高。2 h后,CAT酶逐渐失活,无法正常参与胁迫反应。
3 结论
银杏外种皮提取物的抑菌作用呈浓度依赖性,水溶性提取物于1 200 mg/L抑菌率达到16.94%,乙醇提取物于1 200 mg/L抑菌率达到61.39%,约是水溶性提取物的3.6倍,IC50值为744.074 mg/L。不同浓度的银杏外种皮乙醇提取物对链格孢霉孢子萌发和芽管伸长具有显著的抑制作用,对照组中的所有链格孢霉孢子均发芽,萌发率达98.63%,而1 000 mg/L GBEE处理组的孢子发芽率为14.28%。对照中的芽管长度为262μm,处理组的芽管长度为21 μm。通过光学显微镜观察到处理组的链格孢霉菌菌丝出现断裂、变细、变形且无细胞壁间隔。此外,银杏外种皮乙醇提取物使苹果链格孢霉菌体细胞膜通透性增加,膜脂过氧化程度加剧,MDA和H2O2含量升高,分别为对照组的4.86倍和3.51倍。银杏外种皮乙醇提取物使胞内核酸、蛋白质外泄,并抑制抗性相关酶活性。因此,得出乙醇提取物的抑菌效果好,其抑制行为通过破坏苹果链格孢霉菌的细胞膜完整性和抑制抗性相关酶活性实现。
