不同光照模式对卷枝毛霉类胡萝卜素合成及相关基因表达的影响
2023-03-06孙丽娟池铭马立杰赵婧周宏胜凌军罗淑芬周鑫李国锋李鹏霞张映曈
孙丽娟,池铭,马立杰,赵婧,周宏胜,2,3,凌军,2,3,罗淑芬,2,3,周鑫,李国锋,2,3,李鹏霞,2,3,4,张映曈,2,3*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.江苏省农业科学院农业设施与装备研究所,江苏 南京 210014;3.农业农村部农产品冷链物流技术重点实验室,江苏 南京 210014;4.江苏省高校园艺作物遗传改良重点实验室,江苏 南京 210014)
类胡萝卜素是自然界广泛存在的一类天然色素,包括β-胡萝卜素、番茄红素和叶黄素等[1],是天然的强效抗氧化剂和自由基清除剂,具有保护视力[2]、预防肝硬化、肝癌[3]、提高自身抵抗力[4]等功效。目前,类胡萝卜素的来源主要包括植物和微生物。相较于受季节影响大、生产成本高的植物来源,高效、低成本的微生物来源在未来的产业应用中极具潜力。藻类、真菌、细菌等微生物均能生产类胡萝卜素,其中利用较多的是接合真菌[5-6]。在接合真菌中,卷枝毛霉(Mucor circinelloides)发酵条件简单,有清晰的遗传背景和完善的遗传操作体系,常用作研究真菌类胡萝卜素代谢机制的模式菌株[7]。
光是一种重要的环境因子,参与调控大多数物种的生长发育和生理过程,是真菌光反应机制所必需的信息源[8]。在许多生物体中,类胡萝卜素的生物合成均受到光照调控[9-11],在卷枝毛霉[12-13]、粪生粪壳菌(Sordaria fimicola)[10]、三孢布拉霉(Blakeslea trispora)[14]等微生物中光照均能促进次级代谢产物类胡萝卜素的合成。在研究光照对类胡萝卜素合成的影响时,所采用的光照模式大多是“持续恒定光照”[15]。然而,近期有研究发现非持续恒定光照可能对真菌类胡萝卜素合成有积极的影响。例如,在三孢布拉霉中,高强度脉冲蓝光照射(在黑暗培养结束后的12、24、36 h进行2 min的7.3 W/m2蓝光照射,其余时间在黑暗条件下培养)诱导类胡萝卜素合成的效果明显[14,16];在盐生杜氏藻(Dunaliella salina)中发现光暗周期的光照模式比持续增强和持续恒定的光照模式更能促进β-胡萝卜素的积累[17]。这可能与生物为保持内环境稳态形成的一种内在“光适应”机制有关。即生物体受到持续一段时间的光刺激后,为保持内环境稳态系统的输出水平又恢复到刺激之前[18-20]。这种现象在动植物和藻类中普遍存在,例如脊椎动物视觉系统对强光线照射的适应[18]、集胞藻PCC 6803(Synechocystic sp.PCC 6803)接受持续光照后叶绿素合成相关基因被明显抑制[21]等。因此,推测作为最明显的光应答反应,类胡萝卜素代谢在“光适应”作用下面对持续和非持续恒定光照可能会呈现不同的应答模式[22]。
综上所述,光信号对类胡萝卜素合成的调控作用是一个复杂的过程,不同光照模式对类胡萝卜素合成影响不同。在模式菌株卷枝毛霉中,目前的研究主要集中于持续光照对不同菌株类胡萝卜素产量的影响[23-24],有关不同光照模式及过程中可能产生的“光适应”对类胡萝卜素产量及其代谢过程的研究尚未见报道。因此,本研究以卷枝毛霉CBS 277.49菌株为对象,研究不同光照模式下类胡萝卜素产量的变化,并从基因水平解析不同光照模式及过程中可能产生的“光适应”对卷枝毛霉类胡萝卜素代谢机制的影响,为阐明真菌类胡萝卜素合成光诱导机制奠定基础,同时为类胡萝卜素工业发酵模式提供新思路。
1 材料与方法
1.1 材料与试剂
菌株:卷枝毛霉(Mucor circinelloides)CBS 277.49。
YPG固体培养基[25]:1%蛋白胨、0.3%酵母提取物、2%葡萄糖和2%琼脂粉,115℃下高压灭菌21 min。用于菌株活化和产孢。
YNB固体培养基[26]:1.5 g/L硫酸铵、1.5 g/L谷氨酸、0.5 g/L酵母氮源、10 g/L葡萄糖、20 g/L琼脂粉,115℃下高压灭菌21 min后室温25℃添加烟酸/硫胺素至1 μg/mL。用于菌体培养合成类胡萝卜素。
β-巯基乙醇(分析纯):上海麦克林生化科技有限公司;甲醇(分析纯):上海凌峰化学试剂有限公司;石油醚(分析纯):上海阿拉丁生化科技股份有限公司;RNAprep pure Plant Kit提取试剂盒:天根生化科技(北京)有限公司;HiScriptIII RT SuperMix for qPCR cDNA合成试剂盒:南京诺唯赞生物科技股份有限公司。
1.2 仪器与设备
电子天平(PL202-L):梅特勒-托利多仪器(上海)有限公司;全自动高压灭菌锅(IMJ-54A):施都凯仪器设备(上海)有限公司;液氮研磨器(A11 Basic):艾卡(广州)仪器设备有限公司;紫外可见分光光度计(UV-1102):上海天美科学仪器有限公司;真空冷冻干燥机(SCIENTZ-10ND):宁波新芝生物科技股份有限公司;基因扩增仪(EDC-810):东胜国际贸易有限公司;荧光定量聚合酶链式反应仪(CFX connect):美国Bio-Rad公司;核酸蛋白测定仪(BioPhotometer plus):德国Eppendorf公司。
1.3 试验方法
1.3.1 培养条件
将卷枝毛霉(Mucor circinelloides)CBS 277.49菌液接种于YPG固体培养基,(26±2)℃活化24 h,转移至光照条件产孢。用无菌水冲洗菌丝,经滤膜过滤后得到孢子液。通过血球计数板进行计数,并使用无菌水调整孢子悬浮液浓度为107个/mL。将孢子液接种至YNB固体培养基,于(26±2)℃黑暗培养60 h后进行不同光照模式处理。光照模式:1)黑暗处理:全程在黑暗条件下培养24 h;2)持续恒定蓝光照射处理:在1 000 Lux蓝光下持续照射培养24 h;3)光暗交替处理:采用蓝光/黑暗间断照射,光暗周期比为6 h∶6 h∶6 h ∶6 h,光照强度为 1 000 Lux;4)逐步提高光照强度:采用蓝光照射,起始光强为250 Lux,之后每6 h提高250 Lux,至24 h。对应的光照时间轴如图1所示。以上每种处理重复 3次,取样时间点为 0、6、12、18 h和 24 h。收获的菌丝立即用液氮冷冻,保存于-80℃超低温冰箱,以便于后续试验。

图1 不同光照模式对卷枝毛霉CBS 277.49类胡萝卜素合成的影响试验设计Fig.1 Experimental design of different light treatments on carotenoid biosynthesis in Mucor circinelloides CBS 277.49
1.3.2 生物量的测定
收集经不同光照模式处理后第0、6、12、18 h和24 h的菌丝体,使用真空冷冻干燥机冻干(-40℃、12 h)并且称重。
1.3.3 类胡萝卜素的分离与测定
类胡萝卜素含量的测定采用紫外分光光度计法[26],具体步骤:取0.02 g冻干样品,加入2 mL甲醇和4 mL石油醚,涡旋振荡;2 000 r/min离心5 min,小心吸取上清液,转移至干净的离心管中;在原离心管中继续添加2 mL石油醚抽提至菌体无色,合并石油醚层,体积记为V。测定溶液在453 nm处的吸光度A453。
式中:A453为溶液在453 nm处的吸光度;D为稀释倍数;V为提取所用石油醚体积,mL;0.259 2为消光系数;m为样品质量,g。
1.3.4 类胡萝卜素合成相关基因相对表达量的测定
1.3.4.1 RNA的提取及cDNA的合成
取适量菌丝用液氮充分研磨,按照RNAprep pure Plant Kit提取试剂盒说明书提取RNA。提取完成后使用核酸蛋白测定仪和凝胶电泳检测RNA的浓度和质量。以检验合格的RNA为模板,采用HiScriptIII RT SuperMix for qPCR cDNA合成试剂盒进行cDNA第一链合成。
1.3.4.2 实时荧光定量分析
选用actin作为内参基因,测定mcwc-1c、carB和carRP基因在不同处理不同时期菌丝的相对表达量。使用荧光定量聚合酶链式反应仪进行实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)试验,反应体系(20 μL)为 10 μL 2×SYBR Premix Ex TaqTM Ⅱ;0.4 μL 上游引物;0.4 μL下游引物;2 μL cDNA 模板;7.2 μL ddH2O。反应程序:95℃预变性 30 s;95℃变性 10 s;60℃退火 30 s;65℃延伸5 s;39个循环。引物序列信息见表1。

表1 实时荧光定量PCR引物序列Table 1 Primer sequences for RT-qPCR
1.4 数据统计
所有数据进行3次平行测定,2-ΔΔCt法计算目的基因的相对表达量,采用Excel 2010、GraphPad Prism 8.4.2软件进行数据处理及画图,使用SPSS 20.0单因素方差分析(one-way ANOVA)进行显著性分析(P<0.05为差异显著)。
2 结果与分析
2.1 不同光照模式对卷枝毛霉CBS 277.49菌落颜色和生物量的影响
光照处理对卷枝毛霉菌落形态有明显影响。黑暗处理组的卷枝毛霉菌落无明显的色素沉积,呈现白色。与黑暗处理相比,3组光照处理的菌落颜色均从白色转变为橙黄色或暗黄色,暗示类胡萝卜素的积累。其中,持续恒定的蓝光照射处理后类胡萝卜素即开始积累,表现出明显的橙黄色;培养后期(12 h后)色素积累速度减缓,菌落外周形成淡黄色环状菌带。光暗交替处理组菌落呈年轮状生长,24 h时呈现中心橙黄色、外圈淡黄色的形态。逐步提高光强模式下菌落内侧颜色随着培养时间延长而逐渐加深,培养结束时内侧呈现暗黄色,外周有一圈新鲜的菌丝带。生物量的测定结果见图2。
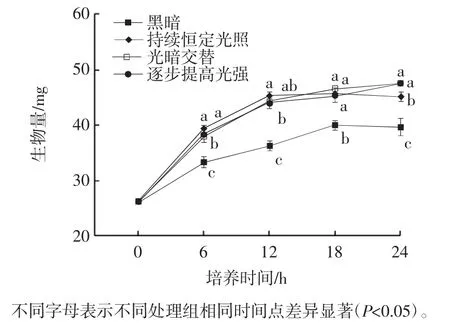
图2 不同光照模式下卷枝毛霉CBS 277.49的生物量Fig.2 Biomass of Mucor circinelloides CBS 277.49 exposed to different light treatments
由图2可知,4种处理在6 h时生物量均明显积累,随后增长速度减缓。24 h时黑暗处理的生物量为(39.67±0.88)mg,而3个光照处理组积累的生物量均显著高于黑暗处理(P<0.05)。6 h~12 h持续恒定光照处理组的生物量显著大于逐步提高光强处理组(P<0.05),18 h后持续恒定光照处理组生物量的积累速度开始减缓,与其他两组光照处理没有明显差异。至24 h时,光暗交替和逐步提高光强处理组生物量高于持续恒定的蓝光处理组。
2.2 不同光照模式对卷枝毛霉CBS 277.49类胡萝卜素含量的影响
不同光照模式下类胡萝卜素含量变化趋势如图3所示。
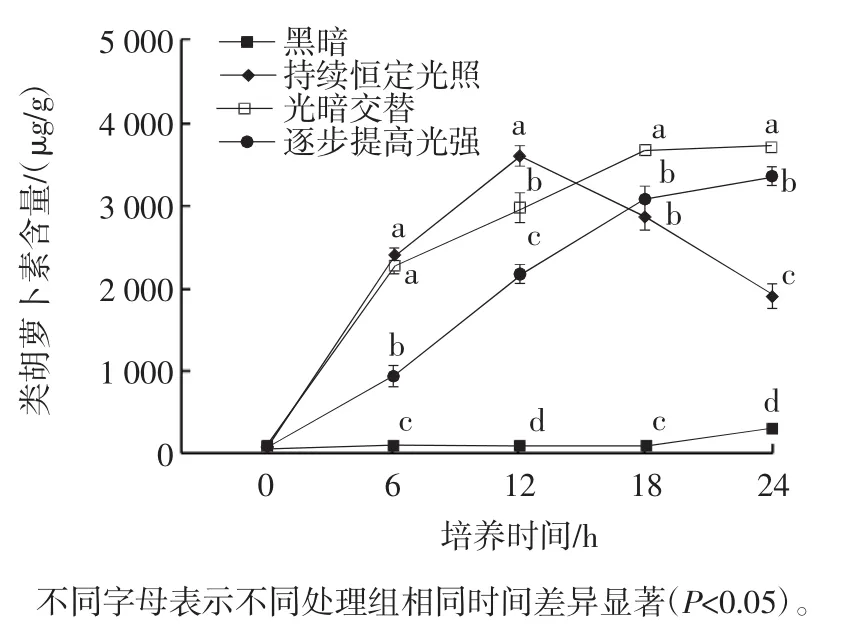
图3 不同光照模式下卷枝毛霉CBS 277.49类胡萝卜素含量随时间变化Fig.3 Carotenoid content of Mucor circinelloides CBS 277.49 exposed to different light treatments for different time periods
由图3可知,黑暗处理组在培养过程中卷枝毛霉CBS 277.49的类胡萝卜素积累缓慢,持续恒定光照处理组的类胡萝卜素含量呈现先升高后下降的趋势,光暗交替和逐步提高光强处理组则呈现持续上升趋势。其中持续恒定光照处理组类胡萝卜素含量在前6 h急剧增加,6 h~12 h时仍然保持上升趋势,但上升速率低于前6 h。至12 h时,类胡萝卜素含量达到峰值(3 599.30±111.77)μg/g,分别为光暗交替处理组、逐步提高光强处理组和黑暗处理组的1.21、1.65倍和22.07倍。然而,在12 h后持续恒定光照处理组的类胡萝卜素积累呈现持续下降趋势,至培养结束(24 h)时,含量仅为(1 915.90±95.83)μg/g。光暗交替处理组在前6 h类胡萝卜素积累速率与持续恒定光照处理组类似,6 h后逐步下降,但类胡萝卜素含量总体呈上升趋势。逐步提高光强处理组的类胡萝卜素积累速率在前6 h显著低于光暗交替处理组(P<0.05),虽然6 h后类胡萝卜素含量明显提升,但类胡萝卜素含量仍显著低于光暗交替处理组(P<0.05)。培养24 h时,4个处理组类胡萝卜素含量差异显著(P<0.05),类胡萝卜素含量结果为光暗交替处理组>逐步提高光强处理组>持续恒定光照处理组>黑暗处理组。以上数据表明,蓝光能够促进卷枝毛霉CBS 277.49的类胡萝卜素合成,持续光照处理组在前期促进作用明显,至培养结束(24 h)时,光暗交替处理组效果最佳,类胡萝卜素含量达(3 728.78±48.09)μg/g。
2.3 不同光照模式对卷枝毛霉CBS 277.49中光感受器MCWC-1C编码基因表达的影响
mcwc-1c基因编码的MCWC-1C蛋白为蓝光感受器,能够感知蓝光信号并激活下游类胡萝卜素合成[27]。对卷枝毛霉CBS 277.49分别实施黑暗、持续恒定、光暗交替和逐步提高光强4种不同的蓝光照射,不同光照模式下卷枝毛霉CBS 277.49蓝光感受器编码基因mcwc-1c表达水平随时间变化结果见图4。

图4 不同光照模式下卷枝毛霉CBS 277.49蓝光感受器编码基因mcwc-1c表达水平随时间变化Fig.4 Expression of mcwc-1c in Mucor circinelloides CBS 277.49 exposed to different light treatments for different time periods
由图4可知,黑暗处理组mcwc-1c基因在培养期间一直保持低表达,而光照处理组则有不同程度变化。培养前期(0~6 h),在1 000 Lux蓝光照射下,持续恒定光照组和光暗交替照射组mcwc-1c基因表达量明显提升,为黑暗处理组的2.79倍和2.73倍,同时明显高于逐步提高光强处理组(250 Lux蓝光照射);6 h后持续恒定光照处理组mcwc-1c基因表达量明显下降,至培养结束(24 h)时,与黑暗处理组表达量相当,为光暗交替和逐步提高光强处理组的61.77%和50.16%。在整个培养期间,光暗交替处理组mcwc-1c基因表达量呈波动趋势,在6 h时表达量最高。逐步提高光强处理组mcwc-1c基因表达量在培养前期呈缓慢上升趋势,培养后期仍以较高水平表达,24 h时逐步提高光强处理组基因表达量和光暗交替处理组没有显著差异(P>0.05)。以上结果表明,蓝光能够激活mcwc-1c的表达,且光强越强,激活作用越明显;随光照时间延长,持续恒定光照组mcwc-1c基因表达量水平明显下降;光暗交替和逐步提高光强处理组mcwc-1c在整个培养期内保持较高水平的表达。
2.4 不同光照模式对卷枝毛霉CBS 277.49中类胡萝卜素合成结构基因表达的影响
编码八氢番茄红素脱氢酶的carB基因以及编码八氢番茄红素合成酶/番茄红素环化酶的carRP基因是卷枝毛霉类胡萝卜素合成的关键结构基因[23,28-29],蓝光照射模式下受MCWC-1C的强烈诱导表达[30]。不同光照模式对卷枝毛霉类胡萝卜素合成结构基因carB和carRP表达量的影响见图5。


图5 不同光照模式对卷枝毛霉类胡萝卜素合成结构基因carB和carRP表达量的影响Fig.5 Expression of carB and carRP involved in carotenoid biosynthesis of Mucor circinelloides CBS 277.49 exposed to different light treatments
由图5A可知,3组光照处理后carRP基因表达量与黑暗处理组相比均显著增加(P<0.05),且随培养时间的延长均表现出先升高后降低的趋势。培养前期(0~6 h),持续恒定光照处理组和光暗交替处理组carRP基因表达量明显增加,12 h时达到峰值,为逐步提高光强处理组的1.88倍和1.68倍,为黑暗处理组的4.13倍和3.69倍。3组光照处理组在18 h的基因表达量均有所下降,其中持续恒定光照组下降最为明显,其基因表达量仅为12 h的55.97%。18 h后,持续恒定光照组carRP基因表达量继续下降,至24 h时仅为光暗交替处理组和逐步提高光强处理组的41.27%和40.53%。此时光暗交替和逐步提高光强处理组的carRP表达量与6 h相当。
由图5B可知,结构基因carB表达量的变化与carRP基因类似,表明持续恒定的蓝光照射在0~12 h显著提高了carB基因的表达(P<0.05)。12 h时,其表达量分别为黑暗处理组、光暗交替处理组和逐步提高光强处理组的2.68、2.98倍和2.05倍。12 h后持续恒定光照处理组carB基因的表达量骤然降低,至24 h时与黑暗处理组表达量相当。光暗交替处理组carB基因的表达量在培养期间呈现波动趋势,在12 h后显著高于持续恒定光照处理组(P<0.05),与逐步提高光强处理组无明显差异(P>0.05)。逐步提高光强组carB基因始终以较高水平表达。以上结果表明,光照明显上调了类胡萝卜素合成结构基因的表达;12 h后持续恒定光照处理组结构基因表达量明显下降;光暗交替和逐步提高光强处理组结构基因在培养后期虽然有所下降,但仍以较高水平表达。
3 讨论与结论
本试验以卷枝毛霉CBS 277.49为试验材料,研究了不同光照模式对其生长发育和类胡萝卜素合成的影响。结果表明,持续恒定、光暗交替、逐步提高光强的蓝光处理下卷枝毛霉菌丝生物量较黑暗处理均显著增加,说明光照在一定程度上能对卷枝毛霉的生长起调控作用,这与Luo等[31]研究的脉冲蓝光照射能够促进三孢布拉霉的生长,使其生物量明显提升的结果一致。在类胡萝卜素合成方面,黑暗处理组菌落颜色呈白色,而3种蓝光处理组的菌落颜色为淡黄色或橙黄色。通过类胡萝卜素含量的测定证实:3种光照处理组的类胡萝卜素含量与黑暗处理组相比明显提高。其中,持续恒定光照处理组类胡萝卜素产量呈现先升高后下降的趋势,而光暗交替和逐步提高光强处理组在12 h后继续积累类胡萝卜素,至24 h时两组的类胡萝卜素含量分别达到峰值。类似的结果在其他物种中也有报道[32-33],例如在三孢布拉霉中,1.5 W/m2蓝光照射0.5 h能够产生大量的类胡萝卜素,延长蓝光照射时间不仅不能继续促进类胡萝卜素合成,还会影响三孢布拉霉中光反应,类胡萝卜素合成停滞[29]。在盐生杜氏藻中进行不同光照周期的培养,结果发现持续恒定的光照模式下类胡萝卜素产量在培养前3 d明显增加,之后保持平稳;而在14 h光照10 h黑暗的光照周期培养下类胡萝卜素含量持续增加,与持续恒定光照模式相比提高了17.96%[17]。基于以上结果,推测在培养过程中进行持续恒定蓝光照射使卷枝毛霉类胡萝卜素合成出现了“光适应”,表现为受到外界光刺激后类胡萝卜素含量骤然上升,但在一段时间之后类胡萝卜素合成水平又恢复到刺激之前,阻碍了类胡萝卜素的高水平积累。产生“光适应”的原因可能是因为持续高强度光照产生大量的活性氧(reactive oxygen species,ROS),对菌体造成氧胁迫,因而会消耗活性氧簇清除剂类胡萝卜素来抵御ROS[16]。光暗交替和逐步提高光强的光照模式则因为光强随时间不断发生变化而变化,不易产生“光适应”,因而能够继续刺激类胡萝卜素的合成。但光暗交替和逐步提高光强处理组后期的类胡萝卜素积累速率逐渐下降,这可能是因为在该处理下菌体内也会积累一定的ROS。
为了进一步探索不同光照模式对类胡萝卜素合成的作用机制,测定了类胡萝卜素合成相关基因表达量。结果表明,在持续恒定的光照处理中,mcwc-1c基因受到强烈的蓝光刺激后表达量显著上调,光照持续12 h后,mcwc-1c基因的表达迅速降低。这种现象在Krobanan等[10]的研究中也有类似的报道,粪生粪壳菌中蓝光感受器编码基因Sfwc-1在光照刺激下表达量逐渐增加,60 min后基因的表达量开始下降。在糙脉孢霉(Neurospora crassa)[22]中,恒定光照 2 h后 wc-1 基因下调,蓝光感受器WC-1蛋白合成受到抑制。光暗交替处理和逐步提高光强处理由于波动的光照模式,未产生“光适应”,12 h后mcwc-1c基因继续以较高水平表达。下游类胡萝卜素合成结构基因的表达受蓝光感受器MCWC-1C调控影响类胡萝卜素合成[34]。在本研究中,持续恒定蓝光处理12 h后mcwc-1c基因表达明显下调,导致结构基因carB和carRP基因表达量明显降低。而光暗交替和逐步提高光强处理组由于mcwc-1c在12 h后仍以较高水平表达,carB和carRP也相应地保持较高的表达水平量,两者之间差异不明显,但因为培养前期光暗交替处理组具有较高含量的carB和carRP mRNA,因此光暗交替处理组的类胡萝卜素终产量最高。该结果与不同光照模式下三孢布拉霉生产β-胡萝卜素的结果一致,即过长的光照时间和过高的光照强度导致类胡萝卜素合成结构基因出现短暂的高表达后迅速降低,间断的蓝光照射模式大幅度提升了类胡萝卜素合成结构基因的转录水平,这种诱导效果能够维持48h,对菌体类胡萝卜素积累的促进效果最为明显,是生产β-胡萝卜素的最佳条件[14]。
研究结果表明卷枝毛霉在持续恒定光照12 h后产生“光适应”,类胡萝卜素合成相关基因表达量均明显下降,类胡萝卜素合成停滞。光暗交替和逐步提高光强两种光照模式避免了“光适应”的产生,能够保持结构基因以较高水平表达,使类胡萝卜素持续积累。在本试验考察光强和培养时间范围内,光暗交替处理组的类胡萝卜素终产量最高。以上研究结果为未来微生物发酵法类胡萝卜素的工业化生产提供新思路,同时为阐明真菌类胡萝卜素合成光诱导机制奠定基础。
