耐盐碱枸杞低聚糖结构鉴定及其体外消化能力和抑菌作用
2023-03-06刘昊于滨崔波
刘昊,于滨,崔波*
(1.齐鲁工业大学(山东省科学院)生物基材料与绿色造纸国家重点实验室,山东 济南 250353;2.齐鲁工业大学(山东省科学院)食品科学与工程学院,山东 济南 250353)
枸杞系茄科、枸杞属植物,广泛分布于宁夏、甘肃、青海等西北地区,在南北美洲和西欧等国家也广为引种,是深受人们欢迎的食品之一[1-2]。枸杞作为我国传统的“药食同源”植物,具有延年益寿、滋阴补肾、强筋壮骨、养血明目、润肺止咳等多种营养价值和保健功能,其果实中有效的活性物质较为复杂[2-6]。在目前的研究中,枸杞多糖已经被很多研究者证明其具有免疫活性和维持肠道菌群的平衡等活性[7-11]。黄河三角洲区域内存在大面积中低产盐碱地,土壤盐渍化导致当地枸杞的开发和利用程度较低[12]。目前,利用多糖降解的方法制备耐盐碱枸杞低聚糖,其结构的鉴定和生理活性尚未见报道。某些低聚糖片段是多糖的活性中心,多糖的活性与其结构和空间构象密切相关,其生物活性主要取决于寡糖活性片段[13-15]。功能性低聚糖是由2个~10个单糖通过糖苷键连接而成的低分子量的非消化性碳水化合物[16],不易被人体消化吸收,并且能够有效地抑制有害菌的生长,降低毒素在肠道内外膜上的附着力[17],从而能够在肠道发挥独特的生理功能来维持机体健康。因此,对低聚糖消化吸收、抑制有害菌生长等生理活性的评价具有重要意义。本试验以黄河三角洲盐碱地枸杞为研究对象,对其果实提取液中的枸杞多糖进行降解,得到耐盐碱枸杞低聚糖,利用现代色谱和波谱技术对其结构进行初步鉴定,同时测定其体外消化能力和抑菌作用,探究其生理活性,为枸杞类产品开发提供参考,以期将其添加到食品中,开发具有独特生理功能的产品,实现黄河三角洲盐碱地枸杞的高效利用。
1 材料与方法
1.1 材料与试剂
枸杞:山东东营黄河三角洲盐碱地;c聚糖(Lycium barbarum oligosaccharides,LBO):齐鲁工业大学生物基材料与绿色造纸国家重点实验室自制;三氟乙酸(trifluoroacetic acid,TFA)、石油醚、重水(D2O)、溴化钾(KBr)(光谱纯):上海麦克林生化科技有限公司;氯仿、正丁醇、碳酸钠(Na2CO3)、无水乙醇、95%乙醇、三氯乙酸(trichloroacetic acid,TCA)、碳酸氢钠(NaHCO3)、无水葡萄糖、醋酸钠(CH3COONa):国药集团化学试剂有限公司;Tris-盐酸缓冲液:Sigma-Aldrich(上海)贸易有限公司;盐酸(HCl)、硫酸(H2SO4):烟台远东精细化工有限公司;链霉蛋白酶(Pronase E,7000 U/g)、胃脂肪酶(30 000 U/g)、胃蛋白酶(3 000 U/mg)、胰酶(4 000 U/g)、胰蛋白酶(4 000 U/mg)、猪胆粉、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)溶液:北京索莱宝科技有限公司;单糖分析标准品(阿拉伯糖、木糖、鼠李糖、半乳糖、葡萄糖、甘露糖)(均为色谱纯):上海源叶生物科技有限公司;金黄色葡萄球菌(Staphylococcus aureus CGMCC.1.12409)、培养基 CM0002:中国共同微生物收集与管理中心;Sephadex G-100、Sephadex G-25:北京瑞达恒辉科技发展有限公司。未单独说明的试剂均为分析纯。
1.2 仪器与设备
FA2004分析天平:上海舜宇恒平科学仪器有限公司;FSJ-A05N6小型粉碎机:广东小熊电器有限公司;TDL-40B离心机:上海安亭科学仪器厂;RE2000A旋转蒸发器:上海贤德实验仪器有限公司;DF-101S集热式恒温加热磁力搅拌器:郑州科泰实验设备有限公司;HH-21-8电热恒温水浴锅:常州诺基仪器有限公司;JXDG-10真空冷冻干燥机:上海净信实业发展有限公司;MixTable涡旋振荡器:合肥艾本森科学仪器有限公司;LAI-3T厌氧培养箱:上海龙跃仪器设备有限公司;FE28型pH计:梅特勒-托力多仪器(上海)有限公司;UV-6100型紫外可见分光光度计:上海元析仪器有限公司;Frontier型傅里叶变换红外光谱仪:美国Perkin-Elmer公司;Avance II400核磁共振波谱仪:瑞士Bruker公司;LC-20A液相色谱仪:日本岛津公司。
1.3 方法
1.3.1 枸杞低聚糖的制备
将枸杞进行预处理,洗净、烘干后,用粉碎机粉碎,过筛。定量称取经预处理后的干燥枸杞粉,经石油醚加热回流重复脱脂3次,烘干后按料液比1∶3(g/mL)加入蒸馏水于90℃水浴提取2 h,过滤,得滤液,4 000 r/min离心15 min,弃去残渣,重复离心2次,合并上清液。采用旋转蒸发器真空浓缩至1/4体积,冷却至室温(25℃)。加入1/5体积Sevag试剂(氯仿∶正丁醇=4∶1,体积比),剧烈振摇,使其充分混匀,4 000 r/min离心15 min,倾出上清液,除去中间变性蛋白和下层氯仿,重复以上操作直至中间层无变性蛋白,收集上清液加入4倍体积的95%乙醇沉淀,静置24 h,滤布过滤,冷冻干燥后得到枸杞多糖(Lycium barbarum polysaccharides,LBP)[18]。在 0.1 mol/L 的 Tris-盐酸缓冲液加入一定量的 LBP、Pronase E(LBP ∶Pronase E=1 ∶2,质量比),60℃预热30 min使其它酶灭活。然后在样品液中加入样品质量1%的Pronase E,37℃消化24 h后,再补加样品质量0.5%的Pronase E,继续消化48 h,确保反应液的pH值保持在8.0左右。反应结束后以Sephadex G-100纯化,Sephadex G-25除盐,之后加入40 mmol/L H2SO4,80℃搅拌反应取样,以0.25 mol/L Na2CO3溶液中和,然后以蒸馏水透析,收集袋内液浓缩,加入0.5 mol/L TFA水解,80℃反应4 h,蒸馏水浓缩数次至中性为止,冷冻干燥后得到LBO[19]。
1.3.2 枸杞低聚糖结构的鉴定
1.3.2.1 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)分析
取一定量干燥的LBO,按照质量比1∶200~1∶250添加干燥的KBr粉末,混合均匀,制得压片,波数范围为4 000 cm-1~400 cm-1,置于傅里叶变换红外光谱仪上进行扫描,绘制红外光谱图[20]。
1.3.2.2 核磁共振波谱(nuclear magnetic resonance spectroscopy,NMR)分析
将干燥的LBO溶解于含有0.1%四甲基硅烷的0.5 mL D2O中,使用核磁共振光谱仪(400 MHz)对样品进行1H NMR和13C NMR波谱分析[20]。
1.3.2.3 高效凝胶渗透色谱(high-performance gel chromatography,HPGPC)分析
配制葡聚糖标准品,用流动相溶解LBO样品,过0.45 μm微孔滤膜,5 000 r/min离心10 min后取上清液,用流动相冲洗色谱柱至平衡,标准品和待测样品分别进样测定。色谱条件为色谱柱:TSKgel G4000-PWXL(7.8mm×30cm,10μm);流动相:0.1mol/L NaNO3;检测器:示差检测器;柱温:40 ℃;流速:0.5 mL/min;进样体积:20 μL。以葡聚糖标准品重均分子量的对数(lgMw)对保留时间(tR)作图,通过分子量标准曲线及回归方程计算得出LBO分子量[21]。
1.3.2.4 高效液相色谱(high-performance liquid chromatography,HPLC)分析
依次精确移取阿拉伯糖(arabinose,Ara)、木糖(xylose,Xyl)、鼠李糖(rhamnose,Rha)、半乳糖(galactose,Gal)、葡萄糖(glucose,Glu)和甘露糖(mannose,Man)标准溶液 1 000、500、200、100、50 μL,用水定容至1 mL,配制成浓度为 100、50、20、10、5 mg/L 系列标准溶液,上机测定。称量0.1 g LBO,加4 mol/L TFA 10 mL,充氮气,110℃水解2 h,冷却至室温(25℃),加入4 mol/L NaOH调pH值为6.5,加水定容。参照文献[22]的方法,取1 mL样品溶液同标准品一起衍生后,过0.45 μm微孔滤膜上机。色谱条件为色谱柱:Diamonsil Plus 5 μm C18色谱柱(250 mm×4.6 mm);流动相 A:0.05 mol/L KH2PO4-NaOH;流动相B:乙腈;检测器:紫外检测器;柱温:40 ℃;流速:1.0 mL/min;进样体积:20 μL。
1.3.3 枸杞低聚糖体外模拟胃肠道消化能力的测定
1.3.3.1 消化体系的制备
参照文献[23]的方法配制胃电解质和肠电解质。胃肠液的配制:称取12.5mg胃脂肪酶和11.8mg胃蛋白酶,加入50 mL胃电解质和1.5 mL CH3COONa(1 mol/L,pH5),在室温(25℃)条件下于磁力搅拌器上搅拌,用0.1 mol/L HCl调pH值至2;将100 g肠电解质、100 g胰酶溶液、13 mg胰蛋白酶、200 g胆汁混合,用0.1 mol/L NaHCO3调pH值至7。胃肠液-4℃冷藏备用。
1.3.3.2 模拟消化
取4 mL LBO样品溶液(1 mg/mL),加10 mL胃液,放在 37℃、200 r/min摇床内反应,在 0、2、4、6 h时取样1 mL,沸水浴5 min灭酶活。消化6 h后用0.1 mol/L NaHCO3调pH值至7,加肠液1.8 mL,混匀,继续37℃、200 r/min 摇床内反应,在 0、2、4、6 h 时取样 1 mL,沸水浴5 min灭酶活。同时设立空白对照组,只加胃液和胃肠液,不加样品。设置3个重复。釆用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定消化产物中还原糖的生成量。以葡萄糖浓度为横坐标,吸光度为纵坐标建立标准曲线。取200 μL样品,加600 μL DNS溶液,沸水浴15 min,冷却后加3.2 mL水,于550 nm处测吸光度,测定样品中还原糖含量[24]。
1.3.4 枸杞低聚糖的抑菌性
1.3.4.1 菌种的活化
试验前在无菌操作条件下,将金黄色葡萄球菌制剂胶囊中的冻干菌粉移入盛有无菌生理盐水的试管中,充分振荡使菌体混合均匀。以0.1%接菌量接种于10 mL活化培养基,37℃厌氧培养,传代2次,重新接种发酵18 h后得菌种母液。
1.3.4.2 生长曲线的测定
参照文献[25]的方法并进行修改,LBO添加量依次为基础培养基中葡萄糖质量的1/3、2/3和1取代基础培养基中的葡萄糖作为试验培养基,113℃湿热灭菌20 min,取菌种母液以0.1%接菌量分别接种基础培养基和试验培养基。37℃厌氧培养48 h,分别于0、2、4、6、8、10、12、24 h 取样测定在 600 nm 下金黄色葡萄球菌的菌体浓度,每个处理设3个重复。以培养时间为横坐标,菌体浓度OD600nm为纵坐标,绘制生长曲线。
1.4 数据处理
采用SPSS 20.0软件中的Duncan法进行数据的差异性分析,Origin 8.5作图。
2 结果与分析
2.1 枸杞低聚糖结构鉴定分析
2.1.1 FT-IR分析
LBO的FT-IR如图1所示。

图1 LBO红外光谱图Fig.1 Infrared spectrum of LBO
由图1可知,3 400 cm-1处宽峰是由O-H伸缩振动和N-H伸缩振动引起的[26]。因此,LBO可能含-OH、-NH2或-NH-基团。2 930 cm-1C-H的伸缩振动是糖类的特征峰,表明多糖发生降解后仍含有-CH2-基团[27]。1 640 cm-1附近的吸收峰为一级氨基和二级氨基N-H的变角振动或-C=O的非对称伸缩振动峰[5,28],表明有蛋白质成分存在。-COOH的C-O伸缩振动引起的1 420 cm-1吸收峰,-COO的C=O对称伸缩振动引起的1 350 cm-1吸收峰和-COOH的O-H变角振动引起的1 250 cm-1吸收峰表明LBO中含有-COOH基团[29]。1 040 cm-1处的吸收峰为一级醇羟基的变角振动峰。1 400 cm-1~1 160 cm-1处的吸收峰是C-H键的变角振动,它与C-H的伸缩振动构成了糖环的特征吸收,1 160 cm-1~1 040 cm-1间的吸收峰证明了吡喃糖糖苷的存在[30]。840 cm-1和760 cm-1左右为α型糖苷键和α-D-葡萄糖环的吸收峰[31],870 cm-1~810 cm-1为甘露糖的特征峰[32]。
2.1.21H NMR和18C NMR分析
LBO的1H NMR图谱如图2所示。
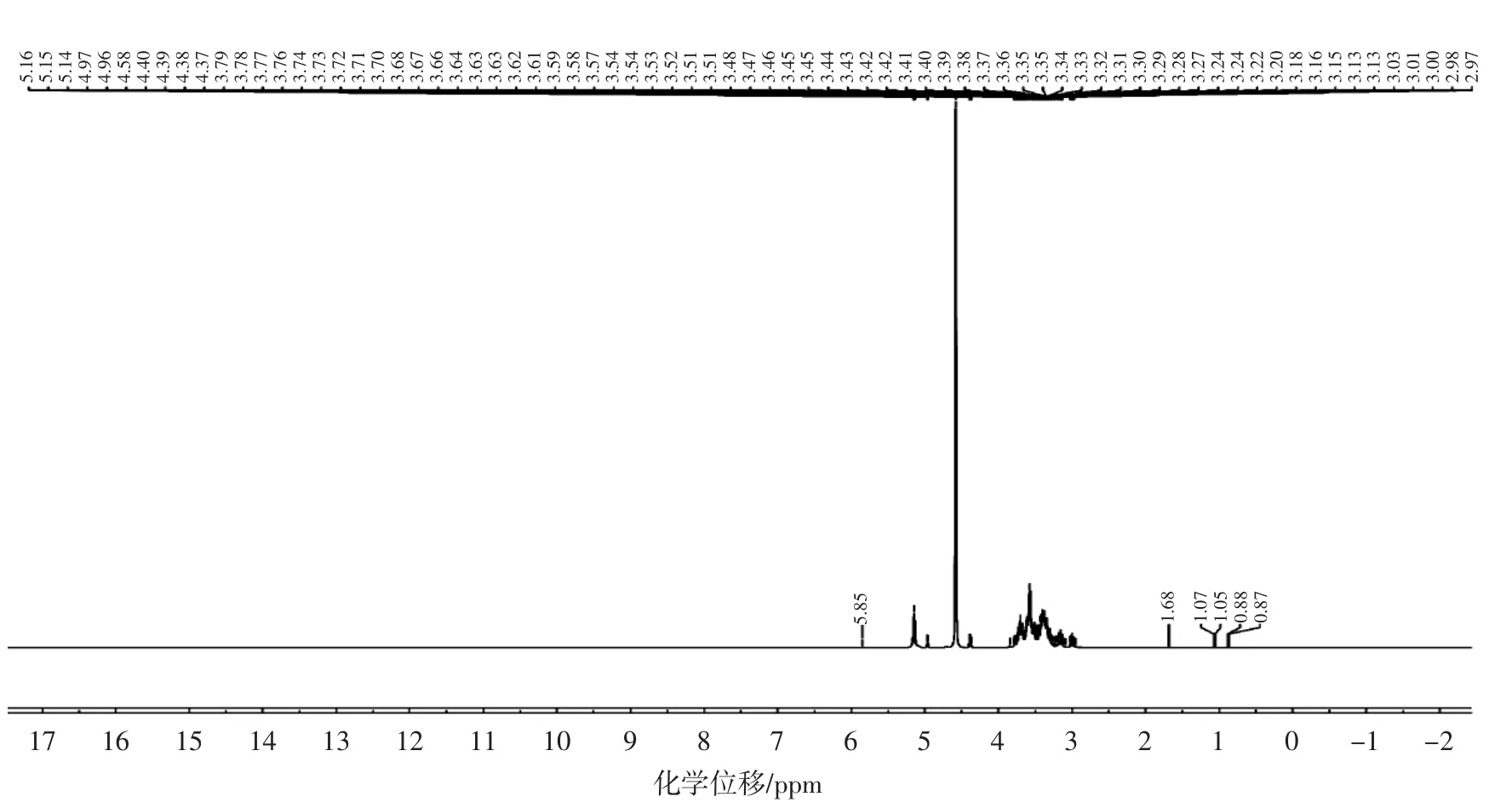
图2 LBO1H NMR图谱Fig.2 Spectrum of LBO1H NMR
由图2可知,LBO的信号大多集中在δ 2.9 ppm~5.1 ppm之间,δ 4.58 ppm处的质子信号为溶剂D2O的质子位移,δ 3.2 ppm~4.3 ppm为糖环质子信号。谱图中显示在δ 5.15 ppm处有端基氢质子的信号,表明LBO样品中含有α型糖苷键[30]。异头碳上氢的化学位移δ 2.9 ppm~4.1 ppm出现糖类的特征分裂信号,产生吸收峰裂分的原因可能是相邻的自旋核(氢核)之间通过成键电子发生相互干扰作用而形成的多重共振跃迁,产生共振吸收峰的裂分[33]。除此之外,谱图显示具有小于δ 4.8 ppm的质子信号,这表明存在吡喃糖残基[34]。13C NMR图谱比1H NMR图谱有着范围更广的化学位移,且有着较高的分辨率,能够更好地区分分子的构型和构象。
LBO13C NMR图谱见图3。

图3 LBO13C NMR图谱Fig.3 Spectrum of LBO13C NMR
如图3所示,异头碳的共振区有4个信号,均为α型糖苷异头碳,表明LBO主要以α型糖苷键构型存在。另外,LBO的信号大多集中在δ 60 ppm~77 ppm之间,表明其中吡喃环占有较大比例,且δ 71.50 ppm~71.69 ppm、δ 73.29~73.96 ppm、δ 76.68 ppm~76.81 ppm、δ 72.65 ppm~72.81 ppm有着较强信号,它们属于吡喃葡萄糖残基的 C2、C3、C4、C5的振动信号[35]。这与 FT-IR和1H NMR的研究结果相一致。
2.1.3 HPGPC分析分子量分布
葡聚糖标准品和LBO样品的HPGPC结果如图4所示。

图4 LBO的分子量分布色谱图Fig.4 Molecular weight distribution chromatogram of LBO
由图4可知,黑色实线为LBO样品的示差信号图,图中出现了1个非常明显的出峰区间,其出峰的保留时间为20.092 min,该区间为LBO主要的分子量组分,占LBO样品的63.1%。根据葡聚糖的标准曲线,lgMw=-0.043 9tR3+2.300 1tR2-40.552 7tR+244.938 5,R2=0.994 2。计算可得LBO的平均重均分子量Mw在507.48 Da左右。
2.1.4 PMP-HPLC分析单糖组成结果
通过对比添加的单糖的峰型、峰面积和出峰时间的变化,确定了LBO的单糖组成,结果如图5和图6所示。
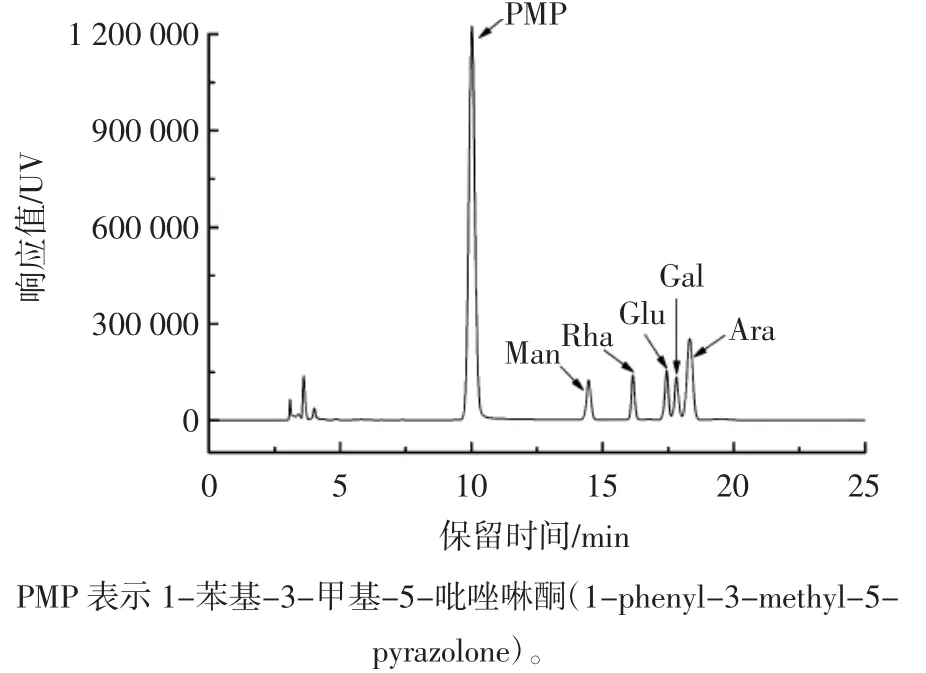
图5 标准单糖的分析色谱图Fig.5 Analysis chromatogram of standard monosaccharide
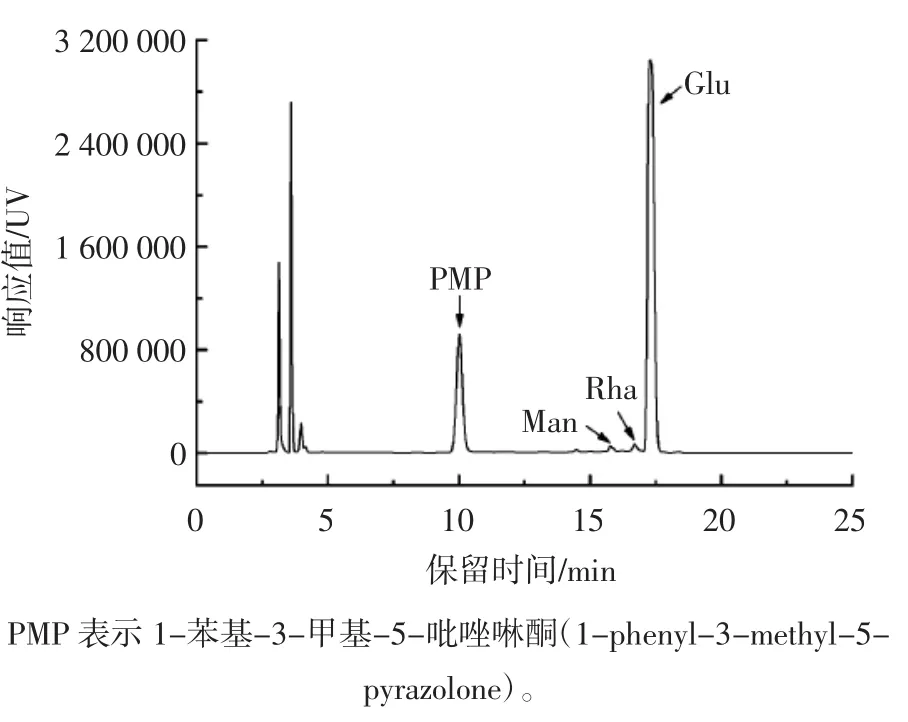
图6 LBO单糖的组成分析色谱图Fig.6 Composition analysis chromatogram of LBO monosaccharide
由图5、图6可知,从左至右,各出峰依次为PMP、甘露糖、鼠李糖、葡萄糖、半乳糖和阿拉伯糖;添加了样品水解液后,甘露糖、鼠李糖和葡萄糖的峰型和出峰时间保持一致,其相应的单糖的峰面积增加,各单糖的出峰顺序依次为甘露糖、鼠李糖、葡萄糖,说明样品水解液中包含这3种糖类。
2.2 体外模拟胃肠道消化能力分析
DNS法绘制的还原糖标准曲线如图7所示。

图7 DNS法绘制葡萄糖标准曲线Fig.7 Drawing glucose standard curve by DNS method
计算得到枸杞低聚糖经胃液消化后产物的还原糖含量,以此来表示LBO在胃液和胃肠液中的消化能力,消化产物的还原糖含量与消化能力成正比,其变化趋势如表1所示。
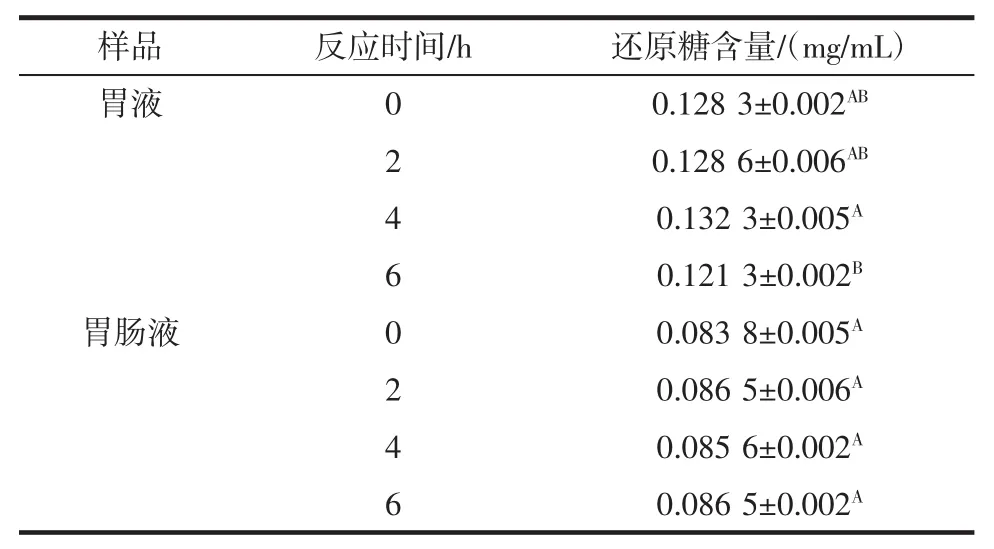
表1 不同模拟消化时间下LBO消化产物的还原糖含量Table 1 Reducing sugar content of LBO digestion products at different simulated digestion times
由表1可知,胃肠环境中也含有一定量还原糖。在0、2、4、6 h时取样检测,发现随着胃液消化的进行,还原糖含量由0 h的0.128 3 mg/mL降至6 h的0.121 3 mg/mL,还原糖的含量并没有明显升高,说明枸杞多糖在胃液中只有轻微程度的降解,甚至不降解。而在胃肠液消化时,LBO的还原糖含量无显著差异(P>0.05),说明即使在消化了6 h后,也只有少量的还原糖产生,有极少的糖苷键发生了变化。LBO在胃肠液中不发生降解这一结论,可以初步推断出LBO可作为一种益生元应用到宿主机体内,调控肠道平衡。
2.3 抑菌性分析
图8为LBO对金黄色葡萄球菌在不同添加量下处理后的生长曲线。

图8 金黄色葡萄球菌生长曲线Fig.8 Growth curve of Staphylococcus aureus
由图8可知,未添加LBO的金黄色葡萄球菌在整个生长期间表现出了典型的细菌生长特性,生长曲线呈现S型,而添加了LBO的金黄色葡萄球菌的生长曲线逐渐趋于直线,金黄色葡萄球菌的整个生长期间的菌体浓度出现了下降的趋势,对数期增长速度减缓,稳定期菌体数量下降。添加更高浓度的LBO,对金黄色葡萄球菌的生长抑制作用更加明显。
3 结论
通过酸解和酶解联合的方法对枸杞多糖进行降解,得到了枸杞低聚糖。分别以傅里叶变换红外光谱、核磁共振波谱、高效凝胶渗透色谱和高效液相色谱对枸杞低聚糖的结构进行了初步鉴定,确定了其可能存在的基团和糖苷键、分子量和单糖组分。根据上述结果,可以确定枸杞低聚糖的分子量在507.48 Da左右,主要以α型糖苷键连接的吡喃糖存在,由甘露糖、鼠李糖和葡萄糖组成。要系统完整地分析其结构还需要采用高碘酸氧化、Smith降解等分析方法进行更深入的研究。同时,在模拟胃肠液试验中发现枸杞低聚糖的降解程度较低,枸杞低聚糖可能作为一种益生元被机体所利用,这可以作为下一步对其生物活性研究的全新突破口。此外,以常见的致病菌金黄色葡萄球菌为代表,枸杞聚糖对其有较强的抑制作用,且抑菌能力随着浓度的增加而增强。对作用于未来体内实验的机理研究提供了更为可靠的依据,有助于探索枸杞低聚糖与肠道菌群间相互干预的作用关系。
