用于肉类腐败监测的纳米银混合凝胶的简便制备
2023-03-06胡安夏碧华蒋杰李婷陈明清东为富
胡安,夏碧华,蒋杰,李婷,陈明清,东为富
(江南大学化学与材料工程学院教育部合成与生物胶体重点实验室,江苏 无锡 214122)
食品安全和质量是影响人们健康的重要因素。鲜肉是人体主要营养来源之一。然而,肉类在运输过程易变质。因此,确定肉品质量和安全性对降低食品安全风险[1]具有重要意义。传统化学方法测定挥发性盐基氮(total vol-atile base nitrogen,TVBN)的结果虽然相对准确[2],但TVBN需要在专门的实验室进行测定,过程费时费力。由于肉类变质具有很强的时效性,因此能实时测定肉类新鲜度的方法是近年来的热门研究对象。
近年来,智能食品包装受到越来越多的关注,因为它具有随包装实时监控食品质量的潜力[3]。智能食品包装系统一般可通过传感器、指示剂、数据载体3种主要技术来实现[4]。其中,颜色指示剂(如新鲜度指示剂、时间温度指示剂、气体指示剂等)便于肉眼识别,可以通过颜色的变化提供定性或半定量的信息,因此得到了广泛的研究。近年来,人们研发出了很多比色指示剂,如pH敏感指示剂[5-7]、生物胺指示剂[8-9]、二氧化碳指示剂等[10-11],用于评价肉类的新鲜度。这些指示剂会随着肉类在贮藏过程中新鲜度变化而发生特定的颜色变化。但是仍需探索更有特色和有效的指示剂。
硫化氢(H2S)是肉类腐败过程中产生的一种挥发性气体,主要产生于含硫氨基酸的降解过程中[12]。因此,H2S被认为是评价肉类腐败的特征化合物[13-15]。然而,在智能包装系统中开发比色H2S传感器来判断肉类新鲜度的研究较少[16]。因此,用于智能包装的比色H2S传感器是非常可取的。
Ag纳米颗粒(Ag nanoparticles,Ag NPs)与 H2S反应生成Ag2S[17-18],由于其颜色变化明显,被广泛用于开发比色传感器[19]。然而,Ag纳米颗粒需要与生物材料协同作用来固定和感知H2S。双醛淀粉(dialdehyde starch,DAS)、壳聚糖、聚乙烯醇(polyvinyl alcohol,PVA)都是具有良好生物相容性的材料,它们之间可以交联,形成三维网络结构,用于固定Ag NPs[20-22]。因此,基于Ag NPs混合DAS-壳聚糖-PVA甘油凝胶的比色H2S传感器可以用作智能包装肉类变质指示剂。这种新型的Ag NPs混合甘油凝胶具有较高的机械强度、形状稳定性和H2S敏感性,适合在智能食品包装中应用。本研究可为高蛋白肉类的新鲜度检测提供参考。
1 材料与方法
1.1 材料与试剂
新鲜鸡胸肉、猪里脊肉:市售。聚乙烯醇(polyvinyl alcohol,PVA)、高碘酸钠、硝酸银、氢氧化铵、硫化钠、冰醋酸、盐酸、乙醇、丙酮(均为分析纯):国药集团化学试剂有限公司;木薯淀粉、壳聚糖:西格玛奥德里奇(上海)贸易有限公司。
1.2 仪器与设备
电热恒温油浴锅(HHW-21CU-600):上海福玛实验设备有限公司;冷冻干燥机(FD-A10N-50):冠森生物科技(上海)有限公司;电热恒温鼓风干燥箱(DHG-9023A):上海廷翌仪器设备厂;电子分析天平(AR-1140):上海奥豪斯国际贸易有限公司;双光束紫外可见分光光度计(TU-1950):北京普济通用仪器有限公司;傅里叶变换红外光谱(Nicolet 6700):美国赛默飞世尔科技有限公司;万能试验机(双立柱台式试验系统)(5967X):美国ITW公司;高分辨率透射电子显微镜(JEM-2100):日本电子株式会社广州代表处;热重分析仪(1100SF):梅特勒-托利多国际贸易有限公司。
1.3 方法
1.3.1 高碘酸钠氧化木薯淀粉制备DAS
将100 g木薯淀粉溶解于600 mL去离子水中,然后加入2.5 g高碘酸钠,室温25℃下反应24 h。由于高碘酸盐的特异性,高碘酸钠可以选择性氧化相邻两个羟基,并破坏葡萄糖环的C2-C3键形成双醛结构。用去离子水清洗氧化淀粉3次,残渣溶解后再用无水乙醇过滤。这样可以防止淀粉团聚,并有助于淀粉干燥。滤渣干燥后,最终得到DAS。
1.3.2 DAS-壳聚糖-PVA水凝胶及甘油凝胶的制备
将壳聚糖溶解在稀冰醋酸溶液中,得到壳聚糖溶液。在17 mL去离子水中加入0.2 g壳聚糖,搅拌后加入几滴冰醋酸,得到具有黏性的壳聚糖溶液。将10 g PVA溶于90 g去离子水中,90℃持续搅拌,得到10%的PVA溶液。
以DAS为基料,PVA和壳聚糖为交联剂,设置DAS、PVA和壳聚糖的质量比为60∶1∶5,得到水凝胶。在10 mL PVA和壳聚糖的混合溶液中加入12 g DAS,搅拌1 h,然后将混合溶液倒入培养皿中,在电热恒温鼓风干燥箱中80℃加热1.5 h,最终得到水凝胶。DAS的醛基与PVA的羟基和壳聚糖的氨基分别发生醛醇缩合反应和席夫碱反应。
甘油凝胶的制备过程与水凝胶基本相同,唯一不同的是用甘油代替水制备壳聚糖溶液,0.2 g壳聚糖溶于7 mL稀释冰醋酸(1 mol/L)再与10 mL甘油共混。首先设置DAS、PVA和壳聚糖的质量比为60∶1∶5,然后在PVA和壳聚糖甘油的混合溶液中加入12 g DAS,搅拌1 h。将得到的混合液倒入培养皿中,80℃加热1.5 h,得到甘油凝胶。
1.3.3 Ag NPs混合凝胶的制备
醛基具有还原能力,Ag+被DAS的醛基还原成为Ag NPs。制备Ag NPs混合凝胶的方法为先将5 mL的0.01 mol/L硝酸银与45 mL去离子水混合,再加入10滴25%氨,在室温25℃下分别浸泡水凝胶和甘油凝胶1.5 h。从混合溶液中取出凝胶,用滤纸擦干。
Ag NPs溶液的制备方法:将1 g DAS加入100 mL去离子水中搅拌,80℃油浴加热2 h。然后在室温25℃下将银氨溶液加入DAS溶液中,避光反应6 h,得到Ag NPs溶液。
1.3.4 Ag NPs溶液的紫外表征
使用双束紫外可见分光光度计在300 nm~800 nm记录溶液的紫外光谱。
1.3.5 红外光谱分析
采用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)曲线来表征淀粉的化学变化,样品在4 000 cm-1~400 cm-1范围内获得。
1.3.6 Ag NPs的形态观察
Ag NPs的形态观察采用高分辨率透射电子显微镜(transmission electron microscope,TEM)进行,样品通过将Ag NPs溶液滴在碳涂层铜网格上制备,并在室温25℃下干燥。
1.3.7 凝胶的热重分析
水凝胶、甘油凝胶、Ag NPs混合水凝胶和Ag NPs混合甘油凝胶的热稳定性利用热重分析仪测定。将约10 mg的干燥样品放入坩埚中,以25℃/min的速度从50℃加热至650℃。氮气吹扫气体的速度设置为25 mL/min。
1.3.8 Ag NPs混合凝胶对H2S的敏感性测定
硫化钠与稀盐酸反应生成H2S,用Na2S溶液浓度测定H2S浓度。7.8 g Na2S溶于1 000 mL去离子水,制备0.1 mol/L硫化钠溶液。控制Na2S和HCl的摩尔比为3∶1,将Na2S溶液和HCl溶液加入到培养皿中,用聚乙烯薄膜密封培养皿,薄膜上有1个戳孔。然后将Ag NPs混合水凝胶或Ag NPs混合甘油凝胶盖在孔上,再次用聚乙烯薄膜密封。
1.3.9 Ag NPs混合凝胶颜色变化
以白色标准作为背景,采用RGB色值模型,使用色度仪来测定Ag NPs混合凝胶的色值。
1.3.10 肉类腐败测定
新鲜鸡胸肉和猪里脊肉在从市场到实验室的运输过程中冷冻(-15℃)保存。将100 g切成大块的新鲜鸡胸肉和猪里脊肉放入一次性塑料盒中。Ag NPs混合凝胶放在箱子的另一边,不与肉样品发生物理接触,用聚乙烯薄膜覆盖整个一次性塑料盒,并在室温25℃下贮存。
1.4 凝胶特性
称取若干同等质量的干凝胶,置于40 mL去离子水中,每隔一段时间取出凝胶,用滤纸擦去表层水,称其质量,根据溶胀比(swelling ratio,SR)式(1)计算凝胶质量。
式中:Wd为完全干燥凝胶的质量,g;Ws为凝胶在平衡膨胀状态下的质量,g。
②陆游从乾道六年(1170,46岁)闰五月十八日离山阴赴夔州通判,到淳熙五年(1178,54岁)春别蜀东归。期间于乾道八年三月到兴元府,同年十一月二日启程赴成都。实际在梁益时间不足八年。但陆游谈到这段经历,常自云九年或十年,如《遣兴》云“西州落魄九年余”,《新滩舟中作》云“九年行半九州岛地”,《南烹》云“十年流落忆南烹”等等。陆游的梁益地区书写,研究论文颇多,此处不一一列举。
取1 cm×1 cm×0.1 cm大小的凝胶,用电热恒温鼓风干燥箱50℃加热24 h制备干凝胶。将干凝胶浸泡于去离子水中,在不同温度下浸泡24 h,得到平衡溶胀凝胶。
将试样制成高15 mm、直径20 mm的圆柱体,用万能试验机测量,并将压缩速率固定为5 mm/min,读取最大抗压强度。凝胶强度可以由最大压缩应力τ来表示,计算公式(2)如下。
式中:τ 为压缩应力,g/cm2;F 为载荷质量,g;A 为压缩面面积,cm2;G 为剪切模量,g/cm2;σ 为压缩应变,%;σ为压缩厚度与非压缩厚度之比。
凝胶有效交联点密度可由式(3)计算。
式中:ρ为有效交联点密度,mol/cm3;G为凝胶剪切模量,g/cm2;SR为凝胶溶胀比,%;R为气体常数,8.48×104(g·cm)/(mol·K);T为绝对温度,298 K。
1.5 数据分析
所有试验均重复5次,试验数据以平均值±标准差表示,图像采用Origin 8.0软件绘制,试验数据与图表采用Excel 2018处理。
2 结果与分析
2.1 DAS和Ag NPs的制备
本试验采用高碘酸钠氧化木薯淀粉制备DAS。为研究木薯淀粉结构的变化,采用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测定木薯淀粉和DAS的特征基团。木薯淀粉和DAS的FTIR光谱见图1。

图1 木薯淀粉与DAS的傅里叶红外光谱Fig.1 Fourier infrared spectra of cassava starch and dialdehyde starch
由于DAS具有醛基的还原能力,因此采用DAS作为Ag+的还原剂制备Ag NPs。DAS还原Ag NPs的透射电子显微镜图像见图2。由图2可知,Ag NPs为直径10 nm~20 nm的球形。DAS溶液和Ag NPs-DAS溶液的紫外光谱见图3。

图2 Ag纳米粒子TEM图像Fig.2 TEM image of Ag nanoparticles
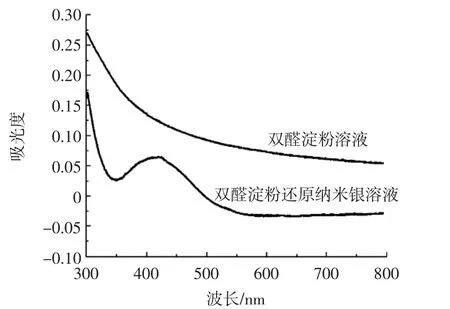
图3 DAS和Ag NPs溶液的紫外光谱Fig.3 UV spectra of the solutions of DAS and Ag nanoparticles
由图3可知,Ag NPs在420 nm处有明显的吸收峰,以DAS溶液为参比溶液,300nm~800nm处无吸收。
2.2 Ag NPs混合水凝胶和Ag NPs混合甘油凝胶的性质
将DAS-壳聚糖-聚乙烯醇交联凝胶浸泡于银氨溶液中,制备Ag NPs混合凝胶。应用于肉类变质监测领域,Ag NPs混合凝胶需要具有优良的力学性能,保持形状和结构的稳定,不易被外力破坏,例如低溶胀比(SR)、高压缩强度和高交联密度。溶胀比(SR)是凝胶的重要性质,它代表了凝胶的结构保留性能[25]。SR试验结果见表1和表2。
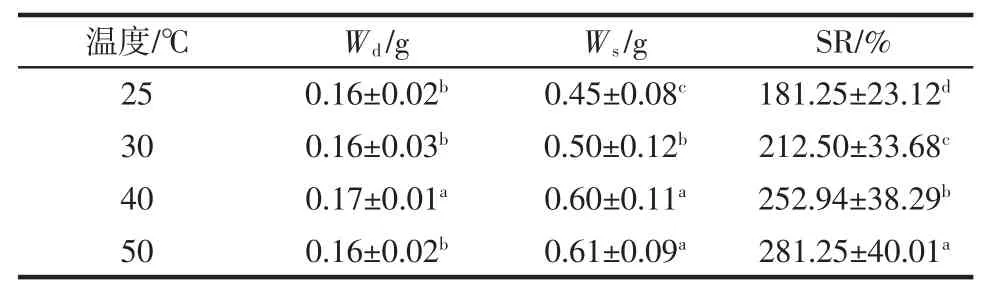
表1 Ag NPs混合水凝胶的SRTable 1 Swelling ratio of Ag nanoparticle-loaded hybrid hydrogel

表2 Ag NPs混合甘油凝胶的SRTable 2 Swelling ratio of Ag nanoparticle-loaded hybrid glycerogel
由表 1可知,当温度分别为 25、30、40、50℃时,SR分别为 181.25%、212.50%、252.94%、281.25%,Ag NPs混合水凝胶的SR随温度的升高而增加。由表2可知,Ag NPs混合甘油凝胶与Ag NPs混合水凝胶的SR具有相同变化趋势,但SR随着温度升高而升高的趋势明显小于Ag NPs混合水凝胶,这一现象表明Ag NPs混合水凝胶SR受环境温度的影响较大。
凝胶压缩强度τ和有效交联点密度ρ是凝胶的重要性能,结果见表3。

表3 凝胶的强度和交联密度Table 3 Strength and cross-linking density of gels
由表3可知,AgNPs混合水凝胶τ为137.85g/cm2,Ag NPs混合甘油凝胶τ为303.10 g/cm2。Ag NPs混合水凝胶的ρ值为1.32 mol/cm3,Ag NPs混合甘油凝胶的ρ值为1.71 mol/cm3。结果表明甘油凝胶具有较高的压缩强度和交联密度,产生这些现象的主要原因是甘油具有更多的羟基和更高的分子间作用力,这些特性可以提高凝胶强度和交联密度[26]。
除溶胀比、凝胶强度和交联密度外,凝胶的形状稳定性是另一个重要的性能。图4为室温25℃不同放置时间下凝胶的表观形貌。

图4 凝胶在不同放置时间下的表观形貌Fig.4 Appearance of gelsstored for different time periods
由图4可知,随着放置时间的延长,Ag NPs混合水凝胶的形状发生了明显的坍塌,而Ag NPs混合甘油凝胶的形状变化不明显。Ag NPs混合水凝胶和Ag NPs混合甘油凝胶在不同时间的质量变化如表4所示。
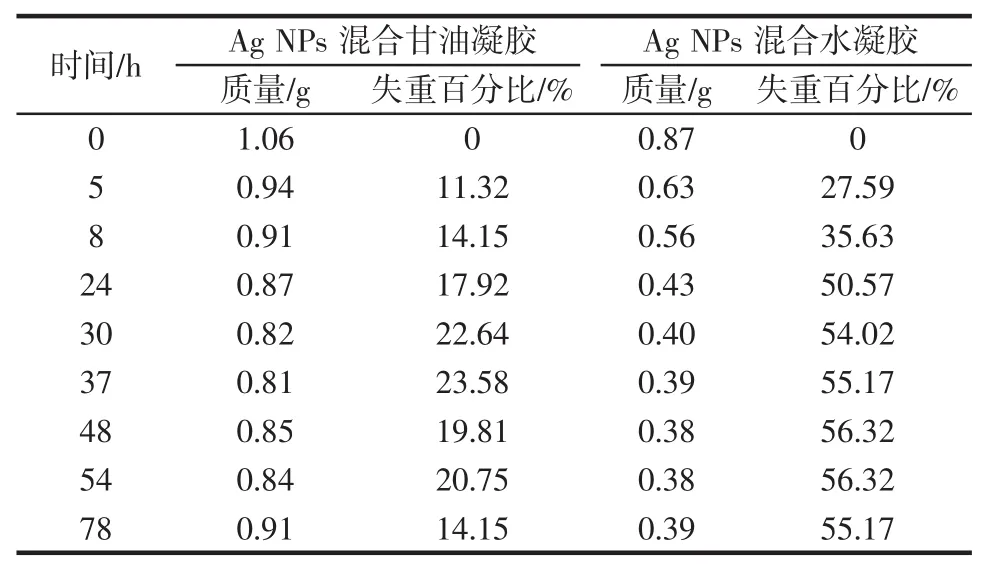
表4 Ag NPs混合甘油凝胶和Ag NPs混合水凝胶在不同时间的质量Table 4 Weights of Ag nanoparticle-loaded hybrid glycerogel and hydrogel stored for different time periods
由表4可知,Ag NPs混合水凝胶78 h后的失重率为55%左右,而Ag NPs混合甘油凝胶相应的失重率仅为14%左右。Ag NPs混合水凝胶中的水分容易挥发,从而使凝胶结构发生较大的改变。而Ag NPs混合甘油凝胶相对稳定,因此,甘油可以改善形状稳定性。
2.3 Ag NPs混合水凝胶与Ag NPs混合甘油凝胶中纳米银的含量
H2S的敏感程度与Ag NPs的含量密切相关。采用热重分析(thermogravimetric analysis,TGA)测定混合凝胶中Ag NPs含量。表5为凝胶、Ag NPs混合凝胶的失重率和相应的Ag NPs含量。

表5 凝胶和Ag NPs混合凝胶的失重率Table 5 Weight loss ratios of gels and Ag nanoparticle-loaded hybrid gels
由表5可知,水凝胶和Ag NPs混合水凝胶的失重率分别为79.22%和77.16%,差值为2.06%。甘油凝胶和Ag NPs混合甘油凝胶的失重率分别为79.59%和77.66%,二者差值为1.93%,与水凝胶和Ag NPs混合水凝胶体系一致。结果表明,Ag NPs占混合凝胶质量的2%。
2.4 Ag NPs混合水凝胶与Ag NPs混合甘油凝胶对H2S敏感性表征
对于H2S传感器,将AgNPs混合水凝胶切成1.0cm×1.0 cm×0.8 cm大小,在封闭的培养皿中形成H2S气氛环境,H2S可以渗透到Ag NPs混合水凝胶中,Ag NPs混合水凝胶的颜色随时间和浓度的变化如图5所示。
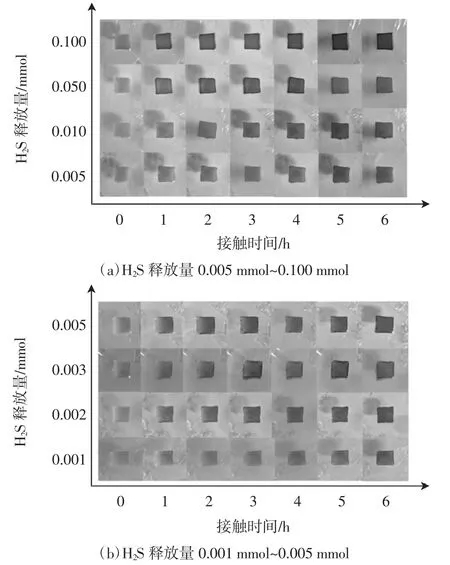
图5 Ag NPs混合水凝胶暴露于H2S中的变色情况Fig.5 Color changes of Ag nanoparticle-loaded hybrid hydrogel exposed to H2S
由图5可知,随着接触时间的延长,颜色有加深的趋势,在低释放量 H2S(0.005 mmol~0.100 mmol)的条件下,感官水凝胶的颜色变化需要5 h才能达到稳定。随着H2S释放量的升高,Ag NPs混合水凝胶的颜色也呈现出加深趋势。产生这种现象的主要原因是Ag NPs被H2S氧化,形成Ag2S,使水凝胶颜色变深[27]。Ag NPs混合水凝胶对H2S优异的亲和性为其在肉类变质监测中的应用提供了有力的支持。
利用Ag NPs混合甘油凝胶对H2S进行检测,测试结果如图6所示。

图6 Ag NPs混合甘油凝胶暴露于H2S中的变色情况Fig.6 Color changes of Ag nanoparticle-loaded hybrid glycerogel exposed to H2S
由图6可知,Ag NPs混合甘油凝胶与H2S接触后,随着Ag NPs混合甘油凝胶与H2S接触时间的延长,颜色有加深趋势,但甘油凝胶仅需4 h即可达到颜色稳定。与Ag NPs混合水凝胶相比,Ag NPs混合甘油凝胶反应速度更快。Ag NPs混合甘油凝胶对应的颜色变化更明显,对H2S的敏感性较高。
2.5 Ag NPs混合甘油凝胶颜色随H2S浓度的变化
采用RGB色值模型对Ag NPs混合甘油凝胶颜色变化进行量化,用色度仪测定不同H2S浓度下Ag NPs混合甘油凝胶颜色的绿值(G)。根据不同H2S浓度下的G值作图,结果如图7所示。

图7 Ag NPs混合甘油凝胶颜色G值随H2S浓度的变化Fig.7 The variations in the color G value of Ag nanoparticleloadedhybrid glycerogel with H2S concentration
由图7可知,G值和H2S浓度在0~2.0 mg/100 g呈线性关系。校正曲线为y=-37.797x+142.62,相关系数R2=0.9209。
2.6 Ag NPs混合甘油凝胶在肉类变质监测中的应用
由于Ag NPs混合甘油凝胶具有更高的传感灵敏度,将其与新鲜的鸡胸肉和猪里脊肉进行有氧包装,用于肉品腐败监测。鸡胸肉与猪里脊肉切成大块,与Ag NPs混合甘油凝胶放置在同一个密封袋中,保持不接触,结果如图8所示。

图8 Ag NPs混合甘油凝胶用于监测新鲜鸡胸肉和猪里脊肉在室温25℃下的变质情况Fig.8 Monitoring offresh chicken breast and pork tenderloin stored at 25℃with the Ag nanoparticle-loaded hybrid glycerogel
由图8可知,贮存1 d后,Ag NPs混合甘油凝胶无明显颜色变化,随着贮存时间的延长,颜色逐渐加深。放置5 d后,Ag NPs混合甘油凝胶完全变黑,且与鸡胸肉同包装凝胶的变色较与猪里脊同包装凝胶的变色更为明显。另外,将Ag NPs混合甘油凝胶放置在不含鸡胸肉和猪里脊肉的室温25℃下作为对照试验,试验结果表明,Ag NPs混合甘油凝胶放置5 d后无颜色变化。上述结果表明,Ag NPs混合甘油凝胶能够利用其对挥发性H2S的选择性感知能力,通过肉眼可见的颜色变化监测鸡胸肉和猪里脊肉的腐败情况。
Ag NPs混合凝胶的颜色变化并不能明确指示新鲜等级,采用RGB色值模型对这些颜色变化进行量化,其中选取绿值(G)的变化来代表Ag NPs混合甘油凝胶对H2S的比色响应,能更清楚地指示新鲜等级[28]。通常,G值越低,新鲜度越低。采用比色计测定Ag NPs混合甘油凝胶的G值,并记录测试结果,如图9所示。

图9 Ag NPs混合甘油凝胶对猪里脊肉和对照组的G值随时间的变化Fig.9 Variations in the color G value of Ag nanoparticle-loaded hybrid glycerogel for monitoring pork tenderloin and control group over time
由图9可知,Ag NPs混合甘油凝胶与猪里脊肉放置数天后,G值有明显下降趋势,空白样品G值无明显下降趋势,这些现象表明Ag NPs混合甘油凝胶能够监测猪里脊肉的腐败情况。第3天时Ag NPs混合甘油凝胶颜色发生明显变化,此时凝胶颜色G值为130。有研究表明,猪肉达到国家标准一级鲜度时H2S含量≤145 μg/100 g,二级鲜度猪肉H2S含量≤296 μg/100 g,当 H2S 含量>296 μg/100 g时此猪肉不能食用[29]。将H2S浓度296 μg/100 g,代入校正曲线:y=-37.797x+142.62中,可得此时理论G值约为131,与实际测得的G值一致,表明Ag NPs混合甘油凝胶的颜色变化与猪里脊肉腐败情况相一致,能及时有效地反映猪里脊的新鲜度。
Ag NPs混合甘油凝胶中的PVA和甘油绿色无毒,在各种食品和个人护理产品中均有应用[30-32]。淀粉和壳聚糖是天然可食用的生物相容性多糖。此外,Ag NPs具有低细胞毒性,广泛用于生物和生物医学应用[27]。因此,Ag NPs混合甘油凝胶是一种安全的肉类变质指示剂,有利于其在智能食品包装中的实际应用。
3 结论
本试验以木薯淀粉为原料,通过氧化反应制备DAS。选用聚乙烯醇和壳聚糖作为交联剂,通过希夫碱反应和醛醇缩合反应与DAS形成三维网络结构的水凝胶。DAS原位还原生成Ag NPs,并与DAS-壳聚糖-聚乙烯醇水凝胶形成Ag NPs混合水凝胶。由于Ag NPs对H2S的高敏感性,Ag NPs混合水凝胶与H2S接触后会发生颜色变化,但这种Ag NPs杂化水凝胶也存在机械性能低、形状稳定性差等缺陷,无法应用于食品智能包装材料。为了提高力学性能和形状稳定性,将甘油代替水作为溶剂制备Ag NPs混合甘油凝胶。添加甘油后,τ从137.85 g/cm2提高到303.10 g/cm2,78 h后形状保持不变。此外,Ag NPs混合甘油凝胶在监测新鲜鸡胸肉和猪里脊肉变质时具有较高的灵敏度。
