溶藻弧菌细胞密度相关sRNA的鉴定及其对毒力的调控作用
2023-03-04李印可李莹玉杨文娟何佩云
李 莹, 李印可, 周 欣, 李莹玉, 杨文娟, 王 浩, 何佩云, 刘 欢,2*
(1.陕西科技大学 食品科学与工程学院,陕西 西安 710021;2.陕西农产品加工技术研究院,陕西 西安 710021)
0 引言
溶藻弧菌(Vibrioalginolyticus)是一种嗜盐嗜温的海洋弧菌,在夏季较高温度下容易引起海产品大规模死亡,造成巨大的经济亏损[1].溶藻弧菌具有强致病性,可通过直接侵袭机体或食用污染的海产品等方式损害人类健康,引起腹泻、败血症、中耳炎、食物中毒等疾病的发生[2].迄今为止,已鉴定出的溶藻弧菌毒力因子主要包括胞外蛋白酶、生物被膜、运动性、粘附素(外膜蛋白、脂多糖)和摄铁系统等[3].值得注意的是,细胞密度能够显著影响溶藻弧菌的致病性.在溶藻弧菌生长到对数期或稳定期时,细菌密度达到一定阈值,会产生大量的自诱导因子调控溶藻弧菌一系列基因的表达,从而对其生物被膜形成以及毒力因子分泌等造成影响[4-6].
sRNA是在大肠杆菌中率先发现的一类非编码小RNA(50~400 nt),为转录后调控因子[7,8],在细菌中广泛存在,能够感应环境变化,从而调控相关基因的表达[9].细菌sRNA主要作用机制是与靶基因mRNA通过碱基互补配对相结合,从而促进或抑制靶基因表达.根据其调控作用方式可分为顺式sRNA和反式sRNA.顺式sRNA主要位于噬菌体、转座子和质粒上,能够与靶标mRNA完全互补配对;反式sRNA主要位于染色体,通过分子伴侣蛋白Hfq的协助与靶标mRNA部分碱基互补发挥其功能[10].sRNA参与细菌几乎所有生理功能的调控,包括生长、代谢、毒力[11]、宿主感染以及耐药性[12]等.在大肠杆菌中,sRNA分子EsrF在高浓度铵盐条件可以与鞭毛合成基因flhBmRNA分子5′非编码区直接配对,而增强其运动性和对宿主细胞的粘附[13];sRNA分子RsaG在金黄色葡萄球菌内化至宿主细胞的过程中诱导表达,在利用葡萄糖-6-磷酸时,RsaG通过与氧化还原转录抑制子Rex和乳酸脱氢酶Ldh1反应调节氧化还原稳态,使得糖代谢由有氧氧化转为无氧氧化(即乳酸的形成进行),进而促进氨基酸代谢[14].Kim等[15]为了确定sRNAs在大肠杆菌和沙门氏菌抗生素敏感性中的作用,使用过表达文库进行了Hfq依赖型sRNAs的药敏试验、生长分析和活力测定.发现大肠杆菌中已知的26个Hfq依赖型sRNA中有17个调控其抗生素敏感性,如MicF、RybB、RydC等;沙门氏菌已知的9个Hfq依赖型sRNA中有8个调控其抗生素敏感性,MicF、OxyS、ChiX等.
sRNA是一种广泛存在于细菌体内的非编码RNA,通过与靶标mRNA碱基互补配对影响其稳定性或翻译活性,是一种重要的转录后调控系统.实验室前期研究发现:在溶藻弧菌体内存在sRNA伴侣蛋白Hfq,且对溶藻弧菌毒力具有显著的抑制作用[16].Hfq作为一种重要的转录后全局调控因子,广泛参与细菌不同生理进程,而其调控作用的发挥主要通过作为不同sRNA分子的伴侣蛋白来实现.目前在溶藻弧菌中已鉴定功能的sRNA分子仅有少数几个,尚存在大量未知的sRNA分子需要进行深入研究.而细胞密度相关的sRNA分子,除了实验室前期鉴定的与哈氏弧菌高度同源的Qrr1-5分子外[17],尚未有报道.
本文通过转录组测序及生物信息学手段,对低密度和高密度生长下的溶藻弧菌进行了差异sRNA的筛选,并对高密度条件下显著下调的sRNA0087进行生物信息学分析以及突变株及回补株的构建,检测运动性、生物被膜以及胞外蛋白酶等功能毒力因子的表达情况,初步明确该sRNA0087对溶藻弧菌毒力调控的作用.
1 材料与方法
1.1 实验菌株与培养基
1.1.1 实验菌株
溶藻弧菌EPGS(WT),pDM4,pBAD33(华东理工大学授赠);大肠杆菌DH5α,SM10 λpir,DH5α λpir;pDM19-T载体(宝生物工程(大连)有限公司).
1.1.2 培养基及试剂
LB液体培养基:氯化钠1%(w/v),胰蛋白胨1%(w/v),酵母粉0.5%(w/v).
LBS液体培养基:氯化钠3%(w/v),胰蛋白胨1%(w/v),酵母粉0.5%(w/v).
固体培养基则添加1.5%(w/v)琼脂.氨苄青霉素、硫酸卡那霉素及氯霉素购于生工生物工程(上海)股份有限公司.Trizol、异丙醇及氯仿购于上海捷瑞生物工程有限公司.cDNA第一条链合成试剂盒、琼脂糖凝胶回收试剂盒以及SuperReal荧光定量预混试剂盒购于北京天根生化科技有限公司.
1.2 主要仪器与设备
Micro 17型低温高速离心机,芬兰赛默飞世尔科技有限公司;移液器,德国Eppendorf公司;WH-3型涡旋混合仪,上海沪西分析仪器厂有限公司;DSX-280B型手提式压力蒸汽灭菌锅,上海申安医疗器械厂;DK-98 II型核酸定量仪,美国Quawell;Agilent 2100型生物电泳图像分析系统,美国安捷伦;HiSeq4000型测序仪,美国Illumina.
1.3 实验方法
1.3.1 菌株的培养
将溶藻弧菌接种在培养基LBS中,在30 ℃的条件下培养.大肠杆菌接种于LB培养基中,在37 ℃的条件下培养.液体培养基于摇床200 rpm 培养,固体培养基静置培养.
1.3.2 RNA-Seq高通量测序及sRNA预测分析
抽提溶藻弧菌总RNA,检测其浓度及质量.检验合格的样品送往上海云序生物科技有限公司完成测序分析.主要过程如下:1 μg总RNA经磷酸酶和PNK激酶处理后,使用Illumina公司的小RNA建库试剂盒进行文库构建.质控后的文库通过Illumina HiSeq 4000测序仪进行高通量转录组测序.使用Q30对原始reads(Raw Data)进行质控,之后使用cutadapt软件(v1.9.3)去接头,获得clean reads.使用sRNAscanner进行sRNA的预测分析,删除与已知基因重叠的部分.再使用Hisat2软件将clean reads比对到参考基因组上,使用HTSeq软件统计每个gene上的reads数.通过edgeR软件进行数据标准化和差异表达分析[18-22].使用Mfold软件进行sRNA二级结构预测分析,并通过TargetRNA2对其可能的靶标mRNA分子进行预测分析[23].
1.3.3 引物
突变株Δ0087及回补株0087+引物信息如表1所示.

表1 引物信息
1.3.4 缺失株的构建
根据溶藻弧菌EPGS全基因组序列,以sRNA0087为模板,设计引物up-F/R以及down-F/R,引物具体信息如表1所示.分别进行PCR获得上下游同源臂序列,胶回收后,以其作为模板,利用引物对up-F和down-R进行Overlap PCR,获得Δ0087缺失片段,与pDM4进行重组,并依次转化至大肠杆菌DH5α λpir以及SM10 λpir中,挑取阳性克隆菌株进行PCR验证.验证成功的含有pDM4-Δ0087质粒的SM10 λpir与溶藻弧菌野生型(Wild type,WT)进行两轮同源重组交换,筛选得到Δ0087缺失株.
1.3.5 回补株的构建
根据溶藻弧菌EPGS全基因组序列,以0087编码基因为模板,设计引物com-F及com-R,引物具体信息如表1所示.通过对溶藻弧菌基因组进行PCR获得0087+回补片段.通过进行T-A克隆及双酶切连接将目的基因片段与pBAD33连接重组,依次转化至大肠杆菌DH5α和SM10 λpir中.将含有目的基因质粒的SM10 λpir与缺失株Δ0087进行接合实验后,挑选克隆菌株,并进行菌落PCR验证得到回补株0087+.
1.3.6 运动性的测定
参考邓益琴等[24]的方法对运动性进行测定,将溶藻弧菌WT、Δ0087加入含有100 μg/mL氨苄的LBS培养基中,回补株0087+加入含有14 μg/mL氯霉素、0.04%(w/v)L-阿拉伯糖的LBS培养基中,30 ℃条件下200 rpm于摇床中培养,并将培养物OD600调整为1.0.吸取2 μL菌液分别点样至含有0.3%(w/v)琼脂和1.5%(w/v)琼脂的LBS固体平板中心,置于30 ℃恒温培养箱中培养,观察其运动情况.
1.3.7 生物被膜的测定
使用结晶紫染色法测定生物被膜形成[25].加入300 μL菌液至含有相应抗生素的10 mL LBS液体培养基中.另外,回补株需加0.04%(w/v)的L-阿拉伯糖.30 ℃静置48 h培养,用2%(w/v)的结晶紫染色液染色5 min,将培养液倒出,用去离子水冲洗至清澈,加入冰乙酸溶解,并测定570 nm处的吸光值(OD570).
1.3.8 胞外蛋白酶测定
活化溶藻弧菌WT、Δ0087和0087+,并将其OD600调整为1.0.配置含有2%(w/v)脱脂奶粉液的LBS固体平板,吸取2 μL菌液滴到平板中央,晾干后于30 ℃恒温培养箱倒置培养,观察其透明圈直径并进行拍照.
1.3.9 数据处理与分析
所有实验均设有3个平行,且至少重复3次,使用GraphPad Prism 7.0软件作图,显著性水平为5%.
2 结果与讨论
2.1 细胞密度相关sRNA的筛选
对溶藻弧菌EPGS在低密度(2 h)和高密度(9 h)下总RNA进行质量分析,结果如图1所示.
由图1可以看到,23S rRNA和16S rRNA两条明亮清晰的条带,且没有受到gDNA的污染,OD260/OD280分别为1.95和1.97,所提取的总RNA质量符合后续转录组测序要求,之后进行RNA文库制备和Illumina HiSeq高通量测序.对低密度条件下(2 h)和高密度条件下(9 h)溶藻弧菌的reads进行统计,结果如表2所示.低密度条件下共获得34 070 768个clean reads,比对到基因组中的reads有21 367 976个,Mapped ratio为62.72%;高密度条件下共产生了35 719 972个clean reads,比对到基因组的reads有26 783 063个,占74.98%.

图1 RNA完整性和gDNA污染电泳分析(Lane 1:2 h; Lane 2:9 h)

表2 Reads 统计
对高密度及低密度溶藻弧菌的表达差异进行分析,共有1 327个基因在高密度条件下较低密度条件转录水平上调,1 235个基因下调,结果如图2所示.之后进一步通过sRNAscanner进行sRNA分析预测,结果如表3所示.低密度时表达的sRNA 109个,高密度时表达的sRNA 107个,高密度较低密度共有82个差异表达sRNA分子,其中47个sRNA表达上调,35个表达下调.其中,sRNA0087为新型sRNA分子,其在高密度培养条件下表达水平显著下调(-9.38倍),选取其进行后续研究.

表3 sRNA表达谱及差异表达情况统计

图2 差异表达基因散点图
2.2 sRNA0087二级结构分析
使用Mfold预测sRNA0087的二级结构,结果如图3所示.sRNA0087具有典型的RNA二级结构,包含4个茎环、3个内环、2个凸环以及未能碱基配对的单链结构区组成,此外,其3′端为5个尿嘧啶组成的poly(U)尾巴,为与伴侣蛋白Hfq近端面进行结合的保守区,促进形成sRNA-Hfq的RNA-蛋白复合物.

图3 sRNA0087二级结构预测图
2.3 sRNA0087靶标mRNA的分析
使用Target RNA2对sRNA0087在溶藻弧菌中的靶标mRNA分子进行预测分析,部分靶标mRNA信息如表4所示.sRNA0087在溶藻弧菌体内拥有多个靶标mRNA,包括假定的三型分泌蛋白、酰基载体蛋白,质粒稳定系统蛋白、O-甲基转移酶相关蛋白、HesA/MoeB/ThiF家族蛋白以及核糖体小亚基的形成等.其中三型分泌系统伴侣分子SycN可以激活T3SS效应物的分泌,促进病原菌对宿主的侵染.

表4 部分靶标mRNA预测结果
2.4 Δ0087缺失株的筛选鉴定
关于Δ0087缺失株的构建,结果如图4所示.1号泳道为WT,2号泳道为筛选到的Δ0087菌株,可以看到Δ0087菌株扩增片段较WT减少200 bp左右,与设计缺失的221 bp片段大小相符.将构建成功的菌株进行测序,Δ0087缺失株所缺失的碱基与设计敲除的221 bp的碱基一致,说明缺失株构建成功.

图4 缺失株验证(M:DNA marker 2 000 bp;1:WT;2:Δ0087)
2.5 回补株0087+的筛选鉴定
关于回补株0087+的构建,结果如图5所示.筛选到的回补株0087+,扩增得到大小约为220 bp的特异性条带,与sRNA0087完整片段大小(222 bp)基本一致.利用TCBS培养基将回补株进一步分离纯化,挑取单菌落扩大培养,进行测序分析,发现回补片段碱基组成正确,证明回补株0087+构建成功.

图5 回补株验证(M:DNA marker 2000 bp;1:0087+)
2.6 sRNA0087对运动性的影响
溶藻弧菌WT、Δ0087和0087+的游动性和爬动性结果如图6所示.在琼脂含量分别为0.3%和1.5%的LBS平板上,溶藻弧菌游动以及爬动的距离均明显变小,说明sRNA0087的缺失造成了溶藻弧菌游动性和爬动性的减弱.另外,回补株0087+的爬动和游动能力较缺失株得到明显的增加,但仍然达不到野生株的水平.可见,sRNA0087对溶藻弧菌的运动性具有正向调控作用.

图6 运动性测定
2.7 sRNA0087对生物被膜的作用
结晶紫染色法对溶藻弧菌WT、突变株Δ0087和回补株0087+的生物被膜形成的检测结果如图7(a)所示.由图7(a)可知,溶藻弧菌WT、突变株Δ0087和回补株0087+都形成了生物被膜,但突变株Δ0087的生物被膜形成量显著降低,而回补株0087+的生物被膜形成能力较突变株有所增加,但仍然达不到野生株的水平.突变株Δ0087的生物被膜生成量为野生株的46.7%,而回补株0087+的生物被膜生成量达到野生株的78.7%(如图7(b)所示).可见,sRNA0087对溶藻弧菌生物被膜的形成具有促进作用.
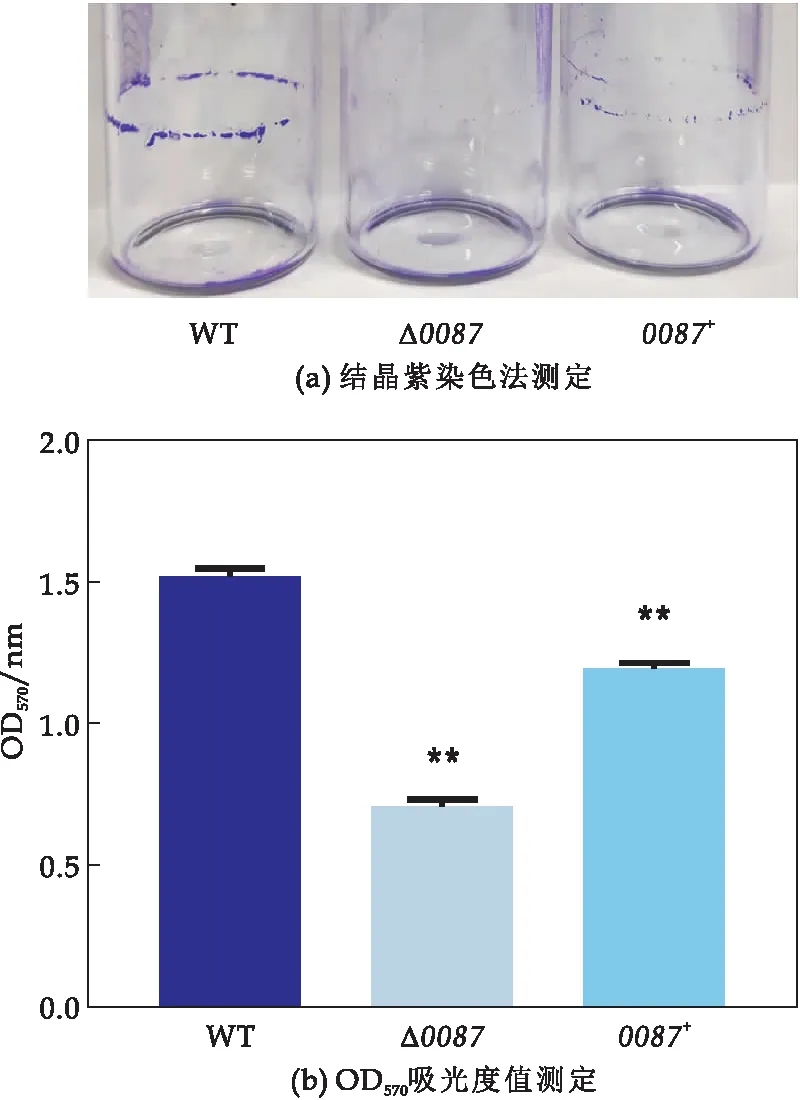
图7 野生株WT、突变株Δ0087和回补株0087+生物被膜测定
2.8 sRNA0087对胞外蛋白酶合成的影响
通过脱脂牛奶平板定性测定溶藻弧菌WT、突变株Δ0087和回补株0087+的胞外蛋白酶变化,结果如图8所示.突变株Δ0087菌落直径相对于野生株而言变小,且在其菌落四周并未形成肉眼可见的透明圈;回补株0087+能够形成与野生株几乎相同的透明圈,但其菌落直径小于野生株.由此可见,sRNA0087对溶藻弧菌胞外蛋白酶的合成具有正向调控作用.溶藻弧菌胞外蛋白酶、运动性以及生物被膜等均受到群体感应系统的影响,而sRNA0087作为一个高细胞密度下表达水平显著下调的sRNA分子,其是否通过与细胞密度响应调控系统-群体感应的相互作用而实现对溶藻弧菌毒力因子的影响,后续可进行深入研究.

图8 胞外蛋白酶测定
3 结论
通过高通量转录组测序及生物信息学方法,筛选出了表达差异显著的sRNA分子0087,发现其具有非常典型的二级结构,且其靶标mRNA有假定的三型分泌蛋白,核糖体小亚基依赖型ATP酶等.成功构建无标记的Δ0087缺失株和其回补株0087+.sRNA0087对溶藻弧菌运动性、生物被膜形成以及胞外蛋白酶的合成均具有正向的调控作用.本研究为溶藻弧菌的毒力调控机制带来了新思路,并进一步丰富了人们对该病原菌毒力调控系统的认识.
