基于RGB颜色空间评价马铃薯块茎绿化程度
2023-02-27鲍天旸刘建刚段绍光简银巧李广存金黎平徐建飞
王 硕 鲍天旸 刘建刚 段绍光 简银巧 李广存 金黎平 徐建飞
基于RGB颜色空间评价马铃薯块茎绿化程度
王 硕 鲍天旸 刘建刚 段绍光 简银巧 李广存 金黎平 徐建飞*
中国农业科学院蔬菜花卉研究所 / 农业农村部薯类作物生物学和遗传育种重点实验室, 北京 100081
马铃薯是世界上最重要的作物之一, 块茎作为马铃薯的商品器官, 块茎绿化严重影响马铃薯商品品质, 造成大量的资源浪费。建立一种方便快捷的块茎绿化评价方法, 对于马铃薯种质资源鉴定和块茎品质评价具有重要意义。本研究基于提取块茎颜色空间特征, 结合RGB颜色空间色差分析, 对15个马铃薯四倍体和二倍体品种(系)材料的绿化趋势和绿化程度进行了系统评价。供试材料块茎在25℃条件下, 125 µmol m–2s–1光照强度下, 中薯2号、中薯18号、中薯19号、Atlantic、Favorita和Kondor的绿化速度较快, HS66的绿化速度较慢。在光照处理9 d后, 块茎色差值趋于稳定, 在光照处理13 d后, 不同品种绿化程度差异明显, 其中Favorita的绿化程度最大, 中薯28号的绿化程度最小。本研究建立的基于RGB颜色空间的马铃薯块茎绿化评价方法能够准确区分不同品种(系)的绿化速度和绿化程度, 该方法简便、高效, 结果可靠, 为精准评价块茎绿化程度并进行相关分析提供了技术方法参考。
马铃薯; 块茎; 绿化; RGB颜色特征; 色差分析
马铃薯(L)是世界上仅次于水稻和小麦的第三大粮食作物, 其富含碳水化合物、蛋白质、矿物质和多种维生素, 是世界上10多亿人口的主要食物[1-2]。马铃薯块茎见光绿化, 会严重降低块茎的品质并且造成潜在的健康威胁。块茎见光绿化与叶绿素的积累和糖苷生物碱的合成有关。当暴露在光下时, 块茎周皮下方薄壁组织中大量淀粉体发育成叶绿体, 造成叶绿素的积累使块茎变绿[3-4], 因此大部分马铃薯品种见光后会变绿, 但是麻皮和色素沉着的块茎表皮会掩盖叶绿素的存在,光照后表皮色素强度增加, 最后颜色变暗[5]; 块茎绿化的同时, 也会伴随有毒物质糖苷生物碱的增加, 糖苷生物碱的合成和积累与叶绿素产生是相互独立的[4]。光照时间和强度会影响块茎绿化速度, 一般情况下, 延长暴露在光下的时间或者增加光照强度, 绿化速度加快[6]。块茎绿化降低了其商品品质, 造成了大量的资源浪费, 在美国块茎绿化每年造成14%~17%的马铃薯损失[7], 在南非农产品市场, 被收购商拒收的马铃薯中, 块茎绿化马铃薯占比达17%[4], 因此块茎绿化程度已经成为了马铃薯品质重要评价指标。
通过对块茎颜色进行分析, 可以评价块茎绿化程度。在马铃薯块茎绿化遗传分析时, 有研究者通过目测进行绿化分级[5,8], 但目测分级方法存在主观性或测试人个体颜色视觉敏感度差别。颜色是物体的重要特征之一, 颜色模型或者颜色空间可以描述色差现象, 其中, RGB模型是面向硬件的简单直观模型, 许多图像的处理都是此模型开发的[9], 在农业研究领域得到了广泛应用。RGB模型是通过对红、绿、蓝3个颜色通道的变化及叠加来得到各种颜色, 其中每个通道有8位共256个级别, 3个颜色的组合可以得到1600万种颜色, 几乎涵盖了所有能感知到的颜色[10]。可通过RGB模型进行苹果重量和糖度预测并进行分级[11], 对脱绒棉种质量与表面颜色特征的关系进行分析[12]。还可运用RGB颜色空间进行猪肉储藏时间的判定[13], 分析叶片颜色特征参数和叶绿素的相关性, 构建叶绿素SPAD估算模型并进行大豆叶片叶绿素含量预测[14]。在马铃薯块茎绿化研究中, 常通过测定不同处理条件下块茎的叶绿素含量, 进而分析块茎表皮绿化速度和程度[15], 或是对马铃薯表皮绿化进行简单肉眼颜色观察分级[16], 这2种方法虽然能够直观地评价块茎绿化, 但在具体评价过程中的取样、测定等操作中会产生较大误差, 加之工作量较大, 肉眼对于颜色相近的块茎难以精确辨别。有研究者以颜色特征分析为基础, 结合BP神经网络, 测定绿化区域的百分比[17], 基于饱和度灰度化的阈值分割方法对自然光下的马铃薯块茎进行检测分析[18], 同时, 利用计算机视觉系统对单个块茎样本图像进行研究, 提出了一种基于色度域划分的马铃薯绿化检测方法[19], 虽然这些方法能够精确地识别并区分块茎绿化, 但均使用了较复杂的仪器设备及算法, 难以在实际研究和生产中广泛运用。建立一个更加简便、高效、准确的块茎绿化测定方法, 对于马铃薯种质资源和块茎商品品质评价具有重要的应用价值。
基于视觉观察来判断马铃薯块茎的绿化速度和绿化程度并不精准, 而利用RGB模型来评价马铃薯绿化速度和绿化程度的研究尚未见报道。本研究通过RGB颜色空间距离分析, 分析了不同马铃薯材料块茎在恒定的光照条件下各时段块茎表皮颜色变化,建立了一个定量化、可操作性强和高效的马铃薯块茎绿化评价方法, 为精准鉴定评价马铃薯块茎绿化表型提供了方法基础。
1 材料与方法
1.1 供试材料与仪器
供试材料为中国农业科学院蔬菜花卉研究所保存的15个马铃薯品种(系), 其中包括中薯2号、中薯3号、中薯5号、中薯18号、中薯19号、中薯21号、中薯27号、中薯28号、Atlantic、Favorita、Kondor和Shepody等12个四倍体栽培品种(), HS66、CE125和RH89-039-16 (RH) 等 3个二倍体材料()。供试材料收获后遮光保存, 选取大小一致、无损伤和无病虫害的2个块茎进行光照处理和分析。同样方法, 各选取中薯2号、中薯3号、中薯5号、中薯18号、中薯19号、中薯21号、中薯27号、中薯28号、Atlantic、Favorita和Shepody等11个品种(系)的2个块茎用锡纸包裹进行同样条件下黑暗处理, 考察温度和贮藏时间对块茎绿化的影响。
使用的仪器设备为照度计(HIOKI)、智能光照培养箱(宁波江南仪器厂, GXZ型)、照相机(Canon Power Shot G10)、摄影棚(小丑鱼)和灰色背景板(深圳市金佳诚摄影器材有限公司, GC-1II)。
1.2 光照处理和图像采集
供试品种(系)块茎光照和黑暗处理之前, 将收获后一直遮光保存的块茎置于摄影棚背景板上进行照相, 背景板平均光照强度37.5 µmol m–2s–1左右, 将供试块茎均匀放置于培养箱的一层培养架上, 培养架4个角落和中心位置平均光照强度125 µmol m–2s–1左右, 光照培养箱24 h持续光照, 温度设置为25℃。供试块茎光照和黑暗处理24 h后, 进行摄影棚内照相, 之后原位返回光照箱, 每隔48 h进行照相, 块茎摄影棚背景板和光照箱培养架放置位置和方向保持不变, 共进行8次照相, 持续13 d。
1.3 颜色特征参数的提取及分析方法
运用软件Adobe Photoshop CC 2018进行块茎颜色特征值的提取[12,20]。块茎颜色特征参数的取值: 将照相机拍摄的照片导入电脑, 用Adobe Photoshop CC 2018打开块茎图像, 首先在工具栏中选择“快速选择工具”, 分别选择背景上的每一个块茎, 然后在菜单栏中打开“窗口”一栏中的直方图(Histogram), 分别选择红(R)、绿(G)、蓝(B)通道, 分别读取其特征值作为每个块茎的R、G、B值。背景板颜色特征参数的取值: 首先在工具栏中选择“矩形选框工具”, 设置为(宽度300像素和高度300像素)固定大小, 分别选择背景板上无阴影的4角, 然后在菜单栏中的“窗口”一栏直方图中读取相应的R、G、B值, 最后将背景板上4角R、G、B的均值作为该图像的背景R、G、B值。
应用RGB色差公式[21-22], 利用Microsoft Excel 2019和IBM SPSS Statistics 22对每幅图像中的2个块茎的绿化色差值相关性、每个品种(系)各时期的绿化色差值以及不同品种(系)之间的绿化程度进行统计分析。
RGB色差值计算公式:

式中, 2个空间颜色(x表示块茎, x表示背景), 坐标分别为(r,g,b), (r,g,b)。
式中, GE为绿化程度, Db为光照处理前色差值, Da为光照处理后色差值。
2 结果与分析
2.1 重复块茎间色差相关性
在整个光照处理时期内, 选取供试品种(系)光照处理1、7和13 d后图像, 进行同一品种(系) 2个块茎间色差相关性分析(表1)。1、7和13 d后2个块茎的相关性系数均达到极显著水平(<0.01), 表明在不同的光照处理周期, 同一品种(系)的2个块茎的色差重复性好, 光照处理和选取块茎误差较小。

表1 2个块茎之间的相关性分析
**表示在0.01概率水平相关显著。**indicates a significant correlation at the 0.01 probability level.
2.2 块茎色差变化趋势
以块茎光照处理之前的状态作为对照, 对不同时期不同品种(系)块茎色差进行分析(图1)。结果表明, 虽有个别品种(系)在整个阶段中会出现某个时期色差的微小波动, 随着光照处理时间延长, 供试品种(系)的块茎色差值整体上都呈现出逐渐降低并且趋于稳定的趋势。供试品种(系)块茎在黑暗处理下,各品种(系)的2个块茎的色差值变化趋于一致, 重复性好, 且各供试品种(系)的块茎色差值从黑暗处理开始到结束变化较小, 同时各品种(系)在不同黑暗处理时期的块茎图像在颜色上变化较小, 与色差值变化趋势一致(数据未列出)。
对供试品种(系)在不同光照处理时间的色差值进行差异显著性分析(表2)发现, 不同品种(系)在不同阶段色差值差异程度不同, 其中, 中薯2号、中薯18号、中薯19号、Atlantic、Favorita和Kondor在光照1 d后, 色差出现了显著降低; 中薯3号、中薯5号、中薯21号、中薯27号、中薯28号、CE125、RH和Shepody在光照3 d后, 色差值显著降低; HS66在光照11 d后, 色差显著降低。光照后不同品种(系)色差值趋于稳定的时间不同, 其中, 中薯3号、中薯18号、中薯21号、Atlantic、RH和Shepody在光照处理3 d后色差值趋于稳定; 中薯2号、中薯5号、中薯27号、CE125、Favorita和Kondor在光照处理5 d后色差趋于稳定; 中薯19号在光照处理7 d后色差趋于稳定; 中薯28号在光照处理9 d后色差趋于稳定。
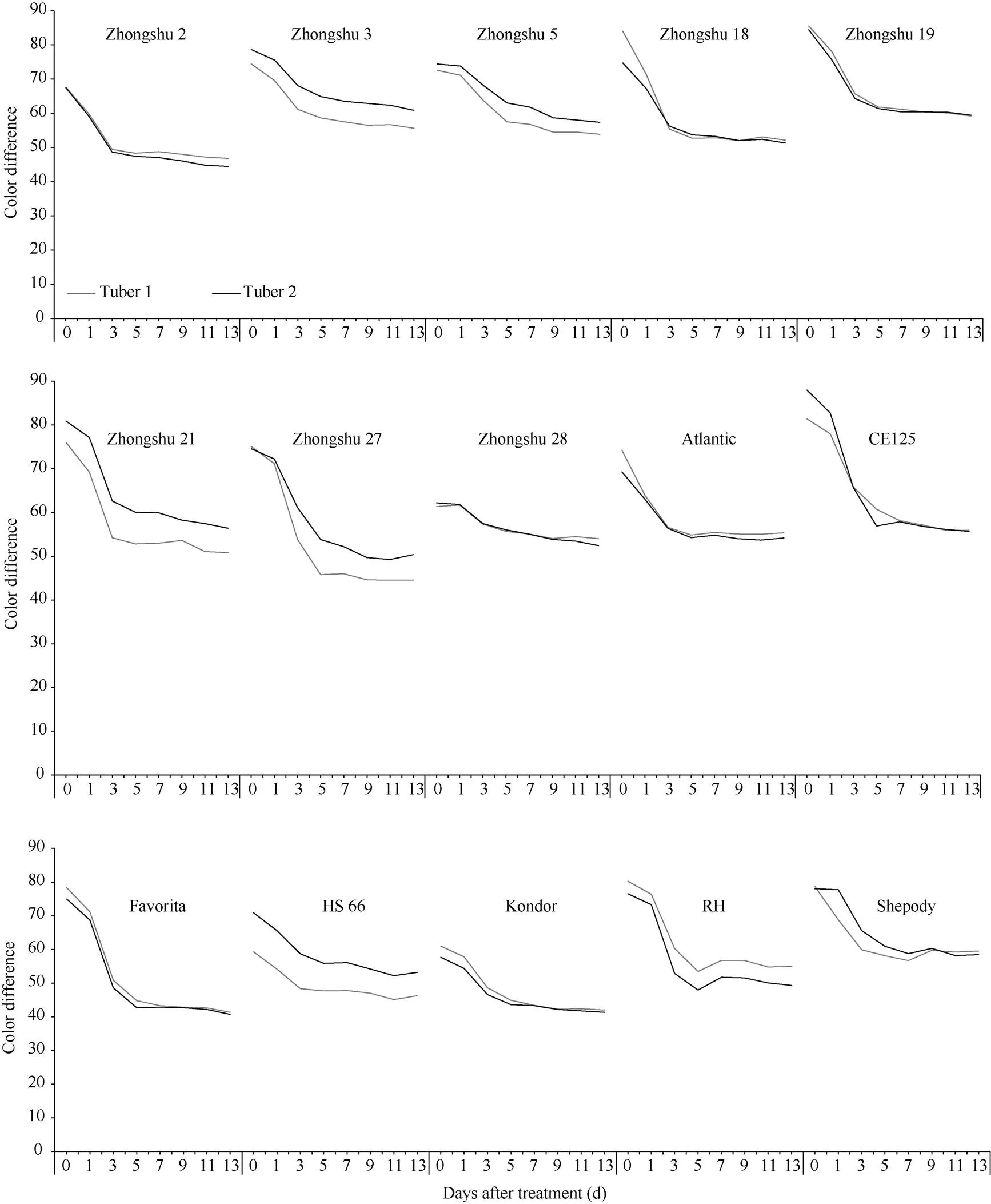
图1 不同品种(系)的色差变化趋势
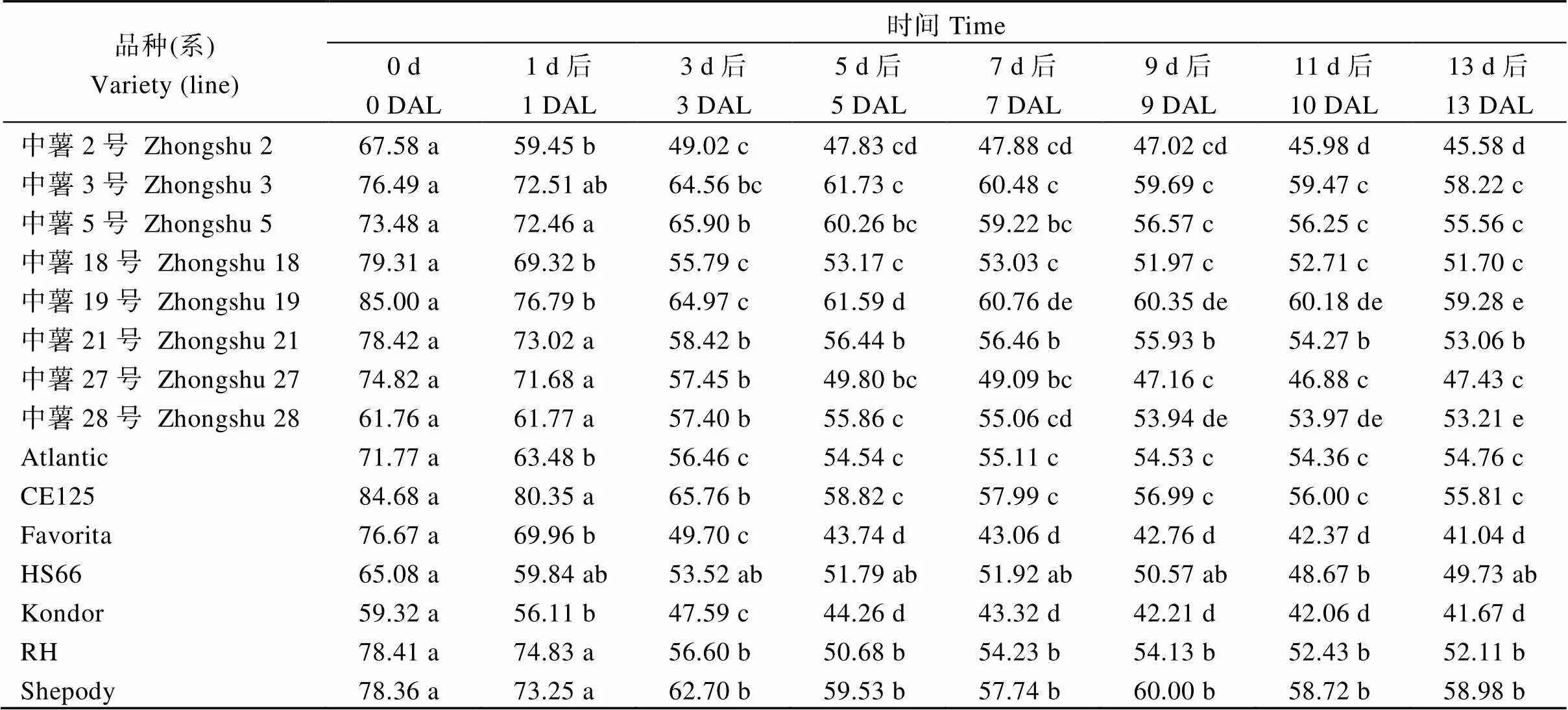
表2 供试品种(系)不同光照处理时间的块茎色差
DAL: 光照处理天数; Duncan’s检测, 不同小写字母表示在0.05概率水平差异显著。
DAL: days after light treatment. Duncan’s test. Different lowercase letters indicate significant differences at the 0.05 probability level.
2.3 品种(系)绿化程度
对供试品种(系)光照处理前和光照处理13 d后的块茎绿化程度进行分析(图2)发现, 15个供试品种(系)中, Favorita的绿化程度最高, 显著高于其他品种(系), 中薯28号的绿化程度最小, 显著低于其他品种(系); 中薯27号、中薯18号、CE125、RH、中薯2号、中薯21号、中薯19号的绿化程度相对于Favorita显著减小, 但这7个品种(系)之间的颜色变化程度无显著差异; Kondor的绿化程度显著低于中薯27号, 但与Shepody、中薯5号、中薯3号、Atlantic、HS66绿化程度无显著差异。以块茎色差值计算的各品种(系)块茎绿化程度与肉眼观察的块茎绿化程度保持一致(图3)。
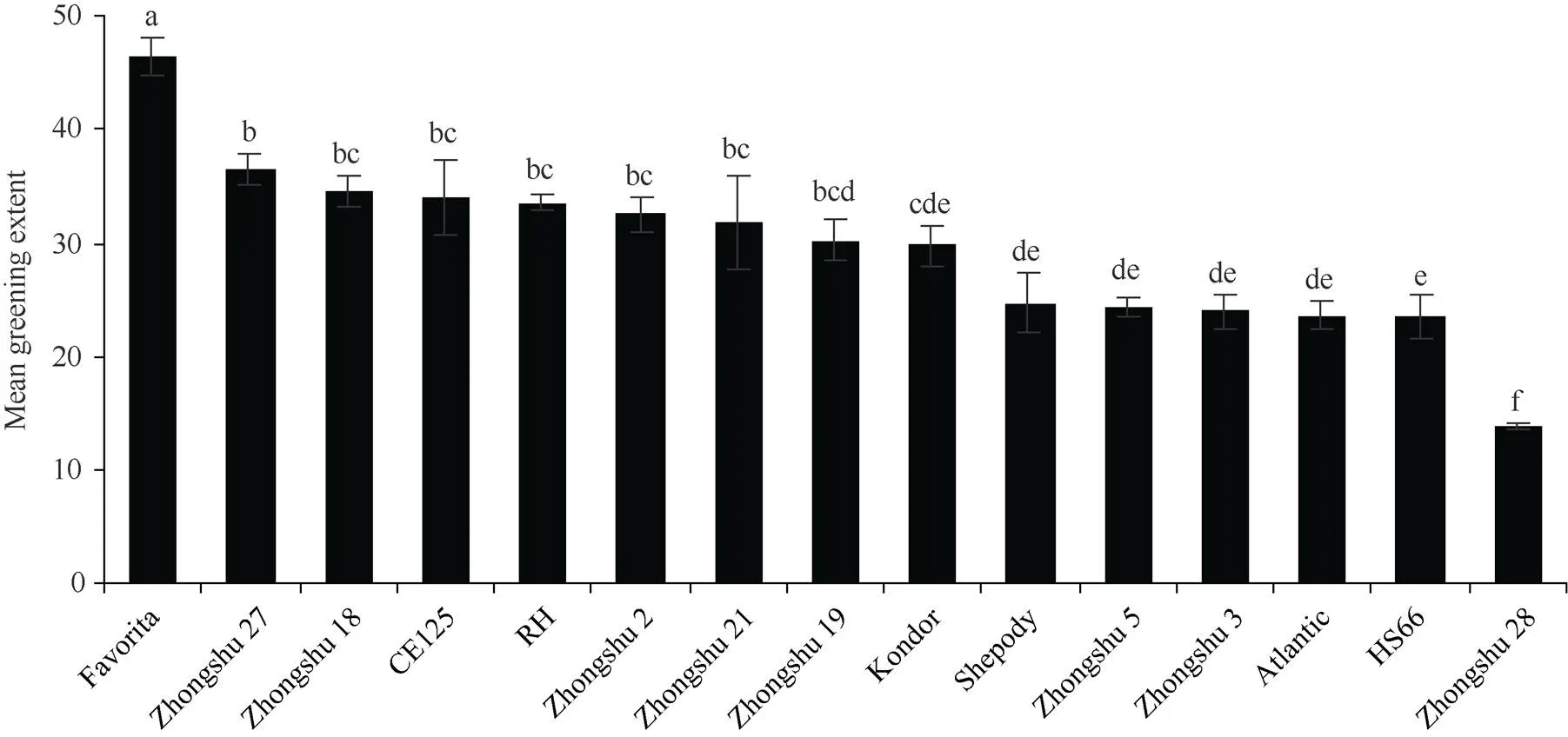
图2 不同品种(系)间的绿化程度差异
采用Duncan’s检验, 图中误差线表示标准误, 不同小写字母表示在0.05概率水平差异显著。
Duncan’s test is used for data analysis and error bars in the figure indicate standard error. Different lowercase letters indicate significant differences at the 0.05 probability level.
3 讨论
马铃薯块茎的绿化程度和速度会受到光照和温度等环境条件的影响, 因此, 块茎的绿化在块茎发育期间及收获、运输、贮藏、加工等产业链阶段均可能发生。马铃薯在全球的贸易中具有相当大的份额, 中国又是世界上最大的马铃薯生产国, 建立一种可操作性强的块茎绿化鉴定评价方法对于品种的鉴定评价具有重要意义。本试验利用光照培养箱在25℃和125 µmol m–2s–1连续光照条件下对15个品种(系)块茎进行绿化处理, 应用RGB颜色空间计算块茎色差值发现, 重复块茎间色差值具有显著的相关性, 供试品种(系)在光照处理9 d后, 块茎绿化程度趋于稳定, 在光照处理13 d后, Favorita的绿化程度最大并显著高于其他品种(系), 中薯28号的绿化程度最小并显著低于其他品种(系), 基于RGB颜色空间的块茎绿化评价能客观反映肉眼绿化观测结果。

图3 供试品种(系)块茎绿化程度变化
DAL: 光照处理天数。DAL: days after light treatment.
光照强度、持续时间以及温度和薯皮颜色都会对块茎绿化的过程产生影响。本研究结果显示, 在相同的光照处理下, 不同品种(系)的2个重复块茎之间RGB色差值显著相关, 表明同一基因型的不同块茎之间的绿化趋势及程度是一致的, 具有良好的生物学重复。黑暗处理下的各供试品种(系)的2个块茎色差值具有一致的变化趋势, 各品种(系)在黑暗处理前后各个时期的色差值和颜色有微小波动, 推测造成微小波动的原因是试验期间照相操作引起了色差值和块茎颜色的微小变化。前人在不同的条件下, 进行过绿化程度和稳定时间评价, Olsen等[23]在22℃、17.38 µmol m–2s–1和16.25 µmol m–2s–1条件下每天光照22 h, 在第0天到第9天时评价了不同光源对块茎绿化的影响, 董田田等[24]在20℃、7.5 µmol m–2s–1条件下24 h持续光照, 从光照0 d至8 d研究了NaCl处理后对块茎绿化的影响, 也有研究者通过对叶绿素含量的测定来研究块茎绿化速度和程度, 发现块茎绿化速度和程度会随着光照时间的延长而增加, 但最终逐渐趋于平稳[15]。本研究对光照0~13 d的块茎绿化评价后发现, 在25℃和125 µmol m-2s-1光照9 d后, 不同品种(系)的块茎的绿化程度都趋于稳定, 这可为评价块茎绿化的光照处理时间提供参考和依据。马铃薯薯皮颜色类型对块茎绿化的程度具有一定的影响, Reeves[5]在块茎绿化的品种差异比较中显示, 部分品种见光会变成棕色或者紫色, 红皮块茎的绿化程度较小, 本研究中薯28和Kondor薯皮为红色, 其余品种(系)的薯皮颜色为黄色或浅黄色, 表明中薯28号的绿化程度最小, HS66和Kondor相对其他黄皮品种(系)绿化程度也较小, HS66薯皮颜色为黄褐色。
基于RGB颜色空间进行马铃薯块茎绿化分析, 方法简便, 易于操作, 结果可靠。有研究者将块茎绿化程度分为5个等级, 进行人为肉眼评定[24], 也有人根据目测挑选各个光照处理时期典型块茎, 划分绿化程度等级, 并使用色度仪测量块茎颜色[25], Olsen等[23]使用Grunenfelder等[25]的方法, 对马铃薯去皮薯肉进行了绿化程度评级。目测评价块茎绿化程度虽然操作简便, 但人为主观影响较大, 研究者也尝试使用仪器设备进行绿化评价, 如利用计算机视觉与感知机器学习算法区分正常块茎与绿化块茎[26], 运用了计算机视觉结合相关算法来检测块茎表皮的绿化缺陷[17,19], 这些方法都是光学仪器设备结合计算机算法进行绿化块茎区分和筛选, 并不能够将绿化速度与绿化程度都鉴别出来, 且应用简易设备对块茎绿化程度的评价方法较少。本研究利用简易仪器设备通过提取块茎与背景板的RGB特征值, 转化为色差值和绿化程度数值量化评价块茎绿化, 可将不同品种(系)的绿化程度进行有效区分, 且与肉眼观察到的结果保持一致, 相比于人为肉眼鉴定更为准确可靠。对不同时期的块茎进行图像的采集, 可以将处理时间缩短, 同时也可以省略叶绿素含量测定, 减少试验误差与工作量, 提高鉴定精度和效率。结合RGB颜色空间对块茎图像进行色差分析, 不需要复杂的算法及仪器设备, 将块茎绿化程度数值量化, 方法简单, 可操作性强, 可在实际研究和生产中广泛运用, 为精准评价马铃薯块茎绿化表型提供了方法参考。
本研究中, 随着光照处理时间延长, 不同品种(系)的色差值都呈逐渐减小的趋势, 但在某个阶段会出现微小色差波动, 试验操作中一些因素可能会对RGB特征值产生影响。首先, 供试的块茎须清洗干净, 表皮的泥土杂质会影响图像色差值; 其次, 不同时期光照处理和照相时, 块茎放置在光照箱培养架和摄影棚背景板上的位置应尽可能保持一致, 由于供试品种(系)不同, 块茎的形状大小各异, 加之光照箱和摄影棚内各位置光照强度难以保持绝对一致, 会造成块茎色差值偏差。
4 结论
供试材料块茎在25℃和125 µmol m–2s–1光照强度下进行处理, 同一品种(系)的不同块茎色差值重复性好, 在处理9 d后, 块茎色差值趋于稳定。不同品种(系)绿化程度具有明显差异, 其中Favorita的绿化程度最大, 中薯28号的绿化程度最小, 利用色差值计算的块茎绿化程度与肉眼观察的绿化程度相一致。本文建立了一种基于RGB颜色空间的简便、高效、可靠的马铃薯块茎绿化评价方法。
[1] Hameed A, Mehmood M A, Shahid M, Fatma S, Khan A, Ali S. Prospects for potato genome editing to engineer resistance against viruses and cold-induced sweetening., 2020, 11: 185–205.
[2] 徐建飞, 金黎平. 马铃薯遗传育种研究: 现状与展望. 中国农业科学, 2017, 50: 990–1015.
Xu J F, Jin L P. Advances and perspectives in research of potato genetics and breeding., 2017, 50: 990–1015 (in Chinese with English abstract).
[3] Muraja-Fras J, Krsnik-Rasol M, Wrischer M. Plastid transformation in greening potato tuber tissue., 1994, 144: 58–63.
[4] Tanios S, Eyles A, Tegg R, Wilson C. Potato tuber greening: a review of predisposing factors, management and future challenges., 2018,95: 248–257.
[5] Reeves A F. Varietal differences in potato tuber greening., 1988, 65: 651–658.
[6] Tanios S, Eyles A, Corkrey R, Tegg R S, Thangavel T, Wilson C R. Quantifying risk factors associated with light-induced potato tuber greening in retail stores., 2020, 15: e0235522.
[7] Grunenfelder L A, Knowles L O, Hiller L K, Knowles N R. Glycoalkaloid development during greening of fresh market potatoes (L.)., 2006, 54: 5847–5854.
[8] Jakuczun H, Zimnoch-Guzowska E. Inheritance of tuber greening under light exposure in diploid potatoes., 2006, 83: 211–221.
[9] 贾渊, 姬长英. 农产品自动检测中的常见颜色模型. 农机化研究, 2004, (4): 205–208.
Jia Y, Ji C Y. Some common color models in automatic detection of agricultural products., 2004, (4): 205–208 (in Chinese with English abstract).
[10] Belati A, Cajaiba J. Measurement of wax appearance temperature using RGB image analysis and FBRM., 2018, 220: 264–269.
[11] 郭俊先, 李俊伟, 胡光辉, 刘军, 虞飞宇. 新疆冰糖心红富士苹果RGB图像多指标分析. 新疆农业科学, 2013, 50: 509–517.
Guo J X, Li J W, Hu G H, Liu J, Yu F Y. Analysis of multi-objective of Xinjiang Fuji apple by RGB image., 2013, 50: 509–517 (in Chinese with English abstract).
[12] 张若宇, 坎杂, 马蓉, 曹卫彬, 李江波. 基于RGB模型的脱绒棉种颜色特征与发芽状况的关系. 农业工程学报, 2010, 26(10): 172–177.
Zhang R Y, Kan Z, Ma R, Cao W B, Li J B. Relationship between color features and germination of delinted cottonseed based on RGB color model., 2010, 26(10): 172–177 (in Chinese with English abstract).
[13] 李文采, 李家鹏, 田寒友, 邹昊, 刘飞, 白京, 张振琪, 王辉, 王守伟. 基于RGB颜色空间的冷冻猪肉储藏时间机器视觉判定. 农业工程学报, 2019, 35(3): 294–300.
Li W C, Li J P, Tian H Y, Zou H, Liu F, Bai J, Zhang Z Q, Wang H, Wang S W. Determination of storage times for chilled pork using RGB color space method based on machine vision., 2019, 35(3): 294–300 (in Chinese with English abstract).
[14] 宋一帆, 张武, 姚雨晴, 洪迅, 张嫚嫚, 刘连忠. 基于RGB模型的大豆叶片叶绿素含量预测. 江汉大学学报(自然科学版), 2020, 48(1): 65–72.
Song Y F, Zhang W, Yao Y Q, Hong X, Zhang M M, Liu L Z. Estimation of chlorophyll content in soybean leaves based on RGB model.(Nat Sci Edn), 2020, 48(1): 65–72 (in Chinese with English abstract).
[15] 李梅, 田世龙, 颉敏华, 李守强, 冯焕德, 刘刚. 不同颜色PE食品包装袋对马铃薯绿化和龙葵素含量的影响. 食品科学, 2010, 31(4): 264–267.
Li M, Tian S L, Xie M H, Li S Q, Feng H D, Liu G. Effect of different color polyethylene food packaging bags on greening and steriodal glycoalkaloids content of potatoes., 2010, 31(4): 264–267 (in Chinese with English abstract).
[16] 霍权恭, 范璐. 储藏条件对马铃薯品质的影响. 河南工业大学学报(自然科学版), 2005, 26(6): 47–49.
Huo Q G, Fan L. Effects of storage condition on the potato quality.(Nat Sci Edn), 2005, 26(6): 47–49 (in Chinese with English abstract).
[17] 杨冬风, 陈争光.基于颜色特征的马铃薯绿皮检测. 黑龙江八一农垦大学学报, 2011, 23(1): 83–87.
Yang D F, Chen Z G. Greened surface detection of potatoes based on color character., 2011, 23(1): 83–87 (in Chinese with English abstract).
[18] 曾嵘, 陆玲, 吕牡丹. 自然光下绿皮马铃薯的检测. 电脑知识与技术, 2016, 12(24): 191–193.
Zeng R, Lu L, Lyu M D. Detection of greened potatoes under natural light., 2016, 12(24): 191–193 (in Chinese).
[19] 虞晓娟, 廖桂平, 李锦卫, 金晶.基于色度域划分的马铃薯绿皮检测方法. 农业工程学报, 2009, 25(增刊2): 314–319.
Yu X J, Liao G P, Li J W, Jin J. Greened potatoes detection based on hue threshold division.,2009, 25(S2): 314–319 (in Chinese with English abstract).
[20] 张京平, 彭争, 汪剑. 苹果水分与CT值相关性的研究. 农业工程学报, 2003, 19(2): 180–182.
Zhang J P, Peng Z, Wang J. Correlation between moisture of apples and values of CT., 2003, 19(2): 180–182 (in Chinese with English abstract).
[21] 顿绍坤, 魏海平, 孙明柱. RGB颜色空间新的色差公式. 科学技术与工程, 2011, 11: 1833–1836.
Dun S K, Wei H P, Sun M Z. A new distance color difference formula in RGB color space., 2011, 11: 1833–1836 (in Chinese with English abstract).
[22] 杨振亚, 王勇, 杨振东, 王成道. RGB颜色空间的矢量-角度距离色差公式. 计算机工程与应用, 2010, 46(6): 154–156.
Yang Z Y, Wang Y, Yang Z D, Wang C D. Vector-angular distance color difference formula in RGB color space., 2010, 46(6): 154–156 (in Chinese with English abstract).
[23] Olsen N L, Brandt T, Price W J. The impact of retail light source on greening of russet burbank potato tubers., 2018, 95: 123–129.
[24] 董田田, 孟卫芹, 王庆国. NaCl胁迫处理对采后马铃薯见光绿变的影响. 中国农学通报, 2018, 34(21): 29–34.
Dong T T, Meng W Q, Wang Q G. Effect of NaCl stress on greening of postharvest potatoes under light., 2018, 34(21): 29–34 (in Chinese with English abstract).
[25] Grunenfelder L, Hiller L K, Knowles N R. Color indices for the assessment of chlorophyll development and greening of fresh market potatoes., 2006, 40: 73–81.
[26] 向静, 何志良, 汤林越, 熊俊涛. 结合计算机视觉的马铃薯外部品质检测技术. 计算机工程与应用, 2018, 54(5): 165–169.
Xiang J, He Z L, Tang L Y, Xiong J T. Research of potato quality detection technology based on computer vision., 2018, 54(5): 165–169 (in Chinese with English abstract).
Potato tuber greening evaluation based on RGB color space
WANG Shuo, BAO Tian-Yang, LIU Jian-Gang, DUAN Shao-Guang, JIAN Yin-Qiao, LI Guang-Cun, JIN Li-Ping, and XU Jian-Fei*
Institute of Vegetables and Flowers, Chinese Academy of Agricultural Sciences / Key Laboratory of Biology and Genetic Improvement of Tuber and Root Crops, Ministry of Agriculture and Rural Affairs, Beijing 100081, China
Potato is one of the most important crops in the world. Tuber is the commercial product of potato, whereas tuber greening seriously affects product quality and results in a large amount of potatoes waste. It is very necessary to establish a convenient evaluation method of tuber greening for the identification of potato germplasm resources and the analysis of tuber quality. In this study, we systematically evaluated the greening trend and greening degree of 15 potato tetraploid and diploid varieties (lines) base on the extraction of tuber color space characteristics and RGB color space color difference. Zhongshu 2, Zhongshu 18, Zhongshu 19, Atlantic, Favorita, and Kondor appeared faster greening speed, but HS66 appeared slower greening speed under 25℃ and 125 µmol m-2s-1. Color difference value of tubers of all potato varieties (lines) tended to the stability after 9 days lighting treatment. There was an obvious greening extent differences among potato varieties (lines). Among them, the afforestation degree of Favorita was the highest, whereas Zhongshu 28 was the lowest after 13 days lighting treatment. The method established in this study can accurately distinguish the greening speed and the extent of different varieties (lines), which provided a convenient and reliable technical reference for tuber greening evaluation.
potato; tuber; greening; RGB color features; color difference analysis
10.3724/SP.J.1006.2023.24078
本研究由宁夏回族自治区农业育种专项(2019NYYZ01-1)和财政部和农业农村部国家现代农业产业技术体系建设专项(CARS-09)资助。
This study was supported by the Agricultural Breeding Project of Ningxia Hui Autonomous Region, China (2019NYYZ01-1) and the China Agriculture Research System of MOF and MARA (CARS-09).
徐建飞, E-mail: xujianfei@caas.cn
E-mail: wangshuo202099@163.com
2022-04-02;
2022-09-05;
2022-09-15.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220915.0854.004.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
