甘蓝型油菜长链烷烃合成相关基因的克隆及其与BnCER1-2的互作
2023-02-27柏成成姚小尧王雨璐王赛玉李金莹蒋有为靳舒荣陈春杰魏星玥徐新福李加纳
柏成成 姚小尧 王雨璐 王赛玉 李金莹 蒋有为 靳舒荣 陈春杰 刘 渔 魏星玥 徐新福 李加纳 倪 郁
甘蓝型油菜长链烷烃合成相关基因的克隆及其与BnCER1-2的互作
柏成成**姚小尧**王雨璐 王赛玉 李金莹 蒋有为 靳舒荣 陈春杰 刘 渔 魏星玥 徐新福 李加纳 倪 郁*
西南大学农学与生物科技学院 / 西南大学农业科学研究院, 重庆 400716
长链烷烃是甘蓝型油菜角质层蜡质的优势组分, 在阻止植株的非气孔性水分散失中起主要作用。BnCER1-2催化甘蓝型油菜长链烷烃的生物合成, 但BnCER1-2是否通过与其他蛋白互作调控长链烷烃合成还不清楚。前期通过甘蓝型油菜蜡质差异材料转录组筛选获得4个长链烷烃合成相关基因、、、。本研究克隆了这4个基因的编码序列, 序列分析表明BnCER3.a10/c02和BnCER1-L2.a05前体蛋白具有典型的脂肪酸羟化酶与WAX2 C末端结构域, 而BnCYTB5B.c09具有Cyt_B5蛋白家族保守结构域。亚细胞定位结果表明, BnCER3.a10/c02、BnCYTB5B.c09和BnCER1-L2.a05均定位于细胞内质网, 与BnCER1-2共定位。双分子荧光互补(bimolecular fluorescent complementation, BiFC)与萤火素酶互补试验(luciferase complementation assay, LCA)检测结果表明, BnCER3.a10、BnCYTB5B.c09、BnCER1-L2.a05与BnCER1-2蛋白存在相互作用, 而BnCER3.c02与BnCER1-2蛋白不互作。实时荧光定量PCR结果显示, 与的表达模式一致,和主要在甘蓝型油菜茎/叶中表达, 并受干旱胁迫诱导显著上调。在NaCl与低温胁迫下表达量显著减少, 其中受MeJA、ACC诱导显著下调,表达受ABA诱导上调。在花中的表达量最高, 在茎和叶片中的表达量最低, 在干旱、低温及NaCl胁迫下转录水平均显著下降, 其中SA诱导表达上调, 而MeJA诱导其表达下调。蜡质差异材料荧光定量PCR结果证实,与在高蜡(烷)油菜中的表达量显著高于低蜡(烷)油菜, 而则呈相反变化。综合分析认为, BnCER3.a10和BnCYTB5B.c09可能通过与BnCER1-2互作而促进甘蓝型油菜长链烷烃的生物合成, BnCER1-L2.a05可能通过与BnCER1-2互作负调控长链烷烃的合成。
甘蓝型油菜; 角质层蜡质; 蛋白互作; 长链烷烃
甘蓝型油菜(L.)是全球最重要的油料作物之一, 目前已发展成为集油用、能源、菜用、饲用、绿肥、蜜源和观花于一身的多功能作物。然而在许多国家和地区, 干旱严重降低了甘蓝型油菜的产量和种植分布[1-2]。植物角质层蜡质是植物抵御外界环境胁迫的第一层屏障, 具有多种生理和生态功能, 例如限制植物非气孔性水分散失[3-4]、防止外源病虫害侵入[5-6]、阻挡紫外线辐射[7-8]、以及降低灰尘和空气中的污染物在植物表面的沉积等[9-10]。长链烷烃是甘蓝型油菜叶角质层蜡质的主要组分, 占蜡质总量的50%以上[11]。已被证明在甘蓝型油菜长链烷烃生物合成中起作用, 并主要负责C29烷的生物合成[12]。拟南芥中, CER1需要伙伴蛋白来发挥其活性, 其中CER3、CER1-LIKE1 (CER1-L1)和定位于内质网的细胞色素B5亚型(CYTB5B)被证明与CER1互作调控拟南芥长链烷烃的生物合成[13-14]。前期转录组测序结果发现,、的油菜同源基因、与共表达, 且在甘蓝型油菜低蜡(烷)材料中显著下调[15], 暗示了这几个基因编码的蛋白可能与BnCER1-2互作调控甘蓝型油菜长链烷烃的合成。拟南芥()与、同属一个基因家族, 但在拟南芥各组织器官中未检测到其表达[16], 而我们转录组测序结果表明,的油菜同源基因在低蜡(烷)油菜中显著上调[15], 暗示其可能参与了油菜的蜡质合成。
本研究从甘蓝型油菜中克隆了、、基因, 亚细胞定位结果表明它们与BnCER1-2共定位; 利用双分子荧光互补(bimolecular fluorescent complimentary, BiFC)与萤火素酶互补试验(luciferase complementation assay, LCA)验证了BnCER1-2与BnCER3.a10、BnCYTB5B.c09、BnCER1-L2.a05蛋白相互作用, 并利用荧光定量PCR技术对互作基因的表达模式进行了分析, 研究结果为进一步解析甘蓝型油菜长链烷烃的生物合成以及基因的调控网络奠定基础。
1 材料与方法
1.1 植物材料与菌株
甘蓝型油菜中双11号(Zhongshuang 11, ZS11)、低蜡(烷)油菜NoWax、本氏烟草由西南大学油菜工程中心提供。采集甘蓝型油菜ZS11的根、茎、叶、花、角果以及NoWax材料的叶片, 储存于–80℃, 用于RNA提取。大肠杆菌()菌株DH5α感受态购自北京全式金生物技术有限公司。根癌农杆菌菌株GV3101购买自上海唯地生物技术有限公司。
1.2 激素及胁迫处理
将ZS11幼苗放在组织培养瓶中进行溶液培养(1/10的MS溶液配制: 1 L培养液中含MS培养基基盐0.474 g L–1, 蔗糖3 g L–1, MES 0.05 g L–1, 调节pH为5.7, 121℃高温灭菌15 min, 稀释10倍后使用), 放置在人工气候室中(昼夜温度22℃/20℃、光照周期8 h/16 h), 待幼苗长至5片真叶时, 分别进行激素、盐胁迫与干旱胁迫处理。激素处理: 分别将水杨酸(salicylic acid, SA)、茉莉酸甲酯(methyl jasmonic acid, MeJA)、脱落酸(abscisic acid, ABA)及乙烯合成促进剂1-氨基环丙烷-1-羧酸(1-aminocyclopropanecarboxylic acid, ACC)加入到培养液中, 使其终浓度分别为200 μmol L–1、100 μmol L–1、20 μmol L–1、200 μmol L–1, 处理6 h后取样; 盐胁迫处理: 用100 mmol L–1NaCl溶液分别处理6 h、12 h; 干旱胁迫处理: 将幼苗分别暴露在空气中6 h、12 h; 低温胁迫处理: 将幼苗放在冷室(4℃)中12 h、24 h。处理结束后, 取上述材料保存于–80℃, 用于RNA提取。每处理3个重复。
1.3 总RNA提取和cDNA合成
采用TRIzol (TaKaRa)试剂按照说明书提取样品总RNA, DNase I (TaKaRa)消化去除基因组DNA。使用Nanodrop (Thermo Scientific, 美国)测定RNA浓度后, 依照TransScript First-Strand cDNA Synthesis SuperMix反转录试剂盒(北京全式金生物技术有限公司)操做指南将RNA反转录成cDNA。
1.4 基因克隆与生物信息学分析
根据甘蓝型油菜、、序列设计引物, 在上下游引物中分别引入BiFC (表1)和LCA载体的同源序列(表2), 用于后期利用同源重组方法进行克隆; 同时引入酶切位点用于后期验证。以甘蓝型油菜cDNA为模板, 按照TransStart Fast Pfu DNA Polymerase试剂盒说明进行PCR扩增。PCR反应程序参数设置为: 预变性95℃ 2 min; 变性95℃ 20 s, 退火55℃ 20 s, 延伸72℃ 1 min, 30个循环; 终延伸72℃ 5 min。扩增得到序列胶回收后与载体(pMD-19T Vector)连接, 转化α感受态, 筛选阳性克隆并测序。

表1 BiFC重组载体构建引物
双下画线为酶切位点, 单下画线为载体重组序列。
The restriction enzyme site is double underlined, and the DNA recombination sequences of the vector is single underlined.

表2 LCA重组载体构建引物
双下画线为酶切位点, 单下画线为载体重组序列。
The restriction enzyme site is double underlined, and the DNA recombination sequences of the vector is single underlined.
利用NCBI (https://www.ncbi.nlm.nih.gov/)在线工具、Vector NTI Advance 11.5、以及MEGA 7.0软件进行序列比对与进化树分析, 在InterPro (http:// www.ebi.ac.uk/interpro/)上进行蛋白质保守域、功能域分析。
1.5 亚细胞定位
以甘蓝型油菜ZS11的cDNA为模板, 利用带有限制性内切酶R I、H I位点的引物(表3)扩增目的基因编码区, 采用同源重组的方法将其与线性化的亚细胞定位载体pEGAD连接, 构建重组质粒, 测序验证后将重组质粒转入农杆菌并注射烟草, 注射后的烟草覆膜黑暗培养2 d, 利用激光共聚焦显微镜观察GFP信号并照相。
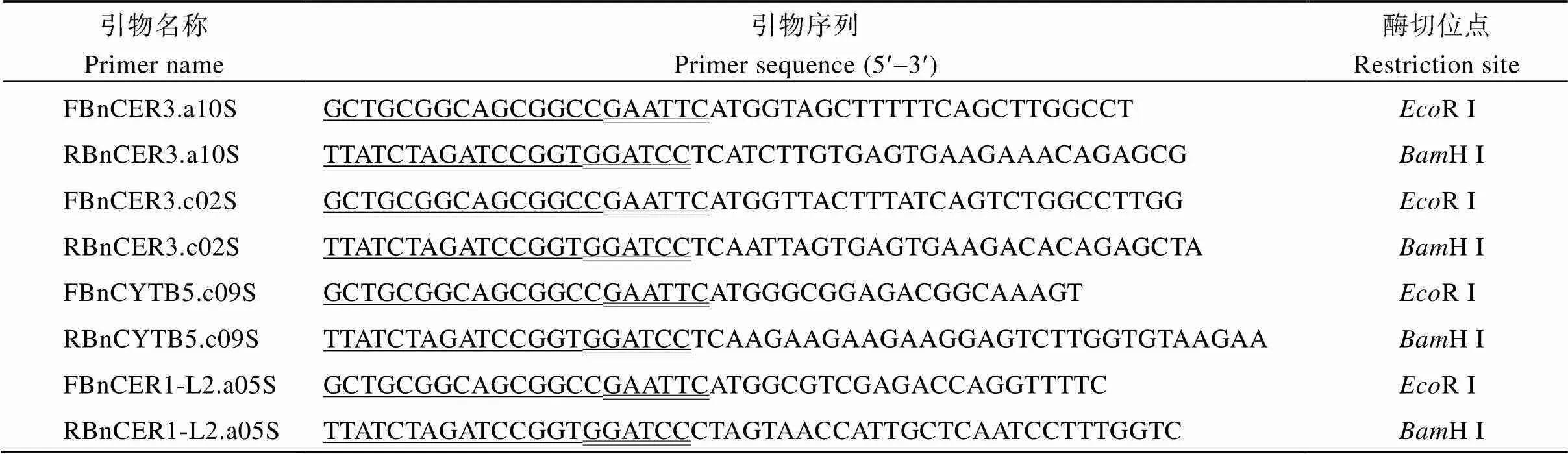
表3 亚细胞定位引物
双下画线为酶切位点, 单下画线为载体重组序列。
The restriction enzyme site is double underlined, and the DNA recombination sequences of the vector pEGAD is single underlined.
1.6 BiFC检测BnCER1-2与候选蛋白的互作
利用限制性内切酶I、I对nYFP载体pC1300-YN-OsHAL3进行双酶切, 按照ClonEXPress II One Step Cloning Kit试剂盒操作说明, 将胶回收线性化载体与经测序验证后的连接; 利用限制性内切酶I、I对cYFP载体pC2300-OsHAL3-YC进行双酶切, 按同样方法分别与/、和相连接; 构建好的5个重组质粒经酶切和测序验证后分别命名为: pC1300-YN- BnCER1-2、pC2300-BnCER3.a10-YC、pC2300- BnCER3.c02-YC、pC2300-BnCYTB5B.c09-YC、pC2300-BnCER1-L2.a05-YC。
以检测BnCER3.a10和BnCER1-2的互作为例, 将构建好的重组质粒转化农杆菌, 然后将pC1300- YN-BnCER1-2 + pC2300-BnCER3.a10-YC菌液等体积混匀后注射烟草, 同时分别以pC1300-YN- OsHAL3 + pC2300-OsHAL3-YC菌液共侵染烟草作为阳性对照, pC1300-YN-OsHAL3 + pC2300-BnCER3. a10-YC、pC1300-YN-BnCER1-2 + pC2300-OsHAL3- YC为阴性对照, 保湿黑暗处理2 d后在激光共聚焦显微镜下观察。其余候选蛋白与BnCER1-2的BiFC互作检测方法同上。
1.7 LCA检测BnCER1-2与候选蛋白的互作
利用I与I分别对LCA载体pC1300-Nluc、pC1300-Cluc进行双酶切, 按照ClonEXPress II One Step Cloning Kit试剂盒操作说明, 将胶回收线性化载体与经测序验证后的目的基因进行连接, 转化感受态大肠杆菌DH5α。经酶切和测序验证后, 构建好的5个重组质粒分别命名为: pC1300-Nluc-BnCER1-2、pC1300-BnCER3.a10-Cluc、pC1300-BnCER3.c02-Cluc、pC1300-BnCYTB5B.c09- Cluc、pC1300-BnCER1-L2.a05-Cluc。
以检测BnCER3.a10和BnCER1-2的互作为例, 将构建好的重组质粒转化农杆菌, 然后将处理组pC1300-Nluc-BnCER1-2 + pC1300-BnCER3.a10- Cluc菌液等体积混匀后注射烟草, 同时分别以pC1300-Cluc + pC1300-NLuc-BnCER1-2、pC1300- BnCER3.a10-CLuc + pC1300-NLuc、pC1300-Cluc + pC1300-NLuc为阴性对照, 保湿黑暗处理2 d后, 用含1 mmol L–1荧火素底物D-luciferin的反应液喷湿叶片背面, 于黑暗中静置7 min, 利用植物活体分子影像系统(CCD imaging system)测定荧光强度。其余候选蛋白与BnCER1-2的LCA互作检测方法同上。
1.8 实时荧光定量PCR
根据测序验证后的序列设计荧光定量PCR引物(表4), 在CFX Connect荧光定量PCR仪(美国Bio-Rad公司)上扩增。反应体系按照ChamQ SYBR qPCR Master Mix试剂盒(Vazyme)说明配制, 荧光定量PCR的反应体系(20 μL), 包含2× ChamQ SYBR qPCR Master Mix 10.0 μL、10 μmol L–1上下游引物各0.4 μL、cDNA 2.0 μL、ddH2O 7.2 μL。扩增程序为95℃ 30 s; 95℃ 5 s, 58℃ 30 s, 40个循环。作为内参基因, 设置3个生物学重复, 2个技术重复。
2 结果与分析
2.1 甘蓝型油菜BnCER3.a10、BnCER3.c02、BnCYTB5B.c09和BnCER1-L2.a05基因的克隆与生物信息学分析
为寻找BnCER1-2可能的互作蛋白, 根据蜡质差异材料转录组测序结果, 本研究从甘蓝型油菜中克隆了、、、这4个基因, 测序结果表明, 扩增的、编码序列均为1893 bp, 各自编码630个氨基酸;为423 bp, 编码140个氨基酸;为1887 bp, 编码628个氨基酸。
BlastN结果显示,与白菜(XM_033281803.1)的相似性最高, 为99.9%, 而与甘蓝(XM_013757293.1)的相似性达100%; 它们与拟南芥()的相似性分别为88.3%和88.8%。与甘蓝(XM_013754065.1)、拟南芥()的相似性分别为100%和86.8%;与白菜(XM_009145209.3)、拟南芥()的相似性分别为99.5%和85.3%。将推导的BnCER3.a10、BnCER3.c02、BnCER1-L2.a05蛋白与BnCER1-2以及拟南芥CER1、CER1-L1、CER1-L2、CER3蛋白进行氨基酸序列多重比对发现, BnCER3.a10与BnCER3.c02的序列之间的同源性为93.8%, 它们与拟南芥CER3序列分别具有91.8%与93.4%的同源性; BnCER1-L2.a05与拟南芥CER1、CER1-L1、CER1-L2的同源性分别为50.6%、74.9%、85.9%。推导的BnCYTB5B.c09氨基酸序列与拟南芥CYTB5具有88.7%的同源性。氨基酸序列比对和蛋白保守结构域预测结果表明, 与拟南芥对应的同源基因一样, BnCER3.a10/c02、BnCER1-L2.a05以及BnCER1-2蛋白中均含有脂肪酸羟化酶结构域(图1-A)和WAX2 C末端结构域(图1-B)。BnCYTB5B. c09具有典型的Cyt_B5蛋白家族保守结构域(图1-C)。系统进化树分析表明, BnCER3.a10/c02、BnCER1-L2.a05与BnCER1-2以及甘蓝、白菜、拟南芥CER1、CER3聚在一个亚组, 而BnCYTB5B.c09与甘蓝、白菜、拟南芥CYTB5聚在另外一个亚组(图2)。
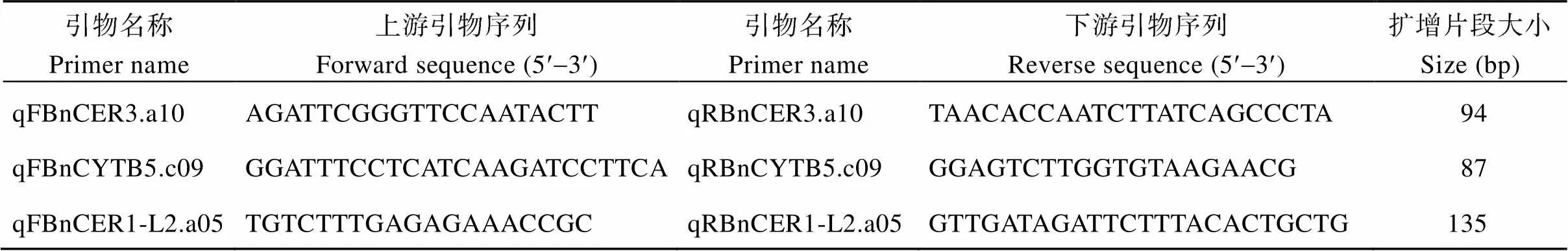
表4 荧光定量PCR引物

(图1)
A: 脂肪酸羟化酶结构域; B: WAX2 C末端结构域; C: Cyt_B5蛋白家族保守结构域。参与氨基酸序列比对的有拟南芥() CER1 (AT1G02205)、CER1-L1 (AT1G02190)、CER1-L2 (AT2G37700)、CER3 (AT5G57800), 参与比对的CYTB5分别来自拟南芥() (AT5G48810)、甘蓝() (XP_013609519.1)、埃塞俄比亚芥() (KAG2316461.1)、荠菜() (XP_006279708.1)、萝卜() (XP_018457867.1)。
A: fatty_acid_hydroxylase domain Wax2 C-terminal domain; B: wax2 C-terminal domain; C: cyt_B5 protein conserved domain. The proteins involved in amino acid sequence alignment includeCER1 (AT1G02205), CER1-L1 (AT1G02190), CER1-L2 (AT2G37700), and CER3 (AT5G57800). The CYTB5 proteins aligned are from(AT5G48810),(XP_013609519.1),(KAG2316461.1),(XP_006279708.1), and(XP_018457867.1), respectively.
2.2 BnCER3.a10/c02、BnCYTB5B.c09和BnCER1- L2.a05的亚细胞定位
将、和基因融合GFP信号, 分别转化烟草原生质体进行亚细胞定位, 结果如图3所示, 含目标基因的融合GFP蛋白普遍表达于烟草叶片内质网中, 且与内质网mCherry信号重合, 表明这4个基因皆定位于内质网。这与BnCER1-2的亚细胞定位结果一致[17]。
2.3 BnCER1-2与BnCER3.a10/c02、BnCYTB5B. c09、BnCER1-L2.a05相互作用的BiFC检测
将含与、、基因的BiFC重组载体共侵染烟草, 在激光共聚焦显微镜下进行观察发现, 处理组pC1300-YN-BnCER1-2 + pC2300-BnCER3.a10- YC、pC1300-YN-BnCER1-2 + pC2300-BnCYTB5B. c09-YC、pC1300-YN-BnCER1-2 + pC2300-BnCER1- L2.a05-YC与阳性对照组在显微镜下均观察到明显的黄色荧光, 而阴性对照组则没有检测到荧光(图4),表明BnCER1-2与BnCER3.a10、BnCYTB5.c09、BnCER1-L2.a05蛋白可能存在互作。
将含和基因的BiFC重组载体共侵染烟草后没有检测到荧光信号(图略), 说明BnCER1-2与BnCER3.c02蛋白可能不互作。
2.4 BnCER1-2与BnCER3.a10、BnCYTB5B. c09、BnCER1-L2.a05相互作用的LCA检测
将含与、、基因的LCA重组载体共侵染烟草, 在CCD成像系统中进行观察发现, pC1300-Nluc- BnCER1-2与pC1300-BnCER3.a10-Cluc共转化的烟草叶片在成像系统中观察到荧光信号, 而阴性对照组则没有检测到荧光(图5-A), 说明BnCER1-2与BnCER3.a10蛋白存在互作。使用同样的方法检测到pC1300-Nluc-BnCER1-2与pC1300-BnCYTB5B.c09- Cluc、pC1300-Nluc-BnCER1-2与pC1300-BnCER1- L2.a05-Cluc共转化烟草叶片存在荧光信号(图5-B, C), 说明BnCER1-2与BnCYTB5.c09、BnCER1- L2.a05蛋白均存在互作。

图2 BnCER3.a10/c02、BnCYTB5B.c09、BnCER1-L2.a05与其他十字花科物种相关蛋白的系统进化树分析
参与系统进化树分析的氨基酸序列包括拟南芥AtCER1 (AT1G02205)、AtCER1-L1 (AT1G02190)、AtCER1-L2 (AT2G37700)、AtCER3(AT5G57800)、AtCYTB5 (AT5G48810), 白菜BrCER1 (XP_009118866.2)、BrCER1-L2 (XP_009143457.1)、BrCER3 (XP_033137694.1)、BrCYTB5B (XP_009151679.1), 甘蓝BoCER1 (QCO76034.1)、BoCER1-L2 (XP_013632332.1)、BoCER3 (XP_013621098.1)、BoCYTB5B(XP_013597870.1)。
The amino acid sequences involved in phylogenetic analysis include AtCER1 (AT1G02205), AtCER1-L1 (AT1G02190), AtCER1-L2 (AT2G37700), AtCER3 (AT5G57800), and AtCYTB5 (AT5G48810) from, BrCER1 (XP_009118866.2), BrCER1-L2 (XP_009143457.1), BrCER3 (XP_033137694.1), and BrCYTB5B (XP_009151679.1) from, BoCER1 (QCO76034.1), BoCER1-L2 (XP_013632332.1), BoCER3 (XP_013621098.1), and BoCYTB5B (XP_013597870.1) from.

图3 BnCER3.a10/c02、BnCYTB5B.c09和BnCER1-L2.a05在烟草叶片中的亚细胞定位
标尺为20 µm。Bar: 20 µm.

图4 BiFC检测BnCER1-2与BnCER3.a10、BnCYTB5B.c09、BnCER1-L2.a05蛋白互作
pC1300-YN-OsHAL3 + pC2300-OsHAL3-YC为阳性对照, pC1300-YN-BnCER1-2 + pC2300-OsHAL3-YC、pC1300-YN-OsHAL3 + pC2300-BnCER3.a10-YC、pC1300-YN-OsHAL3 + pC2300-BnCYTB5B.c09-YC、pC1300-YN-OsHAL3 + pC2300-BnCER1-L2.a05-YC为阴性对照。标尺为20 µm。
The combination “pC1300-YN-OsHAL3 + pC2300-OsHAL3-YC” is used as the positive control, while the combination “pC1300-YN-BnCER1-2 + pC2300-OsHAL3-YC”, “pC1300-YN-OsHAL3 + pC2300-BnCER3.a10-YC”, “pC1300-YN-OsHAL3 + pC2300-BnCYTB5B.c09-YC”, and “pC1300-YN-OsHAL3 + pC2300-BnCER1-L2.a05-YC” are used as the negative controls, respectively. Bar: 20 µm.
2.5 甘蓝型油菜BnCER3.a10、BnCYTB5B.c09、BnCER1-L2.a05的表达分析
利用实时荧光定量PCR对与存在互作的、、基因的表达模式进行分析发现,主要在甘蓝型油菜茎、叶中表达;在甘蓝型油菜茎中的表达量最高, 其次是在花、叶片和根中, 在角果中的表达量最低;在花中的表达量最高, 在茎和叶片中的表达量最低(图6-A)。甘蓝型油菜蜡质差异材料表达分析结果显示,与在低蜡(烷)材料中显著下调, 其中在低蜡(烷)材料中几乎不表达; 而在低蜡(烷)材料中显著上调(图6-B)。
受MeJA、ACC诱导显著下调,受ABA诱导显著上调, 而则受SA诱导表达上调、受MeJA诱导下调(图6-C)。在干旱胁迫下,和的表达量显著增加,则显著下降(图6-C)。在NaCl与低温胁迫下,与的表达量均显著下降(在NaCl胁迫6 h下降显著, 12 h无显著变化), 而对NaCl胁迫无响应, 在低温处理12 h显著增加(图6-C)。
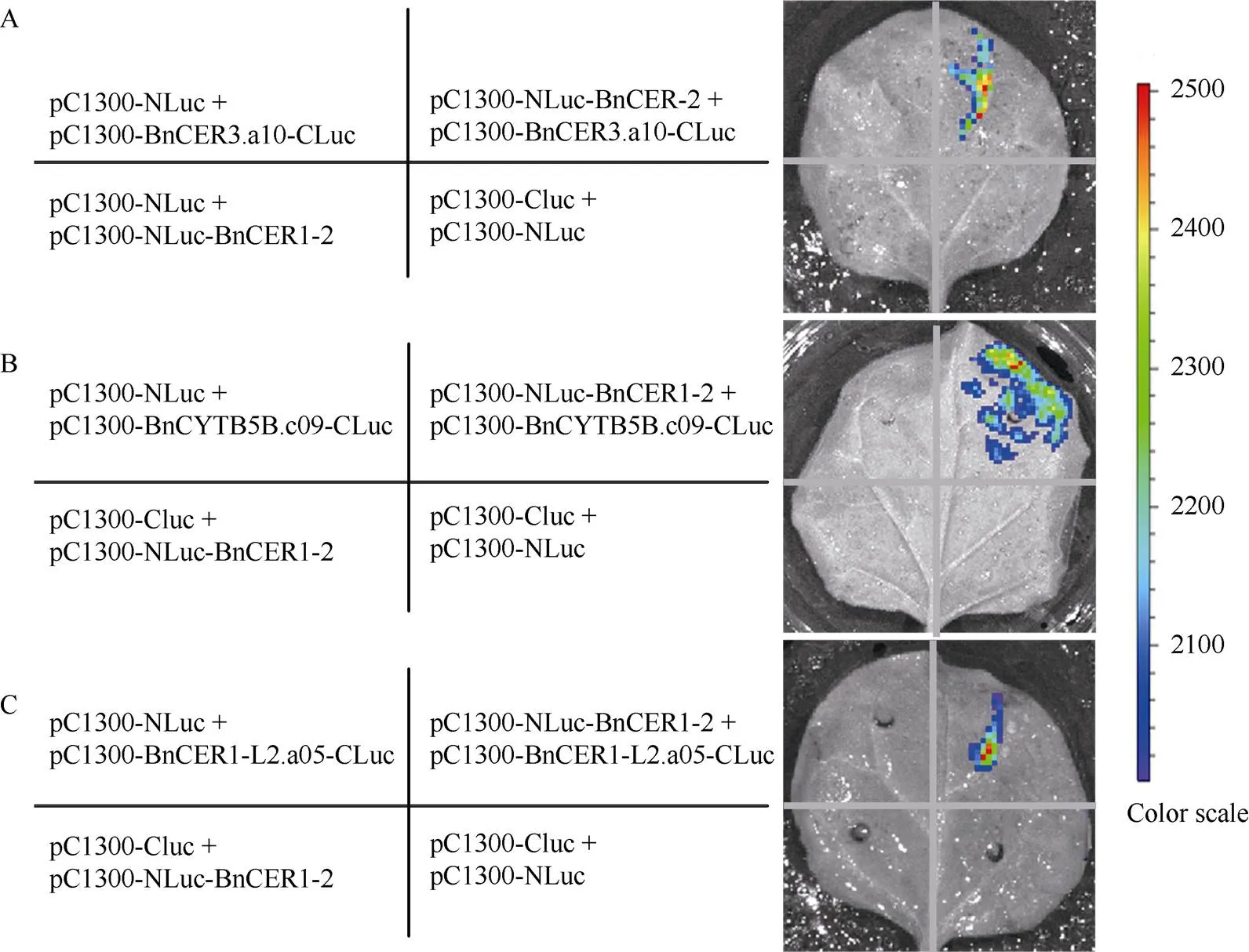
图5 LCA检测BnCER1-2与BnCER3.a10、BnCYTB5B.c09、BnCER1-L2.a05蛋白互作
A: BnCER3.a10与BnCER1-2互作检测; B: BnCYTB5B.c09与BnCER1-2互作检测; C: BnCER1-L2.a05与BnCER1-2互作检测; NLuc空载体与含目的基因的CLuc载体组合、CLuc空载体与含目的基因的NLuc载体组合以及均为空载体的CLuc/NLuc载体组合分别作为阴性对照。
A: the interaction detection between BnCER3.a10 and BnCER1-2; B: the interaction detection between BnCYTB5B.c09 and BnCER1-2; C: the interaction detection between BnCER1-L2.a05 and BnCER1-2. The combination of NLuc empty vector with CLuc vector containing target gene, the combination of CLuc empty vector with NLuc vector containing target gene, and the combination of CLuc empty vector with NLuc empty vector were used as the negative controls, respectively.
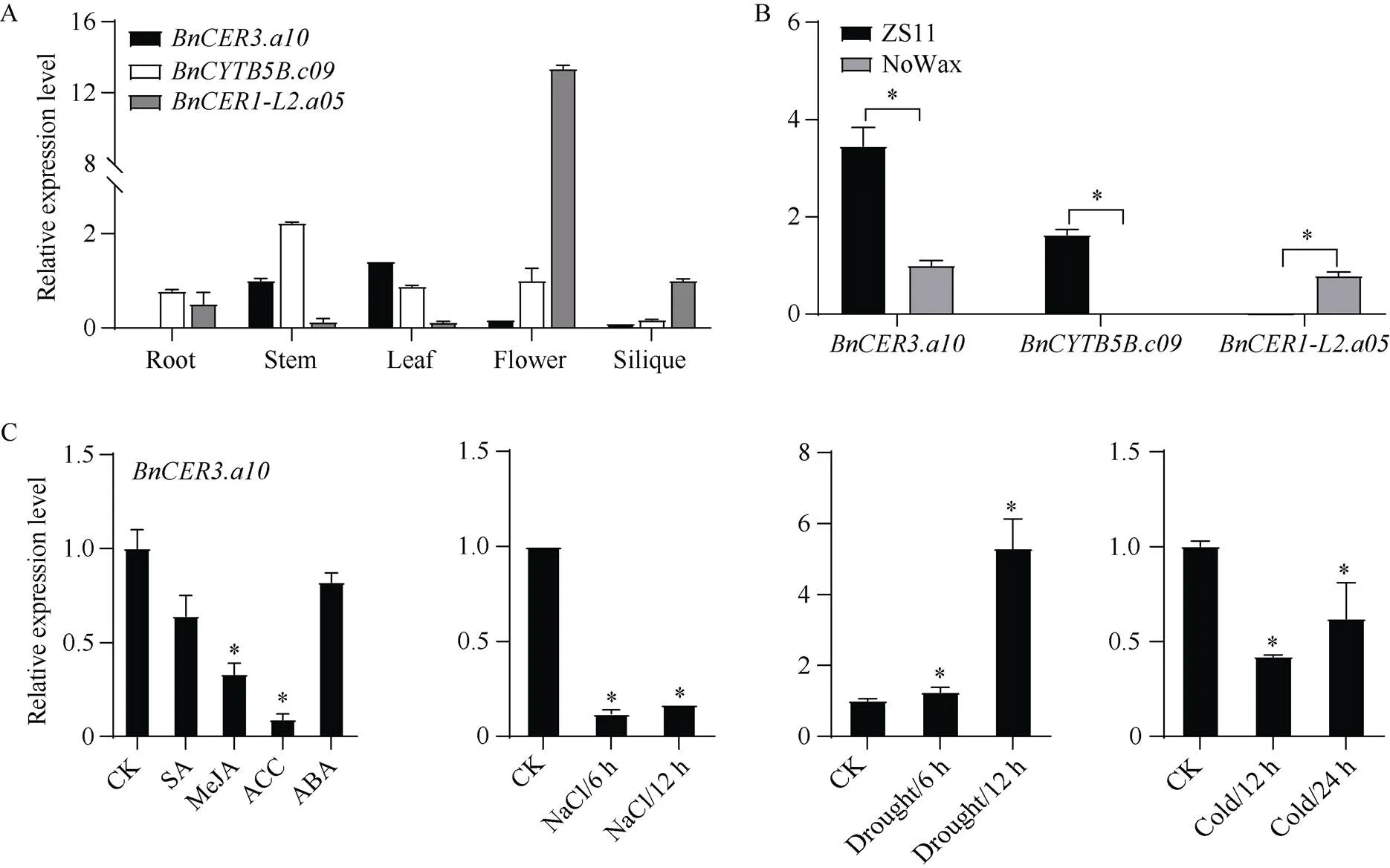
(图6)
A: 组织器官特异性表达; B: 蜡质差异材料表达; C: 非生物胁迫和激素诱导表达。SA: 水杨酸; MeJA: 茉莉酸甲酯; ACC: 1-氨基环丙烷-1-羧酸; ABA: 脱落酸。*代表< 0.05。
A: the specific relative expression of organs and tissues; B: the differential expression inwith high load wax and low load wax; C: induced expression by abiotic stress and hormone. SA: salicylic acid; MeJA: methyl jasmonic acid; ACC: 1-aminocyclopropanecarboxylic acid; ABA: abscisic acid. *:< 0.05.
3 讨论
长链烷烃在植物的耐旱性、植物与病原菌互作以及花粉水合作用中承担着重要功能[16,18-19]。甘蓝型油菜参与长链烷烃的生物合成, 并主要负责C29烷的合成, 其在甘蓝型油菜中过表达增强了植株的抗旱性[12]。为进一步揭示BnCER1-2的作用机制, 根据蜡质差异材料转录组测序结果, 本研究克隆了BnCER1-2潜在的互作蛋白基因/、、, 序列分析表明, 它们分别是对应于拟南芥、的垂直同源基因。亚细胞定位结果表明, BnCER3.a10/c02、BnCYTB5B.c09、BnCER1- L2.a05均定位在细胞内质网, 与BnCER1-2的亚细胞定位结果一致[17]。
前人研究报道, 拟南芥CER1和CER3组成的复合物可催化酰基辅酶A转化为烷烃, 且主要催化合成29个碳及以上的长链烷烃[13]。在生产超长链脂肪酸的酵母工程菌株中, 添加CYTB5s可提高CER1/CER3催化烷烃的产量, 进一步研究表明, CYTB5B是CER1的特异辅因子[13]。为观察BnCER3.a10/c02、BnCYTB5B.c09与BnCER1-2是否存在互作, 本研究利用BiFC与LCA技术对蛋白互作进行了检测。BiFC是一种可直观、快速判断目标蛋白在活细胞中定位和相互作用的技术[20], 而荧火素酶互补试验(luciferase complementation assay, LCA)则因其高灵敏度、可定量化、操作简单高效被广泛应用于植物学和动物学蛋白质互作研究[21]。最终检测结果表明, BnCER1-2蛋白能与BnCER3.a10、BnCYTB5B.c09蛋白互作。实时荧光定量PCR结果显示,和主要在甘蓝型油菜茎/叶中表达, 这与角质层蜡质主要在地上部器官沉积的功能一致(图6-A)。蜡质差异材料研究结果表明,和在低蜡(烷)油菜中的表达量显著低于高蜡(烷)油菜, 其中在低蜡(烷)油菜中几乎不表达(图6-B), 这与在低蜡(烷)材料中的表达趋势一致[12]。低蜡(烷)油菜NoWax与ZS11相比, 烷类含量低是其蜡质含量低的主要原因[12]。这些结果表明, BnCER3.a10与BnCYTB5B.c09可能通过与BnCER1-2互作而促进甘蓝型油菜长链烷烃的生物合成。与对干旱胁迫的响应一致[12],和的转录水平受干旱胁迫诱导, 其中表达受ABA诱导, 而和对旱胁迫的响应可能独立于ABA途径。
Bourdenx等[16]在拟南芥数据库中共鉴定到4个同源基因:、、和, 其中与、高度同源, 而为假基因。进一步研究表明, CER1-L1与CER3和CYTB5在酵母工程菌株中相互作用, 形成的功能复合物催化产生的烷烃与CER1复合物催化的烷烃链长不同[14]。利用拟南芥突变体与过表达研究表明, CER1-L1也是催化烷烃形成的复合物的一部分[14]。在拟南芥各组织器官中未检测到其表达, 可能不参与拟南芥蜡质合成[16]。甘蓝型油菜蜡质差异材料转录组测序结果中,表达无显著差异, 而在低蜡(烷)材料中转录水平显著上调[15], 这一结果被荧光定量PCR所证实(图6-B), 暗示了可能参与了甘蓝型油菜蜡(烷)的负调控。在干旱等逆境胁迫下转录水平显著下调(图6-C), 也说明其存在与以及不同的调控方式。BiFC与LCA检测结果最终证明BnCER1-L2.a05与BnCER1-2蛋白存在互作。综合分析认为, 甘蓝型油菜中存在着与拟南芥不一样的长链烷烃合成模式, BnCER1-L2.a05可能通过与BnCER1-2互作而负调控长链烷烃的生物合成。此外,在花器官中的高表达量也暗示了其可能在花器官的形成或功能中发挥重要作用。
4 结论
甘蓝型油菜BnCER3.a10、BnCYTB5B.c09、BnCER1-L2.a05可能通过与BnCER1-2互作而调控长链烷烃的生物合成, 参与干旱胁迫响应, 其中BnCER3.a10与BnCYTB5B.c09促进长链烷烃的合成, 而BnCER1-L2.a05可能负调控长链烷烃的合成。
[1] Ahmadi M, Bahrani M J. Yield and yield components of rapeseed as influenced by water stress at different growth stages and nitrogen levels., 2009, 5: 755–761.
[2] Iizumi T, Ramankutty N. How do weather and climate influence cropping area and intensity?, 2015, 4: 46–50.
[3] Schreiber L, Skrabs M, Hartmann K D, Diamantopoulos P, Simanova E, Santrucek J. Effect of humidity on cuticular water permeability of isolated cuticular membranes and leaf disks., 2001, 214: 274–282.
[4] Riederer M, Schreiber L. Protecting against water loss: analysis of the barrier properties of plant cuticles., 2001, 52: 205–208.
[5] Ficke A, Gadoury D M, Godfrey D, Dry I B. Host barriers and responses to Uncinula necator in developing grape berries., 2004, 94: 438–445.
[6] Eigenbrode S D, Rayor L, Chow J, Latty P. Effects of wax bloom variation inon foraging by avespid wasp., 2000, 97: 161–166.
[7] Krauss P, Markstädter C, Riederer M. Attenuation of UV radiation by plant cuticles from woody species., 1997, 20: 1079–1085.
[8] Ni Y, Xia R E, Li J N. Changes of epicuticular wax induced by enhanced UV-B radiation impact on gas exchange in., 2014, 36: 2481–2490.
[9] Kunst L, Samuels A L. Biosynthesis and secretion of plant cuticular wax., 2003, 42: 5180.
[10] Barthhlott W, Neinhuis C. Purity of the sacred lotus, or escape from contamination in biological surface., 1997, 202: 18.
[11] 王婧, 刘泓利, 宋超, 倪郁. 甘蓝型油菜叶表皮蜡质组分及结构与菌核病抗性关系. 植物生理学报, 2012, 48: 958–964.
Wang J, Liu H L, Song C, Ni Y. Relationship betweenepicuticular wax composition and structure and resistance to., 2012, 48: 958–964 (in Chinese with English abstract).
[12] Wang Y M, Jin S R, Xu Y, Li S, Zhang S J, Yuan Z, Li J N, Ni Y. Overexpression of,, andpromotes cuticular wax production and increases drought tolerance in., 2020, 8: 26–37.
[13] Bernard A, Domergue F, Pascal S, Jetter R, Renne C, Faure J D, Haslam R P, Napier J A, Lessire R, Joubès J. Reconstitution of plant alkane biosynthesis in yeast demonstrates thatECERIFERUM1 and ECERIFERUM3 are core components of a very-long-chain alkane synthesis complex., 2012, 24: 3106–3118.
[14] Pascal S, Bernard A, Deslous P, Gronnier J, Fournier-Goss A, Domergue F, Rowland O, Joubès J, Notes A.CER1-LIKE1 functions in a cuticular very-long-chain alkane- forming complex., 2019, 179: 415–432.
[15] Jin S R, Zhang S J, Liu Y H, Jiang Y W, Wang Y M, Li J N, Ni Y. A combination of genome-wide association study and transcriptome analysis in leaf epidermis identifies candidate genes involved in cuticular wax biosynthesis in., 2020, 20: 458.
[16] Bourdenx B, Bernard A, Domergue F, Pascal S, Léger A, Roby D, Pervent M, Vile D, Haslam R P, Napier J A, Lessire R, Joubès J. Overexpression ofECERIFERUM1 promotes wax very-long-chain alkane biosynthesis and influences plant response to biotic and abiotic stresses., 2011, 156: 29–45.
[17] 蒋有为. 甘蓝型油菜顺式作用元件及其反式作用因子研究. 西南大学硕士学位论文, 重庆, 2021.
Jiang Y W. Studies on the-acting Elements and Trans-acting Factors ofin. MS Thesis of Southwest University, Chongqing, China, 2021 (in Chinese with English abstract).
[18] Aarts M, Keijzer C J, Stiekema W J, Pereira A. Molecular characterization of thegene ofinvolved in epicuticular wax biosynthesis and pollen fertility., 1995, 7: 2115–2127.
[19] Kosma D K, Bourdenx B, Bernard A, Parsons E P, Lü S, Joubès J, Jenks M A. The impact of water deficiency on leaf cuticle lipids of., 2009, 151: 1918–1929.
[20] Hu C D, Chinenov Y, Kerppola T K. Visualization of interactions among bZIP and Rel family proteins in living cells using bimolecular fluorescence complementation., 2002, 9: 789–798.
[21] Zhou Z Y, Bi G Z, Zhou J M. Luciferase complementation assay for protein-protein interactions in plants., 2018, 3: 42–50.
Cloning of genes involved in cuticular very-long-chain alkane synthesis and its interaction with BnCER1-2 in
BAI Cheng-Cheng**, YAO Xiao-Yao**, WANG Yu-Lu, WANG Sai-Yu, LI Jin-Ying, JIANG You-Wei, JIN Shu-Rong, CHEN Chun-Jie, LIU Yu, WEI Xing-Yue, XU Xin-Fu, LI Jia-Na, and NI Yu*
College of Agronomy and Biotechnology / Academy of Agricultural Sciences, Southwest University, Chongqing 400716, China
Very-long-chain (VLC) alkanes are the main components of cuticular wax in, which play a key role in preventing non-stomatal water loss. BnCER1-2 is the core enzyme that catalyzes the synthesis of VLC alkanes in. However, it is unclear whether BnCER1-2 protein regulates VLC alkane synthesis by interacting with other proteins. Four genes potentially involved in VLC alkane synthesis,,,, and, were screened previously by the transcriptome inwith differential wax load. In this study, their coding sequences were cloned from. A typical fatty acid hydroxylase domain and a wax2 C-terminal domain were detected in the predicted BnCER3.a10/c02 and BnCER1-L2.a05 proteins, while cyt_b5 protein family conserved domain was in the predicted BnCYTB5B.c09. Subcellular localization showed that BnCER3.a10/c02, BnCYTB5B.c09, and BnCER1-L2.a05 were all located in the endoplasmic reticulum, which were co-located with BnCER1-2. Bimolecular fluorescence complementary (BiFC) and luciferase complementation assay (LCA) revealed that BnCER3.a10, BnCYTB5B.c09, and BnCER1-L2.a05 interacted with BnCER1-2 protein, while BnCER3.c02 did not interact with BnCER1-2. The RT-qPCR indicated thatandwere mainly expressed in the stems or leaves of, and the relative expression was significantly up-regulated under drought stress, which were consistent with the expression pattern of. The relative expression levels ofdecreased significantly under NaCl and low temperature stresses. Further, the relative expression level ofwas significantly down-regulated by MeJA and ACC, while the relative expression level ofwas up-regulated by ABA. The highest relative expression ofwas in flowers and the lowest in stems and leaves, and its expression was significantly down-regulated under drought, cold, and NaCl stresses. Further, the relative expression level ofwas up-regulated by SA, while down-regulated by MeJA. The relative expression levels ofandinwith high wax/alkane load were significantly higher than that with low wax/alkane load, whilehad the opposite change. Comprehensive analysis suggested that BnCER3.a10 and BnCYTB5B.c09 may promote the biosynthesis of VLC alkanes inby interacting with BnCER1-2, while BnCER1-L2.a05 may negatively regulate the synthesis of VLC alkanes by interacting with BnCER1-2.
; cuticular wax; protein interaction; very-long-chain alkanes
10.3724/SP.J.1006.2023.24037
本研究由国家自然科学基金项目(32171938, 31771694), 重庆市自然科学基金项目(cstc2021jcyj-msxmX0332)和财政部和农村农业部国家现代农业产业技术体系建设专项(CARS-12)资助。
This study was supported by the National Natural Science Foundation of China (32171938, 31771694), the Natural Science Foundation of Chongqing, China (cstc2021jcyj-msxmX0332), and the China Agriculture Research System of MOF and MARA (CARS-12).
倪郁, E-mail: nmniyu@126.com
**同等贡献(Contributed equally to this work)
柏成成, E-mail: 1316502363@qq.com; 姚小尧, E-mail: 823706108@qq.com
2022-02-13;
2022-06-07;
2022-06-21.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220620.1635.002.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
