生物医用亚稳β钛合金的研究进展
2023-02-22肖文龙王俊帅梁雄伟赵新青马朝利
肖文龙,付 雨,王俊帅,曾 达,梁雄伟,陈 恒,赵新青,马朝利
(1 北京航空航天大学 材料科学与工程学院,北京 100191;2 大博医疗科技股份有限公司,福建 厦门 361026)
随着医疗器械行业的快速发展,人们对接骨板、牙种植体和人工关节等硬组织修复替代材料的需求越来越大。相比于不锈钢和Co-Cr合金,钛及钛合金具有高比强度、低弹性模量、优异的耐腐蚀性和生物相容性等优点,在临床上已经得到了广泛应用。然而,传统的生物医用钛合金如Ti-6Al-4V和Ti-6Al-7Nb等,由于存在Al,V等对人体有毒元素,并且弹性模量远高于人体骨骼,在生物相容性和力学相容性方面无法满足医用金属材料的要求。以Ti-Nb基为代表的生物医用β型钛合金,具有更优异的生物相容性、更低的弹性模量以及超弹性和形状记忆等功能特性,已成为新一代医用金属材料重点的发展方向。本文将综述生物医用钛合金的发展历程,重点介绍Ti-Nb基钛合金的设计与制备方法和发展现状,并展望医用钛合金的发展趋势。
1 生物医用钛合金的基本特征及发展概况
1.1 医用金属材料的基本特征
医用植入金属材料的安全性对其综合性能提出了高要求。植入物在使用过程中承受力学/化学环境的交互作用,除了应具备低弹性模量、高强度、耐磨损和优异的疲劳性能等之外,还应具有无毒、不致敏和不致癌等生物相容性。针对不同用途的医用金属材料,其性能要求的侧重点也不同,例如对于人工关节和接骨板等需要承受较大载荷的外科植入物用金属材料,除了应满足良好的生物相容性(biocompatibility)、化学稳定性以及耐腐蚀性外,还对其力学相容性(mechanical compatibility)提出了额外的要求,如高强度、高韧性、低弹性模量、良好的耐磨性和足够的疲劳寿命等。目前常用的医用金属材料主要为316L不锈钢、Co-Cr合金以及纯钛和钛合金。表1为常用金属元素的生物相容性及各项生物性能指标,可以知道Co,Cr和Ni等元素存在生物毒性[1]。并且,医用不锈钢(210~250 GPa)和Co-Cr合金(190~210 GPa)的弹性模量远高于人骨(10~30 GPa)[2],容易引起“应力屏蔽”效应而导致植入物失效,无法满足长期使用的要求。钛及钛合金因具有高比强度、低弹性模量、优异的生物相容性和耐腐蚀性等综合特性,成为当前生物医用金属材料领域的研究热点和重要候选材料[3]。

表1 钛合金中常用合金化元素的生物相容性[1]Table 1 Biocompatibility of common alloying elements in Ti alloys[1]
1.2 医用钛合金的发展概况
生物医用钛合金的发展可以划分为三代。第一代是纯钛和Ti-6Al-4V(质量分数,下同)。Ti-6Al-4V具有良好的耐蚀性、较低的弹性模量(110~130 GPa)和优良的强塑性匹配,在医用金属材料领域获得了广泛应用。然而,其弹性模量为人体骨骼的4~20倍,且临床使用发现Al元素和V元素可能导致阿兹海默症、神经紊乱和骨软化等不良反应[4]。随后,德国和瑞士在20世纪80年代分别用Fe和Nb替代V,开发了以Ti-5Al-2.5Fe和Ti-6Al-7Nb为代表的第二代α+β型医用钛合金[5]。Ti-5Al-2.5Fe和Ti-6Al-7Nb具有与Ti-6Al-4V相近的力学性能和更优的生物相容性,但仍含有潜在毒性元素Al,且弹性模量仍远高于人骨[6]。为了进一步改善医用钛合金的生物相容性和力学相容性,自20世纪90年代开始,世界各国相继开展了不含Al和V等有毒元素且具有更低弹性模量的第三代β型医用钛合金的研究,并开发了一系列新型医用钛合金,如美国的Ti-13Nb-13Zr, Ti-12Mo-6Zr-2Fe(TMZF)和Ti-35Nb-7Zr-5Ta(T-Osteum),日本的Ti-29Nb-13Ta-4.6Zr(TNTZ)和Ti-23Nb-0.7Ta-2Zr-1.2O(原子分数/%,Gum metal),中国的Ti-24Nb-4Zr-7.9Sn(Ti-2448),TLE(Ti-(3~6)Zr-(2~4)Mo-(24~27)Nb)与TLM(Ti-(1.5~4.5)Zr-(0.5~5.5)Sn-(1.5~4.4)Mo-(23.5~26.5)Nb等。表2给出了目前列入ASTM标准的医用钛合金及力学性能。可以看出,新一代医用钛合金大多为Ti-Nb体系,并添加了表1[1]列出的Mo,Ta,Zr和Sn等生物友好元素,具有比纯钛和Ti-6Al-4V等医用钛合金更低的弹性模量与更优的生物相容性。Ti-Nb基钛合金通过合金成分设计和微观组织调控可以获得优异的生物相容性、低弹性模量、高强度、超弹性和形状记忆效应等特性[7-8],受到了材料和医学领域研究人员的广泛关注。

表2 列入ASTM标准的医用钛合金Table 2 Titanium alloys for biomedical applications registered in ASTM standard
2 新型生物医用钛合金的成分设计方法
新型医用钛合金以近/亚稳β钛合金为主,将降低弹性模量作为发展第三代医用钛合金的重要目标之一。钛合金的弹性模量与相组成以及β相的结构稳定性密切相关,可借助经验方法和理论计算设计合金成分,获得低弹性模量。传统钛合金的成分设计主要基于钼当量([Mo]Eq)经验方法,其计算公式为[9]:[Mo]Eq=1.0Mo+0.67V+0.44W+0.28Nb+0.22Ta+2.9Fe+1.25Cr+1.25Ni+1.7Mn-1.0Al,钼当量与β相稳定性成正比。新型医用钛合金含有较高含量的Nb,Mo,Zr,Sn和Ta等元素,而钼当量经验法将Zr和Sn视为中性甚至α稳定元素,未计入计算公式中。但研究发现,当Zr和Sn与Nb和Mo等β稳定元素复合添加时,能有效抑制α″马氏体和无热ω相的形成,表现为较强的β稳定元素作用,且其β稳定作用的强弱还与所添加的其他β稳定元素的种类和含量有关[10-11]。近年来,研究学者提出将Zr作为钛合金中弱β稳定元素,其钼当量系数为0.34或0.47,而Sn的钼当量系数为0.38或0.30[12-13]。此外,研究表明间隙元素O和N等α稳定元素也是新型医用钛合金的理想合金化元素,溶入β相中的O和N元素实际起着稳定β相的作用[14],但并未计入钼当量计算或被作为α稳定元素看待。因此,钼当量只能粗略估算医用钛合金的β相稳定性,在进行β型医用钛合金的成分设计时,应充分考虑Zr,Sn和O等元素对β相的稳定作用和合金化元素间的交互作用,并结合其他方法进行成分设计。
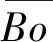
(1)
式中:Xi为元素i的原子分数;(Bo)i和(Md)i分别为元素i的Bo和Md值。


图图及常见Ti-Nb基医用钛合金在其中的位置(a)[16]以及合金元素Nb,Mo,Ta,Zr,Sn和Hf对和值的影响趋势(b)[10] map showing the positions of some typical Ti-Nb based biomedical Ti alloys (a)[16] and the effect trend of Nb,Mo,Ta,Zr,Sn and Hf addition on values (b)[10]
You等[18]在d-电子理论的基础上,考虑钛与其他合金化元素间的键合力(bonding force,BF),进行低弹性模量钛合金的设计,设计的Ti-11Nb-38Zr(原子分数/%)的弹性模量低至38 GPa。基于库仑定律,合金元素间的键合力计算方式为:
(2)

需要特别注意的是,d-电子理论、平均价电子浓度和钼当量等方法均是建立在Ti-M二元合金(M为合金化元素)的基础上发展而来的半经验方法,仅考虑了Ti元素与第二组元元素之间的相互作用。新型医用钛合金的多元合金化元素间的交互作用比较复杂,采用d-电子理论、平均价电子浓度法和钼当量进行合金成分设计会与预期出现偏差。这可能是由于在具有较高Zr,Sn和O含量的钛合金中,这些合金化元素可被视为点缺陷,抑制了宏观长程马氏体转变和无热ω相,形成纳米畴(nanodomain)即O′相,从而将室温不稳定的β相稳定至室温,获得低弹性模量、超弹性和高强度等多种特性,但并未反映在电子参数和钼当量计算中。此外,合金化元素之间存在相互作用,而这些平均参量设计法没有考虑它们之间的相互作用。因此,在进行新型医用β钛合金成分设计时,应充分考虑多组元间的交互作用,综合利用各种手段,如高通量实验法、第一性原理计算、人工神经网络和团簇线配比法等。
3 Ti-Nb基医用钛合金的研究进展
3.1 合金元素的作用
新型医用钛合金设计的基本原则是抑制α′,α″和ω相的形成,获得低稳定性的近/亚稳β钛合金。合金化元素的选取考虑生物相容性、β相稳定作用以及固溶强化效果等。从表1[1]可知,可选取的生物相容性元素为Nb,Mo,Ta,Zr,Sn,Hf(注:Mo的生物相容性较低)以及间隙元素O和N。根据钛合金的物理冶金原理,Nb,Mo,Ta为β稳定元素,Zr,Sn,Hf为中性元素,O和N通常被视为α稳定元素。
图2[28-32]列出了上述合金化元素对Ti-M二元和Ti-Nb-M三元合金(M为合金化元素)的马氏体相变开始温度(Ms)的影响,Mo是最强的β稳定元素,每添加1%(原子分数)Mo,Ms降低88 K,当Mo与Nb复合添加时,Mo的β稳定作用更强,添加1%(原子分数)Mo使Ti-Nb的Ms降低120 K[32]。Nb的β稳定作用次之,每添加1%(原子分数)Nb,Ms可以降低40 K[33],Ta较弱,每添加1%(原子分数)Ta,Ms降低30 K[28]。Nb,Mo,Ta,Zr,Hf在β相中均可无限互溶,产生固溶强化作用。实验和理论计算均表明,在Nb含量低于26%(原子分数)时,随着Nb含量增加,Ti-Nb合金应力诱发α″马氏体相变所需的临界应力降低[34-35]。Mo的原子半径和熔点与Nb比较接近,但Ti-Mo合金的超弹性和形状记忆效应较差[36]。金属Ta已经在生物医用材料领域获得应用,但Ta在钛合金中的β稳定作用较弱,且密度大、熔点高、成本较高,一般避免添加或少添加。表3对比了一些低弹性模量的Ti-Nb,Ti-Mo和Ti-Ta二元亚稳β钛合金的力学性能[37-40]。由于Ti-Nb合金弹性模量更低,受到人们的高度关注。

图2 合金元素M对Ti-M二元合金与Ti-Nb-M三元合金Ms的影响[28-32]Fig.2 Reduction of Ms as a function of alloying element M in Ti-M binary alloys and Ti-Nb-M ternary alloys[28-32]

表3 Ti-Nb,Ti-Mo和Ti-Ta二元亚稳β钛合金的力学性能Table 3 Mechanical properties of metastable Ti-Nb,Ti-Mo and Ti-Ta binary alloys
除了β稳定元素外,新型医用β钛合金一般会同时加入中性元素Zr和Sn。Zr和Sn对β转变温度影响较小,但在α和β相中均有较大的固溶度,起固溶强化作用。当Zr和Sn与其他β稳定元素复合添加时,能够降低Ms,有效抑制α″和ω的析出,获得低弹性模量,如Ti-24Nb-4Zr-8Sn[26]。Miyazaki等[41]指出,在Ti-Nb-Zr中每增加1%(原子分数)Zr,Ms降低35 K;在Ti-Nb-Sn中每增加1%(原子分数)Sn,Ms降低150 K,而在Ti-Nb-Zr-Sn中Ms仅降低80 K[42]。Zr和Sn的β相稳定作用受合金体系的影响,可能与合金化元素之间的交互作用有关,关于Zr和Sn与其他元素复合添加对β相稳定性的影响机理尚不完全清楚。此外,Zr和Sn可以提高β-TiNb合金的应力诱发马氏体相变和位错滑移的临界应力,从而获得更高的超弹性和形状记忆效应。
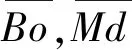

图3 Ti-22Nb-xO(原子分数/%)的拉伸应力-应变曲线(a)[43]以及Ti-38Nb-0.5O与Gum metal的拉伸性能对比(b)[22,46]Fig.3 Tensile stress-strain curves of Ti-22Nb-xO (atom fraction/%) alloys(a)[43] and comparison of tensile properties between Ti-38Nb-0.5O and Gum metal(b)[22,46]
3.2 Ti-Nb二元合金的组织与性能
Ti-Nb二元合金的弹性模量随Nb含量的变化趋势呈“W”形[52],如图4(a)[52]所示,这与不同Nb含量的合金相组成和β相结构稳定性变化密切相关。当Nb含量分别约为16%和40%时,合金的主要相组成分别为α″马氏体和亚稳β相,具有最低的弹性模量。当Nb含量低于14%时,为α′相,此时随Nb含量的降低,弹性模量逐渐升高;当Nb含量高于40%时,弹性模量随Nb含量的增加而增加;而当Nb含量位于16%~40%之间时,由于存在ω相,弹性模量随Nb含量的增加先升高后降低,在28%时达到最大。
Kim等[33]研究发现,β-TiNb二元合金具有低弹性模量、超弹性和形状记忆等特性。Ti-Nb二元合金的力学性能强烈依赖于Nb含量,如图4(b)所示。低β相结构稳定性容易引起应力诱发β→α″马氏体相变,出现双屈服现象,初始屈服强度低至200 MPa以下,控制Nb含量在40%附近时可获得低弹性模量,且具有一定的超弹性和形状记忆效应[33,53]。Ti-45Nb合金的应力诱发马氏体相变被抑制,但Nb的固溶强化作用弱,合金的强度低。添加其他合金元素如Mo,Zr,Sn和O等,可以对相组成、相稳定性和弹性模量进行调控,获得低弹性模量和高强度,改善超弹性和形状记忆效应,由此发展出三元和多元Ti-Nb基生物医用钛合金。
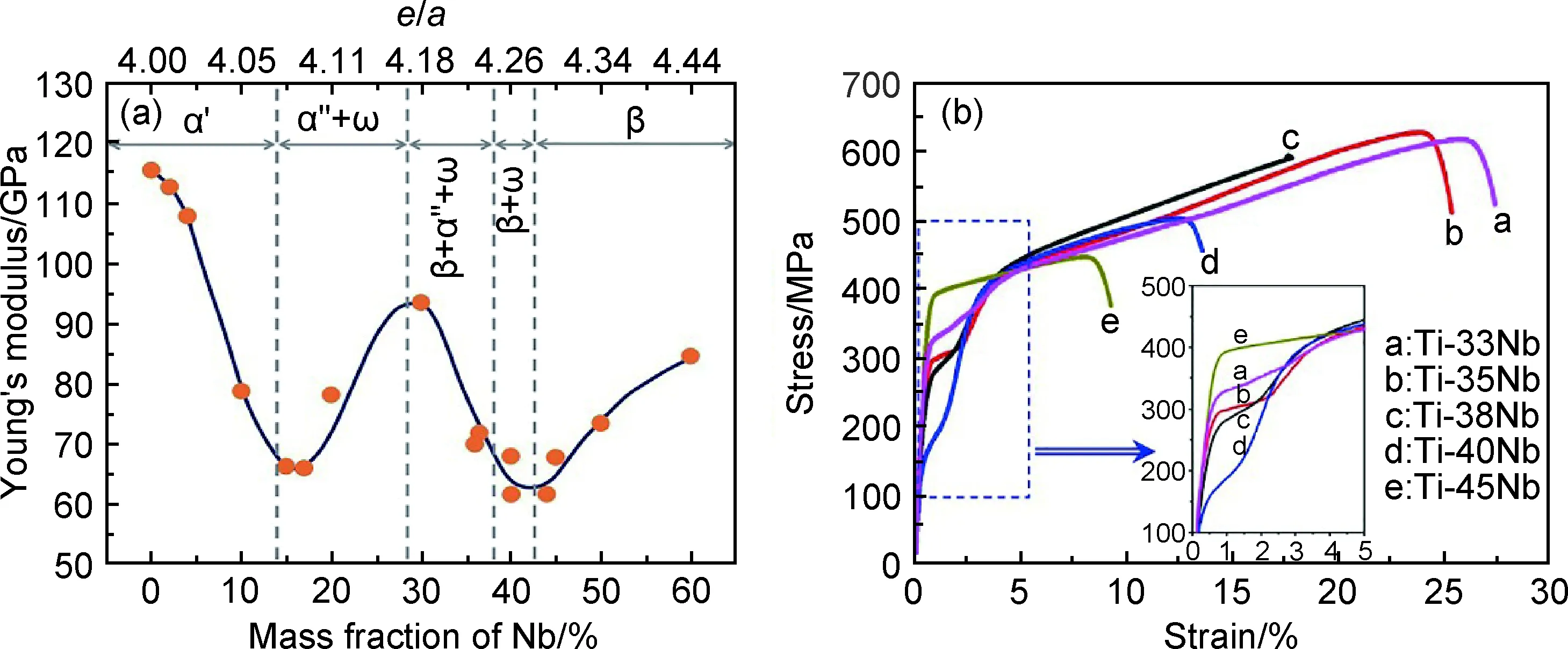
图4 Ti-Nb二元合金的弹性模量与相组成(a)[52]和拉伸应力-应变曲线(b)随Nb含量的变化Fig.4 Evolution of Young’s modulus and phase constituents (a)[52] and tensile stress-strain curves (b) of Ti-Nb binary alloys as a function of Nb contents
3.3 Ti-Nb基钛合金的发展现状
通过多元合金化进一步降低弹性模量,提高强度,改善超弹性和形状记忆效应,是拓宽Ti-Nb合金在生物医学领域应用的关键。目前,世界各国通过添加Mo,Zr,Sn,Ta等生物友好元素以及间隙元素O,研发了一系列低弹性模量Ti-Nb基生物医用钛合金,部分列于表4[7,25,27,37,46,54-79]。由于Ti-Nb二元合金塑性较好,通过热机械处理可以大幅度提高强度。例如,Zhao课题组[55]通过冷轧后进行低温退火,利用细小弥散的α相、高密度位错和晶界抑制应力诱发α″马氏体相变,在保持低弹性模量(56 GPa)的情况下,将Ti-38Nb的屈服强度和抗拉强度分别提高至850 MPa和1020 MPa。日本学者Kim等[33]研究了Ti-Nb二元合金的超弹性和形状记忆效应,Ti-(22~25)Nb(原子分数/%)具有形状记忆效应,Ti-(25.5~27)Nb(原子分数/%)具有超弹性,由于Ti-Nb二元合金较低的应力诱发α″马氏体相变临界应力、位错滑移临界应力和马氏体相变应变(martensitic transformation strain),超弹性最大为3%。

表4 医用Ti-Nb基合金的组织类型与力学性能Table 4 Phase constitutions and mechanical properties of biomedical Ti-Nb based alloys
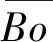
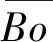
4 医用钛合金的制备技术
通过各种制备技术对新型医用钛合金组织结构进行调控,可以提高其综合性能,目前研究人员针对医用钛合金的形变热处理、大塑性变形、表面改性、多孔化和增材制造技术等开展了大量的研究。
4.1 形变热处理技术
通过冷/热加工与热处理相结合的形变热处理方法调控钛合金的微观组织,可以改善高强度和低弹性模量匹配,提高超弹性和形状记忆效应。为了获得低弹性模量,β型钛合金一般采用β单相区固溶淬火获得单一β相,但低的β相结构稳定性容易导致低屈服强度。通过后续时效处理析出α和ω相可以提高强度,但伴随着弹性模量升高和塑性降低[86]。低弹性模量亚稳β钛合金的低强度源自其本征低β稳定性,Zhao等[55,71,87]通过冷轧获得超细晶,并进行后续低温短时退火处理,引入大量晶界和位错等抑制应力诱发马氏体相变,稳定具有本征低弹性模量的亚稳β相,同时获得了超低弹性模量和高强度。形变热处理的关键在于引入各种强化因素提高强度,抑制宏观长程马氏体相变,但应尽量降低β相结构稳定性,以此实现高强度和低弹性模量匹配。在轧制后进行退火处理,调控β晶粒尺寸和α相的析出,或低温时效析出一定等温ω相,可提高位错滑移的临界应力,改善超弹性和形状记忆效应[88-89]。此外,形变热处理还能形成特定织构,对降低弹性模量和改善超弹性和形状记忆效应有利[53,90]。如前所述,α′和α″马氏体亦能获得低弹性模量,但由于应力作用下马氏体变体的自协作(reorientation)作用,导致α′和α″型钛合金的屈服强度较低。最近研究发现,利用高压固溶处理获得的纯α″型Ti-30Zr-5Al-3V的弹性模量低至34 GPa[91]。Hanada等[65]采用冷轧预变形使Ti-35Nb-4Sn诱发大量α″马氏体,弹性模量降低至42 GPa,同时实现强度提升。经冷轧细化晶粒后,α′型Ti-15Nb-9Zr[57]和Ti-10Nb-2Mo-4Sn[25]弹性模量分别为39 GPa和41 GPa,抗拉强度超过850 MPa。
由于对低弹性模量的要求,医用钛合金的形变热处理一般应尽可能避免析出高弹性模量的α和ω相。然而,通过在两相区形变热处理调控等轴α相的大小和数量,亦可使具有低β相结构稳定性的亚稳β型Ti-Nb合金获得低弹性模量。最近,本课题组提出基于电子理论的合金成分设计和基于β基体稳定性的组织调控方法,通过析出超细等轴α产生的元素再分配调控剩余β基体的结构稳定性至能获得低弹性模量的范围,利用低稳定性的β基体提供低弹性模量和超细等轴α相提供强化,获得了低弹性模量和高强度匹配[47,77,92]。进一步研究形变热处理调控β稳定性和α的析出、形貌、数量和分布等,是制备低弹性模量、高强度Ti-Nb基医用钛合金的研究方向之一。
4.2 大塑性变形方法
与粗晶材料相比,超细晶/纳米晶材料可以获得更高的强度、硬度和疲劳性能。针对医用钛合金,研究人员采用等通道转角挤压(equal channel angle pressing,ECAP)、累积叠轧(accumulative roll bonding,ARB)、高压扭转(high pressure torsion,HPT)和搅拌摩擦加工(friction stir processing,FSP)等大塑性变形晶粒细化方法开展了相关工作。Hohenwarter等[93]通过HPT将Ti-45Nb的晶粒尺寸从15 μm细化至50 nm,强度从450 MPa提升至990 MPa以上。Inoue等[94]利用冷轧大变形将Ti-18Nb-17Zr的晶粒细化为约5 nm,在弹性模量为55 GPa时强度提高至1100 MPa,弹性应变极限约为2%。于振涛等[95]利用改进的ARB法将Ti-25Nb-3Zr-2Sn-3Mo(TLM)合金板材的晶粒细化至80~300 nm,弹性模量为62~70 GPa,抗拉强度达到了995~1050 MPa。Arockiakumar等[96]利用ECAP将Ti-40Nb-0.3O的晶粒尺寸细化至1 μm,并利用随后的退火处理析出细小α相,降低应力诱发马氏体相变临界应力和提高位错滑移临界应力,从而改善了合金的超弹性。FSP主要应用于Ti-6Al-4V,进行合金表面超细晶化/纳米化[97]。本研究团队利用传统轧制退火工艺获得了等轴超细α+β双相组织,实现了良好的低弹性模量和高强度匹配[47]。针对新型医用钛合金,大塑性变形方法主要应用于改善本征低弹性模量钛合金的强度,关于大塑性变形表面改性的研究较少。利用表面喷丸、机械碾磨和搅拌摩擦加工等[98]表面纳米化技术不仅能提高材料的力学性能,还可使其具备纳米生物学的优点,提高钛合金的表面活性,有利于细胞黏附增殖,提高耐磨性,但目前关于新型医用钛合金的研究较少。
4.3 多孔化技术
多孔化方法可以进一步降低弹性模量至与人体骨骼相匹配的水平,且多孔结构及粗糙的表面有利于成骨细胞的黏附、增殖和分化,促进新骨组织的再生与重建,加快愈合过程。此外,多孔钛合金受到应力作用时,还存在较长的应力平台区,可以有效地缓冲外来应力,起到减震和抗冲击效果[99]。目前,医用多孔钛合金制备方法主要有液态成孔法、固态成孔法、气态成孔法和水溶液成孔法,其中以固态成孔法中的粉末冶金法的研究和应用最多。Rao等[100]利用NH4HCO3作为发泡剂,将TiH2与Nb,Zr粉末复合,制备出不同孔隙率(6.06%~62.80%)的多孔Ti-20Nb-15Zr合金,其力学性能与孔隙率及孔洞大小密切相关,弹性模量在1.2~10.8 GPa之间。邵烨[101]利用粉末冶金法制备了多孔Ti-39Nb-6Zr钛合金,弹性模量低至3.5 GPa左右。研究发现,随着孔隙率的提高,多孔材料的压缩强度和弹性模量急剧下降;粉末粒度对多孔材料的屈服强度和弹性模量也有一定的影响,在相同孔隙率下,粉末越细,多孔材料的力学性能越好。王玺涵等[102]在常规粉末冶金法的基础上对成形方法和烧结工艺进行了优化,制得的多孔Ti-24Nb-4Zr-8Sn合金孔隙率为20%~30%,弹性模量为6~20 GPa,抗压强度为140~432 MPa,与人体皮质骨相当。Nouri等[103]采用粉末冶金法制备多孔Ti-4Nb-16Sn合金,获得的弹性模量为0.3~2 GPa,抗压强度为7~14 MPa,与人体松质骨的力学性能基本接近。粉末冶金法多用于制备形状简单的多孔钛合金,其生产工艺简单,工艺参数可控性强,制备孔隙率范围宽,但孔隙结构不易控制,必须对工艺参数进行精确调控,才能获得优异的综合性能。此外,还可利用增材制造技术制备复杂形状的多孔钛合金,并对孔隙结构进行精细调控,制备的Ti-35Nb-2Ta-3Zr合金兼具低模量(约3.1 GPa)和超弹性[104]。
4.4 表面改性技术
钛合金是生物惰性材料,植入生物组织后会在表面形成纤维膜,影响与周围组织间的结合。另外,钛合金在体内长期服役时,有可能产生有害的金属颗粒或碎屑,这些微粒容易与体液发生化学反应,导致局部组织磨损,产生炎症和毒性反应等。因此,对钛合金植入物进行表面改性,提高钛合金的生物活性、耐磨性、耐腐蚀性和生物学行为等,研究其与生物组织之间的相互作用和微观机制,是医用钛合金重要的研究方向。用于生物医用金属材料的表面改性技术主要有机械法(研磨、抛光和表面喷丸等)、物理法(离子注入、激光表面改性和物理气相沉积等)、化学法(电化学处理、微弧氧化和化学气相沉积等)和生物化学法等[98]。目前对钛合金表面改性主要关注其改性后的生物学性能,主要研究对象为纯钛和Ti-6Al-4V。有学者[105-107]分别将苯乙烯磺酸钠、甲基硅氧烷、醋酸乙烯酯等引入钛表面,大幅度提高了涂层的生物活性。Rychly等[108]利用植入材料与细胞之间基体透明质酸带负电的特性,在钛合金表面嫁接功能化氨基,引导成骨细胞,进而引导骨形成。而采用细胞学和分子生物学方法将蛋白质、细胞生长因子和酶等固定在支架表面,可有效提高钛合金植入物的血液相容性,减少并发症,引导内皮细胞快速准确定向生长,加快植入物内皮化速度。将具有生物活性的分子固定在血管内支架,可以明显地降低纤维蛋白原的吸附、沉积以及血小板的活化,表现出极好的生物相容性。Huang等[109]通过表面机械处理在TLM钛合金上形成纳米和超细晶粒的β-Ti层,纳米晶层的成骨细胞黏附、增殖、成熟和矿化能力显著增强。在Ti-35Nb-2Ta-3Zr表面通过微弧氧化和搅拌摩擦加工分别形成致密的Nb2O5和TiO2微/纳米复合层,极大地改善了其耐腐蚀性,搅拌摩擦加工还细化了表层晶粒,进一步增加了表面氧化层的致密度[110-111]。对Ti-Nb基钛合金进行表面改性提高其生物学性能,将促进Ti-Nb基钛合金在生物植入物领域的应用。
4.5 增材制造技术
增材制造技术又称3D打印技术,可以对植入物进行三维个性化设计,高效率制造复杂结构产品,还可以引入多孔结构,并对孔隙直径和分布进行针对性设计[112]。增材制造技术已经逐渐成为高端个性化医疗器械设计、制造和医用的重点发展趋势[113]。目前主要的增材制造技术有激光选区烧结(selective laser sintering,SLS)、激光近净成形(laser near net shaping,LENS)、电子束熔化成形(electron beam melting,EBM)和激光选区熔化(selective laser melting,SLM)等。在医学领域,目前的研究工作主要集中在Ti-6Al-4V这一传统医用钛合金[114],对低弹性模量亚稳β钛合金的研究报道较少。Fischer等[115]利用SLM技术制备了二元Ti-26Nb(原子分数/%)合金,其力学性能与传统熔炼制备的Ti-26Nb(原子分数/%)合金相近。Hernandez等[116]采用EBM技术制备了块体Ti-24Nb-4Zr-8Sn,在β基体中观察到了厚度为60 nm左右的板条状α″相,合金的硬度约为2.5 GPa。Yang等[117]采用SLM方法制备了具有双峰晶粒结构的Ti-24Nb-4Zr-8Sn,表现出比锻造态合金更高的强度和塑性。Liu等[118]采用SLM和EBM制备了多孔Ti-24Nb-4Zr-8Sn支架,弹性模量仅为0.95 GPa。Hariharan等[119]通过调控增材制造工艺和后续热处理制度,在Ti-13Nb-13Zr中保持较低弹性模量的同时,实现了良好的强塑性匹配。最近,Kong等[120]对Ti,Nb,Ta和Zr纯元素粉末进行混合和SLM打印,制备的合金具有较高的强塑性和生物相容性。由于增材制造特殊的凝固和冷却过程,增材制造亚稳β钛合金的组织结构随着合金成分和工艺参数发生明显的变化。近期Alabort等[2]提出了基于最优增材制造工艺参数和低弹性模量合金成分要求的医用β钛合金设计与制备方法,采用该方法研发的新型β钛合金具有较大的工艺窗口,获得了强度、塑性和弹性模量的良好匹配。利用患病部位的CT扫描成像辅助三维建模,增材制造技术可以制造个性化的钛合金医疗器械[121]。于振涛等[122]利用有限元分析了钛合金材料、多孔结构对梯度多孔材料力学性能的影响,最后通过激光选区熔化技术制备出类骨小梁组织的多孔TLM钛合金植入物。
5 结束语
提高生物相容性和力学相容性是发展生物医用钛合金的重要目标。以Ti-Nb基为代表的医用亚稳β钛合金具有优异的生物相容性、低弹性模量和良好的功能特性等特点,在医用植入材料领域有着广阔的应用前景。但采用传统的合金设计与制备方法往往难以兼具低弹性模量和高强度的匹配。目前进入临床应用的亚稳β型医用钛合金只有少数几种,进一步降低β钛合金的弹性模量,提高强度、疲劳性能和功能特性等综合性能是扩大其应用的关键,建议可以从以下方面进行深入研究:(1)深入研究多元合金中元素之间的交互作用机理及其对相结构稳定性、弹性模量和强韧性的影响机制,明确Zr,Sn和O等元素的β稳定作用及其与其他合金元素的交互作用机制;(2)开展兼具高强度和低弹性模量的钛合金设计与制备技术研究,探索合金的成分设计与组织性能调控方法,研究β单相和α+β双相钛合金的微观组织特征对弹性模量、屈服强度、耐磨性能和疲劳性能等综合力学性能的影响,揭示不同相含量和相结构稳定性耦合下钛合金的微观力学机制;(3)探索基于大塑性变形、增材制造等工艺特点的合金成分设计方法和制备技术,研究不同工艺条件下亚稳β钛合金的组织演变及其对力学性能和功能特性的影响机制,开发综合性能优异的医用亚稳β钛合金及其医疗器械。
