不同肠道手术方式对肠道受侵上皮性卵巢癌患者预后的影响
2023-02-16蒋亚萍杨宏英汪昊涵宁显灵杨谢兰
蒋亚萍,杨宏英,汪昊涵,宁显灵,杨谢兰
(云南省肿瘤医院/昆明医科大学第三附属医院妇科,云南 昆明 650118)
上皮性卵巢癌恶性程度高,死亡率高[1],目前晚期上皮性卵巢癌的治疗模式主要为肿瘤细胞减灭术及以铂为基础的联合化疗和化疗后的维持治疗。研究证明,手术后残留病灶的大小是晚期卵巢癌患者最重要的独立预后因素,术后无肉眼残留病灶的患者,中位无复发生存期和总生存期比残留病灶直径在 0~1 cm 的患者及残留病灶直径大于 1 cm 的患者更长[2]。因此,肿瘤细胞减灭术的目标是满意减瘤(残留病灶≤1 cm)。然而对于那些肿瘤已盆腹腔广泛种植的晚期卵巢癌患者,往往需要行肠道手术才能实现满意减瘤。有研究表明[3],在卵巢癌减瘤术中行受累部位肠切除一期吻合是安全有效的,其术后并发症是可接受的。但是,很多研究都显示,尽管在减瘤术中接受肠切除后达到满意减瘤的患者预后较好,但其术后并发症如肠瘘的发生率却随之增加[4-6]。非粘液性上皮性卵巢癌最常见的转移途径是沿腹膜表面种植,最常累及的肠道是结肠及直肠,并且大多数肿瘤只浸润至肠壁浆膜和浆膜下层,因此,如果这些患者可以仅通过肿瘤剥除而实现满意减瘤,不仅可以保留肠道,还可以使妇科医生的手术难度降低,在手术准入制度及分工精细的今天,更具有现实意义。但仅行肿瘤剥除的手术模式安全性及有效性还存在争议。一些研究认为,单纯的肠壁肿瘤切除可能会留下微小病灶,从而使患者的生存率降低[7-8],然而也有研究认为,保留肠道的肿瘤剥除不会影响晚期卵巢癌患者的预后[9]。因此,本研究旨在比较接受肠切除与单纯肿瘤剥除2 种肠道手术方式的患者的生存结果,评估2种手术方式的安全性及可行性,为临床实践提供理论依据。
1 资料与方法
1.1 研究对象
回顾性分析2017 年6 月至2021 年6 月在云南省肿瘤医院初诊治疗并接受肠道手术的晚期上皮性卵巢癌患者的病例资料,共56 例患者纳入本研究,平均年龄52.93 岁,其中行肠局部肿瘤剥除术的有23 例(41.1%),20 例(86.96%)达到满意减瘤;另外 33 例患者(58.9%)行受累部位肠道及肿瘤切除并使用吻合器吻合,其中3 例同时行预防性肠造瘘,满意减瘤患者21 例(63.6%),减瘤术中最常切除的肠段是乙状结肠及直肠16 例(28.5%),其次是右半结肠5 例(8.9%)。
纳入标准[10]:(1)经病理确诊为非粘液性上皮性卵巢癌;(2)所有患者均由云南省肿瘤医院妇科同一位妇瘤专家及其团队完成肿瘤细胞减灭术,并在相对固定的普外科医生协助下同时行肠道手术;(3)所有治疗均在云南省肿瘤医院完成。排除标准:(1)同时合并其他恶性肿瘤;(2)合并严重内科疾病影响生存期;(3)病例资料缺失或失访。收集符合纳排标准患者的各项临床资料,包括年龄、术前实验室值、是否行新辅助化疗、病理类型、病理分级、FIGO 分期、手术方式、腹水量、失血量、围手术期并发症、术后化疗情况等。本研究经昆明医科大学第三附属医院(云南省肿瘤医院)伦理委员会批准,所有患者均知情同意。
1.2 治疗与随访
所有入组患者均常规行全子宫、双附件、大网膜、受累盆腔腹膜的切除术,并根据术中探查情况行肿瘤细胞减灭术,将无肉眼可见残留病灶(R0)及单个肉眼可见残留病灶≤1 cm(R1)定义为满意减瘤;将单个肉眼可见残留病灶 > 1 cm(R2)定义为不满意减瘤。采用手术复杂性评分(surgical complexity score,SCS)[11]评估手术难度,并使用Clavien-Dindo 并发症分类系统(claviendindo classification,CDC)[12]分级记录手术并发症,如患者有1 个以上的并发症,笔者在分析中仅记录最高级别。所有患者术后1 个月内接受紫杉醇联合铂类的化疗方案化疗,每3~4 周重复,通过实体瘤疗效评估标准(response evaluation criteria In solid tumors,RECIST)标准(1.1 版)[13]评估肿瘤治疗后反应,经门诊或电话随访至2022 年7 月31 日,记录患者的无进展生存期(progression-free survival,PFS)、和总生存期(overall survival,OS)。PFS 被定义为从治疗开始日期到疾病复发或最后1 次随访日期的时间间隔,而OS 被定义为从治疗开始日期到癌症相关死亡或最后1 次随访日期的时间间隔。
1.3 统计学处理
采用SPSS26.0 进行统计学分析,连续数值型变量服从正态分布采用t检验,以均数±标准差()表示,不服从正态分布采用Mann-Whitney U 检验,以中位数(四分位数间距)[M(P25,P75)] 表示,计数资料采用χ2检验,以频数(百分数)[n(%)]表示。采用Kaplan-Meier 法Logrank 检验进行生存分析,P< 0.05 表示差异具有统计学意义。
2 结果
2.1 肠切除组和肿瘤剥除组的手术情况比较
按照肠道手术方式进行分组,比较肠切除组和肿瘤剥除组之间的患者信息和手术结果,见表1。2 组患者在年龄、体重指数、术前CA125水平、腹水量、满意减瘤率、复发率及死亡率方面,差异无统计学意义(P> 0.05),但与肿瘤剥除相比,肠切除患者的手术时间更长(300/240 min,P=0.006)、手术难度更大(7 分/4 分,P< 0.01)、术中失血量更多(1 050/500 mL,P=0.014),输血量也更多(1 300/900 mL,P=0.012),差异有统计学意义。肠切除组中,浆膜层及肌层受侵的患者有29 例(87.9%),而侵犯黏膜的仅有4 例(12.1%),肿瘤剥除组的肠壁浸润深度无法从手术记录及术后病理检查获取,未行统计。
表1 2 组患者一般资料及手术情况比较[()n(%)/M(P25,P75)]Tab.1 Comparison of general information and operation between two groups[()n(%)/M(P25,P75)]

表1 2 组患者一般资料及手术情况比较[()n(%)/M(P25,P75)]Tab.1 Comparison of general information and operation between two groups[()n(%)/M(P25,P75)]
*P < 0.05。
2.2 术后并发症
患者术后并发症如表2 所示,肠切除组术后并发症的发生率大于肿瘤局部切除组,差异有统计学意义(P=0.039),其中最常见的并发症为大便习惯改变(23 例,41.1%),其次为感染(17 例,30.2%)、胸腔积液(11 例,19.6%)、输血(9 例,16.1%)、血栓栓塞(6,10.7%)、肠梗阻(5 例,8.9%)、切口延迟愈合(4 例,7.1%)、吻合口瘘(2 例,3.6%),吻合口瘘均发生在肠切除组。
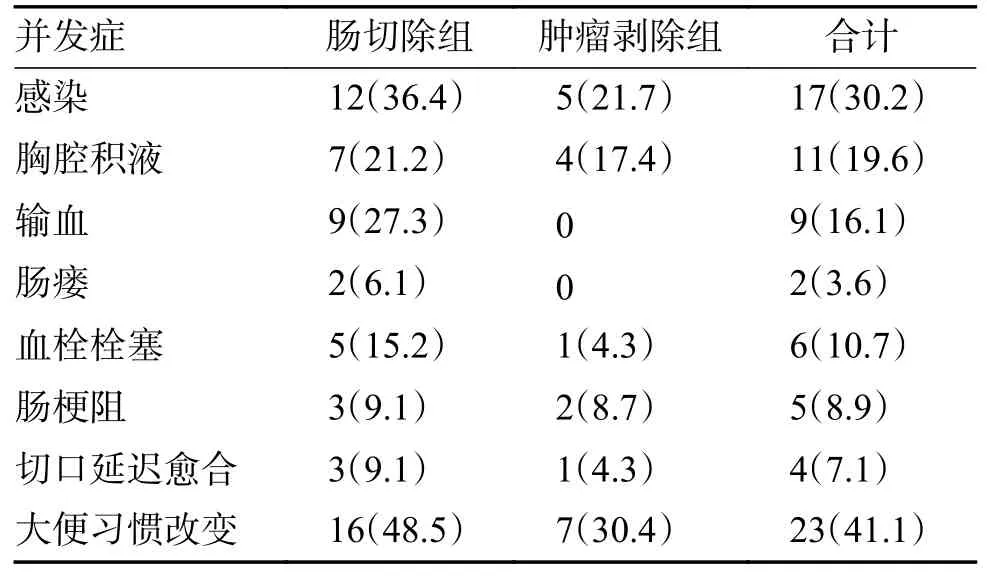
表2 术后并发症发生情况[n(%)]Tab.2 The incidence of postoperative complications[n(%)]
为进一步比较2 组术后并发症严重程度,按Clavien-Dindo 分级进行记录,CDC 评分0~2 分记为轻度并发症,CDC 评分3~5 分组为重度并发症,2 组患者术后轻重度并发症频数比较如表3 所示。肠切除组严重并发症发生率为33.3%,肿瘤剥除组严重并发症发生率为17.4%,2 组的严重并发症发生率,差异无统计学意义(P=0.185)。

表3 2 组患者术后并发症严重程度比较[n(%)]Tab.3 Comparison of the severity of postoperativecomplications between the two groups [n(%)]
2.3 生存分析
以治疗开始日期为研究起点,疾病复发、死亡或最后1 次随访日期为研究终点,根据肠道手术的类型,使用Kaplan-Meier 方法与 log-rank 检验比较肠切除组和肿瘤剥除组的累积生存率。如图1 所示,肠切除组和肿瘤剥除组的PFS 中位值分别为31 个月(95%CI:15.569~46.431)、19 个月(95%CI:10.223~27.777),OS 的中位值未达到,见图2。2 组PFS 及OS 的Kaplan-Meier 曲线,差异无统计学意义(P=0.534,P=0.884)。
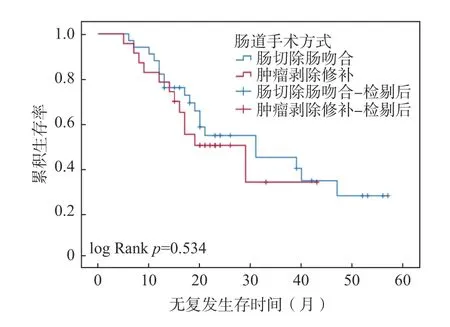
图1 肠切除或肿瘤剥除的无复发生存时间对比Fig.1 Comparison of PFS between the two groups
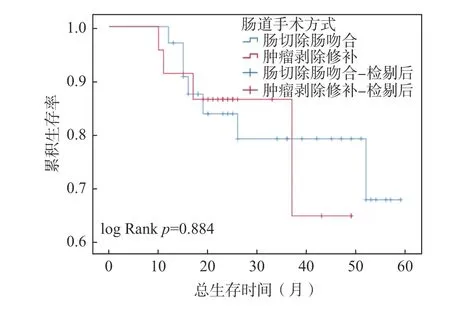
图2 肠切除或肿瘤剥除的总生存时间对比Fig.2 Comparison of OS between the two groups
3 讨论
卵巢癌的转移途径主要为直接蔓延和腹腔内扩散,文献中报道的晚期卵巢癌最常见的转移部位就是肠道[14],特别是直肠和乙状结肠,有的甚至侵犯肠壁全层浸润生长而形成肠梗阻,严重影响患者的生存。因此,要想达到满意减瘤,肠道手术不可避免。
在本研究中,笔者比较了晚期上皮性卵巢癌减瘤术中受累部位肠切除及肿瘤剥除2 种手术方式的生存结局及术后并发症发生情况。笔者发现,仅接受肿瘤剥除的患者满意减瘤率高于肠切除的患者[20 例(86.9%),21 例(63.6%),P=0.08],尽管2 组的满意减瘤率差异不明显,但在没有切除肠道的情况下,肿瘤同样可以得到较好的控制。另外,在24.5 个月的中位随访时间里,2 组患者的复发率及死亡率,PFS 及OS 同样差异无统计学意义,这意味着单纯肿瘤剥除与肠切除一样可以有效安全的切除肿瘤。然而,行肠道切除的患者较肿瘤剥除的患者往往要面对手术时间更长、术中失血量更多、输血量更多、术后恢复更慢等问题,这与既往研究相符[15-16]。为进一步比较2 种手术方式的安全性,笔者分析了入组患者的术后并发症发生情况,结果显示,肠切除组术后并发症的发生率明显高于肿瘤剥除组,并且2 例吻合口瘘均发生在肠切除的患者中,1 例经保守治疗愈合,另1 例经2 次手术肠造瘘,除此之外,行肠切除的患者有48.5%出现大便习惯的改变,例如长期稀便、便秘、腹泻便秘交替、大便次数增多等,这些并发症从生理及心理上影响着患者的生活。在Plott 等[16]的一项前瞻性病例对照研究中,比较了全直肠乙状结肠切除术与部分直肠乙状结肠切除术在围手术期并发症、生活质量、复发率和总生存期等方面的差异,结果发现,2 组患者的满意减瘤率(分别为92%和96%)和5 年生存率(分别为48%,52%)差异无统计学意义,而在术中、围手术期并发症方面差异有统计学意义,这一结果与本研究结果相似,因此,就长远来说,肿瘤细胞减灭术中切除肠道,可能使患者面临更差的生活质量。
本研究中,笔者统计了肠切除组的肿瘤浸润深度,发现绝大多数仅侵犯肠壁的浆膜层及肌层,侵犯黏膜层的仅有4 例,长期的临床实践也发现肿瘤浸润的深度似乎与局部转移病灶的大小无明显的相关性。因此,可以通过剥除的方式将肿瘤从肠壁表面完整切除而不损伤肠道的粘膜层,从而可以仅修补而不需要行肠断切除就可能达到满意的肿瘤细胞减灭术。对于肠道多段受侵的患者,局部肿瘤的剥除术有可能避免和减少多段肠断切除的风险,从而大大降低术后肠瘘及术中预防性造瘘的风险。因肿瘤剥除组的肠壁浸润深度无法通过术前检查、手术记录及术后病理情况判断,笔者没有进一步分析肿瘤浸润深度对手术方式及预后的影响,之前的一些研究[17]已经明确了肿瘤浸润肠管的深度与患者预后有关,同时影响手术方式的选择,然而在2021 年Park 等[18]的研究认为手术方式的选择取决于肿瘤的可分离性,而不是肿瘤的浸润深度,肿瘤的可分离性对确定是否可以保留肠管更为关键,这也提示笔者,在选择肠道手术方式之前,最为重要的就是评估肠道肿瘤的浸润深度、种植范围及可分离性。
总之,晚期上皮性卵巢癌肿瘤细胞减灭术中肠道手术的最终目的是实现满意减瘤,本研究结果说明,肠切除及肿瘤剥除患者的生存结局差异无统计学意义,考虑围手术期并发症及术后生活质量,术中应充分评估,选择对患者生存最有益的手术方式,对于那些癌灶浸润肠壁浅、可分离性好、肿瘤范围小的患者,术中应尽可能保留肠道,以减少术后并发症的发生。本研究也存在一些局限性,例如在行减瘤手术时,总是优先考虑最大限度剥除局部肿瘤后再决定是否切除受侵肠道,这可能会导致肠切除组的手术时间更长;除此之外,笔者没有考虑新辅助化疗对肿瘤可切除性的影响、病例数量较少等,因此关于本研究结果还需进一步探讨。
