L-精氨酸-D-核糖的美拉德产物对花生油抗氧化活性的影响
2023-02-15章银良黄天琪郭浩彬赵宇程梦梦张丽黄圆圆
章银良,黄天琪,郭浩彬,赵宇,程梦梦,张丽,黄圆圆
(郑州轻工业大学 食品与生物工程学院,郑州 450001)
美拉德反应(Maillard reaction,MR)是指在一定条件下含羰基的碳水化合物与含氨基的氨基酸、多肽或蛋白质之间的两种基团发生缩合反应。美拉德反应产物(Maillard reaction products,MRPs)是指羰基化合物和氨基化合物形成的复杂的棕黑色聚合物[1-2]。MRPs中因为具有还原酮、呋喃、类黑精等物质而具有较强的抗氧化活性[3-5]。食品加工过程中合理利用MRPs中抗氧化活性物质的生成能够很好地提高食品的货架期、抑菌性等性能[6-7]。美拉德反应在食品热加工过程中经常发生,且MRPs能和BHA、BHT等人工合成的抗氧化剂相媲美,因此,MRPs 也被称为天然抗氧化剂[8]。多数研究表明MRPs对脂质氧化具有较好的抑制作用[9]。阮雁春等[10]将花生蛋白水解物和半乳糖反应产生的MRPs应用于猪肉脯中,发现MRPs能够很好地抑制猪肉脯中蛋白和脂质的氧化,起到护色和抗氧化的作用。葛伟等[11]研究表明超声处理的酪蛋白-葡萄糖的MRPs具有很好的抗脂质体氧化能力。章银良等[12]应用L-赖氨酸和D-阿拉伯糖反应产生的MRPs与人工合成的BHA对肉馅进行抗氧化活性比较,发现6% MRPs的处理组与添加0.02%BHA的肉馅抗氧化程度相近。
脂质的氧化是造成食品变质的重要原因之一[13],油脂的氧化主要分为4种,分别是自动氧化、光氧化、酶促氧化和热氧化[14]。其中自动氧化占比最大,自动氧化过程主要分为诱导过程、自由基链式反应过程和二级氧化产物生成过程[15]。油脂氧化自由基链式反应过程中会产生大量自由基(R·、RO·、ROO·),由于自由基存在时间较短,因此很难被捕捉到,电子自旋共振技术(electron spin resonance,ESR)能利用自由基的顺磁性直接以谱图的形式反映出自由基的含量以及种类,能够很好地借助其阐述油脂氧化的过程[16-17]。本文旨在利用ESR技术测定氧化前期的自由基总量和自由基种类,以及过氧化值(POV)、茴香胺值(AV)、2-硫代巴比妥酸值(TBA),从不同阶段类比研究L-精氨酸-D-核糖的MRPs与常见的抗氧化剂(BHA、TBHQ、茶多酚)对花生油的抗氧化效果,为完善天然抗氧化剂的检测方法和深入研究MRPs提供了参考依据。
1 材料、设备与方法
1.1 试剂与材料
花生油(未添加抗氧化剂):郑州市紫竹路农贸市场;D-核糖(AR)、L-精氨酸(AR):北京索莱宝科技有限公司;冰乙酸(AR):天津市富宇精细化工有限公司;正丁醇(AR)、氢氧化钠(AR)、可溶性淀粉、无水乙醇(AR):天津市永大化学试剂有限公司;三氯甲烷(AR)、盐酸(AR):烟台市双双化工有限公司;1,1-二苯基-2-苦肼基自由基(DPPH) (AR,进口试剂);丁基羟基茴香醚(BHA)(AR)、叔丁基对苯二酚(TBHQ)(AR)、异辛烷(AR)、N-叔丁基-α-苯基硝酮(PBN)(97%)、P-茴香胺(AR)、硫代硫酸钠(AR)、碘化钾(AR)、2-硫代巴比妥酸(AR)、5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)(AR):上海麦克林生化科技有限公司。
1.2 仪器设备
SQP电子天平 赛多利斯科学仪器(北京)有限公司;电子顺磁共振波谱仪 美国布鲁克科技(北京)有限公司;FE20 pH计 瑞士梅特勒-托利多公司;HH-1智能型数显恒温油浴槽 巩义市予华仪器有限责任公司;HH-S水浴锅 巩义市英峪予华仪器厂;DH-400A电热恒温培养箱 北京中兴伟业仪器有限公司。
1.3 试验方法
在前期的优化试验中,我们通过均匀试验得出L-精氨酸-D-核糖的最优条件为精氨酸∶核糖为1∶1、pH 12、反应时间200 min、反应温度160 ℃,其生产的MRPs对DPPH·的清除率为64.34%。DPPH自由基清除率测定方法:MRPs稀释50倍,取500 μL与2 mL的0.5 mmol/L DPPH混合,暗反应20 min后,立即放入电子顺磁共振波谱仪的谐振腔中,待仪器自动调谐完毕后开始测量。ESR测定条件:频率9.792 069 GHz,功率5.00 mW,中心磁场3 487 G,扫描宽度100 G,调制幅度2.27 G,调制频率86.00 kHz,时间常数40.96,扫描时间83.88 s(20.97 s×4次),横坐标点数512,接收机增益3.17×103。
1.3.1 美拉德反应产物(MRPs)的制备
准确称量1.25 g D-核糖和1.25 g L-精氨酸,溶解于45 mL的去离子水中,并分别用4 mol/L的HCl溶液和6 mol/L的NaOH溶液调整pH至12.0,然后用去离子水定容至50 mL,混合均匀,转移至圆底烧瓶中,置于160 ℃恒温油浴槽中反应200 min。反应结束后快速置于冰水中冷却并进行相关测定,剩余样品置于-20 ℃冰箱中保存备用。
1.3.2 抗氧化剂待测样品的配制
取花生油置于锥形瓶中,按照GB 2760—2014《食品安全国家标准 食品添加剂使用标准》中的规定加入0.02%的BHA、TBHQ、茶多酚以及MRPs(质量分数为2%、4%、6%),超声5 min后备用。
1.3.3 自由基总量的测定
温度组:在1 mL花生油样品中加入10 mg PBN捕获剂(对照组加入6% MRPs)并超声5 min,溶解后,用10 mL的注射器将其注射进核磁管中,甩至底部。将其分别置于60,80,100,120,140 ℃的油浴锅中,加热2 min后迅速取出,置于电子自旋共振波谱仪的共振腔中,测定ESR强度(用二重积分表示)。
时间组:在1 mL花生油样品及抗氧化剂待测样品中加入10 mg PBN捕获剂,并超声5 min溶解后,用10 mL的注射器将其注射进核磁管中,甩至底部。将其置于100 ℃的油浴锅中,每隔2 min迅速取出,置于电子自旋共振波谱仪的共振腔中,测定ESR强度(用二重积分表示)。
1.3.4 花生油氧化不同自由基含量的测定
在1 mL加入不同抗氧化剂的花生油油样及未加入抗氧化剂的花生油油样中加入50 μL DMPO后超声5 min,溶解后,用10 mL的注射器将其注射进核磁管中甩至底部。将其置于120 ℃的油浴锅中,每隔1 min迅速取出,置于电子自旋共振波谱仪的共振腔中,测定ESR强度(用二重积分表示)。
仪器测定条件:中心磁场3 487 G;扫描宽度100 G;微波频率9.831 712 GHz;微波功率5 mW;调制幅度2.27 G;调制频率100 kHz;保留时间40.96 s;扫描次数4次。
1.3.5 花生油主要品质指标的检测
采用Schaal烘箱加速氧化试验研究花生油的氧化稳定性[18-19],取100 g油样于锥形瓶中。将抗氧化剂待测油样和花生油油样置于(60±1) ℃的恒温培养箱内避光保存,每隔 1 d 取样一次测定油样的过氧化值(POV)、茴香胺值(AV)和2-硫代巴比妥酸值(TBA)。茴香胺值的测定参照 GB/T 24304—2009《动植物油脂 茴香胺值的测定》;2-硫代巴比妥酸值的测定参照GB/T 35252—2017《动植物油脂2-硫代巴比妥酸值的测定 直接法》;过氧化值的测定参照 GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》中的滴定法。
1.4 统计分析
所有试验均做3次平行,采用WinEPR-Processing、Simfonia、Origin 8.0、Mathematics 4.0及其相关方法进行处理,并用SPSS软件进行显著性分析(P<0.05表示差异显著)。
2 结果与讨论
2.1 不同抗氧化剂对花生油自由基总量的影响
PBN捕获的花生油ESR谱图及拟合曲线见图1。
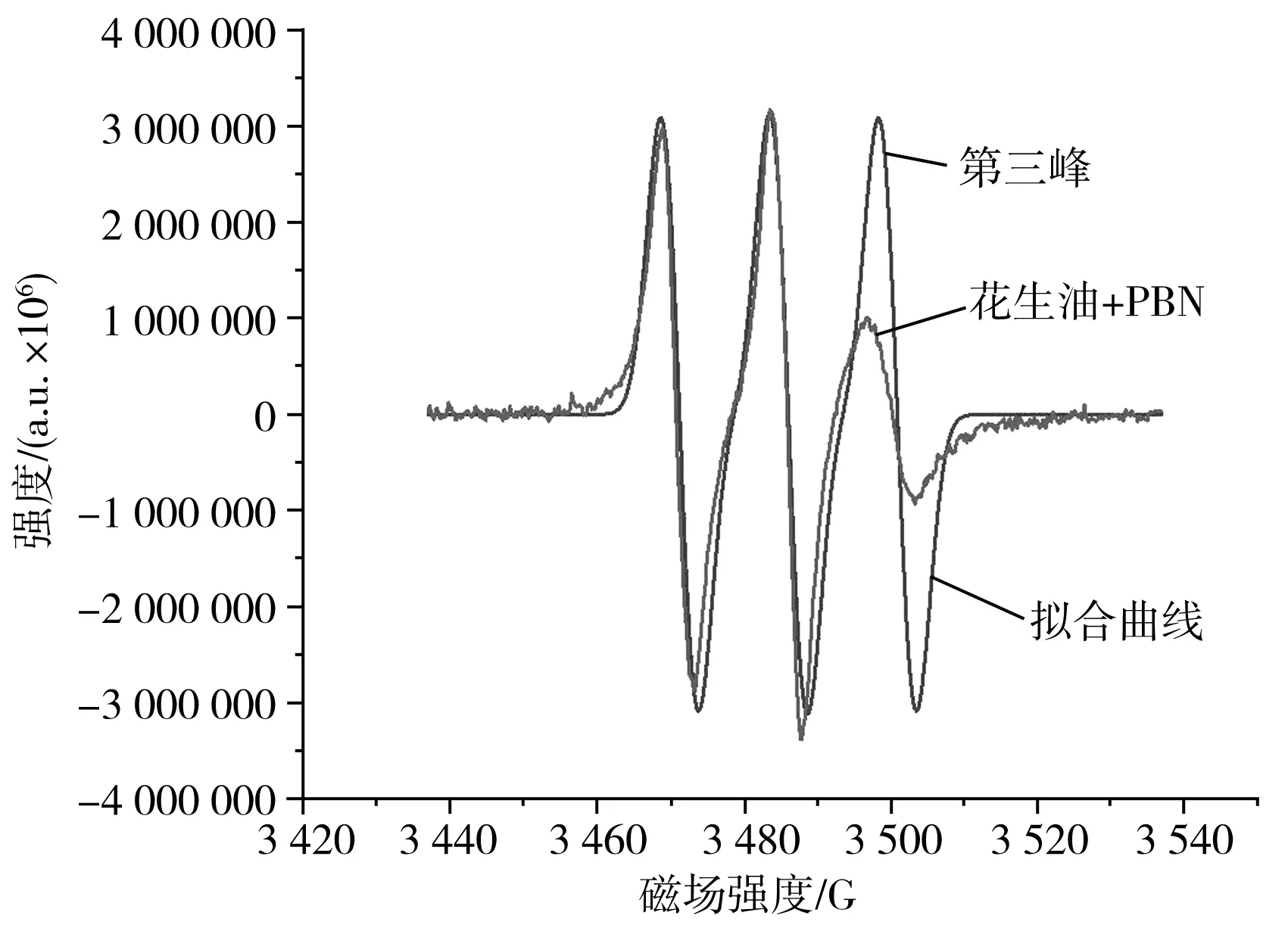
图1 PBN捕获的花生油ESR谱图及拟合曲线Fig.1 ESR spectrogram and fitting curve of peanut oil captured by PBN
PBN捕获的花生油的ESR谱图常用于表示油脂氧化生成的自由基的相对定量研究[20],其谱图的二重积分可表示为氧化前期自由基生成的总量,PBN捕获的油脂自由基由1个N核和1个H核构成,第三峰和拟合曲线不一致是因为花生油具有较大的黏性,导致实际信号和拟合信号不一致。
不同温度花生油自由基总量的影响曲线图见图2。

图2 不同温度花生油自由基总量的影响曲线图Fig.2 Effect curves of the total amount of peanut oil radicals at different temperatures
随着温度的升高,花生油氧化产生的自由基越多,且高温会导致自由基产生的速率增快,结果与李培等的研究一致。加入MRPs能够延缓油脂的氧化。在温度低于80 ℃时加入MRPs与空白组自由基总量十分接近,这说明花生油中也有一定的抗氧化活性物质,例如VE等,能够在前期对油脂氧化进行保护,而随着温度进一步升高,MRPs对油脂自由基生成的抑制作用显著提高。
不同抗氧化剂对花生油自由基总量的抑制情况见图3。
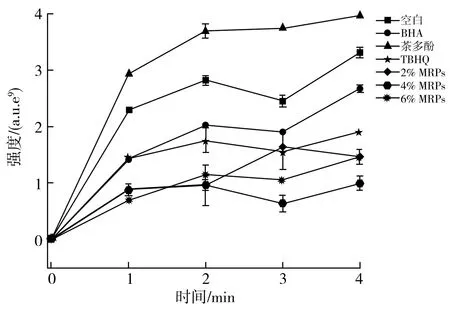
图3 不同抗氧化剂对花生油自由基总量的抑制曲线图Fig.3 Inhibition curves of different antioxidants on total amount of free radicals in peanut oil
由图3可知,随着加热时间的延长,花生油的氧化程度不断加深。根据自由基生成总量对上述抗氧化剂的抗氧化效果进行排序,即自由基清除能力大小依次为4% MRPs>6% MRPs>2% MRPs>TBHQ>BHA>茶多酚。随着MRPs浓度不断增加,其抗氧化效果也不断增强。加入茶多酚后,理论上能够提高花生油的抗氧化活性[21],高温下反而比空白花生油样产生更多的自由基,这一原因需要进一步研究。
2.2 不同抗氧化剂对花生油自由基总量的影响
不同加热时间的花生油ESR谱图见图4。
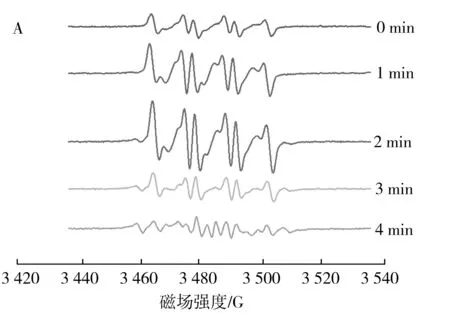

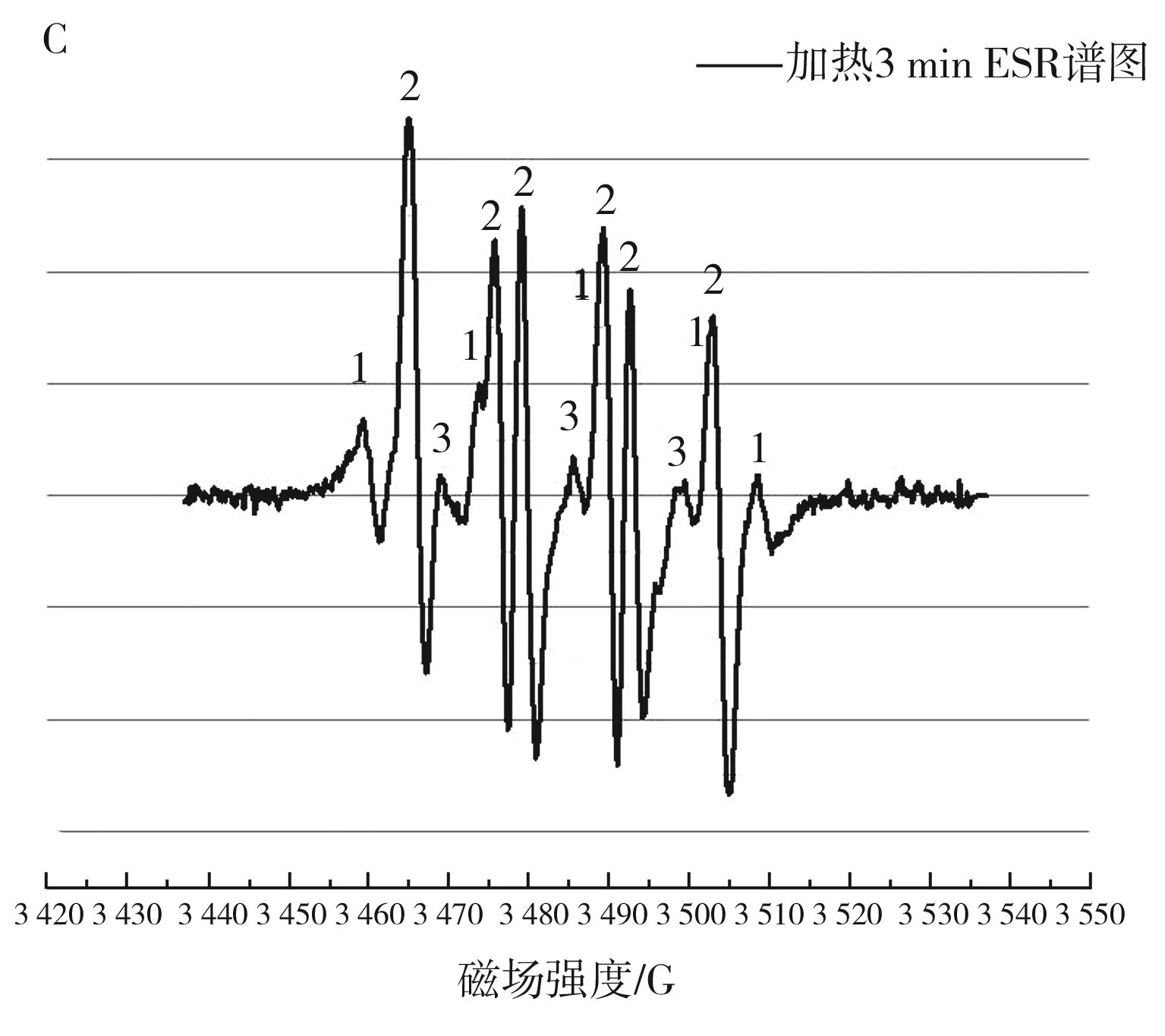

图4 不同加热时间的花生油ESR谱图Fig.4 ESR spectrograms of peanut oil heated for different time
由图4中B可知,未加热时DMPO捕获到的自由基为ROO·,而未捕获到R·,这可能是由于油样放置时间过长或注射器注射时混入过多的氧气,导致烷基自由基氧化,而随着加热时间的延长逐渐捕获到烷基自由基和DMPO-X自由基(见图4中C和D),而未捕获到RO·,RO·一旦产生则很快参与自由基链式反应而生成其他中间产物,导致其含量低,达不到仪器检测限[22]。而烷基自由基的生成说明温度的升高能够加速油脂自由基的生成,这和前期的试验结果一致,且花生油的氧化过程符合油脂氧化自由基链式反应[15]。加热3 min时的花生油ESR谱图见图4中C,其中1,2,3分别表示烷基自由基、烷过氧自由基、DMPO-X自由基。由图4中A可知,随着加热时间的延长,DMPO捕获到的花生油的ESR谱图的峰高和峰数在不断变化,且加热能够催化烷基自由基和烷过氧自由基的生成,当加热到4 min时,DMPO已经过度出现开环现象。
选取烷基自由基的第一条峰高和烷过氧自由基的第一条峰高绘制不同抗氧化剂对花生油氧化前期自由基的影响曲线图,见图5和图6。

图5 烷过氧自由基随时间变化曲线图Fig.5 Changing curves of alkyl-peroxy radicals with time

图6 烷基自由基随时间变化曲线图Fig.6 Changing of curves alkyl radicals with time
由图5可知,随着加热时间的延长,烷过氧自由基的信号强度呈现出先升高后降低的趋势,升高的原因在于加热加速油脂氧化,导致烷过氧自由基迅速积累,因此信号强度不断增大,而进一步加热,核磁管中的氧气有限,新生成的烷过氧自由基会减少,且大量的烷过氧自由基会转变为二级氧化产物[15],因此造成烷过氧自由基信号强度不断降低。此外由图5可知,添加抗氧化剂可以抑制烷过氧自由基的生成,抑制效果由强到弱依次为2% MRPs>4% MRPs>茶多酚>TBHQ>6% MRPs>BHA。此外,加入抗氧化剂的花生油样品比空白样品的烷过氧自由基的下降时间有所提前,这极有可能是抗氧化剂消耗核磁管中的氧气所致,因而对花生油具有保护作用。
由图6可知,烷基自由基随着加热时间的延长而逐渐积累,而茶多酚和TBHQ的烷基自由基含量要高于空白油样组,综上所述,由烷过氧自由基与空白油样对比可推测,茶多酚和TBHQ的作用效果极有可能是阻止油脂链式自由基中从烷基自由基向烷氧自由基和烷过氧自由基生成这一过程。随着MRPs添加量的不断增大,烷基自由基的生成量不断减少,说明烷基自由基的生成量和MRPs的添加量相关,烷基自由基量大小为:2% MRPs>4% MRPs>6% MRPs,而上述烷过氧自由基和自由基总量MRPs低于空白油样,因此MRPs也极有可能和TBHQ的作用机制一致。添加BHA的样品生成的烷基自由基的信号强度明显弱于空白组,因此BHA可抑制烷基自由基的生成且可能能够作用于链式自由基反应前期诱导作用这一过程。
2.3 不同抗氧化剂对花生油品质的影响
不同抗氧化剂对花生油品质的影响见图7~图9。
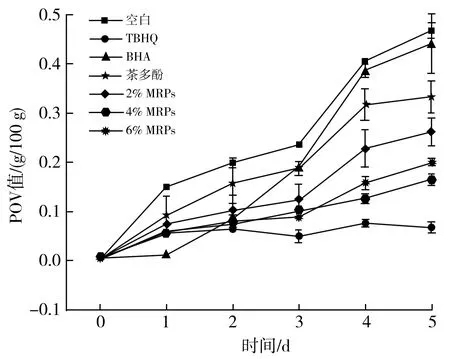
图7 不同抗氧化剂对花生油过氧化值的影响曲线图Fig.7 Effect curves of different antioxidants on the peroxide value of peanut oil
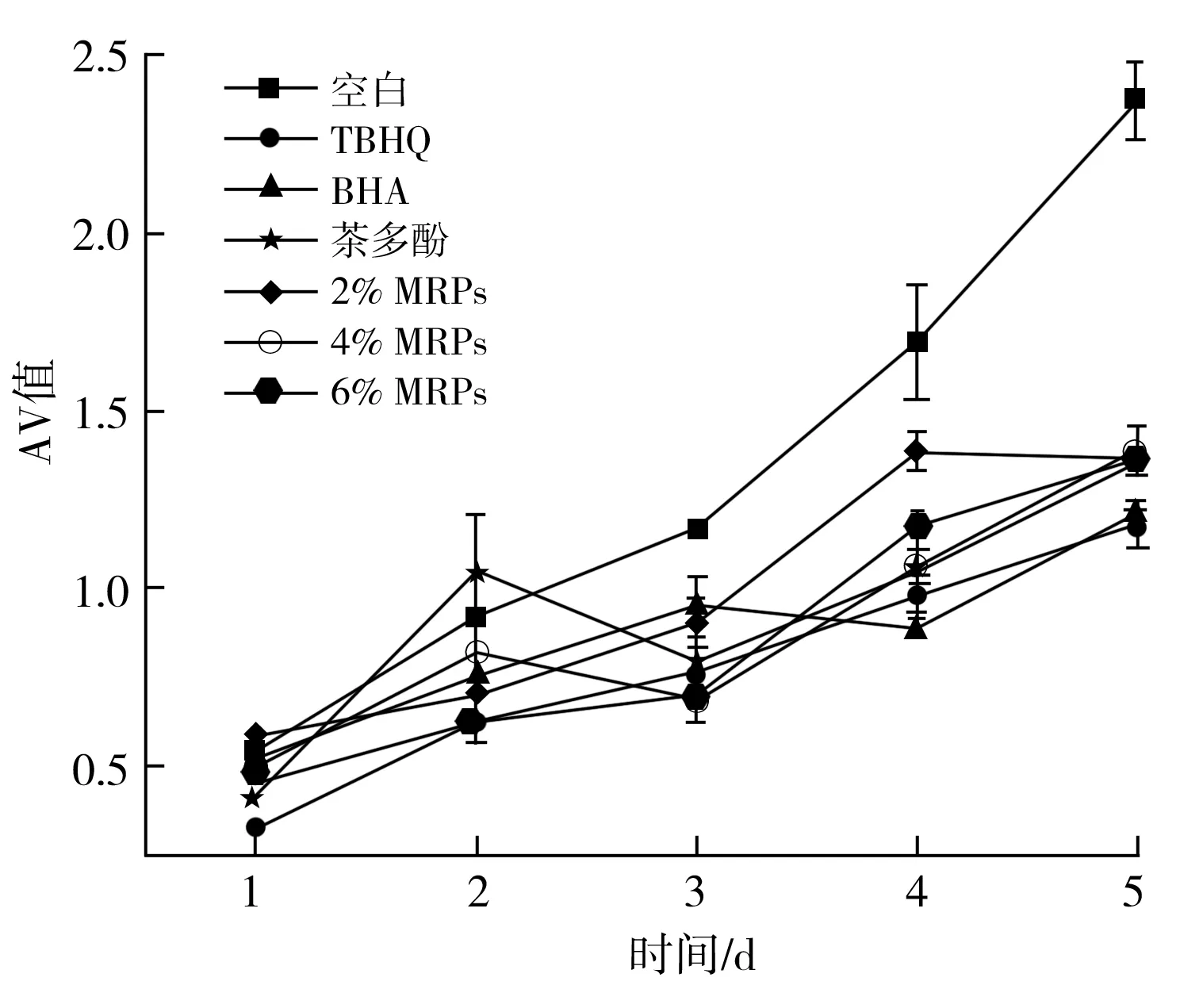
由图7可知,添加抗氧化剂和MRPs能够很好地抑制油脂的过氧化物以及醛类、酮类物质的生成。随着加速氧化的进行,空白组和对照组的过氧化值随时间的延长而增大,对于花生油的氧化保护作用由强到弱依次为TBHQ>4% MRPs>6% MRPs>2% MRPs>茶多酚>BHA,在加速氧化前3 d可以观察到MRPs对花生油的抑制效果随其浓度的增大而增大,而后4% MRPs抑制过氧化物的能力>6% MRPs的抑制能力,这可能是用于MRPs本身的抗氧化作用能够抑制油脂氧化,而MRPs的加入也意味着会加入水,而水的加入会促进油脂氧化,因此POV(4% MRPs) 图8 不同抗氧化剂对花生油TBA值的影响曲线图Fig.8 Effect curves of different antioxidants on the TBA value of peanut oil 由图8可知,随着加速氧化的不断进行,花生油不断氧化产生丙二醛,上述抗氧化剂对于丙二醛的生成均具有较好的抑制效果。不同抗氧化剂抑制丙二醛的能力强弱依次为TBHQ>6% MRPs>茶多酚>4% MRPs>2% MRPs>BHA,因此MRPs的添加量越大,对于花生油氧化生成的丙二醛的抑制效果越好。因此合理添加MRPs有利于抑制花生油的氧化,提高花生油的品质。 图9 不同抗氧化剂对花生油AV值的影响曲线图Fig.9 Effect curves of different antioxidants on the AV value of peanut oil 由图9可知,随着加速氧化时间的延长,花生油的茴香胺值不断增大,添加的各种抗氧化剂对于AV值的抑制强弱约为TBHQ>BHA>茶多酚>4% MRPs>6% MRPs>2% MRPs,几种抗氧化剂对于花生油氧化产生的游离脂肪酸的效果较为接近。 运用ESR探究不同抗氧化剂对花生油自由基总量和种类可以得出:花生油随着加热温度的升高和时间的延长,其自由基总量不断增大。茶多酚和TBHQ会使花生的烷基自由基增大,但是会抑制烷基自由基向烷过氧自由基转化这一过程,MRPs和BHA能够抑制花生油生成烷基自由基和烷过氧自由基,且MRPs的抑制效果与其添加量呈正相关。通过测定花生油的POV值、AV值、TBA值可以得出:上述抗氧化剂均能很好地抑制花生油的氧化,其中抑制效果最好的抗氧化剂是TBHQ。MRPs的添加量能够影响花生油氧化的二级产物的生成。综上所述,运用ESR分析脂质的自由基链式反应,能更细致地了解油脂氧化的机制,MRPs能抑制花生油的氧化。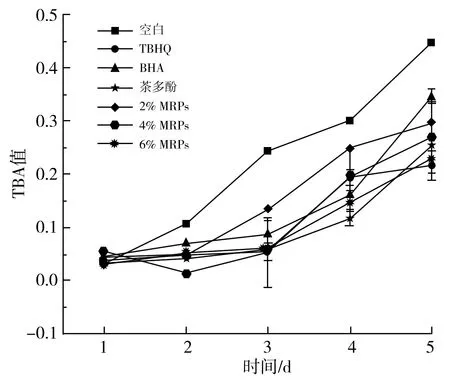
3 结论
