海洋产几丁质酶菌株Stenotrophomonas nitritireducens CZW003的筛选、鉴定及酶学特性研究
2023-02-15赵倩丁志雯钱亮亮李甜黄志发房耀维刘姝
赵倩,丁志雯,钱亮亮,李甜,黄志发,房耀维,刘姝*
(1.江苏海洋大学 食品科学与工程学院,江苏 连云港 222005;2.连云港市质量技术综合检验检测中心,江苏 连云港 222005)
几丁质(chitin)又名甲壳素,由N-乙酰-D-氨基葡萄糖(GlcNAc)残基的线性链组成,并由氢键紧密连接,是广泛存在于自然界中的一种含氮多糖类生物性高分子,在海洋中尤为丰富,是海洋生物N和C的能量来源[1]。部分海产品加工副产物中含有大量的甲壳素,因其难溶于水及普通溶剂,常被当作废物丢弃,导致环境污染[2—4]。而几丁质的水解产物几丁寡糖广泛应用于农业、工业、医学和食品等多个领域,具有抗真菌、杀虫、抗疟疾、抗癌、降血脂和提高食品质量等特性[5]。
目前,制备几丁寡糖的方法主要有化学法、物理法和生物酶法。几丁质酶催化制备几丁寡糖的生物酶方法绿色、安全、高效[6—7]。不仅减少了环境污染,而且降低了工业成本。几丁质酶是一种专一催化几丁质生成几丁寡糖的酶。细菌、真菌和病毒等微生物,以及植物、昆虫和哺乳动物都可产生几丁质酶[8—9]。其中,由于微生物几丁质酶易于生产制备的优势,因而逐渐成为研究热点。已报道有超70种微生物可分泌出几丁质酶,海洋微生物蕴藏巨大潜力,如Clonostachysrosea[10],Pseudoalteromonassp.DL-6[11],Paenicibacillusbarengoltzii[12],Moritellamarina等[13]来自海洋微生物,具有较强的分泌几丁质酶的能力。
工业上大多采用强酸进行甲壳素的预处理以及后续的低温发酵,因此如能挖掘出低温耐酸的几丁质酶产生菌,在工业化应用上具有明显优势。与环境来源的几丁质酶相比,从海洋微生物来源的几丁质酶,易培养,pH和温度范围较广[14]。但目前,海洋几丁质酶报道中多在偏碱性条件下具有最大活性及稳定性,例如海洋细菌Bacillussp. R2产几丁质酶最适pH为7.5,在pH 7.0~8.0之间具备很好的稳定性[15];Pseudoalteromonassp. DC14产几丁质酶最适pH为9.0, 在pH 8.0~11.0之间保持较好的稳定性等[16];而在酸性环境下表现出最佳活性及稳定性鲜少报道。本实验从海泥中筛选并鉴定菌株CZW003为Stenotrophomonasnitritireducens(还原亚硝酸盐寡养单胞菌),目前关于海洋来源的S.nitritireducens产几丁质酶尚无报道,通过研究其产几丁质酶的酶学特性,为低温耐酸几丁质酶的深入研究提供了实验基础,也为制备几丁寡糖提供了新颖酶源。
1 材料与方法
1.1 样品采集
连云港市风景区连岛海域的海泥,置于便携冷藏保温箱中带回实验室。
1.2 海洋微生物培养基
富集培养基:10 g粉状几丁质、0.5 g MgSO4·7H2O、0.3 g KH2PO4、0.7 g K2HPO4、0.01 g ZnSO4、0.01 g FeSO4·7H2O、1 L陈海水,调配至pH 7.0。
筛选培养基:20 g琼脂、10 g硫酸铵、10 g胶体几丁质、0.3 g KH2PO4、0.7 g K2HPO4、1.5 g MgSO4·7H2O、1 L陈海水,调配至pH 7.0。
种子培养基:10 g蛋白胨、5 g酵母粉、1 L陈海水,调配至pH 7.0。
发酵培养基:10 g粉状几丁质、5 g 蛋白胨、10 g葡萄糖、0.3 g K2HPO4、0.2 g MgSO4·7H2O、1 L陈海水,调配至pH 7.0。
1.3 仪器设备
LRHS-250B智能型恒温恒湿培养箱 上海贺德实验设备有限公司;HS-F16/3离心机 德国赛默飞世尔公司;E200生物显微镜 Nikon公司;T100 PCR仪 伯乐生命医学产品(上海)有限公司。
1.4 实验方法
1.4.1 产几丁质酶菌株的筛选
用分析天平称取1 g海泥试样于50 mL富集培养基中,设定温度30 ℃、转速200 r/min恒温摇床,培养48~120 h。取富集后的样液进行梯度稀释,分别为10-1,10-2,10-3,10-4,10-5,10-6,并各取0.05 mL均匀涂布于两个平板,倒置培养在35 ℃恒温培养箱中4~6 d,每天观察直至菌落出现透明圈,有透明圈的菌落即为产几丁质酶,挑选透明圈清晰且最大的菌落,用三区划线方法进行纯化培养24~72 h,观察直至出现单菌落。
1.4.2 菌株CZW003的鉴定
依照文献[17]对纯化培养的菌株CZW003进行菌落、细胞形态学和革兰氏染色特征观察,并对其生理生化特征进行测定。提取菌株CZW003的总DNA进行16S rDNA扩增。PCR细菌通用引物:27F:5′-AGA-GTTTGATCCTGGCTCAG-3′;1492R:5′-GGTTACCT-TGTTACGACTT-3′。PCR反应体系(50 μL):Template DNA(1 μL);上游引物27F(1 μL);下游引物1492R(1 μL);Premix(25 μL);ddH2O(22 μL)。PCR反应流程:94 ℃预变性5 min,不循环;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃终延伸8 min,不循环;PCR扩增产物于4 ℃冷藏保存。基因序列寄送南京思普金生物科技有限公司测定,将测序结果上传GenBank,用BLAST与数据库中所有核糖序列进行种属同源性比对,挑选同源性相近的菌株,用MEGA 7.0构建分子进化树。
1.4.3 胶体几丁质的制备
参照陈茜文等[18]的方法制备胶体几丁质。称取20 g粉状几丁质缓慢倒入200 mL浓HCl中,再加入200 mL蒸馏水,并用磁力搅拌器不断搅拌12 h后,倒入2 L、4 ℃的95%乙醇中,混匀后放室温静置12 h,设置离心机4 ℃、5 000 r/min离心20 min,将沉淀物加蒸馏水反复冲洗至中性,最终用蒸馏水定容至1 L,置于4 ℃保存,备用。
1.4.4 酶活的测定
参考常国炜等[19]的研究方法制备DNS试剂,并用DNS法测定还原糖含量[20]。称取100.00 mg葡萄糖标准品,用蒸馏水定容至100.00 mL,配制成质量浓度为1 mg/mL的标准储备液,将其稀释成5个不同浓度的葡萄糖标准溶液,并且设空白对照,加入DNS试剂煮沸5 min显色,测定540 nm处的吸光值并绘制葡萄糖标准曲线。用移液枪取100 μL粗酶液与900 μL 1%的胶体几丁质,于35 ℃水浴30 min,再加入1.5 mL DNS试剂煮沸5 min显色,离心取上清液,在540 nm处测定吸光值,根据葡萄糖标准曲线计算还原糖含量。酶活力单位(U):在最适条件下,每分钟生成1 μmol还原糖所消耗的酶量定义为一个酶活力单位。相对酶活(%):酶在各组不同条件下酶活性相对最高酶活性的百分比。
1.4.5 酶学特性研究
1.4.5.1 酶最适温度及其稳定性
设定5~65 ℃不同反应温度,分别测定不同温度下的酶活力;将上述不同温度条件下的酶保温0.5,1,1.5,2,2.5,3 h后,再分别测定酶活力。将每组的最高酶活设为100%,其他各组为相对酶活,探究酶最适温度及其稳定性情况。每组设计3次平行实验。
1.4.5.2 酶最适pH及其稳定性
调配pH值分别为3.0,4.0,5.0,6.0,7.0,8.0,9.0不同梯度的磷酸盐缓冲液后,加入粗酶液与底物,一并于30 ℃恒温水浴锅中保育,分别测定不同pH条件下的酶活力;将上述不同pH值的混合液在30 ℃恒温水浴锅中继续放置12 h后,再分别测定其酶活力。将最高酶活的一组设为100%,其他各组为相对酶活,探究酶最适pH及其稳定性情况。每组设计3次平行实验。
1.4.5.3 金属阳离子和EDTA对酶活的影响
以1%胶体几丁质为底物,向粗酶液中分别加入含Mg2+、Na+、Hg+、Co2+、Fe2+、Ca2+、Ag+、Zn2+、K+的金属阳离子溶液以及EDTA,浓度均为1 mmol/L,再分别测酶活。以只加入蒸馏水的酶液酶活为100%,其他各组为相对酶活,探究金属阳离子对酶活的影响。
1.4.5.4 底物特异性
分别选择粉状几丁质、壳聚糖、胶体几丁质作为底物,与粗酶液进行反应,按照质量体积比0.5%形成反应体系,在其最适条件下测定酶活。
2 结果与分析
2.1 产几丁质酶菌株的筛选
将富集培养基上的海泥样品梯度稀释涂布于筛选培养基上,通过透明圈法挑取透明圈明显且较大的菌株共4株,透明圈最大的命名为CZW003,见图1。将其单菌落用接种环移至种子培养基中培养后,再以1%的接种量接种到发酵培养基中,设定30 ℃、200 r/min条件下培养72 h后再离心,取上清液进行酶活的测定,得出酶活为16.91 U/L。

图1 平板透明圈Fig.1 Plate transparent zone
2.2 菌株CZW003的鉴定
2.2.1 菌株CZW003的形态学特征
菌株CZW003的形态学观察见图2。

图2 菌株CZW003的形态学特征Fig.2 Morphological characteristics of strain CZW003
由图2中a可知,通过革兰氏染色观察,此菌株为革兰氏阴性菌,无芽孢,短杆状。在筛选培养基上菌落呈现的形态:菌落较小呈浅黄色,表面光滑湿润,有黏性,不透明,微凸易挑取(见图2中b)。
2.2.2 生理生化特征
对菌株CZW003进行16项生理生化特征测定。其中β-半乳糖苷酶、氧化酶、VP反应和明胶水解均为阳性,吲哚试验、脲酶和产生H2S均为阴性,具体测定结果见表1。根据形态学和生理生化特征初步鉴定为S.nitritireducens。

表1 菌株CZW003的生理生化试验结果Table 1 Physiological and biochemical test results of strain CZW003
2.2.3 菌株CZW003的16S rDNA扩增与分析
将菌株CZW003的DNA作为模板DNA进行16S rDNA扩增,PCR产物测序结果序列上传GenBank(登录号:MW435380),用BLAST与数据库中所有核糖序列进行种属同源性比对,发现该菌株与Stenotrophomonasnitritireducens(登录号NR 025305.1)的同源性最高,一致性达到96%,从中选择亲缘关系相近的菌株,用MEGA 7.0软件构建分子进化树(见图3),做比对分析得出菌株CZW003与S.nitritireducens在同一支且亲缘关系最近,因此将菌株CZW003鉴定为寡养单胞菌属(Stenotrophomonas)的还原亚硝酸盐寡养单胞菌。
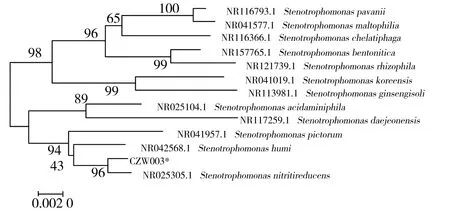
图3 菌株CZW003的分子进化树Fig.3 Molecular evolutionary tree of strain CZW003
2.2.4 标准曲线的绘制
用DNS法绘制菌株CZW003几丁质酶酶活的葡萄糖标准曲线,见图4。得到线性方程y=2.328 4x-0.004 4,相关系数R2=0.999 4,契合度较高。

图4 葡萄糖标准曲线Fig.4 Standard curve of glucose
2.3 酶学特性研究
2.3.1 酶的最适温度
在设定的不同温度条件下,测定其酶活力。由图5可知,温度在35 ℃时酶活力最高,并设为酶活100%,在35~65 ℃之间酶活呈急剧下降趋势,随着温度升高,酶逐渐变性失活;相比之下,在5~35 ℃之间酶活的下降趋势较为缓慢,在15 ℃时相对酶活达到60%以上,且在5 ℃仍有催化活性,说明该酶具有较强的冷适应性。
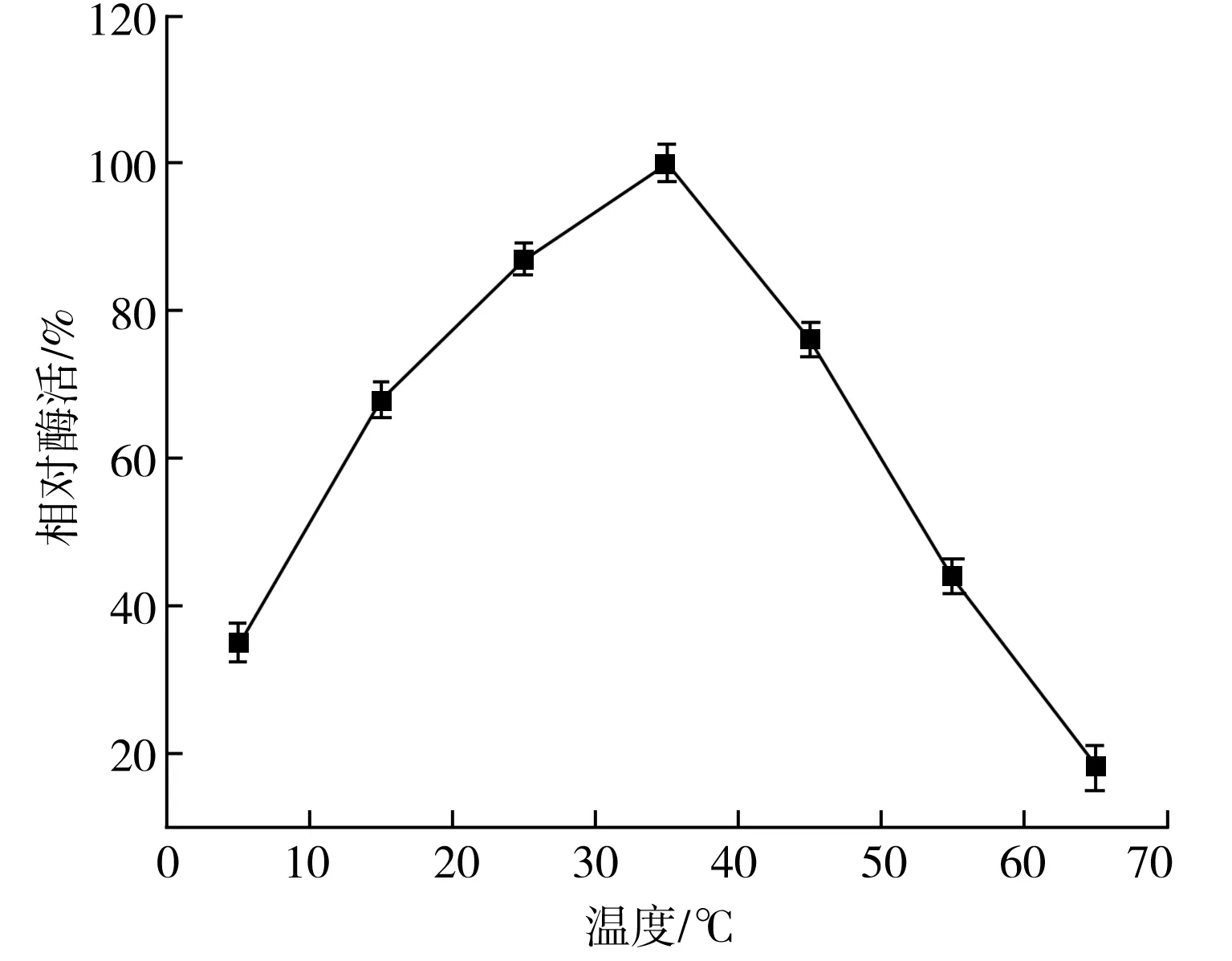
图5 温度对菌株CZW003产几丁质酶的酶活影响Fig.5 Effect of temperature on the enzyme activity of chitinase produced by strain CZW003
2.3.2 温度对酶活稳定性的影响

图6 温度对酶活稳定性的影响Fig.6 Effect of temperature on the stability of enzyme activity
将菌株CZW003在6个不同温度环境下同时放置在恒温水浴锅中,分别将6个不同温度的初始酶活设为100%,每间隔0.5 h分别测定其酶活力,并计算其相对酶活。由图6可知,菌株CZW003在温度5~35 ℃下,酶活变化较稳定,尤其在5 ℃和15 ℃温度下水浴保温3 h后相对酶活仍能保持在70%以上,在55 ℃水浴1 h后酶活急剧下降,3 h后已低至20%以下,说明该酶在低于35 ℃下具有良好的酶活稳定性。
2.3.3 酶的最适pH

图7 pH对菌株CZW003产几丁质酶酶活的影响Fig.7 Effect of pH on the enzyme activity of chitinase produced by strain CZW003
设定pH值分别为3.0,4.0,5.0,6.0,7.0,8.0,9.0,测定其酶活力。由图7可知,当pH为6.0时,酶活力最高并设为酶活100%,当pH为5.0时,酶活仍达到90%以上。而当pH>8.0时,酶活迅速降低,这是因为pH过高破坏酶蛋白的空间结构,使酶受到不可逆的破坏,可见该酶最适pH为6.0。
2.3.4 pH对酶活稳定性的影响

图8 pH对酶活稳定性的影响Fig.8 Effect of pH on the stability of enzyme activity
将不同pH值的混合液在30 ℃恒温水浴锅中继续放置12 h后,再分别测定其酶活力。由图8可知,在混合液pH值为6.0时,酶活力最高并设为酶活100%。pH在 3.0~7.0酸性条件下,保温12 h仍保持相对稳定的酶活性,特别在pH 5.0和pH 3.0时,相对酶活分别保持在95%和80%以上,可见该酶是耐酸几丁质酶。
2.3.5 金属阳离子和EDTA对酶活的影响
向粗酶液中加入不同的金属阳离子和EDTA,并分别测定酶活力,将只加入蒸馏水的酶活设为100%,结果见图9。

图9 金属阳离子及EDTA对酶活的影响Fig.9 Effect of metal cations and EDTA on the enzyme activity
Mg2+、Ca2+、K+对酶活具有激活作用,而Hg+、Fe2+、Ag+及EDTA对酶活具有明显的抑制作用。
2.3.6 底物对酶活的影响
因几丁质酶为底物诱导酶,所以分别选择粉状几丁质、壳聚糖、胶体几丁质作为底物,与粗酶液进行反应,CZW003对不同底物的降解能力见图10。

图10 底物对酶活的影响Fig.10 Effect of substrates on the enzyme activity
由图10可知,该酶有严格的底物特异性,对胶体几丁质的酶解能力显著,而粉状几丁质与壳聚糖的酶解能力很弱。
3 结论
本实验研究的样品来自连云港市风景区连岛海域的海泥,从中筛选出一株产几丁质酶的菌株CZW003,经形态学特征、生理生化试验及16S rDNA序列扩增分析,鉴定该菌株为S.nitritireducens。菌株CZW003产几丁质酶的最适温度为35 ℃,在低温5 ℃下仍具有催化活性,在5~35 ℃之间具有较好的稳定性;该酶的最适pH为6.0,在pH 3.0~7.0酸性条件下保持较强的酶活力,相对酶活达到80%以上;金属阳离子Mg2+、Ca2+、K+对该酶酶活具有促进作用,而Hg+、Fe2+、Ag+及EDTA对酶活具有明显的抑制作用,用胶体几丁质作为底物时酶活力最高。由实验结果可知,该酶属于低温耐酸几丁质酶,能在低温和酸性环境中发挥更好的作用,有利于严酷的工业发酵条件。该酶的独特酶学特性为其进一步开发与应用提供了理论和实验基础。
