微波提取香菇多糖制备微胶囊的抑菌抗氧化活性研究
2023-02-15何皎孙晓菲潘琳田慧敏陈霞
何皎,孙晓菲,潘琳,田慧敏,陈霞
(河南科技大学 食品与生物工程学院,河南科技大学微生物资源开发与利用校级重点实验室,食品微生物河南省工程技术研究中心,河南 洛阳 471023)
香菇在世界食用菌中排行第二,在食用和药用方面都具有较高的价值,香菇多糖为香菇提取物中最重要的活性成分之一[1-2]。在调控机体免疫、抗菌和抗病毒、抗寄生虫、神经系统保护和抗氧化等方面的作用显著[3]。微波辅助法为目前获取香菇多糖的较优方法[4-5]。目前,纳米级微胶囊的制备技术已经逐渐渗透到医药、食品、生物等领域中。微胶囊可以很好地隔绝药物与外界的接触,达到保护药物、减缓其变性的目的[6-7],并且外层的壁材能够起到控制药物释放的目的,使药物的释放速度能够人为控制[8],从而提高药物的疗效与作用。本实验采用β-环糊精作为壁材,香菇多糖作为芯材制备微胶囊,旨在最大限度地发挥香菇多糖的生物活性[9-10]。
本研究以微波辅助提取制备香菇多糖β-环糊精微胶囊,以期为开发新型香菇多糖防腐剂及抗衰老保健品提供理论依据。
1 实验材料
1.1 材料
实验所用的干香菇购自洛阳白云山五马寺村;β-环糊精购自绿叶生物科技有限公司。
1.2 菌种
沙门氏菌、绿脓杆菌、大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌等菌种为本实验室保藏。
2 实验方法
2.1 供试品的制备
将干香菇粉碎,过40目筛,置于棕色瓶中备用。
2.2 微波提取香菇多糖的提取工艺流程[11-13]
准确称取5份过40目筛后的香菇粉各1 g分别于500 mL烧杯中,按预设料液比各加入适量蒸馏水搅拌均匀,在预设微波功率的条件下处理相应时间。处理好的样品得滤液,量出其体积并倒入烧杯中,按其体积的3倍加入无水乙醇,4 ℃醇沉12 h,4 000 r/min离心10 min,取沉淀于不同的烧杯中,加蒸馏水在100 mL容量瓶中进行定容,得到含香菇多糖的溶液后分装进行冷冻干燥。
2.3 抑菌与抗氧化双活性检测[14-16]
2.3.1 培养基制备与菌种活化
BPA培养基、LB培养基配方均参考现代分子生物学实验技术第二版。
金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、沙门氏菌、绿脓杆菌用各自培养基复苏备用。
2.3.2 抑菌活性的测定
采用牛津杯法测定抑菌活性,在带孔混菌平板中按顺序加入 100 μL样品,以100 μL无菌水作为阴性对照,100 μL相应浓度的尼泊金甲脂醇溶液作为阳性对照,每组设 3个平行,平板于相应温度恒温培养 12~24 h,电子游标卡尺测量抑菌圈直径,记录数据。
2.3.3 抗氧化测定
2.3.3.1 DPPH·清除能力测定
吸取2.0 mL待测液,加入0.1 mmol/L DPPH·乙醇溶液4.0 mL,25 ℃避光反应30 min,以无菌水调零,在517 nm波长处测定吸光度值A1,用无菌水代替DPPH所测值为吸光度值A2,用无菌水代替待测液所测值为吸光度值A0,同时以同浓度的维生素C溶液作为阳性对照,重复3次。
DPPH·清除率(%)=[1-(A1-A2)/A0]×100%。
2.3.3.2 羟自由基清除能力测定
试管中依次加入样品溶液2 mL、9 mol/L H2O2溶液2 mL,室温静置10 min,再加入9 mmol/L 水杨酸-乙醇溶液2 mL,混匀室温静置 40 min,于510 nm 处测吸光度A1;用相同浓度乙醇替代水杨酸-乙醇溶液,其余条件不变测得A2;同浓度乙醇替代样品溶液,其余条件不变测得吸光度值A0。
羟自由基清除率(%)=[1-(A1-A2)/A0]×100%。
2.4 微波提取香菇多糖的提取工艺单因素实验
2.4.1 微波功率对香菇多糖得率的影响
提取工艺流程依据2.2,固定料液比为1∶30,微波时间为2 min,分别在微波功率为0,119,238,385,539 W的条件下进行处理,结果见图1。
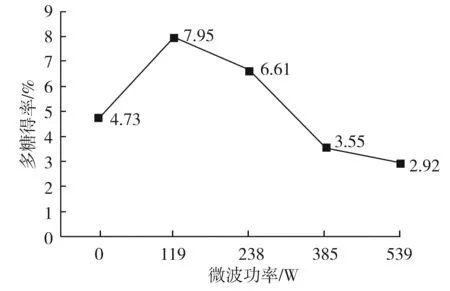
图1 微波功率对香菇多糖得率的影响Fig.1 Effect of microwave power on the yield of lentinan
由图1可知,当微波功率为119 W时,香菇多糖得率达到最高,为7.95%,故选择微波功率为119 W进行优化。
2.4.2 微波时间对香菇多糖得率的影响
在料液比1∶40、微波功率119 W的条件下处理2,4,6,8,10 min,其余实验操作条件同2.4.1。

图2 微波时间对香菇多糖得率的影响Fig.2 Effect of microwave time on the yield of lentinan
由图2可知,当微波时间为4 min时,香菇多糖得率达到最高,时间超过4 min时,香菇多糖得率逐渐下降,故选择微波提取时间4 min进行优化最适宜。
2.4.3 料液比对香菇多糖得率的影响
固定微波功率119 W,处理2 min,料液比分别为为1∶20、1∶30、1∶40、1∶50、1∶60,其余实验操作条件同2.4.1。

图3 料液比对香菇多糖得率的影响Fig.3 Effect of solid-liquid ratio on the yield of lentinan
由图3可知,料液比为1∶40时,香菇多糖得率达到最大,故选择料液比1∶40进行优化最适宜。
2.5 响应面法优化香菇多糖提取工艺实验
结合单因素实验得到的结果,确定料液比为1∶30、1∶40、1∶50;微波功率为0,119,238 W;微波时间为2,4,6 min。利用响应面法中的Box-Behnken设计三因素三水平实验,测定样品在490 nm处的吸光度,得出香菇多糖得率,结果见表1。

表1 响应面实验设计及结果Table 1 Design and results of response surface experiment
采用Design-Expert 8.0.6 Trial软件分析所得数据并拟合多元回归方程:Y=9.59-1.15A-1.08B+0.016C-1.00AB+0.23AC-0.22BC-1.61A2-0.85B2-1.73C2。由方程一次项系数可知,影响香菇多糖得率最大的因素是料液比,其次是微波功率和微波时间。
2.5.1β-环糊精香菇多糖微胶囊的制备工艺单因素实验
称取适量β-环糊精4份,溶解于25 mL蒸馏水中,50 ℃恒温搅拌保持20 min后,分别加入预设香菇多糖。分别加入不同量乳化剂吐温80,置于磁力搅拌器中,设置温度为50 ℃,保持恒定转速搅拌30 min,得乳状液。将所得不同乳化剂添加量的乳状液分别倒入单个培养皿内,放入冷冻干燥机,进行冷冻干燥。将冻干后所得到的固体物质研磨成细粉状,装瓶备用,即得香菇多糖β-环糊精微胶囊。
2.5.2 不同乳化剂添加量的香菇多糖β-环糊精微胶囊的制备
固定包埋时间为30 min,固形物质量浓度为20 g/dL,壁材和芯材比例为1∶3,乳化剂添加量分别为0.1%、0.2%、0.3%、0.4%,以枯草芽孢杆菌为指示菌,抑菌圈直径作为指标,结果见图4。
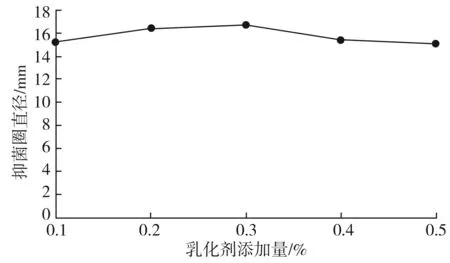
图4 乳化剂添加量对微胶囊抑菌活性的影响Fig.4 Effect of the addition amount of emulsifier on the antibacterial activity of microcapsules
由图4可知,当乳化剂添加量为0.3%时,微胶囊的抑菌活性最强,抑菌圈直径为16.7 mm。
2.5.3 不同固形物质量浓度的香菇多糖β-环糊精微胶囊的制备
固定乳化剂添加量为0.2%,包埋时间为30 min,壁材和芯材比例为1∶3,分别在固形物质量浓度为10,20,30,40 g/dL的条件下制备香菇多糖β-环糊精微胶囊,其余步骤同2.5.1。

图5 固形物质量浓度对微胶囊抑菌活性的影响Fig.5 Effect of mass concentration of solids on the antibacterial activity of microcapsules
由图5可知,香菇多糖β-环糊精微胶囊的抑菌活性在固形物质量浓度为20 g/dL时达到最大值,其抑菌圈直径为16.4 mm。
2.5.4 不同包埋时间的香菇多糖β-环糊精微胶囊的制备
固定乳化剂添加量为0.2%,固形物质量浓度为20 g/dL,壁材和芯材比例为1∶3,分别在包埋时间为20,30,40,50 min的条件下制备香菇多糖β-环糊精微胶囊,其余步骤同2.5.1。

图6 包埋时间对微胶囊抑菌活性的影响Fig.6 Effect of embedding time on the antibacterial activity of microcapsules
由图6可知,随着包埋时间的增加,香菇多糖β-环糊精微胶囊的抑菌活性不断增大,在包埋时间为40 min时,抑菌圈直径达到最大值17.9 mm。
2.6 响应面法优化香菇多糖β-环糊精微胶囊工艺实验
结合单因素实验确定乳化剂添加量的梯度范围为0.2%、0.3%、0.4%;包理时间的梯度范围为30,40,50 min;固形物质量浓度为10,20,30,40 g/dL。利用响应面软件中的 Box-Behnken 功能设计三因素三水平实验,以枯草芽孢杆菌为指示菌,使用抑菌圈直径作为响应值。
得到回归方程:Y=17.04-0.21D-0.18E-0.12F+0.010DE+0.013DF+0.033EF-0.50D2-0.92E2-1.09F2。
2.6.1 回归模型的方差分析
对回归方程方程进行分析,结果见表2。

表2 回归模型方差分析结果Table 2 The variance analysis results of regression model
2.6.2 优化提取参数及验证
通过软件中的 Optimization 程序优化得到:乳化剂添加量0.38%、包埋时间39 min、固形物质量浓度19.5 g/dL。根据实际情况调整最佳工艺参数为乳化剂添加量0.38%、包埋时间39 min、固形物质量浓度20 g/dL,抑菌圈直径理论值为16.59 mm。通过3次验证实验,得到抑菌圈大小为17.07 mm,与预测值非常接近,说明按照模型进行实验准确可行。由表2可知,拟合方程的相关系数RAdj2=0.975 4,说明该模型能够解释97.54%的响应值的变化。相关系数R2=0.989 3>0.9,说明该模型拟合程度好,实验误差小,可以用此模型对制备工艺参数进行分析以及预测。该模型中D、E、F、D2、E2、F2项达到显著水平。影响香菇多糖β-环糊精微胶囊的抑菌活性的最显著因素为乳化剂添加量。

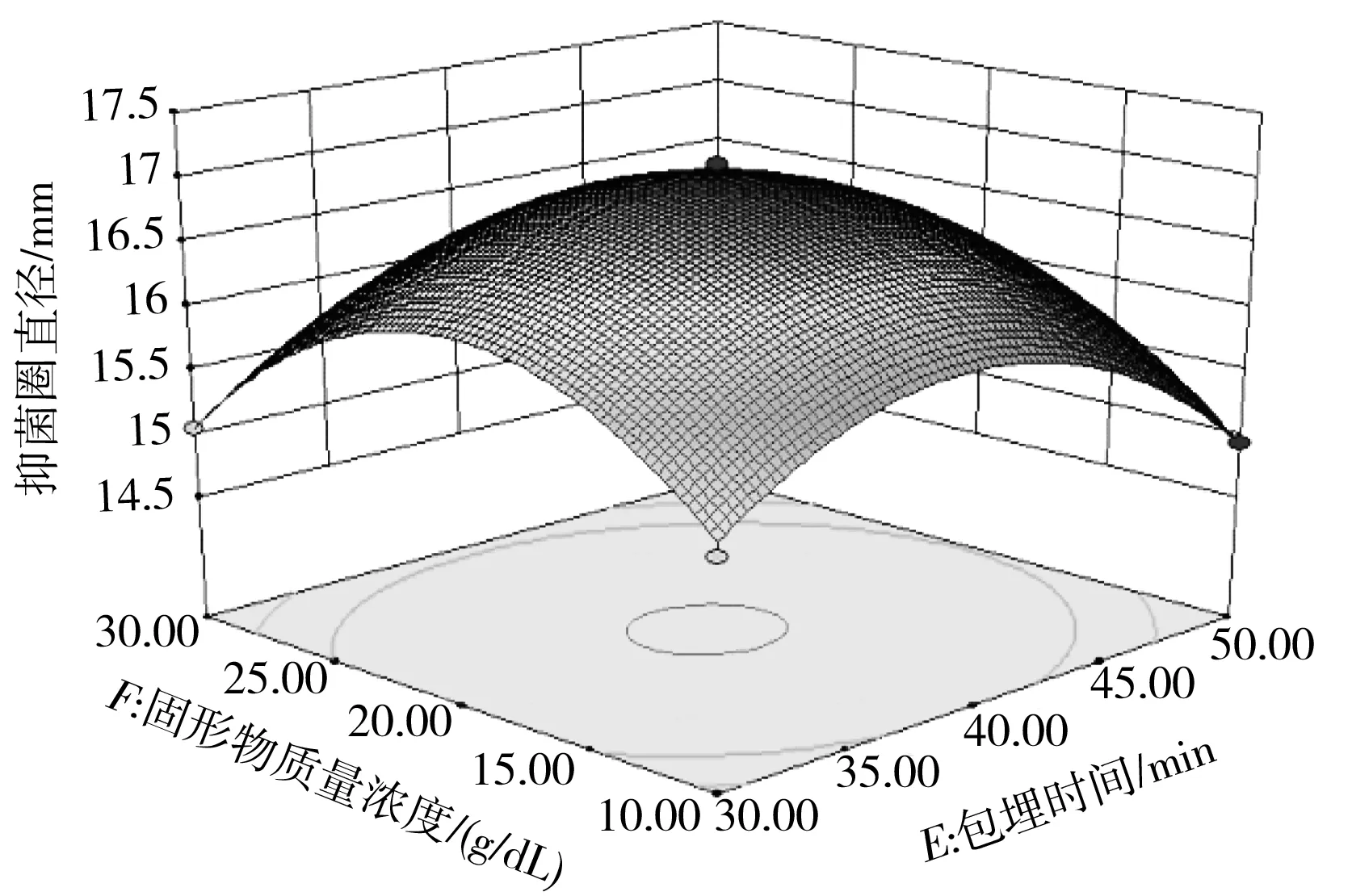

图7 固型物质量浓度、乳化剂添加量、包埋时间的交互作用对抑菌圈直径影响的响应面及等高线Fig.7 The response surface diagrams and contour lines of effect of interaction of mass concentration of solids, emulsifier addition amount and embedding time on the antibacterial zone diameter
3 结论与讨论
3.1 香菇多糖β-环糊精微胶囊的扫描电镜观察
通过单因素实验结合响应面优化得到最佳工艺制备的香菇多糖纳米胶囊的扫描电镜图。采用扫描电子显微镜测得最佳条件下纳米微粒粒径的形态,见图8。
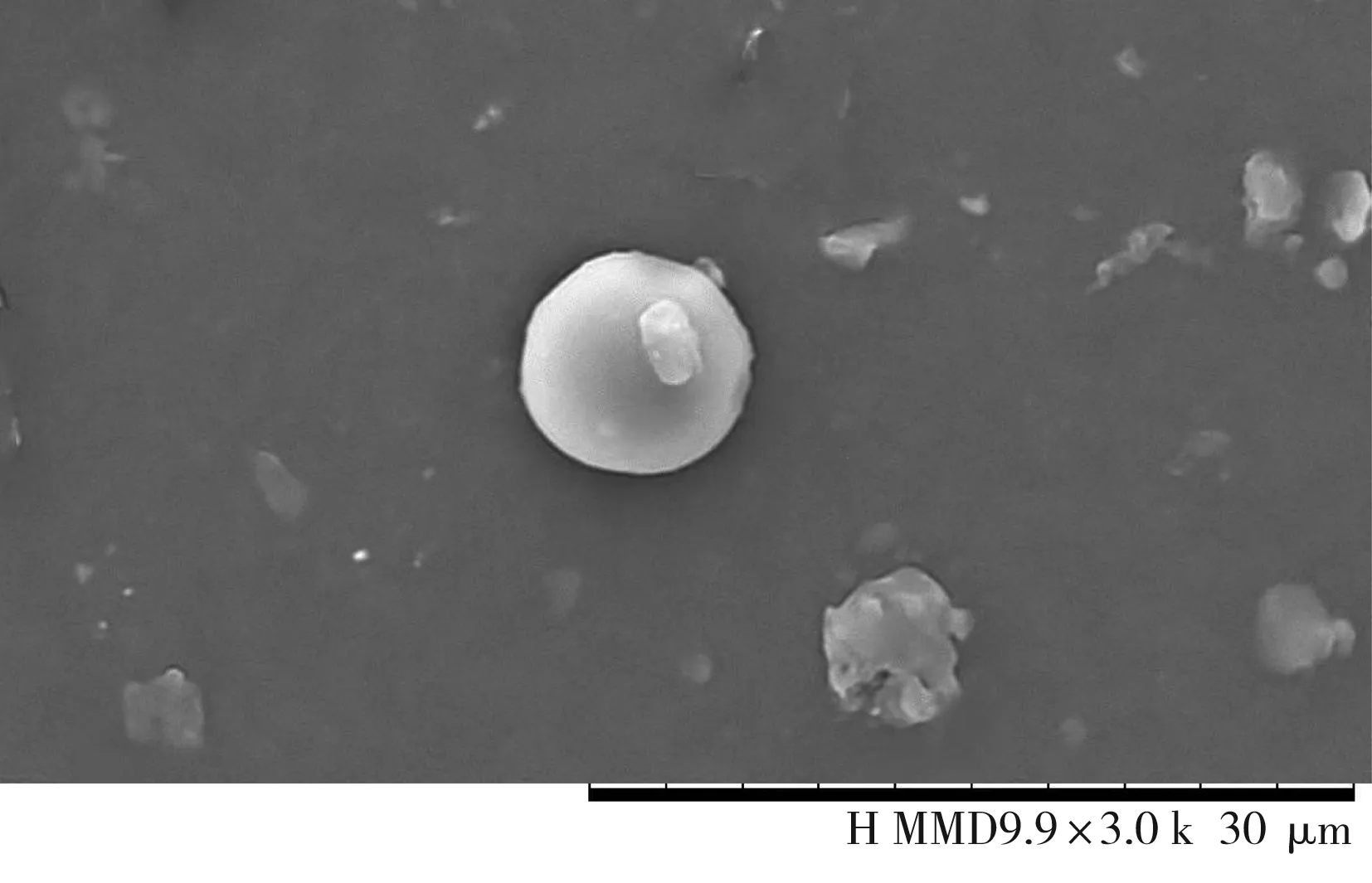
图8 香菇多糖纳米微胶囊的扫描电镜图Fig.8 Scanning electron micrograph of lentinan nanocapsules
3.2 香菇多糖β-环糊精微胶囊的抑菌抗氧化效果
香菇多糖β-环糊精微胶囊及相应成分抑菌性对比见表3,香菇多糖β-环糊精微胶囊及相应成分抗氧化对比见表4。

表3 香菇多糖β-环糊精微胶囊及相应成分抑菌性对比Table 3 Antibiosis comparison of lentinan β-cyclodextrin microcapsules and the corresponding components mm
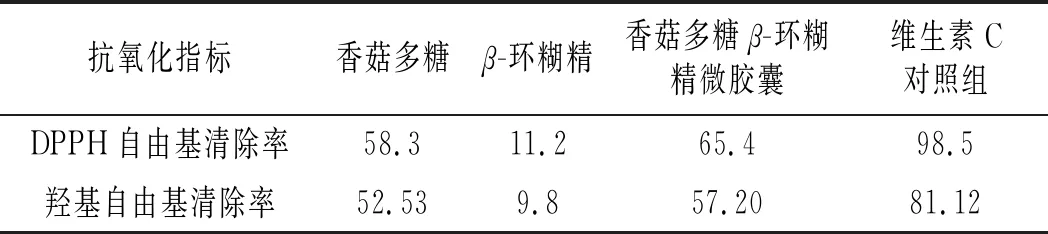
表4 香菇多糖β-环糊精微胶囊及相应成分抗氧化对比Table 4 Antioxidant comparison of lentinan β-cyclodextrin microcapsules and the corresponding components %
结果表明,微波提取香菇多糖的最佳工艺条件为料液比1∶40、微波提取时间4 min、微波功率119 W。香菇多糖β-环糊精微胶囊的最佳制备工艺为乳化剂添加量0.38%、包埋时间39 min、固形物质量浓度19.5 g/dL。得出纳米级微胶囊对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌的抑制作用较强,对沙门氏菌的抑制作用较弱,同时具有较好的抗氧化性。所制备的微胶囊抑菌活性和抗氧化活性与香菇多糖相比有增幅。通过微波获得的香菇多糖制作的微胶囊可作为药物和功能性食品工业中天然防腐剂与抗氧化剂组分,作为新型天然抗菌抗氧化剂使用具有巨大潜力。因此,未来应对其结构和功能评估进一步研究。
