重组左聚糖蔗糖酶生产左聚糖工艺优化
2023-02-14梁文凤侯媛媛郭晓磊陈硕昌朱萍蒙健宗杨辉
梁文凤,侯媛媛,郭晓磊,陈硕昌,朱萍,蒙健宗,杨辉 ,4*
(1.广西大学 生命科学与技术学院,广西 南宁 530004;2.亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530004;3.邯郸职业技术学院 食品与生物工程系,河北 邯郸 056000;4.广西微生物与酶工程技术研究中心,广西 南宁 530004)
左聚糖是一类分子中含有大量茁-2,6-糖苷键连接的主链和少量茁-2,1-糖苷键连接的支链的多糖。其化学结构很稳定,固有黏度低,且有一定的温度稳定性[1]。左聚糖具有抗菌抗病毒、降低血糖和胆固醇等功能[1],保湿效果可以与透明质酸媲美,同时还具有美白的功能[2]。除此之外,文献[3-5]研究表明,左聚糖对益生菌和复杂肠道中的微生物群有益。目前合成左聚糖的主要方法有化学合成法、微生物发酵法和酶合成法。相比而言,化学合成法实施过程很繁琐[6],微生物发酵法的左聚糖产量低,大约在14.4 g/L~41.7 g/L[7],而酶合成法具有易控制、产量高、转化率高等特点。因此,酶法合成制备左聚糖比较有优势[8]。
左聚糖蔗糖酶属于GH68水解家族中[9]的一员,具有水解和聚合双重活性,不但可以水解蔗糖,还可以将果糖基聚合成左聚糖。广西壮族自治区的蔗糖产量占全国总产量60%以上,但是蔗糖及其衍生产品种类较少,形成了糖业发展技术的瓶颈。据报道,广西制糖业在2017年亏损11.41亿元[10]。利用左聚糖蔗糖酶转化蔗糖生产左聚糖,可提高产品的附加值,对蔗糖深加工及相关行业的发展具有重要意义。
已有研究表明,不同微生物来源的左聚糖蔗糖酶利用蔗糖合成左聚糖的效率及产量会有所不同。例如来自解淀粉芽孢杆菌(Bacillus amyloliquefaciens H47)[11]、纳豆枯草芽孢杆菌(Bacillus subtilis natto CCT7712)[8]和嗜甲基芽孢杆菌(Bacillus methylotrophicus SK 21.002)[12]的左聚糖蔗糖酶分别可合成116、63.60 g/L和100 g/L左聚糖,蔗糖转化率分别为38.67%、18.17%和33.33%。虽然有个别已报道的左聚糖蔗糖酶合成左聚糖可获得较高的产量或较高的蔗糖转化率,但其是在实验室摇瓶小规模发酵产酶,再经过镍柱亲和层析纯化后才进行生产左聚糖研究,例如来自罗伊氏乳杆菌(Lactobacillus reuteri LTH5448)[13]和来自 Brenneria goodwinii[14]的重组左聚糖蔗糖酶可在500 g/L的蔗糖浓度中分别合成183 g/L和185 g/L的左聚糖,来自丙酮丁醇梭菌(Bacillus clostridium)[15]重组左聚糖蔗糖酶经过响应面优化,可在200 g/L的蔗糖浓度下得到94.88 g/L左聚糖。
迄今为止世界上只有美国、韩国和日本等少数国家实现了左聚糖量产[16],在我国还没有相关的报道,而且关于中试规模以上生产左聚糖蔗糖酶的研究还很缺乏。本实验室前期已经在5 000 L发酵罐实现了中试生产大肠杆菌重组枯草芽孢杆菌左聚糖蔗糖酶[17],为量产该重组左聚糖蔗糖酶提供了很好的基础。目前关于重组枯草芽孢杆菌左聚糖蔗糖酶生产左聚糖的优化研究尚缺乏,并且大部分的优化研究只考虑蔗糖转化率或左聚糖产量其中一个指标,但是实际中得到最高的蔗糖转化率和左聚糖产量的条件往往不一致,需要综合考虑。因此本文利用中试生产的酶进行合成左聚糖研究,并采用响应面法分析影响蔗糖转化率和左聚糖产量各因素的相互作用,以期获得高蔗糖转化率和高左聚糖产量的工艺条件,为酶法生产左聚糖的规模应用提供理论指导和技术依据。
1 材料与方法
1.1 材料与试剂
大肠杆菌重组枯草芽孢杆菌左聚糖蔗糖酶酶制剂[17]:广西大学生命科学与技术学院自制;蔗糖(分析纯):天津博迪化工有限公司;无水乙醇(分析纯):成都市科隆化学品有限公司。
1.2 仪器与设备
电子天平(SE402F):美国OHAUS公司;数显恒温水浴锅(DK-8D):金坛市医疗仪器厂;数字式pH计(pHS-25):上海日岛科学仪器有限公司;酶标仪(M200 PRO):瑞士 TECAN 公司;真空浓缩仪(AG5301):德国EPPENDORF公司。
1.3 方法
1.3.1 重组左聚糖蔗糖酶水解活力测定
采用 3,5-二硝基水杨酸 (3,5-dinitrosalicylic acid,DNS)显色法[18]测定重组左聚糖蔗糖酶的水解活力。水解活力单位(U)定义:在最适的pH值和温度条件下,1 min催化蔗糖转化成1 μmol葡萄糖所需的左聚糖蔗糖酶的量为一个活力单位[19]。
1.3.2 重组左聚糖蔗糖酶聚合活力测定
称量若干干燥洁净、规格为2.0 mL EP管的质量并记录,从反应结束的反应体系中取500 μL反应液于EP管中,再加入3倍体积无水乙醇终止反应,4℃静置24 h,12 000 r/min离心20 min,弃上清液;用去离子水重悬沉淀,再加入3倍体积无水乙醇,4℃静置24 h,10 000 r/min离心16 min,直至用DNS显色法检测上清液无还原糖残留[20]。将所得到的左聚糖沉淀放入真空浓缩仪干燥至恒重,计算蔗糖转化率和左聚糖产量,蔗糖转化率定义为合成的左聚糖产量(g/L)与初始蔗糖(g/L)的百分比[17],公式如下。

式中:500表示反应终止体积,滋L;10-6表示换算单位的倍数。
1.3.3 响应面试验
根据实验室单因素试验结果[17],选取对酶促反应影响显著的3个因素:反应pH值、反应温度和蔗糖质量浓度为试验因素,分别以蔗糖转化率和左聚糖产量为响应值,通过Design-Expert软件设计三因素三水平Box-Behnken响应面试验,如表1和表2所示。试验过程中,反应时间和酶浓度分别为30 h和1.6 U/mL,每个试验重复3次,结果取平均值。然后对蔗糖转化率和左聚糖产量进行二次多元回归方程拟合,得到各因素与响应值之间函数关系的回归方程,根据试验生成的响应曲面图确定最优的酶促反应条件。

表1 以蔗糖转化率为响应值的Box-Behnken设计因素及水平Table 1 Factors and coded levels in Box-Behnken design of conversion yield of sucrose

表2 以左聚糖产量为响应值的Box-Behnken设计因素及水平Table 2 Factors and coded levels in Box-Behnken design of levan yield
1.3.4 模型的验证及放大体系试验
利用响应面模型优化的最佳条件进行酶促反应,反应体系为100 mL,比较模型预测值与试验值,验证模型的有效性,每个试验重复3次,数值表示为平均值±标准差。将反应体系从100 mL扩大到5 L,其他反应条件不变进行重组左聚糖蔗糖酶聚合反应,比较两个体系的蔗糖转化率和左聚糖产量以考察优化条件的适用性。
1.4 数据分析与处理
试验重复3次,运用Design-Expert 10.0.7软件进行响应面设计和方差分析,用Origin 2018软件进行绘图。
2 结果与分析
2.1 Box-Behnken响应面法优化蔗糖转化率试验结果
2.1.1 Box-Behnken响应面试验结果
重组左聚糖蔗糖酶酶促反应条件Box-Behnken试验优化结果见表3,方差分析结果见表4。

表3 Box-Behnken试验设计与结果Table 3 Experimental design scheme and results of Box-Behnken

表4 Box-Behnken试验方差分析Table 4 Variance analysis of Box-Behnken experiment
利用Design-Expert软件进行分析,蔗糖转化率Y对反应pH值、反应温度和蔗糖质量浓度的多元二次回归方程:蔗糖转化率=35.83-0.21A-1.13B+0.92C-0.11AB-0.02AC+0.52BC-1.19A2-3.94B2-1.8C2。
由表4可知,所选择的回归模型的P<0.01,表示整体模型对试验结果具有极显著影响,具有可信度。模型的失拟项P=0.220>0.05,差异不显著,说明未知因素对试验结果的影响不大,残差主要由随机误差引起的,能较好地反映酶促反应过程中3个因素与蔗糖转化率(Y)之间的准确关系,所以模型选择适当。模型的R2为0.993,校正相关系数为0.984,信噪比32.933>4,表明各因素与蔗糖转化率之间具有高度相关性,拟合程度良好,试验误差较小,可对蔗糖转化率进行准确预测和分析。
在该模型中,一次项反应温度B、蔗糖质量浓度C、二次项 A2、B2和 C2对结果的影响极显著(P<0.01),交互项BC对结果影响显著(P<0.05),其它项对结果影响不显著(P>0.05)。根据F值可知,对蔗糖转化率影响程度:B(F=94.167)>C(F=62.866)>A(F=3.228),即反应温度>蔗糖质量浓度>反应pH值。
2.1.2 响应曲面图
综上所述,蔗糖转化率回归方程为酶法合成左聚糖转化率的优化提供了一个合理模型,利用Design-Expert软件绘制响应曲面图,结果如图1所示。
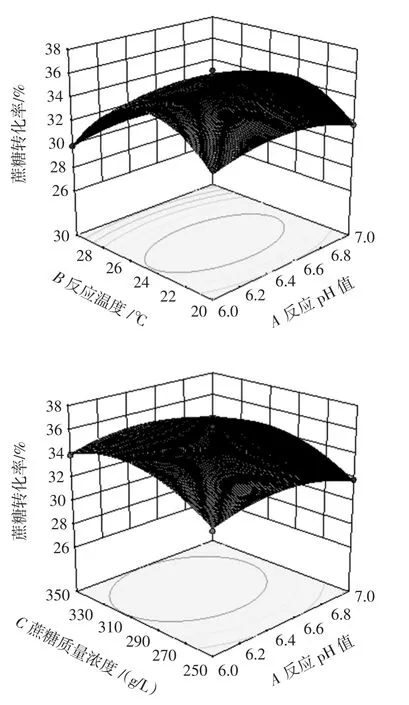

图1 两因素交互作用的响应曲面图Fig.1 Response surface plot of the interaction of each two factors
根据图1的响应曲面图,可以看到曲面最高点都在响应面上,说明都有最佳值,3个因素的最佳水平在所选的范围之内。各因素的交互作用可通过对应的响应曲面图来判断。反应温度和蔗糖质量浓度的响应曲面较为陡峭,呈椭圆形,表示它们之间的交互作用显著,蔗糖质量浓度和反应温度分别达到310 g/L和25℃时,蔗糖转化率与蔗糖质量浓度和反应温度的升高呈正相关,但随着这两个变量的进一步升高,蔗糖转化率下降。反应pH值和反应温度、反应pH值和蔗糖质量浓度的响应曲面较为平缓,表示其交互作用较不显著,在一定范围内增加各变量的取值,蔗糖转化率会随之增加,但与蔗糖质量浓度和反应温度的增加相比,增幅较小。
为进一步准确确定全局最优解,以最大化蔗糖转化率为优化目标,根据Design-Expert软件运行的结果,蔗糖转化率在最佳工艺条件:反应pH值为6.46、反应温度为24.37℃、蔗糖质量浓度为311.90 g/L,在此条件下模型预测的蔗糖转化率达到最大值36.02%。为了验证本模型的准确性,按照优化后的试验条件,结合实际情况,进行模型的验证。修正条件:反应pH 6.5,反应温度24℃,底物浓度310 g/L,按照修正条件进行验证试验,所得蔗糖转化率为(36.73±0.60)%。与模型预测结果基本吻合,误差率仅为1.90%,表明该模型预测的结果符合实际情况,与试验值具有良好的拟合性。同时,与未优化前相比,该工艺条件下蔗糖转化率提高了约19%。
2.2 Box-Behnken响应面法优化左聚糖产量试验结果
2.2.1 Box-Behnken响应面试验结果
以左聚糖产量为响应值(Y)的Box-Behnken试验结果见表5,方差分析结果如表6所示。

表5 Box-Behnken试验设计与结果Table 5 Experimental design scheme and results of Box-Behnken
根据Design-Expert软件分析结果可得,左聚糖产量Y对反应pH值、反应温度和蔗糖质量浓度的多元二次回归方程:左聚糖产量=136.96-3.59A+5.11B+1.35C+1.10AB-4.47AC+1.93BC-4.31A2-13.95B2-10.53C2。
由表6可知,3个因素对左聚糖产量影响最大的为反应温度,其次为反应pH值。失拟项P=0.143>0.05,差异不显著,模型的R2为0.972,校正相关系数为0.935,信噪比13.933>4,以上数据表明该模型的可信度很高,误差较小,所以模型可用。在该模型中,一次项反应pH值A、反应温度B、二次项B2和C2对结果的影响极显著(P<0.01),AC和A2对结果影响显著(P<0.05),其它项对结果影响不显著(P>0.05)。根据F值可知,对左聚糖产量影响程度:B(F=26.234)>A(F=12.945)>C(F=1.839),即反应温度>反应 pH 值>蔗糖质量浓度。

表6 Box-Behnken试验方差分析Table 6 Variance analysis of Box-Behnken experiment
2.2.2 响应曲面图
利用Design-Expert软件对影响左聚糖产量的因素进行分析并绘制响应曲面图,结果如图2所示。

图2 两因素交互作用的响应曲面图Fig.2 Response surface plot of the interaction of each two factors
根据图2的响应曲面图,可以看到曲面最高点都在响应曲面上,所以3个因素的最佳水平在所选的范围之内,均存在最大值。反应pH值和反应温度、反应pH值和蔗糖质量浓度、反应温度和蔗糖质量浓度之间都有一定的交互作用。当反应pH值和蔗糖质量浓度分别达到6.3和410 g/L时,左聚糖产量随着两个变量的升高而升高,两个变量进一步升高时,左聚糖产量急剧下降。且它们的响应曲面图呈椭圆形,表明反应pH值和蔗糖质量浓度之间的交互作用显著,对左聚糖产量的影响最大。其次为反应温度和蔗糖质量浓度的交互作用,反应pH值和反应温度的交互作用最不显著。
根据Design-Expert软件结果可知,左聚糖产量在反应pH值A、反应温度B、蔗糖质量浓度C的共同影响下的最佳工艺条件:反应pH值为6.25、反应温度为25.88℃、蔗糖质量浓度为409.20 g/L,在此条件下模型预测的左聚糖产量达到最大值,为138.42 g/L。为了验证本模型的准确性,按照优化后的试验条件,结合实际情况,进行模型的验证。修正条件:反应pH6.3,反应温度26℃,底物浓度410 g/L,按照修正条件在100 mL反应体系中进行验证试验,所得左聚糖产量为(138.59±2.90)g/L,与模型预测结果较接近,表明该模型具有良好的拟合性。同时,与未优化前相比,该工艺条件下左聚糖产量提高了约80%。
2.3 放大体系试验
为考察酶法合成左聚糖所优化条件的适用性,将优化条件100 mL反应体系扩大到5 L后进行大批量反应,结果如图3所示。
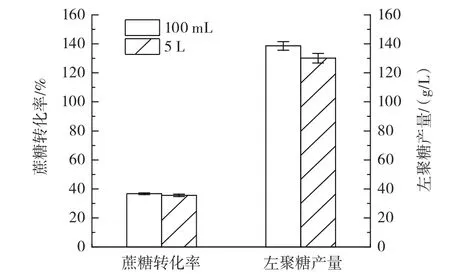
图3 不同反应体积下左聚糖合成试验Fig.3 Levan production under different reaction volumes
由图3可知,5 L反应体系的蔗糖转化率为(35.56±0.80)%、左聚糖产量为(130.15±3.30)g/L,与 100 mL反应体系结果相近。体现了酶法合成左聚糖的效果较为稳定,优化的工艺条件是合理的,为工厂大批量生产左聚糖提供了参考。
3 讨论
响应面试验结果表明,反应温度对蔗糖转化率和左聚糖产量均具有极其显著的影响,由于重组左聚糖蔗糖酶是蛋白质,温度对蛋白的活性影响比较大,温度过高或过低都会使酶的活性遭到抑制,而且过高的温度会使酶变性失活[1],所以控制温度在生产过程中具有极其重要的作用。本文研究的重组枯草芽孢杆菌左聚糖蔗糖酶的最适聚合温度在25℃左右,分别为24℃和26℃,与相关学者[20]研究的枯草芽孢杆菌左聚糖蔗糖酶合成左聚糖温度25℃相近。目前所报道的研究表明,来源不同的左聚糖蔗糖酶反应温度差别比较大[21]。左聚糖蔗糖酶催化的反应不同,所对应的最适温度也不同,例如来自Brenneria goodwinii的左聚糖蔗糖酶的最适聚合和水解温度分别为35℃和45℃[14],来自丁香假单胞菌(Pseudomonas syringae pv)[22]的左聚糖蔗糖酶最适聚合和水解温度分别为18℃和60℃。甚至有研究表明即使是来源相同的左聚糖蔗糖酶转果糖基合成左聚糖的最适温度也不一样,来自Bacillus amyloliquefaciens胞内和胞外的左聚糖蔗糖酶的最适温度分别为25℃~30℃和40℃,均低于最适水解温度45℃~50℃和50℃[23]。
有研究发现,不同来源的左聚糖蔗糖酶合成左聚糖的产量会随着蔗糖质量浓度的升高而有不同的趋势。例如来自地衣芽孢杆菌(Bacillus licheniformis 8-37-0-1)[24]、Bacillus amyloliquefaciens H47[11]的重组左聚糖蔗糖酶在蔗糖浓度超过一定浓度后(300 g/L左右)左聚糖产量开始降低,且Bacillus amyloliquefaciens H47重组左聚糖蔗糖酶在蔗糖质量浓度为600 g/L时转化率降低到不足2%。但也有当蔗糖质量浓度达到一定程度后产量趋于稳定的情况,例如来自Bacillus methylotrophicus SK 21.002[12]的左聚糖蔗糖酶,合成左聚糖产量在蔗糖质量浓度为300 g/L时达到最高,随后逐渐趋于稳定。本文响应面试验结果表明蔗糖质量浓度对蔗糖转化率的影响极显著,当蔗糖质量浓度超过310g/L后,转化率开始下降。Permatasari等[25]使用响应面法优化来自Bacillus licheniformis BK2的重组左聚糖蔗糖酶生产左聚糖时,发现蔗糖质量浓度对左聚糖产量的影响最大。由于左聚糖蔗糖酶拥有水解和聚合双重活性,有研究发现当蔗糖质量浓度超过10%时,左聚糖蔗糖酶催化水解反应超过转果糖基化反应[22]。而且反应体系的渗透压和黏度随着蔗糖质量浓度的增加而增加,会导致酶的活性遭到抑制[25]。此外,来源不同的左聚糖蔗糖酶合成左聚糖的能力差别比较大。虽然蔗糖转化为左聚糖的理论转化率约为50%[18],但已有研究中的实际蔗糖转化率一般在20%~40%左右。来自Bacillus licheniformis的左聚糖蔗糖酶的蔗糖转化率较高,可到40%以上[7],但是其最适底物浓度为100 g/L,实际产量仅为40 g/L左右,即该酶对底物的耐受性不高,限制了其生产应用。有些左聚糖蔗糖酶虽然可以在实验室中得到比较高的转化率,但产量不一定高,说明只看蔗糖转化率是不能评价左聚糖蔗糖酶的应用价值的。本文采用中试发酵生产的重组枯草芽孢杆菌左聚糖蔗糖酶酶制剂可以在较高的底物浓度(300 g/L~400 g/L)下进行反应,说明其底物耐受性比较高。且经酶法合成左聚糖工艺优化,得到的蔗糖转化率(36.73±0.60)%和左聚糖产量(138.59±2.90)g/L,在已有报道中处于较高水平,显著高于来自Bacillus subtilis natto[8]的左聚糖蔗糖酶合成左聚糖的产量(63.60 g/L)和转化率(18.17%)。本工艺在5 L酶促反应体系中能够高效地生产左聚糖,显示了其具有规模生产左聚糖的潜在应用价值。
4 结论
本文应用响应面法优化了大肠杆菌重组枯草芽孢杆菌左聚糖蔗糖酶转化蔗糖生产左聚糖的工艺条件。重组左聚糖蔗糖酶在310 g/L和410 g/L蔗糖质量浓度下反应分别得到最高的蔗糖转化率和左聚糖产量,比优化前分别提高了约19%和80%。得到的回归模型能较好地反映相应的转化率和产量规律,为左聚糖生产提供了有效的理论支持。优化的工艺在5 L体系中能够稳定高效地生产左聚糖,为进一步量产左聚糖研究提供了基础,具有良好的应用潜力。
