黄精基酒对ICR小鼠抗氧化及抗疲劳作用
2023-02-14马永强沈盈王鑫张梓原张一鹏
马永强,沈盈,王鑫,张梓原,张一鹏
(哈尔滨商业大学 食品工程学院黑龙江省谷物食品与谷物资源重点实验室,黑龙江 哈尔滨 150028)
黄精(Polygonatum sibiricum Delar.ex Redoute)又称垂珠、鹿竹,主要分布在朝鲜、俄罗斯、蒙古及中国[1],是我国一种传统的药食同源原料。近年来有关研究发现,黄精具有润肺止咳、降低血糖和血脂、抗菌和抗疲劳等多种功效[2]。例如:巫永华等[3]研究发现,利用超声协同酶法提取的黄精多酚可以有效清除DPPH·和O2-·,杨显辉等[4]研究发现,滇黄精中的黄酮对于机体疲劳造成的脂质过氧化有缓解作用。基酒又称酒基、主料,是配制酒中最主要的要素,基酒有很强的包容性,可以结合各种香料成分、功效成分呈现出色香味俱全的酒品[5],近年来,对于功能型酒饮料的成分分析及功效作用研究较多,例如蓝莓果酒、鲜竹酒基酒、橄榄酒等,但对于药食类基酒的配制及功效研究较少,本研究主要探讨配制的黄精基酒对游泳力竭小鼠抗疲劳和抗氧化作用的影响。
疲劳感是机体的一种常见亚健康状态,主要表现为肌肉力量下降和储存能量降低,并经常伴随着中枢神经紧绷和免疫力下降的现象,严重者更会出现精神不济、意识不清、免疫力下降等状况[6],因此,研究具有抗疲劳作用的功效产品和措施有重要意义。
本研究选用多花黄精作为原料,利用乙醇浸提法进行3次功效成分提取,得到黄精提取液,再将食用酒精作为基酒进行调配,得到黄精基酒,研究其对ICR小鼠的抗氧化及抗疲劳作用,通过测定超氧化物歧化酶、过氧化氢酶、谷丙转氨酶的活性,丙二醛、谷胱甘肽、乳酸、肝糖原的含量和负重游泳时间相关指标,评价黄精基酒的功效性,进一步揭示黄精基酒抗氧化及抗疲劳的作用效果。
1 材料与方法
1.1 主要材料与试剂
5周龄ICR雄性小鼠(清洁级,240只,体质量19 g~20 g):长春亿斯实验动物技术有限责任公司,合格证号:SCXK(吉)-2018-0007,动物质量合格证序号202000034165,饲养于哈尔滨商业大学药学院SPF级动物实验室中,饲养条件:温度22℃~24℃,相对湿度(55±5)%,12h/12h昼夜循环,小鼠转移到饲养箱后进行适应性饲养1周,期间喂养普通饲料,保持自由饮水。
黄精:市售;食用酿造酒精:南通海逸化工有限公司;过氧化氢酶(catalase,CAT)测定试剂盒、总超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、还原型谷胱甘肽(reduced glutathione,GSH)测定试剂盒、乳酸(lactic acid,LA)测定试剂盒、丙二醛(maleic dialdehyde,MDA)测定试剂盒、谷丙转氨酶(alanine aminotransferase,ALT)测定试剂盒、肝糖原(glycogen)测定试剂盒:南京建成生物工程研究所。
1.2 主要仪器与设备
紫外可见分光光度计(UV-5200):北京普析通用仪器有限责任公司;电子天平(MC精密型):北京赛多利斯仪器系统有限公司;酶标仪(SpectraMax 190):上海科华生物工程股份有限公司;电热恒温水浴锅(HH-4):中国化工仪器厂;超声波粉碎机(FW177):上海沪析实业有限公司;游泳箱(60 cm×50 cm×50 cm):盖得化工有限公司。
1.3 方法
1.3.1 黄精基酒制备
工艺流程:黄精→粉碎→称样→乙醇浸提→抽滤→一次浸提→二次浸提→三次浸提→合并滤液→浓缩至30%→加入食用乙醇配制成体积分数为40%的黄精基酒。
1.3.2 动物实验分组及给药
分别进行抗氧化和抗疲劳两部分实验,具体灌胃量参照牛曼思等[7]的方法,其中白酒阴性组为给予和空白组等体积剂量的40%vol白酒,阳性药物组用量依据临床使用的人体推荐用量折算(标准体重60 kg),设置高、中、低剂量组,分别给予等同于人体剂量的20倍、10倍和5倍,具体分组及给药剂量如表1所示。

表1 试验分组及给药剂量Table 1 Group assignment and dosage
1.3.3 抗氧化实验
将其中60只5周龄小鼠进行7 d适应性饲养后随机分为6组,每组10只,实验期间不间断给药21 d,末次给药结束后,在温度为(26.5±0.5)℃,规格为60 cm×50 cm×50 cm的透明游泳箱中进行无负重自由活动,休息1 h后采用颈椎脱臼法处死[8],取小鼠肝脏和肾脏,用生理盐水去污洗净处理后,采用超声波破碎机粉碎组织并制备成匀浆[9]。
1.3.4 抗疲劳实验
另外180只雄性小鼠进行7 d适应性饲养后随机分为6组,每组30只,实验期间不间断给药21 d,每组取10只在末次给药结束后,休息0.5 h进行小鼠负重游泳抗疲劳实验,在小鼠尾部固定其体重5%的清洁铁丝,使其在深度为50 cm,温度为(26.5±0.5)℃的游泳箱中进行负重游泳[10],记录小鼠口鼻露出水面开始游泳直至整体沉入水下8 s且不能浮出水面时终止计时,此时间即为小鼠的负重游泳时间。
1.3.5 抗氧化检测指标
按照试剂盒的操作说明方法进行小鼠肝肾组织中SOD活性、CAT活性、GSH含量和MDA含量的测定[11-13]。
1.3.6 抗疲劳检测指标
在末次给药30 min后,每组取10只小鼠,进行无负重游泳60 min,休息10 min后用颈椎脱臼法处死小鼠,摘取肝脏,并用生理盐水漂洗,滤纸吸干,超声破碎后制备成质量分数10%的组织匀浆,按照试剂盒操作说明测定小鼠肝糖原含量。
血乳酸测定采用对小鼠采取眼内静脉丛采血的方法,每组取10只,在末次给药30 min后进行无负重游泳实验10 min,分别在开始前0 min,游泳结束后0、20 min测定小鼠血清的乳酸值,根据血乳酸曲线面积公式进行计算。

式中:W为血乳酸曲线下面积;A1为游泳实验前0 min血乳酸值,mmol/g prot;A2为游泳实验后0 min血乳酸值,mmol/g prot;A3为游泳实验后20 min血乳酸值,mmol/g prot。
取负重游泳后的小鼠采用微板法测定ALT活性,按照试剂盒操作说明进行测定并记录。
1.4 数据处理与分析
采用SPSS 23.0版本统计软件进行数据分析,数据结果用平均值±标准差表示,并用Origin 2018统计软件对相关数据指标进行作图,当P<0.05时数据有显著性差异,当P<0.01时数据有极显著性差异。
2 结果与分析
2.1 抗氧化功效评价
2.1.1 黄精基酒对小鼠体质量的影响
体质量变化可以直接地反映出小鼠的生长发育情况,也可以间接表现出在饲养期间黄精基酒对ICR小鼠的影响情况。各组小鼠的体质量变化如图1所示。
图1 各组小鼠体质量状况Fig.1 Body weight of mice in each group
在适应性喂养7 d后小鼠的体质量为(20±4)g,由图1可知,黄精基酒给药组的小鼠经过21 d给药灌胃后体质量逐渐上升,与空白组小鼠相比无明显差异,且日常活动正常,毛色发亮,四肢活动自如,好聚集,说明黄精基酒对小鼠正常活动无明显影响。
2.1.2 小鼠肝脏及肾脏丙二醛含量
丙二醛含量可以直接反映脂肪分解酶发生脂质过氧化时的强度和速度。自由基过剩会导致体内的脂质小分子发生氧化反应,产生过量的丙二醛,造成器官组织的损伤[14]。因此,测定组织器官中的MDA含量能够有效反映脂质氧化反应强度和自由基对机体攻击的程度。不间断灌胃给药21 d后取小鼠的肝脏和肾脏组织进行测定,结果如图2所示。
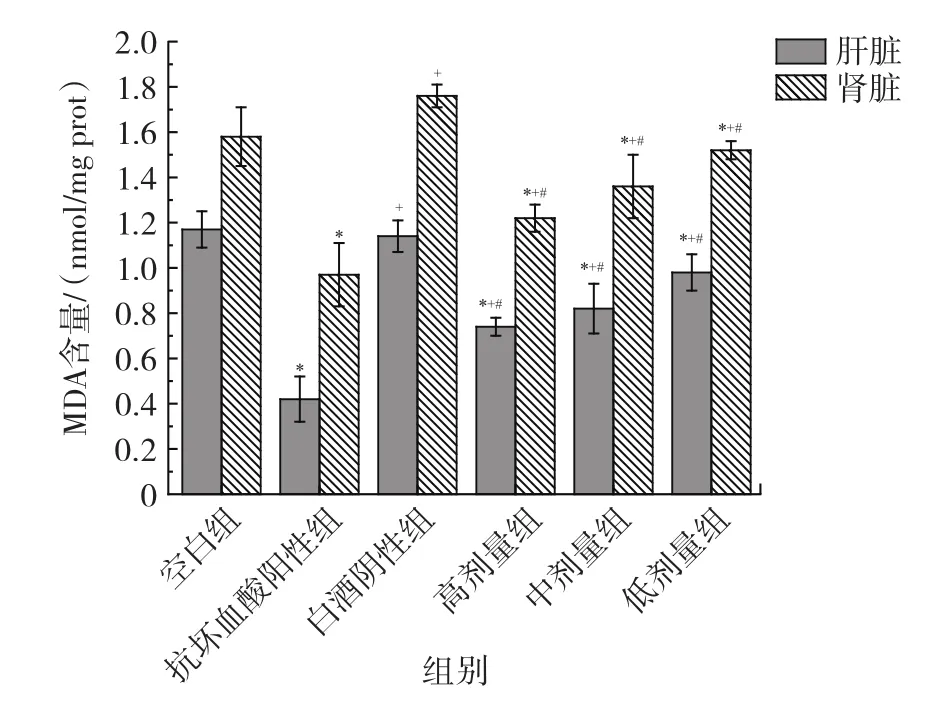
图2 各组小鼠肝、肾丙二醛含量Fig.2 Content of malondialdehyde in the liver and kidney of mice in each group
由图2可知,与空白组相比,抗坏血酸阳性组、黄精基酒高、中、低剂量组均呈现显著降低的趋势(P<0.05),抗坏血酸阳性组肝、肾组织MDA含量分别为0.4、0.93 nmol/mg prot,而白酒阴性组小鼠肝、肾 MDA含量明显高于抗坏血酸阳性组小鼠(P<0.05),分别增加了178.57%、62.89%和171.43%、81.44%,黄精基酒高、中、低剂量组小鼠肝、肾MDA含量显著低于白酒阴性组(P<0.05),这可能是黄精基酒阻断了机体内核酸、蛋白质及大分子物质的交联聚合,阻止了细胞膜上的不饱和脂肪酸发生氧化反应[15],说明黄精基酒可有效降低MDA含量,缓解小鼠肝脏与肾脏的氧化损伤程度。
2.1.3 小鼠肝、肾谷胱甘肽含量
谷胱甘肽是体内一种游离的巯基三肽,主要生理作用是能够保护核糖核酸酶类的蛋白质小分子物质的巯基结构不被破坏,清除掉机体内过剩的自由基[16]。不间断灌胃21 d后GSH含量如图3所示。

图3 各组小鼠谷胱甘肽含量Fig.3 Glutathione content of mice in each group
由图3可知,与空白组相比,抗坏血酸阳性组和黄精基酒3个剂量组的小鼠肝、肾组织均显著增高(P<0.05),白酒阴性组和黄精基酒中、低剂量组显著低于抗坏血酸阳性组小鼠(P<0.05),黄精基酒高、中、低剂量组显著高于白酒阴性组小鼠(P<0.05),说明黄精基酒可有效提高小鼠体内的谷胱甘肽含量,各剂量组之间相互比较发现,随着给药剂量的升高,小鼠体内的谷胱甘肽含量也会随之提升,这可能是由于肝、肾组织内GSH中的巯基(—SH)发生了氧化脱氢反应,与体内过剩的自由基结合,转化为酸类产物,加快了体内排泄[17],刘超等[18]研究发现,沙棘籽油浓度越高,衰老型小鼠脑部谷胱甘肽含量也会持续升高,其结论与本文一致。
2.1.4 小鼠肝、肾超氧化物歧化酶活性
研究表明,超氧化物歧化酶有明显保护肝脏和肾脏细胞并防止肝脏发生纤维化的作用,若SOD活性大幅度降低,则会造成体内自由基清除不足的现象[19]。不间断灌胃给药21 d后,小鼠肝脏及肾脏SOD活性如图4所示。

图4 各组小鼠肝、肾超氧化歧化酶活性Fig.4 Superoxide dismutase activity in the liver and kidney of mice in each group
由图4可知,抗坏血酸阳性组小鼠肝、肾组织中SOD活性显著高于空白组(P<0.05),黄精基酒给药组小鼠肝、肾SOD含量显著低于抗坏血酸阳性组小鼠(P<0.05),且显著高于白酒阴性组小鼠(P<0.05),说明黄精基酒能够增强小鼠肝、肾组织中SOD的活性,这可能是由于肝、肾组织内的超氧阴离子在超氧化物歧化酶的作用下与体内其它的氢离子发生反应生成了过氧化氢酶体,而植物属黄精中叶绿体包含的Zn/Cu-SOD和线粒体中包含的Mn-SOD与这种过氧化氢酶体发生循环催化反应清除了O2-·,使SOD活性升高[20],这一结果充分说明,黄精基酒具有提高小鼠体内超氧化物歧化酶活性的作用。
2.1.5 小鼠肝脏和肾脏的过氧化氢酶活性
过氧化氢酶广泛分布于动物的肝脏和红细胞中,主要作用是清除体内含过氧化氢的自由基,从而使机体内的细胞免受过氧化氢的侵害,为机体提供抗氧化防御,保护机体内的组织器官,是具有抵抗外部物质侵害作用的关键物质之一[21]。因此,测定小鼠体内的CAT能有效反映过氧化氢催化反应的速率和效果。不间断灌胃给药21 d后,小鼠肝、肾组织中CAT活性如图5所示。

图5 各组小鼠肝、肾过氧化氢酶活性Fig.5 Catalase activity in the liver and kidney of mice in each group
由图5可知,抗环血酸阳性组小鼠与空白组相比肝、肾中CAT活性有明显提升且呈现显著性差异(P<0.05),分别增加了48.65%、15.63%,黄精基酒组与抗环血酸阳性组小鼠的CAT活性显著高于空白组与白酒阴性组(P<0.05),白酒阴性组小鼠肝、肾的CAT活性明显低于抗坏血酸阳性组(P<0.05),分别降低了21.82%、14.86%,这可能与过氧化氢酶的酶体及线粒体中氧气浓度的反应速率有关,黄精基酒降低了肝、肾组织线粒体内O2浓度,减缓了过氧化氢酶与H+结合生成H2O的催化反应[22],这一结果表明,黄精基酒可有效提高小鼠体内的CAT活性,增强催化CAT的能力。
2.2 抗疲劳功效评价
2.2.1 小鼠负重游泳时间测定结果
负重游泳实验是评价小鼠抗疲劳的最有效方法之一[23],通过游泳时间长短来评价黄精基酒对小鼠的抗疲劳效果。经口灌胃黄精基酒21 d后,小鼠负重游泳时间结果如表2所示。

表2 各组小鼠负重游泳时间Table 2 Weight-bearing swimming time of mice in each group
由表2可知,与空白组相比,黄精基酒高、中剂量组和红景天苷阳性组小鼠负重游泳时间均有所延长,其中红景天苷阳性组和中剂量组有显著性差异(P<0.05),高剂量组有极显著性差异(P<0.01),与白酒组相比,黄精基酒3个剂量组小鼠负重游泳时间也有所延长,而低、中剂量组呈现显著性差异(P<0.05),高剂量组有极显著性差异(P<0.01),说明黄精基酒可以有效延长小鼠的负重游泳时间,提高小鼠运动过程中的耐力,具有一定的抗疲劳作用,并且小鼠游泳时间会随黄精基酒灌胃浓度的升高逐渐增加。
2.2.2 小鼠肝糖原含量
糖原是生物机体内重要的能量来源,肝糖原能维持机体血糖水平的稳定,当机体进行大量运动时会转化成葡萄糖[24],只有机体中存在一定量的肝糖原,才能提供足够生命活动消耗的能量,从而达到抗疲劳的作用。因此,测定肝糖原含量可以在一定程度上反映机体运动耐力的水平。经口灌胃21 d后测定各组小鼠肝脏中肝糖原的含量如表3所示。

表3 各组小鼠肝糖原含量Table 3 Glycogen content in the liver of mice in each group
由表3可知,负重游泳实验后与空白组相比,3个剂量组的肝糖原含量显著增加(P<0.05),而高剂量组小鼠肝糖原含量显著高于白酒阴性组(P<0.05),且随着黄精基酒剂量的增大,小鼠体内肝糖原的含量也随之增加,这可能是由于黄精基酒能增加机体肝糖原的储备,促进了葡萄糖的转化量,提升小鼠运动耐力,说明黄精基酒具有缓解运动疲劳,增强机体能量储存的效果[25]。
2.2.3 小鼠血乳酸含量
乳酸是糖代谢后的产物,由体内的红细胞和脑组织分泌生成,血液中的乳酸大多在肝脏合成,再经肾脏排出体外,因此,通过测定小鼠体内的乳酸状况可以有效评价机体肝脏的代谢状况[26],各组小鼠的血乳酸含量如表4所示。
由表4可知,负重游泳前各组小鼠的血清乳酸含量无显著差异(P>0.05),游泳结束后中剂量组小鼠即刻的血乳酸含量显著低于空白组和白酒阴性组小鼠(P<0.05),高剂量组小鼠血清乳酸含量极显著低于空白组和白酒阴性组(P<0.01),游泳结束后20 min各组小鼠的血乳酸值没有显著差异(P>0.05),根据血乳酸曲线面积公式计算后发现,中剂量组和高剂量组小鼠血乳酸曲线面积极显著低于空白组和白酒阴性组(P<0.01),这可能是由于红景天苷和黄精基酒可以减少体内乳酸的堆积,促进丙酮酸脱氢酶对丙酮酸的转换作用,生成大量的乙酰辅酶A[27],说明黄精基酒可以有效清除小鼠体内的乳酸,起到缓解疲劳的作用。

表4 各组小鼠血乳酸含量Table 4 Lactic acid content in the blood of mice in each group
2.2.4 酒精肝损伤检测
谷丙转氨酶(ALT)广泛存在于肝脏细胞中,当肝脏受到一定损伤时,体内大量的ALT会流出到肝脏外,造成肝炎性类的疾病。ALT指标能明显反映肝脏损伤的情况,酒精脂肪肝是长期饮酒后最常出现的一种病状,人体在大量饮酒后会加快组织器官的正常活动,对肝脏的生理活动产生负荷作用,形成病变,造成机体血清中的ALT活性升高[28]。因此,测定血清中的ALT活性可以在一定程度上反映出酒精对肝脏的损伤程度。各组小鼠的ALT活性测定结果如表5所示。

表5 各组小鼠谷丙转氨酶活性Table 5 Activity of alanine aminotransferase of mice in each group
由表5可知,负重游泳实验后与空白组相比,中、低剂量组小鼠血清中的ALT活性显著升高(P<0.05),高剂量组小鼠的ALT活性极显著升高(P<0.01),与白酒阴性组相比,黄精基酒中剂量组呈现显著降低趋势(P<0.05),高剂量组呈现极显著降低趋势(P<0.01),这可能是由于肝脏细胞中的ALT将丙氨酸中的α-酮戊二酸转化为谷氨酸,丙氨酸转化成丙酮酸,二者贮存在肝脏细胞的细胞质中,参与机体活动过程中的蛋白质代谢,防止脂肪沉积,进而对小鼠酒精肝损伤起到缓解作用,可在一定程度上保护小鼠肝脏[29]。而白酒阴性组明显高于红景天苷阳性组,证明白酒对于小鼠的肝脏会造成一定损伤。
3 结论
本研究通过测定游泳运动后的小鼠各项指标情况,评价黄精基酒对其抗氧化和抗疲劳的作用,结果显示,黄精基酒3个剂量组和抗坏血酸阳性组小鼠肝、肾组织中的CAT活性和GSH含量明显高于空白组和白酒阴性组小鼠(P<0.05),而MDA含量有明显的降低趋势(P<0.05),不同剂量组之间比较发现,随着黄精基酒浓度的增加,整体抗氧化能力也逐渐提高,说明所调配的黄精基酒可以有效提高小鼠机体内过氧化氢酶的活性和谷胱甘肽的含量,其抗氧化效果与剂量高低也存在一定关系。在小鼠抗疲劳负重游泳实验结果中显示,高、中、低剂量组和阳性药物红景天苷能有效延长小鼠的负重游泳时间(P<0.05),减少乳酸含量(P<0.05),说明所配制的黄精基酒对机体大量运动产生的疲劳感有一定的缓解作用。从酒精肝损伤检测结果看,黄精基酒3个剂量组ALT活性明显低于阴性组小鼠(P<0.05),这证明白酒对于小鼠的肝脏会造成一定的损伤,而黄精基酒具有一定的保护作用。
