6%羟乙基淀粉130/0.4对创伤性家兔炎症介质及其信号通路的影响*
2023-02-13吕洪锦黄绍艳张建中
吕洪锦,张 倩,黄绍艳,张建中△
(1.龙口市人民医院麻醉科,山东 烟台 265700;2.滨州医学院第二临床医学院,山东 烟台 264000;3.烟台市烟台山医院麻醉科,山东 烟台 264000)
创伤后机体存在不同程度的炎性反应,引起白细胞介素-1(IL-1)、IL-6、肿瘤坏死因子-α(TNF-α)等炎性细胞因子释放[1]。创伤性炎症介质能使毛细血管通透性增加、大量蛋白质渗出造成水肿,也能使血管内中性粒细胞变形和黏附能力增强,使其更易游走至间质并释放炎症介质,在组织中形成“瀑布式”的炎症级联反应而加重机体损伤[2]。微小RNA(miRNA)在机体炎性反应和免疫应答中具有重要的调节作用[3]。miR-146a是首先被证实在免疫系统中具有负向调控免疫炎性反应的miRNA[4],被认为是固有免疫及适应性免疫细胞分化的重要调控者。miR-146a主要通过其靶基因IL-1受体相关激酶 1(IRAK1)和TNF受体相关因子 6(TRAF6)在协调免疫和炎症信号传导中发挥作用[5]。活化的 IRAK1、TRAF6可引起Toll样受体-4(TLR4)及核因子-κB(NF-κB)过度表达,促进炎症介质,如TNF-α、IL-1、IL-6的释放,miR-146a的抗炎作用在一定程度上通过抑制TLR4/NF-κB信号通路发挥作用[6]。
羟乙基淀粉(HES)130/0.4是第3代HES,可降低 IL-1、IL-6、TNF-α等炎症因子而减少创伤患者的炎性反应[7];注射HES可降低急性肺损伤大鼠体内TLR4/NF-κB表达水平[8],从而减轻炎性反应,具有抗炎作用,但其作用机制尚不明确。因而建立创伤家兔模型,模拟创伤患者损伤及手术治疗过程,探讨HES对创伤性家兔炎症介质及miR-146a/TLR4/NF-κB的影响,明确HES减轻创伤性炎性反应作用机制具有重要的临床意义。
1 材料与方法
1.1研究对象 2022年4月选取新西兰雄性家兔(购自山东济南朋悦实验动物繁育有限公司,货号37009214625)16只作为研究对象,采用随机数字表法分为乳酸钠林格(LR)组和HES组,每组8只。本研究获医院伦理委员会审批。
1.2方法
1.2.1动物模型制备 将家兔麻醉后用钝器敲打家兔后肢造成后肢骨折,然后行骨折切开内固定术。麻醉方法:5%异戊巴比妥钠(30 mg/kg)经耳缘静脉注射,异戊巴比妥钠2~5 mg/(kg·h)静脉维持。常规备皮、聚维酮碘消毒,铺无菌巾。骨折部位外侧切口,显露股骨骨折部位,术中将骨膜纵行切开,以保留骨膜完整性,胯骨折线置入合适的国产四孔钢板,远近端各2枚螺钉固定,在骨折对应肌肉组织2 cm×2 cm作为软组织缺损模型,同时,取血液和少量肌肉组织备检(T0)。缝合肌肉和皮肤,饲养在清洁环境中。LR组注射10 mL/kg LR,HES组注射10 mL/kg HES,每天1次,输注5 d,完成后麻醉取2组家兔血液和损伤部位肌肉备检(T1)。
1.2.2酶联免疫吸附试验法测定血液TNF-α、IL-1、IL-6水平 T0、T1时经耳缘静脉采集2组家兔血液,离心后吸取上清液,-70 ℃冰箱保存待检。根据酶联免疫吸附试剂盒说明书进行操作;酶标仪吸收450 nm波长检测A值。各孔得到的A值减去空白组A值为各孔实际A值,用于反映血清IL-1、IL-6、TNF-α水平。
1.2.3蛋白质印迹法测定肌肉组织NF-κB P65、TLR4、IRAK1、TRAF6蛋白水平 将损伤肌肉组织研磨后放入蛋白裂解液进行裂解,2 h后取混合液离心后收集上清液加入蛋白上样缓冲液,根据二辛可酸法蛋白定量结果上样,通过凝胶电泳凝胶分离并转移至聚偏二氟乙烯膜,加入针对NF-κB P65(货号ab76302,英国Abcam公司)、TLR4(货号ab13556,英国Abcam公司)、IRAK1(货号ab18256,英国Abcam公司)、TRAF6(货号ab76302,英国Abcam公司)的一抗4 ℃孵育过夜,采用Western洗涤缓冲液洗后加入二抗,采用微型化学发光成像分析系统,应用ImageJ软件分析条带密度,计算蛋白表达量。
1.2.4逆转录-聚合酶链反应(PCR)法检测肌肉组织miR-146a水平 将2组家兔T0、T1时肌肉组织研磨成细粉后加入环氧树脂管中,加入裂解/结合缓冲液、无水乙醇、氯仿等搅拌混匀,将混合液分次加入一个吸附柱RNase-free吸附套管中,经多次离心取出吸附柱RNase-free吸附套管,提取总RNA。根据逆转录试剂盒说明书将纯化的 RNA 逆转录为cDNA,以cDNA为模板进行荧光定量-PCR扩增,最终按荧光定量-PCR试剂盒说明书在荧光定量-PCR仪器中操作,以U6作为内参。引物序列:miR-146a,正向:5′-CAGTGCGTGTCGTGGAGT-3′,反向:5′-GGGTGAGA ACTGAATTCCA-3′。U6,正向:5′-GCTTCGGC AGCACATATACTAAAAT-3′,反向:5′-CGCTTCACGAATTTGCGTGTCAT-3′ 。
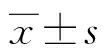
2 结 果
2.12组家兔不同时间点炎性细胞因子水平比较 与T0时比较,2组家兔T1时血液TNF-α、IL-1、IL-6水平均明显升高,差异均有统计学意义(P<0.05);与LR组比较,HES组家兔T1时血液TNF-α、IL-1、IL-6均明显降低,差异均有统计学意义(P<0.05)。见表1。
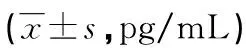
表1 2组家兔不同时间点炎性细胞因子水平比较
2.22组家兔不同时间点NF-κB P65、TLR4、IRAK1、TRAF6蛋白水平比较 与T0时比较,2组家兔T1时TLR4、NF-κB P65、IRAK1、TRAF6蛋白水平均明显升高,差异均有统计学意义(P<0.05);与LR组比较,HES组家兔T1时TLR4、NF-κB P65、IRAK1、TRAF6蛋白水平均明显降低,差异均有统计学意义(P<0.05)。见图1、表2。
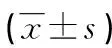
表2 2组家兔不同时间点NF-κB P65、TLR4、IRAK1、TRAF6蛋白水平比较
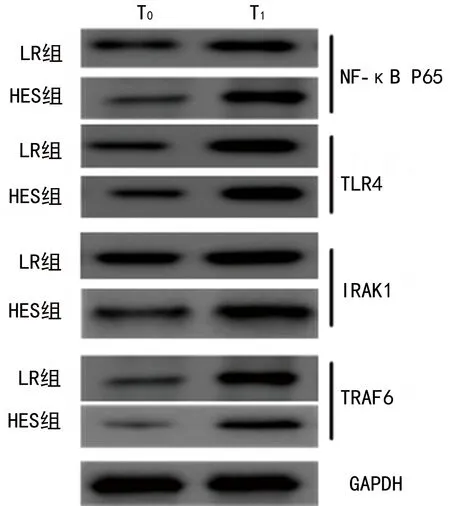
图1 2组家兔不同时间点NF-κB P65、TLR4、IRAK1、TRAF6蛋白水平比较
2.32组家兔不同时间点肌肉组织miR-146a表达水平比较 miR-146a在T0时数值为标准值1,与T0时比较,创伤后miR-146a在T1时相对数值:HES组为1.69±0.07,LR组为1.52±0.07;2组家兔在创伤后miR-146a表达水平均明显升高,差异均有统计学意义(P<0.05);HES组家兔T1时miR-146a表达水平明显高于LR组,差异有统计学意义(P<0.05)。见图2。
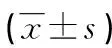
续表2 2组家兔不同时间点NF-κB P65、TLR4、IRAK1、TRAF6蛋白水平比较

图2 2组家兔不同时间点肌肉组织miR-146a表达水平比较
3 讨 论
HES 130/0.4是第3代HES,相对分子质量为130×103,相对分子质量降低且更加集中,对凝血及肝、肾功能的影响更小[7]。HES的使用争论焦点主要在于肾功能损害,有研究表明,中等剂量HES[(10.3±4.7)mL/kg]在合适人群中使用不会增加肾损伤的风险,现在国内将其广泛用于创伤或临床有失血症状的手术患者[9]。创伤刺激能引起机体免疫系统细胞释放大量炎症介质,炎性反应的轻重取决于促炎性细胞因子水平,其中主要促炎性细胞因子有IL-1、IL-6、TNF-α等[2]。促炎性细胞因子可激发NF-κB的表达,而NF-κB反过来可提高IL-6、TNF-α水平,形成一个表达的正反馈。有研究发现,HES可通过影响TNF-α、IL-6、IL-10等炎症因子的促炎及抗炎反应平衡而诱导大鼠淋巴细胞的增殖与分化,HES还可抑制巨噬细胞蛋白增加[10],并且早期应用HES更加有利于抑制炎性反应[11]。既往研究发现,HES可通过抑制NF-κB途径降低炎性反应,从而降低毛细血管渗漏[12]。创伤和手术刺激主要通过启动炎性反应及促进释放大量细胞因子,进而引发全身应激反应。本研究使用创伤家兔模拟创伤患者损伤及手术治疗过程,因损伤部位的炎性反应最明显,所以,取损伤部位肌肉作为不同治疗组进行对照研究,结果显示,与LR组比较,HES组家兔T1时TNF-α、IL-1、IL-6水平均明显降低,差异均有统计学意义(P<0.05),表明使用HES可降低创伤性炎性细胞因子水平。
miRNA是一类内源性非编码单链RNA,其在免疫功能的调节、免疫细胞生长与分化和自身免疫的预防中均具有重要作用,主要通过转录后调控基因表达,最终影响信号通路下游蛋白分子的表达而发挥作用,且绝大多数 miRNA 对基因表达的作用是抑制性的,具有负反馈作用[3,13]。miR-146a是在免疫系统中具有重要调节作用的miRNA,尤其是在免疫应答及炎性反应方面的调节作用[4]。IRAK1在各种细胞中广泛表达,主要作用是作为一种受体蛋白激酶参与了TLR等信号传导通路,对炎性反应具有重要的调节作用。TRAF6是一种重要的细胞内多功能信号分子,具有独特的受体结合特异性。IRAK1、TRAF6作为miR-146a公认的靶基因,是全身炎症及免疫应答的有效调节因子,miR-146a通常通过其发挥作用[5,14]。TLR4是一种膜结合蛋白,激活的TLR4可募集下游细胞内髓样分化因子88(MyD88)蛋白,MyD88通过miR-146a的IRAK1、TRAF6形成 MyD88-IRAKs-TRAF6 复合体参与信号传导,最终作用于下游 NF-κB 通路,调节炎症因子释放[15]。TAGANOV等[16]发现,脂多糖刺激细胞可使NF-κB依赖的miR-146a表达水平升高,并已通过荧光素酶报告基因试验和突变试验证实。有研究在人工模拟炎症疾病模型中使用miR-146a骨髓细胞定向递送的方法,验证了miR-146a通过靶向NF-κB信号通路抑制炎性反应[17]。当miR-146a表达水平升高时,IRAK1、TRAF6表达水平均下调,因此,认为miR-146a调控TLR/NF-κB信号通路应答炎性反应是以负反馈方式发挥作用的[18-19]。本研究结果显示,2组家兔TLR4、NF-κB P65、IRAK1、TRAF6蛋白水平在创伤后均明显升高,HES组家兔T1时TLR4、NF-κB P65、IRAK1、TRAF6蛋白水平均明显低于LR组,差异均有统计学意义(P<0.05),表明HES能抑制TLR4/NF-κB表达,从而减轻创伤性炎性反应。本研究同时发现,2组家兔创伤后miR-146a表达水平均明显升高,而HES组家兔创伤后miR-146a表达水平更高。表明HES可能通过上调miR-146a表达抑制IRAK1、TRAF6的产生,使TLR4/NF-κB活化减少而抑制炎性反应。
综上所述,HES可减轻创伤性家兔的炎性反应,其机制可能是HES通过调控miR-146a负反馈调节TLR4 信号通路的 IRAK1、TRAF6,降低NF-κB蛋白的表达,进而减少信号通路下游促炎性细胞因子IL-6、IL-1、TNF-α的表达。然而,本研究未添加通路抑制剂进行反向验证,今后将进一步完善分组设置进行研究。
