儿童抗结核药物性肝损伤状况及相关影响因素分析
2023-02-10陈芳张小佛周海依张锋王曼知
陈芳 张小佛 周海依 张锋 王曼知
抗结核药物治疗是结核病防治的重要武器,但也存在诸多问题亟待解决,尤其是儿童结核病患者,其肝肾尚未发育成熟,代谢功能受限,不良反应的发生率也相应增加。抗结核药物的不良反应是直接影响结核病治疗效果的重要因素,其中以抗结核药物性肝损伤(anti-tuberculosis drug induced liver injury,ATB-DILI)最为常见,危害性也最大,轻者可表现为一过性转氨酶升高,重者可致肝衰竭,甚至危及生命,部分患儿甚至不得不中止抗结核治疗,从而影响疗效[1-2]。因此,笔者分析了儿童结核病患者发生ATB-DILI的临床表现、严重程度、病理损害、发生时间分布及相关影响因素,为临床医生早期识别高危患者、评估病情和制定恰当的抗结核治疗方案提供依据,以尽早预防ATB-DILI的发生,减少不良临床结局,改善预后。
资料和方法
一、 研究对象
采用回顾性研究方法,收集2018年6月至2022年6月南华大学衡阳医学院附属长沙中心医院确诊为结核病且符合入组标准的200例住院或门诊儿童患者临床资料,包括肺结核157例、结核性胸膜炎19例、支气管结核13例、淋巴结结核11例。所有入组患儿均在抗结核治疗中全疗程使用双环醇或谷胱甘肽护肝药物治疗。其中,发生肝损伤患儿52例(肝损伤组),ATB-DILI发病率为26.0%;未发生肝损伤患儿148例(非肝损伤组)。
纳入标准:(1)首次接受治疗;(2)根据患儿年龄及病情强化期选用3~4种一线抗结核药物[H-R-Z(E)]治疗,巩固期选用H-R治疗[3]的结核病患儿,结核性胸膜炎、支气管结核及淋巴结结核可强化治疗3个月,巩固治疗9个月。其中,H:异烟肼,R:利福平,E:乙胺丁醇,Z:吡嗪酰胺。
排除标准:(1)不使用H-R-Z(E)等一线抗结核药物标准治疗方案进行治疗;(2)临床资料不完善;(3)入组前肝功能异常,或合并患有病毒性肝炎、脂肪肝、EB病毒感染及巨细胞病毒感染,或合并服用其他具有明显肝毒性药物的患儿。
二、 研究方法
1. ATB-DILI诊断标准:由于目前尚无儿童ATB-DILI的诊治指南及专家共识,故目前我科仍依据《抗结核药物性肝损伤诊治指南(2019年版)》[1]诊断ATB-DILI,即血清丙氨酸氨基转移酶(ALT)≥3倍正常值上限(ULN)和(或)总胆红素≥2倍正常值上限;或天冬氨酸氨基转移酶(AST)、ALT和总胆红素同时升高,且至少1项≥2倍正常值上限。
2. ATB-DILI临床分型[1]:(1)肝细胞损伤型:ALT≥3倍ULN,且R值[(ALT的实测值/ALT的ULN)/碱性磷酸酶(ALP)的实测值/ALP的ULN]≥5;(2)胆汁淤积型:ALP≥2倍ULN,且R值≤2,血清ALP水平升高,且先于ALT升高,或ALP升高幅度较ALT升高更明显;(3)肝血管损伤型:ALT≥3倍ULN,R值≥2(伴血管彩色多普勒超声表现);(4)混合型:ALT≥3倍ULN,ALP≥2倍 ULN,且2 3. ATB-DILI严重程度分级[1]:(1)0级(无肝损伤):患者对暴露药物可耐受,无肝毒性反应;(2)1级(轻度肝损伤):血清ALT和(或)ALP呈可恢复性升高,总胆红素<2.5倍ULN(42.8 μmol/L),且国际标准化比值(international normalized ratio,INR)<1.5;(3)2级(中度肝损伤):血清ALT和(或)ALP升高,总胆红素≥2.5倍ULN,或虽无总胆红素升高但INR>1.5;(4)3级(重度肝损伤):血清ALT和(或)ALP升高,总胆红素≥5倍ULN(50 mg/L或85.5 μmol/L),伴或不伴INR>1.5;(5)4级(急性肝功能衰竭):血清ALT和(或)ALP水平升高,总胆红素>10倍ULN(17.1 μmol/L)或每小时升高>10 mg/L或17.1 μmol/L,INR>2.0或凝血酶原活动度(PTA)<40%,可同时出现腹腔积液、肝性脑病或与肝损伤相关的其他器官功能衰竭;(6)5级(致命):因肝损伤死亡,或需接受肝移植才能存活。 4. 观察指标:收集患儿性别、年龄、体质量指数(BMI)、疾病诊断、既往病史、用药史、开始抗结核治疗至肝损伤出现的时间、抗结核治疗药物、分枝杆菌培养、抗酸杆菌涂片、结核分枝杆菌核酸检测、是否多部位结核(结核病灶累及2个及以上部位者)、AST、ALT、白蛋白(ALB)、总胆红素(TBIL)、血清前白蛋白、肾功能(包括尿素、肌酐、尿酸)、血红蛋白、免疫球蛋白E(IgE)等资料为观察指标。其中,病原学阳性为分枝杆菌培养、抗酸杆菌涂片、结核分枝杆菌核酸检测中任意一项阳性者。 148例非肝损伤组患儿中,男性68例,女性80例;年龄范围为1个月至18岁,年龄中位数(四分位数)为102.79(36.00, 180.00)个月;肺结核121例、结核性胸膜炎14例、支气管结核10例、淋巴结结核3例。 52例肝损伤组患儿中,男性24例,女性28例;年龄范围为5个月至18岁,年龄中位数(四分位数)为109.46(46.25, 177.00)个月;肺结核36例、结核性胸膜炎5例、支气管结核3例、淋巴结结核8例;20例(38.5%)无明显症状仅肝功能指标异常,32例(61.5%)厌食,29例(55.8%)呕吐,3例(5.8%)黄疸,均加用护肝药和对症处理后好转。51例为ATB-DILI 1级(轻度),1例为2级(中度),无3~5级肝损伤患者,所有患者均为肝细胞损伤型患者,无其他类型肝损伤患者,故未进行分级和临床分型与发生ATB-DILI的相关性分析。 在开始抗结核治疗2周内有29例(55.8%)发生ATB-DILI,第3~8周有8例(15.4%),第9~12周有5例(9.6%),第13~16周有7例(13.5%),第16~24周有3例(5.7%)。 两组患儿在性别、年龄、是否病原学阳性、是否多部位结核、免疫球蛋白E、尿素、肌酐、尿酸等方面的差异均无统计学意义;在体质量指数、血红蛋白、前白蛋白、白蛋白等方面的差异均有统计学意义。 多因素logistic回归分析显示,体质量指数低于18.5、血清前白蛋白低于200 mg/L和血红蛋白低于120 g/L是儿童发生ATB-DILI的独立危险因素(表2,3)。 表1 临床相关因素在两组患儿中的分布情况 续表1 表2 儿童结核病患者发生ATB-DILI的多因素logistic回归分析变量赋值表 表3 儿童结核病患者发生ATB-DILI的多因素logistic回归分析 ATB-DILI是指结核病患者在使用抗结核药物治疗过程中,由于药物或其代谢产物引起的肝细胞毒性损伤或肝脏对药物及其代谢产物的变态反应所致的病理过程[1],多发生在用药后的1周至3个月内,1~2周或2个月左右达到高峰[4],其临床表现各异,呈现非特异性动态变化,可表现为无症状的一过性转氨酶升高,亦可表现为急性肝炎,甚至发生爆发性肝细胞坏死,少数也会进展为慢性肝炎、肝纤维化和肝硬化[5]。但目前缺乏特异性分子诊断标志物,且不同个体发生ATB-DILI的潜伏期差异也较大,故临床仍主要通过排他性及评估用药因果关系后进行诊断,导致ATB-DILI确诊困难,常误诊漏诊,延误病情[2,6-7]。本研究结合临床分析了200例儿童结核病患者抗结核治疗后发生ATB-DILI的情况,为临床医生提供了早期识别、病情评估和方案制定的直接参考依据,具有重要意义。 文献报道ATB-DILI发病率差异较大,介于2%~33%之间[1,4,8-9],尽管本研究中所有患儿在使用抗结核药物治疗的同时均使用护肝药物,但ATB-DILI 的发生率仍高达26.0%,明显高于成人发生率[10-12],虽数值上与Gafar等[9]报道的儿童ATB-DILI发生率一致,但该报道统计的是2个月强化期的发生率,而本研究是全疗程,故认为本组患者的发生率低于Gafar等[9]研究,这可能与治疗方案、治疗时间、不同国家、不同人群、病情的严重程度、样本量大小、医疗机构的等级差异,以及儿童药物代谢能力不足等因素有关,但值得庆幸的是,所有患儿在护肝药物的辅助下,发生的ATB-DILI多为症状轻微或无症状,或仅为血生化检测值稍高于正常,这也为提高患儿治疗依从性和临床医师的方案制定提供了有利支持。同时,本研究ATB-DILI均发生在抗结核药物治疗6个月内,均为急性DILI,且55.8%的患儿发生在2周内,这可能与本研究中心为独立的学生儿童结核科,临床医师能够在抗结核治疗开始即启动密切随访及肝功能动态监测,有利于及时获得肝功能指标变化有关;同时也说明抗结核药物在治疗2周内即可引起至少50%患儿的肝功能异常,这为儿童结核病抗结核治疗的保肝护肝提出了新的挑战。也提示临床医师在治疗儿童结核病患者时,应尽早启动肝功能监测,并告知抗结核药物治疗中可能出现的不良反应及相应临床表现,以减少家长及患儿对抗结核药物治疗的抵抗及对不良反应的过度担心和焦虑,使其依从常规随诊复查,尽量减少中重度DILI的发生。 本研究还发现,血清前白蛋白含量低于正常值是儿童结核病患者发生ATB-DILI的主要危险因素,但目前暂无该指标与ATB-DILI相关性的其他研究。有研究认为,血清前白蛋白的含量与人体的生理、病理状态密切相关,可反应肝脏合成和分解代谢的轻微改变,其半衰期短,仅约1.9 d,能够较为敏感、特异性地反应早期肝细胞损伤,已被广泛应用为营养不良和疾病预后的标志物[13-15];其含量变化是药物性肝损伤的敏感指标,其血清浓度降低的幅度与肝实质损伤的程度密切相关[16]。因此,笔者认为,监测患儿血清前白蛋白的变化,有助于早期筛选出可能存在ATB-DILI的患儿,有助于及时干预治疗、改善患儿预后。另外,营养不良可造成负氮平衡,在抗结核治疗过程中这类患者更易发生ATB-DILI[17],而前白蛋白能够反应患者的营养状态,负氮平衡也与血清前白蛋白降低相关,故有研究建议将前白蛋白作为营养不良的诊断和监测指标[18],在进行抗结核治疗时应动态监测前白蛋白,当该指标低于正常值时,应及时指导患儿加强营养,增加饮食中优质蛋白的摄入,纠正营养不良;另外,可增加这部分患儿的随访频率,必要时增加护肝药物的种类,以进一步减少ATB-DILI的发生。 另一方面,血红蛋白水平也被证明与ATB-DILI的发生密切相关[8,12,19]。有研究认为≥134 g/L是预测ATB-DILI发生的指标,并认为游离的血红蛋白诱导肝脏发生氧化损伤[12]。本研究发现,血红白蛋白含量下降(贫血)是预测儿童发生ATB-DILI的主要危险因素,且贫血儿童发生ATB-DILI的风险约为非贫血患儿的2.4倍,与上述文献研究一致[8,19]。这可能是血红蛋白的降低可降低机体防御药物性相关氧化应激的能力,使全身携氧能力下降,从而促进了药物性肝损伤的发生。这提示临床医师也应动态监测患者血红蛋白,当血红蛋白下降发现贫血时,应及时查找病因、积极纠正,同时也应避免游离血红蛋白过高所致的氧化性肝损伤。 本研究还发现,体质量指数低于18.5亦为儿童发生ATB-DILI的独立危险因素,且发生率约为体质量指数正常儿童的2.3倍。迟旭等[19]和Makhlouf等[20]认为血清白蛋白<35 g/L和(或)体质量指数降低是发生ATB-DILI的危险因素,但Gafar等[9]认为体质量指数降低与儿童发生ATB-DILI无关,这可能与本研究是观察了患儿全疗程的抗结核药物性肝损伤,而Gafar 等[9]研究仅观察了强化期所致的肝损伤,也可能与营养状况评价指标、样本量及人群不同有关。这提示当结核病患儿进行长时间抗结核药物治疗时,需关注体质量指数低于正常水平的患儿,积极进行营养指导、科学喂养,以尽可能减少ATB-DILI的发生。 刘芳等[21]和Jiang等[12]发现年龄≥40岁为ATB-DILI的独立危险因素,认为可能与中老年患者的身体机能减弱,肝脏代谢和解毒能力下降有关。但Gafar等[9]研究发现年龄因素不是儿童发生ATB-DILI的独立危险因素,这与本研究结论一致,认为可能是肝肾功能尚未发育成熟的儿童与中老年人肝肾机能减弱所致的药物代谢能力差的机制并不完全一致有关。杨学敏等[22]和Zhao等[23]研究发现女性是发生ATB-DILI的高危因素,但张洋婷等[24]研究认为性别与发生ATB-DILI无关,本研究也未得到相关性结论,认为这可能与纳入人群及性别比例不同有关,也可能与儿童的生理和机能在不同性别间的差异不明显有关。还有研究认为白蛋白含量下降是发生ATB-DILI的独立危险因素,认为肝脏既是人体白蛋白的合成器官,同时亦是药物代谢的重要器官,当体内具有药物代谢作用的血清白蛋白下降时,可导致抗结核药物在肝脏中的结合率和清除率的明显下降,从而对肝脏造成负担,甚至肝损伤[4,8,15,19,25]。而本研究并未得出相同结论,这可能与纳入人群为儿童,且多为轻度DILI有关,也可能与样本量较少有关。其他常见预测指标如呼吸衰竭、心功能不全等因临床资料不完善、相关样本量少,尚未纳入研究。而与成人发生ATB-DILI相关的常见高危因素,如肝病史和糖尿病等基础疾病、嗜酒和吸烟等不良生活习惯,在儿童结核病患者中极为少见,也未纳入本研究。 综上所述,儿童结核病在抗结核治疗全疗程使用护肝药物的基础上,ATB-DILI的发生率仍较高,但其临床表现、严重程度、病理损害明显降低,临床医师应重点关注治疗2周内体质量指数、血清前白蛋白和血红蛋白下降的结核病患儿发生ATB-DILI的风险。本研究为单中心、回顾性研究,可能存在一定的选择偏倚和样本量的局限;另外,目前尚缺乏儿童ATB-DILI的诊断标准,因使用成人标准可能会导致结果存在一定偏差,需进一步大数据验证。 利益冲突所有作者均声明不存在利益冲突 作者贡献陈芳:提出研究选题、调研文献、设计研究方案、撰写论文;张小佛:调研整理文献、设计论文框架、修订论文;周海依:数据整理及统计分析;张锋:数据收集;王曼知:研究方案审查及修订、修改及终审论文三、 统计学处理
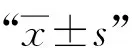
结 果
一、 发生ATB-DILI的结核病患儿基本情况
二、 发生ATB-DILI的时间
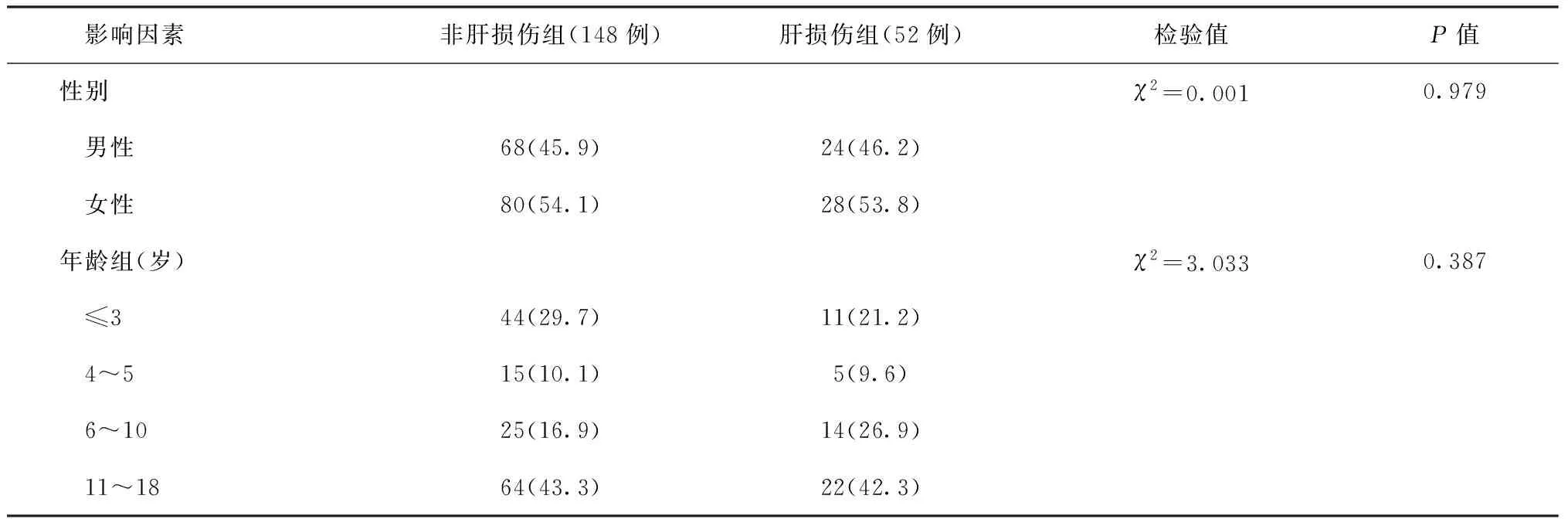
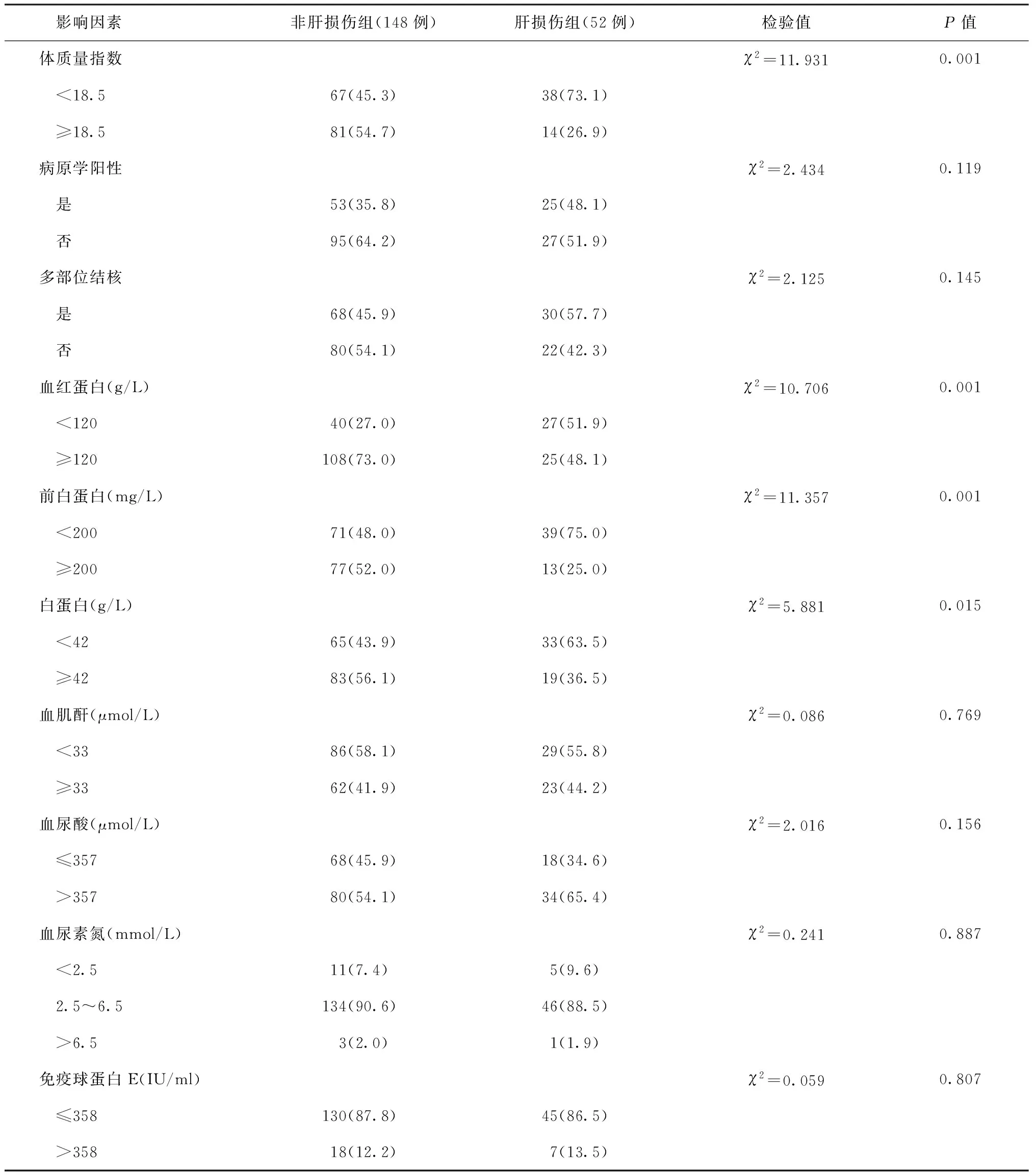
三、发生ATB-DILI的单因素分析
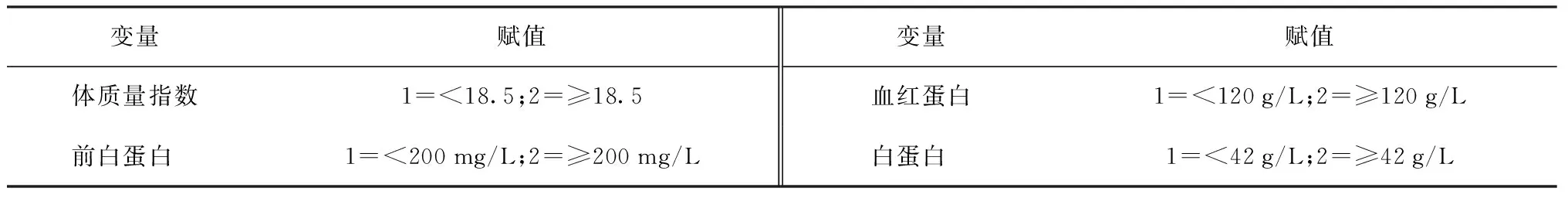
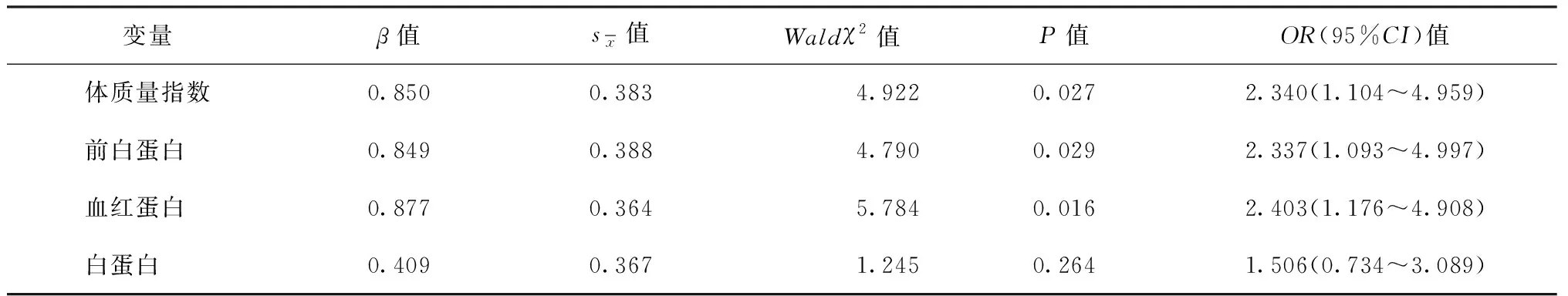
四、发生ATB-DILI的多因素logistic回归分析
讨 论
