丙烯酸接枝改性氧化石墨烯及其对Ce(Ⅲ)的吸附性能研究*
2023-02-09刘遵义
刘遵义,谭 磊,曲 静,杨 卉,郝 燕
(内蒙古科技大学 化学与化工学院,内蒙古 包头 014010)
0 引 言
稀土元素被广泛应用于陶瓷[1]、农业[2]、医疗[3]、能源[4]、催化[5]等领域,在众多稀土元素中,铈(Ce)在医疗、催化、探测器、发光材料等行业都有广泛应用[6-7]。然而,稀土在开采和生产过程中产生的废水会影响生态环境,增加生物毒性并抑制光合作用[2,8-10]。以我国内蒙古包头市白云鄂博矿稀土矿为例,该地区稀土中富含La、Ce、Sm和Eu等轻稀土元素,但是由于大规模的开采和加工稀土,导致包头市周围的土壤、粉尘、地下水中包含了很多轻稀土元素[11-12],研究表明在各种稀土元素污染物中Ce的含量位居首位[13]。土壤、粉尘、地下水中含有过量的Ce会危害生物健康,影响农作物生长[14-15],若通过食物链或皮肤吸收途径进入人体,还会造成神经系统损害,诱导组织特异性生物累积,进而引起肝、肺和脑损伤[16-17]。Dahle等[15]通过研究氧化铈纳米粒子对土壤反硝化过程的亚慢性毒性,对比了Ce(Ⅲ)与Ce(Ⅳ)两种不同价态的Ce对生态系统的毒性大小,结果表明当浓度相同时,可溶性Ce(Ⅲ)的毒性远大于Ce(Ⅳ)。因此,处理土壤、水体中的稀土污染物Ce(Ⅲ)显得格外重要。
目前,处理稀土污染物的方法主要有电化学法[18]、生物处理法[19]、膜分离法[20]和吸附法[21]等。上述各种方法中,吸附法由于具有简单高效、可操作性强、无二次污染等优点[22],近年来被广泛应用于处理稀土污染物。Babu等[23]利用N-[(3-三甲氧基硅基)丙基]乙二胺三乙酸(TMS-EDTA)对氧化活性炭(AC)进行功能化改性,合成了一种EDTA功能化活性炭(EDTA-AC),该材料用于吸附稀土离子Nd(Ⅲ)时,吸附量为71.42 mg/g,约为纯AC吸附量的4倍,而且该方法成本低、易于合成。
用于吸附处理稀土污染物的传统吸附材料主要以活性炭、沸石、树脂等材料为主[24],这些材料在使用时具有一定的局限性,比如吸附容量有限、吸附速率低、易造成环境二次污染等[25]。与之相比,氧化石墨烯(GO)作为碳质类高分子材料具有比表面积大、热稳定性高、在很多溶剂中具有良好的分散性等[26]优点,同时GO分子中含有羟基、羧基、环氧基等含氧基团更有利于吸附。因此,近年来GO被广泛应用于吸附处理稀土离子污染物。Ashour等[27]利用GO表面的含氧官能团与稀土离子之间的静电相互作用,将GO用于吸附处理稀土离子Y(Ⅲ)和La(Ш),其吸附量分别为135.7和85.7 mg/g。Li等[28]采用Hummer法制备GO以去除水溶液中的稀土金属离子,GO对La(Ⅲ)和Nd(Ⅱ)的吸附量分别为105.5 mg/g和99.1 mg/g。但是,单独利用GO作为吸附剂时,其吸附容量有限,成本也较高。为了达到更好的吸附效果,可通过接枝改性的方法在GO基材上引入功能性单体,在有效提高GO的吸附性能的同时,也能降低生产成本。Ma等[29]在室温下采用γ-射线辐照技术在GO上接枝甲基丙烯酸二甲氨基乙酯(DMAEMA),制备出含胺基团的吸附剂(GO-g-P),该吸附剂对酸性溶液中的Cr(Ⅵ)有很好的去除效果。当pH为1.1时,GO-g-P对Cr(Ⅵ)的吸附量为82.4 mg/g。Aghdam等[30]通过GO与乙酰乙酸烯丙酯接枝制备吸附剂,该吸附剂对Hg(Ⅱ)的最大吸附容量为282.7 mg/g。Bao等[31]利用具有高密度氨基官能团的PEI与氨基官能化GO纳米片接枝,该纳米片在从水溶液中捕获Cr(Ⅵ)污染物时表现出高选择性,具有1185 mg/g的超高吸附容量和高吸附速率。
考虑到在GO上接枝含有羧基的单体,既能增加GO表面的羧基含量,还会增强GO与稀土离子之间的静电相互作用[32],从而达到提高吸附材料对稀土离子的吸附量。因此,本文中,以N,N-二甲基甲酰胺(DMF)作为反应溶剂,丙烯酸(AA)作为接枝单体,用于功能化改性GO,以制备对稀土离子具有良好吸附效果的吸附材料(GO-g-PAA),并采用傅里叶变换红外光谱(FTIR)、扫描电子显微镜(SEM)、热重分析(TGA)等表征接枝前后材料的结构、形貌、热稳定性等特征。同时选择Ce(Ⅲ)作为目标污染物离子,系统地研究吸附时间、溶液pH值、吸附剂用量、Ce(Ⅲ)浓度、NaCl浓度等对Ce(Ⅲ)的吸附行为的影响和吸附机理。目前,GO与AA接枝改性并用于吸附处理稀土离子污染物的方法还很少报道。
1 实 验
1.1 原料与试剂
GO,购于常州第六元素材料科技股份有限公司;DMF,购于津市风船化学试剂科技有限公司;过硫酸铵((NH4)2S2O8),为天津市风船化学试剂科技有限公司;N,N-二甲基双丙烯酰胺(MBA),购于上海阿拉丁生化科技股份有限公司;AA,为西陇化工有限公司;偶氮胂Ш,购于北京防化学院工厂。实验所用其他试剂均为分析纯。
1.2 GO-g-PAA的制备
将0.08 g GO加入80 mL DMF中,在60 ℃下超声45 min,再加入0.12 g (NH4)2S2O8继续超声20 min,随后加入0.10 g MBA。在氩气气氛中,再匀速缓慢滴加一定量的单体AA,并在60 ℃下持续机械搅拌1 h,再恢复至室温静置4 h。反应结束后,将其倒入溶剂过滤器中过滤,并用乙醇洗涤,在60 ℃真空干燥6 h至恒重制得吸附材料GO-g-PAA,合成路线如图1所示,然后称重并按公式(1)计算接枝率(GY)。实验中还通过改变加入单体AA的质量,来研究单体质量对GO-g-PAA接枝率的影响。
(1)
式中:Wg为真空干燥后制得GO-g-PAA的质量(g);W0为接枝前GO的质量(g)。
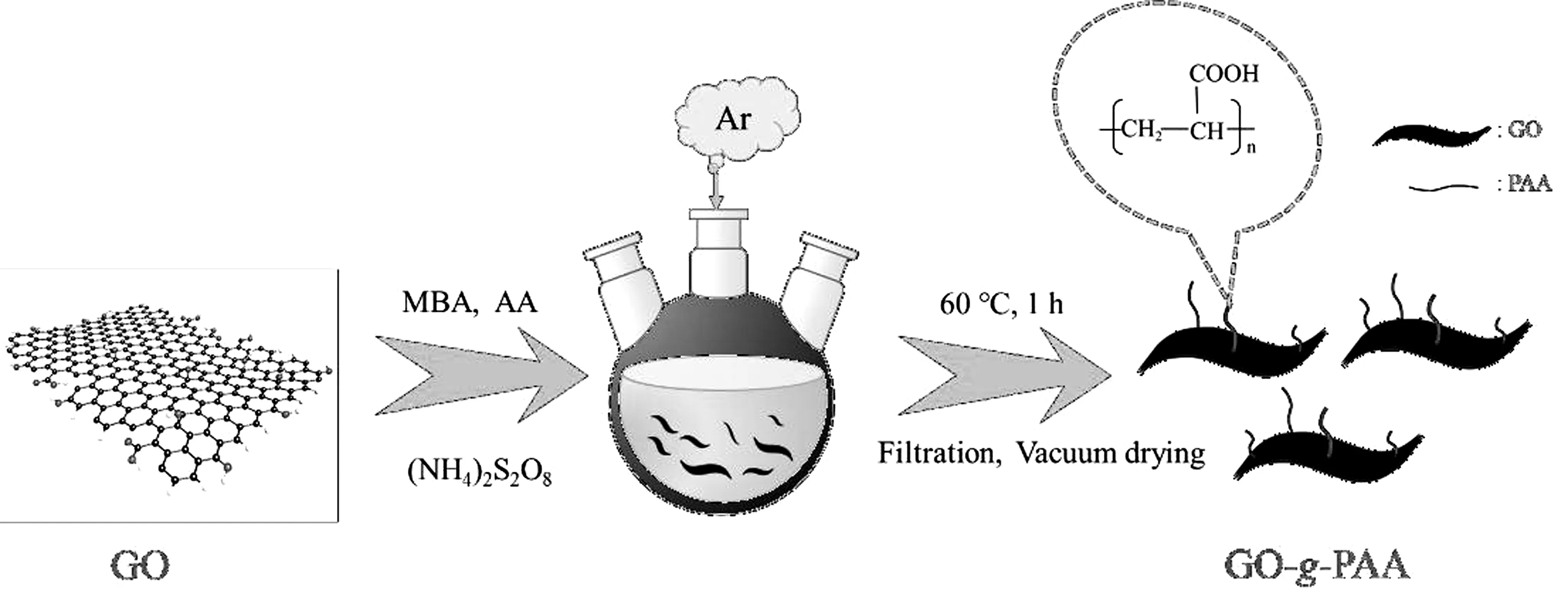
图1 吸附材料GO-g-PAA的合成路线图Fig.1 Schematic illustration for the synthesis of adsorbent GO-g-PAA
1.3 GO-g-PAA的表征
使用Spotlight 200傅立叶变换红外光谱仪测定样品在4 000~650 cm-1范围内的显微红外谱;TGA测定使用德国Netzsch公司生产的STA449C综合热分析仪,氩气下以10 ℃/min的升温速率测定样品从室温~800 ℃温度范围内的热失重曲线;接枝前后样品的表面形貌使用TESCAN公司GALA3 XMN 型号SEM进行测试;X射线光电子能谱(XPS)分析使用Kratos Analytical公司的AXIS-Ultra仪器,使用单色Al-Kα辐射(225 W,15 mA,15 kV)和低能电子注入进行电荷补偿。为了补偿表面电荷效应,电子结合能用碳氢化合物的C1s峰校正(284.8 eV)。
2 GO-g-PAA对Ce(Ⅲ)的吸附性能研究
2.1 吸附动力学
吸附动力学测定过程如下:将 5 mg吸附剂GO-g-PAA置于20 mL,2 mmol/L Ce(NO3)3溶液中,置于25 ℃恒温培养箱中进行静置吸附,在不同吸附时间后,依次拿出样品,去除GO-g-PAA吸附剂后,再加入0.1%的偶氮砷III溶液作为显色剂,通过UV-Vis测定溶液中Ce(Ⅲ)浓度在655 nm处的吸光度值[33],并根据公式(2)计算吸附量(qe):
(2)
式中:qe(mg/g)表示在吸附平衡时GO-g-PAA对Ce(Ⅲ)的吸附量;c0标识为溶液初始质量浓度(mg/L),ct表示t时间时溶液中剩余的稀土离子质量浓度(mg/L);V表示用于吸附的溶液体积(mL);m表示加入吸附剂的质量(mg)。
2.2 不同条件对GO-g-PAA吸附性能的影响
实验中系统研究了吸附剂用量、溶液pH值、Ce(Ⅲ)浓度、NaCl浓度等对GO-g-PAA吸附性能的影响。其中吸附剂用量的影响实验具体步骤如下:称取不同质量的GO-g-PAA分别置于20 mL,2 mmol/L Ce(NO3)3溶液中,在25 ℃下吸附120 min后去除吸附剂,加入0.1%的偶氮砷III溶液作为显色剂,测定滤液中的Ce(Ⅲ)浓度并计算吸附量。另外,pH值对吸附性能的影响实验参照上述实验步骤。通过加入HNO3(0.1 mol/L)和NaOH(0.1mol/L)调整待测溶液的pH值,以测定pH值对GO-g-PAA的吸附性能的影响。
另外,分别称取5 mg 的GO-g-PAA置于 20 mL不同浓度Ce(NO3)3溶液,并参照上述测定和计算吸附量的步骤,以确定不同Ce(Ⅲ)离子浓度的对其吸附量的影响。
为了研究NaCl浓度对GO-g-PAA吸附性能的影响,分别称取5 mg 吸附剂GO-g-PAA 和不同质量 NaCl固体,将其置于20 mL,2 mmol/L Ce(NO3)3溶液中,分别配制不同浓度(0.2,0.4,0.6,0.8,1.0,1.2,1.4 mol/L)的NaCl溶液,在25 ℃下吸附120 min后去除吸附剂,加入0.1%(质量分数)的偶氮砷III溶液作为显色剂,测定滤液中的Ce(Ⅲ)浓度并计算吸附量。
2.3 脱附实验
室温下,将上述实验中达到吸附平衡后的GO-g-PAA过滤取出,置于1 mol/L NaCl溶液中浸泡12 h,过滤后用蒸馏水清洗3次。然后,放置于60 ℃真空烘箱中烘干24 h后再进行XPS分析。
3 结果与讨论
3.1 GO-g-PAA的表征
图2为GO和GO-g-PAA的红外光谱图。如图2所示,GO对应的红外谱图曲线中可以观察到GO上含有大量的羟基、羧基和环氧基的吸收峰,3 282 cm-1为GO上—OH的伸缩振动峰;1 035和1 720 cm-1处分别对应GO中C—O—C和羧基中C=O键的伸缩振动,1 612 cm-1处GO中芳香环中的C=C双键的伸缩振动峰[34-35]。接枝单体AA后,GO-g-PAA的红外光谱中除了保留了GO原有的特征峰,还出现了一些新的变化,3 290 cm-1处的吸收峰为GO-g-PAA的羟基伸缩振动峰,该峰与未接枝GO相比明显变宽,这是由于分子间氢键耦合导致的[36]。在1 405 cm-1出现的峰由于接枝链PAA上的C—O—H面内弯曲振动引起的[37]。另外,有文献报道基材成功接枝PAA后,吸收峰会向高波长、低波数方向位移[38-39], GO和GO-g-PAA的红外光谱图进行对比可以看出,基材GO在接枝PAA后,原来在GO中1 612 cm-1处的吸收峰位移至1 606 cm-1处且有变宽趋势(如图2)。上述实验结果表明PAA已成功接枝到GO上。

图2 GO与GO-g-PAA红外光谱图Fig.2 FT-IR of GO and GO-g-PAA
GO和GO-g-PAA的SEM如图3所示。从图中可以看出,GO呈现层状结构且有很多薄层层叠在一起,片层之间呈现褶皱和弯曲的微观形貌(图3(a))[40],GO层边缘的褶皱是由于GO中的含氧官能团之间的静电相互作用引起的,呈现出片层间“贴合式”的褶皱行为[41-42]。与基材GO相比,在接枝后GO-g-PAA虽保持GO的片状结构(图3(b),(c)),但表面更加粗糙和不均匀,更有利于吸附[43]。

图3 GO (a)、GO-g-PAA (b, c)的SEM图Fig.3 SEM of (a) GO and (b, c) GO-g-PAA
从图4 (a)的TGA结果来看,GO和GO-g-PAA样品在100 ℃左右出现约4%的质量损失,这是由于样品表面吸附水分蒸发引起的[34]。GO在接近210 ℃温度范围内出现了约40%的质量损失,这是GO上不稳定的含氧基团的热降解造成的[44]。从210~800 ℃出现20%左右的质量损失主要是稳定的含氧官能团的热降解[45]和高温下GO碳层的碳化降解[46]。GO-g-PAA的热失重过程共分为3个阶段:第一阶段是室温~100 ℃温度范围内水分蒸发引起的质量损失;第二阶段是100~240 ℃温度范围内的热降解,这主要是由于GO上的不稳定含氧基团和接枝PAA的侧链降解引起的[38,47];第三阶段是高于240 ℃温度范围内由于GO上稳定的含氧基团和接枝PAA的聚合物主链的热降解引起的质量损失[48, 49]。如果将DTG曲线中的峰值温度定义为Tmax,GO和GO-g-PAA的Tmax温度分别为266.4 ℃和345 ℃ (如图4 (b)所示),这说明接枝上PAA后可以提高GO的热稳定性。

图4 GO和GO-g-PAA的热失重曲线 (a)和DTG曲线 (b)Fig.4 (a) TGA curves and (b) DTG curve of GO and GO-g-PAA
3.2 AA用量对GO-g-PAA接枝率的影响
单体用量是对接枝率有显著影响的实验因素,因此,在保持其他实验条件不变的情况下研究了单体用量对GO-g-PAA接枝率的影响[50]。由图5可知,随着AA用量的增加,接枝率呈现出先增后降的趋势。这是由于在加入交联剂和引发剂后,基材GO表面出现新的自由基位点,随着单体用量的增加,越来越多的单体接枝到新出现的自由基位点上,进而提高了接枝率[51]。随着单体用量的进一步增加,单体之间会发生聚合形成均聚物PAA,导致反应体系的粘度增加,阻碍了单体分子向基材GO的扩散,从而导致接枝率降低[52-53]。因此,接枝实验中将单体AA的用量确定为1.6 g。
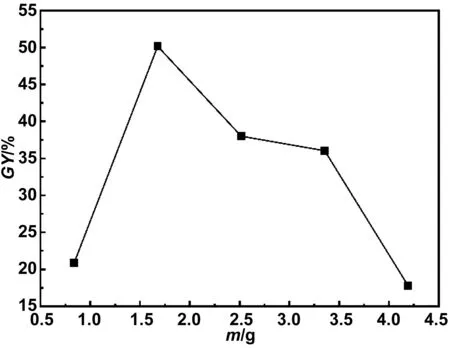
图5 单体AA用量对接枝率的影响Fig.5 The effect of the amount of monomer AA on the grafting yield
3.3 GO-g-PAA对Ce(Ⅲ)的吸附性能测定
3.3.1 吸附动力学
为了保证吸附过程达到吸附平衡,吸附性能实验中需首先测定了吸附剂的吸附动力学。如图6 (a)所示,在吸附的初期,GO-g-PAA对Ce(Ⅲ)的吸附量随着吸附时间的增加而快速增大,这主要是由于在吸附初期吸附剂表面具有大量的活性位点可用于吸附Ce(Ⅲ)[54];随着吸附的进行,吸附剂表面的活性位点逐渐趋于饱和,离子必须进一步扩散到吸附剂更深位置的活性位点,在这个过程中就得克服更大的阻力和离子之间的相互作用力,因此,导致后期的吸附速率趋于缓慢,在100 min时达到吸附平衡。为了保证吸附剂在不同条件下都能达到吸附平衡,后面实验中都将GO-g-PAA吸附Ce(Ⅲ)的吸附时间定为120 min。
吸附动力学数据可以采用准一级(式3)和准二级(式4)两种动力学模型来进行分析,这两种模型对应的公式如下[55]:
准一级动力学方程:
ln(qe-qt)=lnqe-k1t
(3)
准二级动力学方程:
(4)
qt(mg/g)表示在t(min)时刻GO-g-PAA对Ce(Ⅲ)的吸附量;k1(min-1)是准一级动力学常数;k2(g/(mg·min))是准二级动力学常数。根据上述公式进行拟合,得出的结果如表1所示。从表中可以看出采用准二级动力学模型拟合后的线性相关系数明显高于准一级动力学模型的线性相关系数,说明GO-g-PAA对Ce(Ⅲ)的吸附是属于化学吸附过程[56]。

表1 吸附剂GO-g-PAA吸附Ce(Ⅲ) 时准一级和准二级动力学模型的各个参数

图6 吸附动力学曲线(温度:25 ℃,吸附剂用量:5 mg)(a);吸附剂用量(温度:25 ℃,吸附时间为120 min)(b)和溶液pH值(温度:25 ℃,吸附时间为120 min,吸附剂用量:5 mg)(c)对Ce(Ⅲ)吸附量的影响及Langmuir吸附模型曲线(温度:25 ℃;吸附时间为120 min,吸附剂用量:5 mg)(d)Fig.6 (a) The adsorption kinetics curve (temperature: 25 ℃, adsorbent dosage: 5 mg); (b) effects of adsorbent dosage (temperature: 25 ℃, adsorption time: 120 min) and pH value of solution (temperature: (c) 25 ℃, adsorption time: 120 min, dosage: 5 mg) on Ce (Ⅲ) adsorption capacity and (d) Langmuir adsorption model curve (temperature: 25 ℃, adsorption time: 120 min, dosage: 5 mg)
3.3.2 吸附剂用量和pH值对吸附量的影响
图6 (b)为吸附剂GO-g-PAA对Ce(Ⅲ)的吸附量与吸附剂用量之间的关系,从图中可以看出当吸附剂用量增加时,吸附量呈现降低的趋势,这主要是因为当吸附剂的用量较小时,每个吸附位点上可以接触的Ce(Ⅲ)的数量会相对较多,从而增加了吸附剂的吸附量;当吸附剂用量增加的时候,在吸附剂上的每个吸附位点就会有更少的机会去接触Ce(Ⅲ),从而导致单位质量的吸附量减少[57]。上述实验结果表明在Ce(Ⅲ)浓度不变的情况下,吸附剂的用量越小,吸附剂的利用效率就越高。
溶液的pH值会影响Ce(Ⅲ)在水溶液中的存在形式,是决定离子吸附过程的主要因素,因此,实验中研究了pH值对GO-g-PAA吸附Ce(Ⅲ)的影响。如图6 (c)所示,GO-g-PAA对Ce(Ⅲ)的吸附量随着pH值的增加呈现先增加后降低的趋势。主要原因是当pH在1-7范围内,其中在强酸环境下,溶液中会存在较多的H+并与Ce(Ⅲ)进行吸附竞争,吸附的位点更容易被H+占据,羧基主要以-COOH形式存在,减少了与Ce(Ⅲ)结合位点的数量[58-59],从而导致GO-g-PAA对Ce(Ⅲ)的吸附量较少;随着pH增大,羧基与Ce(Ⅲ)之间的静电相互作用增强,导致GO-g-PAA对Ce(Ⅲ)的吸附量增加[59];当pH值大于7时,Ce(Ⅲ)会发生水解,产生Ce3(OH)54+[60],并且会生成Ce(OH)3沉淀[61],从而导致GO-g-PAA对Ce(Ⅲ)的吸附量降低。此外,从图中可以看出,当pH=1时,GO-g-PAA对Ce(Ⅲ)仍可达到101.9 mg/g,明显高于很多文献中报道的吸附Ce(Ⅲ)的吸附量[62-63],说明GO-g-PAA可在强酸性的极端条件下使用。
3.3.3 等温吸附模型
为了进一步研究吸附剂GO-g-PAA对Ce(Ⅲ)的吸附过程,采用 Langmuir等温吸附模型(公式(5))来拟合吸附数据,通过吸附模型来计算吸附剂的理论最大吸附量(qm)来评价和对比吸附剂的吸附性能[64]:
(5)
式中:Ce为Ce(Ⅲ)离子的平衡浓度(mg/L);qe为平衡状态的吸附量(mg/g);qm为吸附剂的理论最大吸附量(mg/g);KL为Langmuir常数(L/mg)。
根据对吸附数据进行拟合(如图6(d)所示),得到的拟合结果列于表2。从表2可以看出,吸附剂GO-g-PAA用于吸附Ce(Ⅲ)时,经过线性拟合后的线性相关系数(R2)为0.993,表明该吸附剂对Ce(Ⅲ)的吸附符合Langmuir等温吸附模型,属于单分子层吸附[65]。按照公式(5)计算得到吸附剂GO-g-PAA对Ce(Ⅲ)的理论最大吸附量为251.9 mg/g,实验结果表明GO-g-PAA用于吸附处理Ce(Ⅲ)时表现出优异的吸附性能。GO-g-PAA对Ce(Ⅲ)的吸附容量明显高于文献报道的其他吸附剂(如表3)。
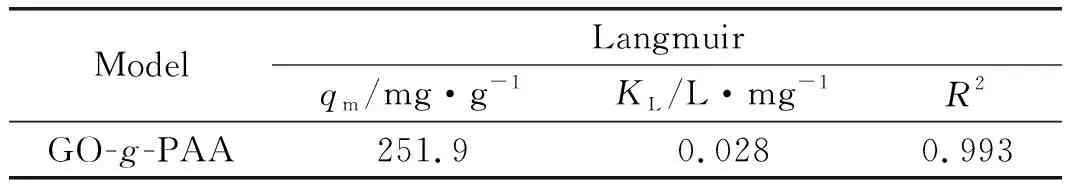
表2 GO-g-PAA用于吸附Ce(Ⅲ)时采用Langmuir等温吸附模型拟合的各参数及相关系数
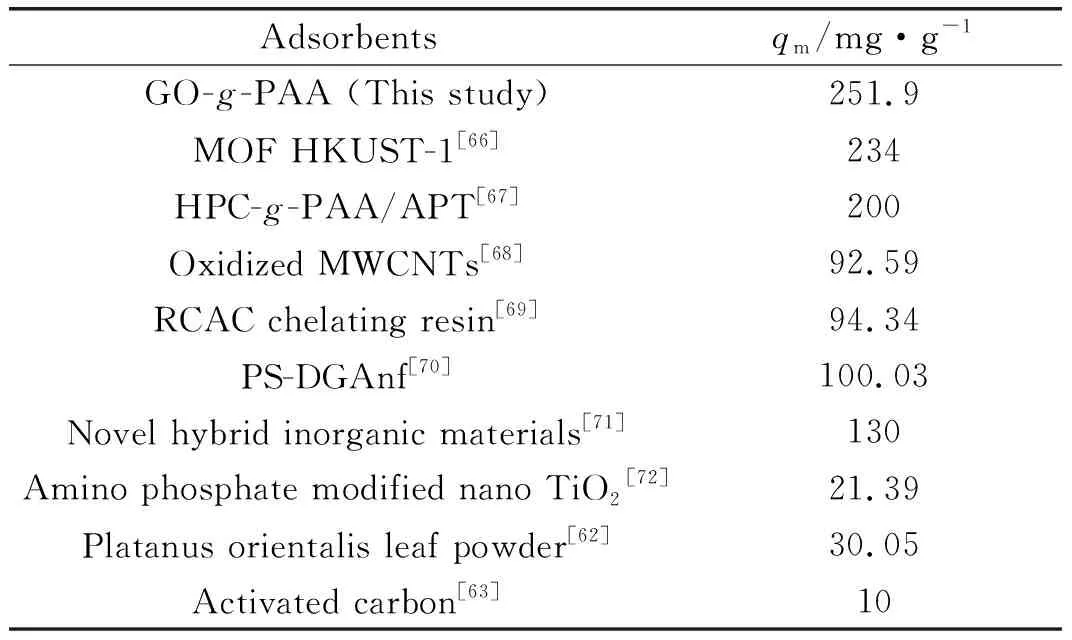
表3 各种吸附剂用于吸附Ce(Ⅲ)的吸附量比较
3.3.4 NaCl浓度对吸附的影响及吸附机理研究
实验中研究了NaCl溶液的浓度对GO-g-PAA吸附量的影响。如图7 (a)所示,随着NaCl浓度增加,GO-g-PAA对Ce (Ⅲ)的吸附能力明显减弱,导致这种现象的主要原因是当加入NaCl溶液后,溶液中的Na+与Ce3+离子之间相互竞争,吸附剂GO-g-PAA表面的吸附位点中的一部分会被溶液中的Na+所占据,进而造成了GO-g-PAA对Ce(Ⅲ)吸附量的减少[73]。NaCl溶液的浓度越高,Na+离子的数量越多,与Ce3+离子之间的竞争就会越激烈。因此,随着NaCl溶液浓度的升高,GO-g-PAA对Ce(Ⅲ)的吸附量呈现下降趋势。

图7 NaCl浓度对吸附剂GO-g-PAA吸附Ce(Ⅲ)的影响(a);吸附平衡后和1 mol/L NaCl脱附后吸附剂GO-g-PAA的XPS谱图(1: 吸附Ce(Ⅲ)后;2:NaCl脱附后)(温度:25 ℃,吸附时间为120 min,吸附剂用量:5 mg)(b)Fig.7 (a) Effect of NaCl concentration on adsorption of Ce (Ⅲ) by adsorbent GO-g-PAA; (b) XPS spectra of GO-g-PAA after adsorption equilibrium and desorption of 1 mol/L NaCl: 1. after adsorption of Ce (Ⅲ); 2. after desorption of NaCl) (temperature: 25 ℃; adsorption time: 120 min; adsorbent dosage: 5 mg)
为了进一步研究吸附剂GO-g-PAA对Ce(Ⅲ)的吸附机理,将上述实验中达到吸附平衡后的吸附剂GO-g-PAA置于1 mol/L NaCl溶液中进行脱附实验,并采用XPS光谱来表征吸附平衡后和脱附后的吸附剂。如图7(b)中的曲线1所示,当GO-g-PAA吸附Ce(Ⅲ)达到吸附平衡后,XPS谱图中分别在885.3和903.9 eV两处出现了属于Ce3d的吸收峰[37, 74],证明了Ce(Ⅲ)吸附在GO-g-PAA上。当把达到吸附平衡的吸附剂浸泡在NaCl溶液中进行脱附实验后,如图7(b)中曲线2所示,GO-g-PAA的XPS谱图中Ce3d峰消失,而在1071.8 eV处出现了属于Na1s的吸收峰,这说明在脱附过程中吸附剂表面上的Ce(Ⅲ)被Na+取代。结合上述NaCl浓度对GO-g-PAA吸附量影响的实验结果和XPS谱图结果分析,GO-g-PAA对Ce(Ⅲ))的吸附属于离子交换吸附机理。
4 结 论
采用DMF作为溶剂体系在GO基材上,通过化学引发法将单体AA接枝在GO上,制备出可高效、高速吸附去除稀土离子污染物的吸附材料GO-g-PAA。实验中采用FTIR、SEM和TGA表征了GO-g-PAA的结构、形貌、热稳定性等特征,证实了单体AA成功接枝到基材GO上,并且接枝PAA有利于提高GO的热稳定性。通过研究单体用量对GO-g-PAA接枝率的影响发现当单体AA的用量为1.6 g时具有最佳接枝率。GO-g-PAA用于吸附Ce(Ⅲ)时,在100 min达到吸附平衡,吸附过程符合准二级吸附动力学模型和Langmuir吸附等温模型,属于化学吸附过程和单分子层吸附,GO-g-PAA对Ce(Ⅲ)的理论最大吸附量分别为251.9 mg/g。吸附剂GO-g-PAA在较宽pH值范围(4~8)对Ce(Ⅲ)都表现出较高的吸附量,尤其是当pH=1时GO-g-PAA对Ce(Ⅲ)的吸附量仍可达到101.9 mg/g,说明该吸附剂可在强酸性的极端条件下。通过分析NaCl浓度对GO-g-PAA吸附量影响以及分析吸附后和脱附后的XPS谱图可以证实GO-g-PAA对Ce(Ⅲ)的吸附是离子交换机理。上述研究结果表明,吸附剂GO-g-PAA用于吸附处理稀土离子如Ce(Ⅲ)时具有高酸度下吸附能力强、吸附容量高等优点,在处理废水中的稀土离子方面具有一定的应用前景。
