蛇床子素对髓核致神经根炎性痛大鼠脊髓背角Wnt3a/β-catenin信号通路的影响
2023-02-03杨琳张嘉明何仲贤刘苑婷鲁杨孙来保江伟航
杨琳,张嘉明,何仲贤,刘苑婷,鲁杨,孙来保,江伟航
(1.广州市番禺区中心医院,广东广州511400;2.中山大学附属第六医院,广东广州510655;3.中山大学附属第一医院,广东广州 510080)
椎间盘突出髓核的生化致炎特性和对脊髓背角神经元及胶质细胞的作用是引发周围神经根炎症反应并引起腰腿痛的重要原因[1]。蛇床子素(osthole)又名甲氧基欧芹酚(化学结构见图1),具有抗炎镇痛作用。本课题组前期研究发现,在髓核致炎神经根痛大鼠硬膜外腔注射蛇床子素可抑制炎性痛的外周及中枢敏化,从而达到缓解痛觉过敏的作用[2-4],但其具体作用机制尚不完全明确。脊髓背角神经元及胶质细胞中Wnt3a/β-catenin信号通路的激活是导致炎性疼痛和神经病理性疼痛的关键因素之一[5]。因此,本研究观察蛇床子素对Wnt3a/β-catenin信号通路及相关分子的影响,进一步探讨蛇床子素的镇痛作用及机制,以期为其临床应用于腰腿痛的治疗提供新的实验依据,现将研究结果报道如下。
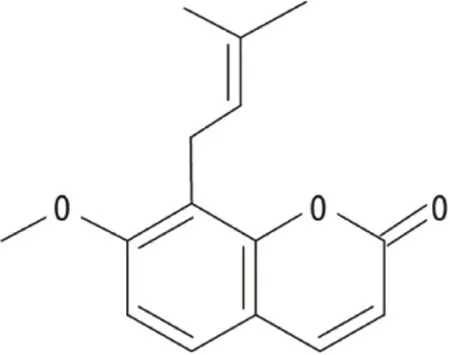
图1 蛇床子素的化学结构Figure 1 Chemical structure of osthole
1 材料与方法
1.1 实验动物SPF级成年雄性SD大鼠,体质量200~280 g,由中山大学动物实验中心提供,动物生产许可证号:SCXK(粤)2016-0029。实验单位为中山大学附属第一医院,动物使用许可证号:SYXK(粤)2020-0233。饲养环境:分笼饲养,自由进食,室温(23±2)℃,相对湿度55%~65%,维持12 h循环昼夜节律。本研究动物实验方案已经中山大学附属第一医院伦理委员会审核通过,伦审号:[2010]94号。本实验所有过程步骤均严格按照中山大学动物实验中心的操作相关指南进行。
1.2 药物、试剂与仪器蛇床子素(C15H16O3,MW=244.29,美国Selleckchem公司生产,批号:S2337)。10%二甲基亚砜(DMSO,美国Sigma公司);兔抗Wnt3a抗体、兔抗β-catenin抗体、兔抗甘油醛-3-磷酸脱氢酶(GAPDH)抗体、山羊抗兔IgG、Alex-488标记的驴抗兔IgG、Alex-594标记的驴抗兔IgG(美国Abcam公司);白细胞介素18(IL-18)酶联免疫吸附分析(ELISA)试剂盒、肿瘤坏死因子α(TNF-α)ELISA试剂盒(深训欣博盛生物科技公司);逆转录试剂盒、聚合酶链反应(PCR)扩增试剂盒(TaKaRa公司)。Von Frey纤毛测痛仪(美国Stoelting公司);热痛觉测试仪(美国IITC Life Science公司);医用显微手术电钻(XSZ-G-1型,上海光电技术有限公司);倒置荧光显微镜(美国Leica公司);电泳及转膜系统(美国Bio-Rad公司);PE-10导管(英国Smiths Medical公司)。
1.3 分组与处理将54只大鼠随机均分为3组,即假手术组、模型组、治疗组,每组18只。除假手术组外,模型组和治疗组构建髓核致炎模型。术后2 d,治疗组经硬膜外导管给予20 g·L-1蛇床子素50 μL(给药剂量参考文献研究[4,6]),模型组和假手术组经硬膜外导管给予100 mL·L-1的DMSO 50 μL。所有大鼠术前3、1 d及术后1、3、7、10、14 d均进行疼痛行为学指标50%机械性撤足阈值(MWT)和热伤害性撤足潜伏期(TWL)测定,于术后7 d(即硬膜外给药后第5天)取术侧脊髓背角组织进行指标检测。
1.4 造模方法参考Sasaki等[7]的方法建立大鼠髓核致炎模型:用10 g/L戊巴比妥钠麻醉大鼠后俯卧位固定在动物用手术操作台上,背部区域备皮后消毒铺巾,以两侧髂嵴点连线中点切开约2.5 cm。逐层暴露组织肌肉直至看清L4~L5半椎板。取医用显微手术电钻在半椎板中央钻孔,暴露出左侧背根神经结。将PE-10导管经孔向头侧轻柔置入(3~4 mm),并将PE-10导管固定好。导管的另一端经皮下从大鼠两耳之间引出约3 cm并固定,回抽确认无血和脑脊液后,用灼烧法封闭导管。模型组和治疗组从尾椎取出约0.4 mg髓核组织,放置于已经暴露好的背根神经结表面,而假手术组取出大鼠尾部自体髓核,但不放置自体髓核组织于背根神经上,其余步骤相同。逐层缝合伤口,并用抗感染的聚维酮碘药膏擦拭皮肤伤口,所有手术操作后的大鼠均单笼饲养。术后将撕咬肢体、下肢运动功能障碍和大小便失禁的大鼠剔除,并通过导管注射2%利多卡因10 μL,观察30 s内是否出现双后肢麻痹验证导管位置。
1.5 观察指标与方法
1.5.1 机械性撤足阈值(MWT)测定测试前,将大鼠放置于有机透明玻璃测试盒内至少30 min,使动物习惯于测试环境。待其安静后,使用直径约0.2 mm均匀尖端圆柱形探针垂直刺激大鼠患侧后爪的足底,力度由弱至强,当大鼠患侧后肢出现迅速撤回、抬起或舔足等躲避应激行为时,记录该压力数值。每只大鼠刺激5次,通过5个读数的平均值计算每只动物的50%MWT。
1.5.2 热伤害性撤足潜伏期(TWL)测定测试前,将大鼠放入有机透明玻璃盒子内约15 min以适应环境,并置放于装有温度控制的透明玻璃板上(厚度为3 mm)。将辐射热源聚焦在大鼠患侧后爪足底皮肤上,当后爪出现迅速撤回、抬起或舔足等躲避应激行为时,关闭热源开关,并记录时间数值。每只大鼠患侧后足底以5 min的时间间隔测试热刺激3次,取平均值作为TWL。
1.5.3 定量聚合酶链反应(Q-PCR)法检测脊髓背角组织Wnt3a、β-catenin mRNA表达水平采用20 g/L戊巴比妥钠(60~80 mg/kg)深麻醉大鼠后,在冰面上迅速取出大鼠L5节段脊髓背角组织,按TRIzol抽提法提取脊髓背角总RNA,测定RNA浓度和纯度。以RNA为模板应用逆转录试剂盒获得cDNA,进行PCR扩增。引物序列见表1。反应条件:95℃变性30 s,55℃复性30 s,72℃延伸1 min,变性到延伸总共35个循环。计算每个样本的循环阈值(Ct值),运用Bio-Rad CFX96荧光定量PCR仪配套的Bio-Rad CFX Manager Software 1.6数据分析软件进行分析,采用2-ΔΔCt法计算Wnt3a和β-catenin的mRNA相对表达量。

表1 PCR引物序列Table 1 PCR primer sequences
1.5.4 Western Blot法检测脊髓背角组织Wnt3a、β-catenin蛋白表达水平将大鼠L5节段脊髓背角组织用显微剪剪成小碎片,加入含有蛋白酶抑制剂的组织裂解液,依次进行超声波匀浆、水浴及离心后取上清。选用10%十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE),用Bio-Rad半干转仪将蛋白转至聚偏氟乙烯(PVDF)膜后用50 g/L脱脂牛奶室温封闭2 h,分别与Wnt3a一抗(体积比1∶1 000稀释),β-catenin一抗(体积比1∶1 000稀释),GAPDH一抗(体积比1∶1 000稀释)置于4℃冰箱孵育过夜,然后与山羊抗兔二抗(体积比1∶500稀释)室温下孵育2 h。将PVDF膜与增强化学发光(ECL)试剂反应后即刻显影,用ImageJ 6.0软件分析PVDF膜条带的灰度值。实验重复3次,将各样品中Wnt3a和β-catenin灰度值分别与相应内参GAPDH灰度值相除作为相应目的蛋白的相对表达量。
1.5.5 免疫荧光染色法检测脊髓背角组织Wnt3a、β-catenin蛋白表达水平取出大鼠L5节段脊髓背角组织,40 g/L多聚甲醛固定后,进行脱水及冰冻切片(厚度为20 μm)。然后将冰冻切片漂洗3次,每次10 min,再用含有5%(V/V)驴血清和0.3%TritonX-100的溶液均匀覆盖组织,室温封闭切片1 h。随后用滤纸吸干封闭液,滴加对应的一抗,放入湿盒中4℃轻摇孵育过夜。次日取出切片于常温复温1 h并吸去一抗。漂洗3次,每次10 min。加入二抗,在避光及室温条件下孵育1 h,再用磷酸盐缓冲液(PBS)洗3次,每次10 min。最后封片,在荧光显微镜下观察,并采用CCD摄像头拍摄图像。
1.5.6 ELISA法检测脊髓背角组织炎症因子IL-18、TNF-α水平将大鼠L5节段脊髓背角组织剪成小碎片,加入含有蛋白酶抑制剂的组织裂解液。按100 μL/孔加入稀释后的Cytokine Standard至标准品孔,然后各加入100 μL待测样品至样品孔,用Dilution Buffer R(1×)代替样品和标准品,设置空白孔。封孔后避光摇床孵育1.5 h。甩除孔内液体,封孔后孵育90 min,再在每孔加入100 μL稀释后的Streptavidin-HRP(1×),孵育30 min。最后于显色后终止反应后的10 min内,置于450 nm波长处检测吸光度,计算待测样品的浓度。
1.6 统计方法采用SPSS 22.0统计软件进行数据分析,采用GraphPad Prism 7.0软件作图。各组计量资料以均数±标准差(±s)表示。行为学数据结果,采用重复测量的方差分析,然后用Turkey Post Hoc Test法检测组间差异或使用T检验进行组间差异比较分析。Western Blot、ELISA以及免疫荧光染色结果的数据比较则采用单因素方差分析(One-way ANOVA),2组间比较采用Student-test检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠机械痛阈值比较图2结果显示:与假手术组比较,模型组和治疗组术后出现50%MWT下降及TWL潜伏期缩短(P<0.05或P<0.01),表明髓核致神经根性疼痛动物模型建立成功。治疗组术后3 d出现50%MWT上升及TWL潜伏期延长,并持续到术后第14天,与模型组比较,差异均有统计学意义(P<0.05或P<0.01)。

图2 各组大鼠机械性撤足阈值(MWT)变化(A)与热伤害性撤足潜伏期(TWL)变化(B)比较(±s,n=6)Figure 2 Comparison of the change in mechanical withdrawal threshold(A)and the change in thermal withdrawal latency(B)among various groups of rats(±s,n=6)
2.2 各组大鼠脊髓背角中Wnt3a、β-catenin的mRNA表达比较图3结果显示:术后7 d,与假手术组比较,模型组大鼠脊髓背角Wnt3a、β-catenin的mRNA表达水平均显著升高(P<0.01);而治疗组Wnt3a、β-catenin的mRNA表达水平降低,与模型组比较,差异均有统计学意义(P<0.05)。

图3 各组大鼠脊髓背角中Wnt3a、β-catenin的mRNA相对表达量比较(±s,n=6)Figure 3 Comparison of the relative mRNA expressions of Wnt3a and β-catenin in the spinal dorsal horn among various groups of rats(±s,n=6)
2.3 各组大鼠脊髓背角中Wnt3a、β-catenin的蛋白表达比较图4结果显示:术后7 d,与假手术组比较,模型组大鼠脊髓背角Wnt3a、β-catenin的蛋白表达水平均显著升高(P<0.01);而治疗组Wnt3a、β-catenin的蛋白表达水平均明显降低,与模型组比较,差异有统计学意义(P<0.05)。
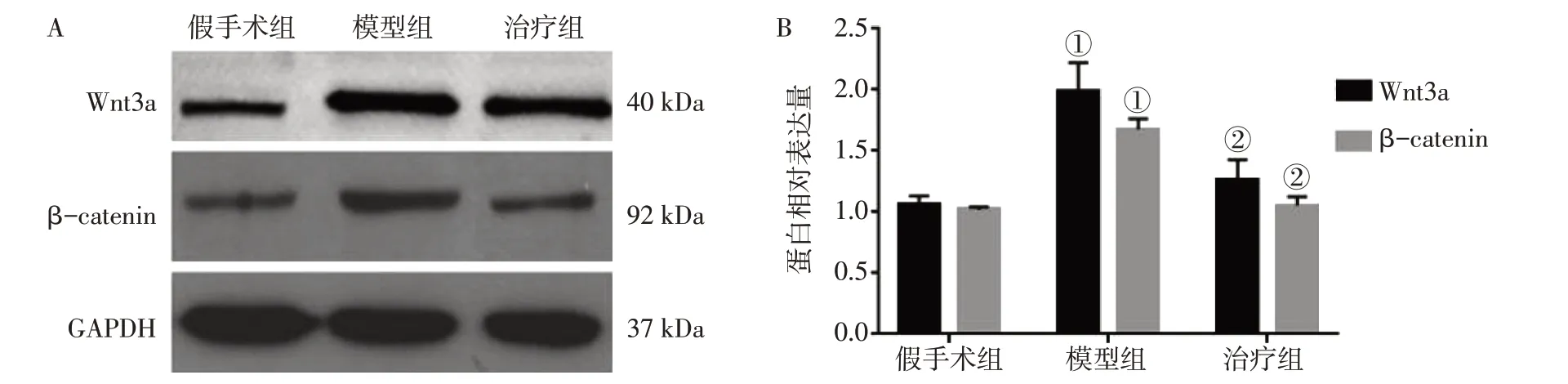
图4 各组大鼠脊髓背角中Wnt3a、β-catenin的Western Blot电泳条带(A)及其蛋白相对表达量(B)比较(±s,n=6)Figure 4 Comparison of Western Blot electrophoretic band of Wnt3a and β-catenin in the spinal dorsal horn(A)and their relative protein expressions(B)among various groups of rats(±s,n=6)
2.4 各组大鼠脊髓背角中Wnt3a、β-catenin的荧光蛋白表达比较图5结果显示:术后7 d,与假手术组比较,模型组大鼠脊髓背角组织Wnt3a、β-catenin的荧光蛋白表达水平均显著升高(P<0.01);而与模型组比较,治疗组Wnt3、β-catenin的荧光蛋白表达水平均降低(P<0.05)。
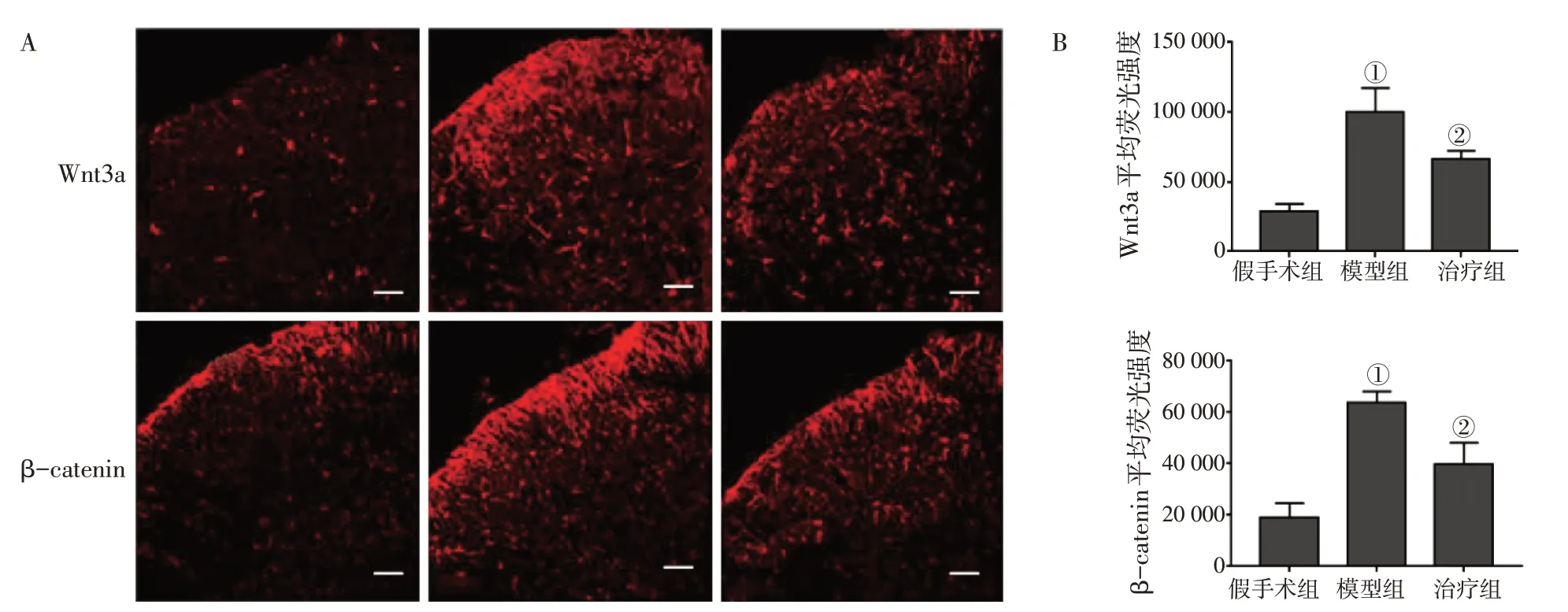
图5 各组大鼠脊髓背角中Wnt3a、β-catenin的免疫荧光染色结果(A)(比例尺:50 μm)及其半定量(B)比较Figure 5 Comparison of immunofluorescence staining results of Wnt3a and β-catenin in the spinal dorsal horn(A)(Scale bar:50 μm)and their semi-quantification(B)among various groups of rats
2.5 各组大鼠脊髓背角中炎症因子IL-18、TNF-α水平比较图6结果显示:术后7 d,与假手术组比较,模型组大鼠脊髓背角中炎症因子IL-18、TNF-α水平均显著升高(P<0.01);与模型组比较,治疗组大鼠脊髓背角IL-18、TNF-α水平均明显降低(P<0.05)。

图6 各组大鼠脊髓背角炎症因子IL-18(A)与TNF-α(B)水平比较(±s,n=6)Figure 6 Comparison of the levels of inflammatory factors IL-18(A)and TNF-α(B)in the spinal dorsal horn among various groups of rats(±s,n=6)
3 讨论
腰腿痛属于慢性疼痛疾病,其最常见的病因是腰椎间盘突出症(lambar disc hemiation,LDH)[8-9]。腰椎间盘突出的髓核组织可作为抗原被人体的免疫系统识别,诱发自身免疫反应,导致炎性物质增加过度,引起神经根肿胀,加重腰腿疼痛的反应,而有效控制炎症能够明显降低根性痛的发病率及严重程度,这正成为国内外腰腿痛研究的热点与方向[10]。
Wnt是一种约40 kDa控制发育的分泌蛋白,其作用包括细胞转运极化及迁移等,Wnt信号通路的异常与许多疾病的发生有关[11-12]。既往研究表明,该通路参与了神经免疫及炎症系统疾病的病理生理过程[13-14]。Wnt3a/β-catenin是经典的Wnt信号通路,Wnt3a为激活剂,在神经病理性疼痛中,Wnt3a蛋白在脊髓水平显著地增加,其受体在脊髓背角神经元上表达增多,进而引起Wnt信号通路下游分子β-catenin长时程地表达。β-catenin是影响神经发育的重要分子[15]。近期研究发现,β-catenin可干预白细胞介素18(IL-18)及肿瘤坏死因子α(TNF-α)等重要炎症因子的形成和释放[16]。在坐骨神经压迫和骨癌痛2种疼痛模型中,Wnt信号通路在脊髓背角中被激活,通过刺激炎症物质的产生,使实验动物的疼痛行为学发生相关改变[17]。课题组前期研究发现,髓核致炎模型大鼠术后脊髓背角中出现Wnt3a、β-catenin mRNA及蛋白表达明显增强,而硬膜外给予Wnt3a抑制剂后则出现50%MWT、TWL的 上 升 和Wnt3a、β-catenin mRNA及蛋白表达的下降,提示Wnt3a/β-catenin信号通路可能参与了髓核致神经根炎性痛的发生发展。与前期研究结果相符,本研究结果亦显示,模型组在术后1 d即出现50%MWT及TWL的持续下降,术后7 d模型组脊髓背角中Wnt3a、βcatenin mRNA和蛋白的表达及炎症因子IL-18、TNF-α的含量较假手术组明显升高,表明异常活化的Wnt信号可能通过激活下游通路,进而上调炎性因子的表达而发挥作用,诱发大鼠的痛觉过敏。
蛇床子素是独活寄生汤的主要药用活性成分,其对椎间盘突出症导致的下腰痛和坐骨神经痛有显著疗效。研究发现,蛇床子素除了具有良好的抗心律失常、抗骨质疏松、抗肿瘤等作用外,其抗炎镇痛作用也非常突出。在HIV gp120诱发的周围神经病理痛模型中,蛇床子素可通过抑制神经元P2X3R等相关受体,抑制炎性反应及疼痛的程度[18]。更有研究发现,蛇床子素可在不同时期通过下调组织炎症反应对神经系统发挥保护作用[19-20]。本课题组前期研究发现,在髓核致炎大鼠模型中,通过硬膜外腔注射蛇床子素可明显提高大鼠50%MWT和TWL,即减轻了大鼠的机械痛敏及热痛敏[6,21-23]。但蛇床子素是否通过干预Wnt3a/β-catenin信号通路达到镇痛效应尚不明确。本研究结果显示,治疗组大鼠术后2 d经硬膜外腔给予蛇床子素后,在术后3 d出现50%MWT上升及TWL潜伏期延长,术后7 d脊髓背角Wnt3a、β-catenin mRNA及蛋白的表达明显下调,IL-18和TNF-α的表达也明显下降,与模型组比较,差异均有统计学意义(P<0.05或P<0.01)。因此,认为蛇床子素干预髓核致炎模型后,可以通过抑制脊髓背角中Wnt3a/β-catenin信号通路活化,下调炎性因子表达,从而减轻疼痛的程度。
综上所述,Wnt3a/β-catenin信号通路在脊髓背角参与了髓核致炎大鼠神经根性疼痛的发展过程,蛇床子素可通过下调Wnt3a神经递质的释放,阻断β-catenin信号通路的活化,进而抑制IL-18和TNF-α的表达,缓解炎性疼痛的中枢敏化,起到抗炎镇痛的作用。
