自动化液体处理工作站在脊髓灰质炎疫苗D抗原含量检测中的应用
2023-01-15刘悦越赵荣荣英志芳王剑锋李长贵
刘悦越,赵荣荣,英志芳,王剑锋,邵 铭,李长贵
(中国食品药品检定研究院呼吸道病毒疫苗室,北京 102629;*通讯作者,E-mail:changguili@aliyun.com)
脊髓灰质炎(以下简称脊灰)是由脊髓灰质炎病毒感染引起的儿童急性传染病,严重者可致瘫痪[1],俗称小儿麻痹症,是20世纪中叶影响全球的重大公共卫生问题。20世纪50年代研发并批准的脊髓灰质炎灭活疫苗(inactivated polio vaccine, IPV)在消灭脊灰方面发挥着越来越重要的作用[2]。尤其是它安全、不会发生病毒回复突变的特点使其成为全球消灭脊灰最后阶段的主要工具[3,4]。
IPV是将3种血清型脊灰病毒接种于细胞,经病毒培养,通过收集上清,浓缩、纯化,并经甲醛灭活后按比例混合制成[5]。为了保证疫苗质量,对疫苗生产的各阶段及成品均需进行质量监测和控制。效力试验是评估IPV免疫原性的关键项目,包括体内和体外试验[6]。根据《欧洲实验用脊椎动物保护公约》要求,在有合适的替代实验并经充分验证的情况下,尽可能放弃体内方法进行分析和评估疫苗效力[7]。D抗原主要表达在脊髓灰质炎病毒颗粒表面,是保护性免疫原,主要诱导机体产生保护性免疫反应,因此D抗原含量被用作脊灰疫苗效力评价体外方法的检测指标[8]。最常用的D-Ag含量检测是间接酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法,于1980年首次开发,以其灵敏度高、省时的优势取代了凝胶扩散法[9]。目前已广泛用于评估IPV的D-Ag含量。
随着人工智能科技的发展和生物医药领域的样本处理需求日益增长,人们设计了用于液体样品的处理、稀释、转移等步骤的自动化液体处理工作站[10]。为了减少人力投入,提高实验的效率和精度,本研究旨在将自动化液体处理工作站应用于D抗原的ELISA检测中。以吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗中的D抗原检测项目为研究对象,探索由工作站代替手动操作完成实验流程的可行性。
1 材料和方法
1.1 疫苗
吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗由赛诺菲巴斯德公司提供。
1.2 主要试剂及仪器
酶标板购自美国Costar公司(批号:01721001),96孔稀释板购自德国Eppendorf公司(批号:J191605J)。Ⅰ、Ⅱ、Ⅲ型脊髓灰质炎病毒包被抗体和捕获抗体由赛诺菲巴斯德公司提供,过氧化物酶标记的羊抗兔IgG抗体购自荷兰Nordic MUbio公司(批号:16461),底物ABTS购自美国Millipore公司(批号:3593731),终止液购自索莱宝公司(批号:20211202)。酶标仪(型号:Infinite M200 Pro)和全自动移液工作站(型号:EVO200)均购自瑞士帝肯公司。
1.3 D抗原检测手动操作方法
1.3.1 包被酶标板 将Ⅰ、Ⅱ、Ⅲ型包被抗体按一定稀释比例稀释后分别加入不同酶标板中,50 μl/孔,2~8 ℃过夜。
1.3.2 样品处理及稀释 将疫苗样品与等体积的解吸附液充分混合,37 ℃孵育5 h,3 578g离心5 min,取上清液作为待测样品。用样品稀释液将标准品11倍预稀释。向96孔稀释板中加入样品稀释液,250 μl/孔,第2行除外。将预稀释好的标准品加入稀释板第2行的第2,5,8孔,待测样品加入稀释板第2行的其他孔,500 μl/孔,用电动多道移液器由第2行向第7行对标准品和待测样品进行2倍倍比稀释。
1.3.3 酶联免疫吸附实验 将包被板用洗液洗涤4次后,加封闭液200 μl/孔,室温孵育1 h。拍干后,将稀释板中液体转移到不同型别的包被板中,50 μl/孔,37 ℃孵育2 h。洗板4次,加入相应型别的捕获抗体,50 μl/孔,37 ℃孵育1 h。洗板4次,加入过氧化物酶标记的羊抗兔IgG,50 μl/孔,37 ℃孵育1 h。洗板4次,加入底物ABTS,50 μl/孔,避光室温显色15 min,加入终止液50 μl/孔终止反应。将酶标板放入酶标仪中以405/630 nm测定吸光度值。
1.4 D抗原检测工作站操作方法
解吸附和标准品预稀释均与手动操作相同,在工作站中编入如下操作程序。
1.4.1 包被 分别从1,2,3号加样槽中取包被液分装至酶标板中,50 μl/孔。每3块酶标板为1组,其中板1包被Ⅰ型脊灰抗体,板2包被Ⅱ型脊灰抗体,板3包被Ⅲ型脊灰抗体。分装结束后,取出酶标板放置于2~8 ℃过夜。
参数设置:分装包被液为LIHA加液模式,吸液速度150 μl/s,喷液速度600 μl/s。
1.4.2 封闭、稀释与加样 按顺序将酶标板转移至洗板机洗板,从封闭液槽中取封闭液分装至酶标板中,200 μl/孔,室温孵育1 h。从稀释液槽中取稀释液分装至稀释板中,第2行除外,200 μl/孔,从样品管中取标准品和样品加入稀释板的相应位置中,400 μl/孔。2倍倍比稀释标准品和样品至第7行。吸干酶标板中液体后,将稀释板中各孔液体分装至3个型别酶标板中,50 μl/孔。
参数设置:分装封闭液和稀释液为LIHA加液模式,吸液速度150 μl/s,封闭液的喷液速度600 μl/s,稀释液的喷液速度400 μl/s;将标准品和样品从样品管转移至稀释板为LIHA加液模式,吸液速度100 μl/s,喷液速度400 μl/s;倍比稀释为MCA混匀模式,吸液速度80 μl/s,喷液速度400 μl/s;稀释后样品转移至酶标板为MCA加液模式,吸液速度80 μl/s,喷液速度200 μl/s。
1.4.3 酶联免疫吸附实验 将加好样的酶标板置于37 ℃加热模块孵育2 h,之后洗板,加捕获抗体、酶标二抗、底物和终止液步骤与手工操作相同。终止反应后由机械臂将酶标板放入酶标仪中以405/620 nm测定吸光度值。
参数设置:分装捕获抗体、酶标抗体、底物和终止液为LIHA加液模式,吸液速度150 μl/s,喷液速度600 μl/s。
1.5 结果计算及验证分析
1.5.1 D抗原含量计算 根据标准品浓度和标准品、样品的吸光度值用平行线法计算疫苗的D抗原浓度,结果以D抗原单位/剂量(DU/剂)表示。药品注册标准中成品Ⅰ、Ⅱ、Ⅲ型D抗原含量的质量标准分别为20~43、5~9、17~36 DU/剂。
1.5.2 相关性分析 分别用手工操作和工作站操作方法测定10批疫苗Ⅰ、Ⅱ、Ⅲ型的D抗原含量。使用SPSS 23.0对手动操作结果和工作站结果进行统计学分析,由于2种方法结果的差值不成正态分布,采用非参数两个相关样本的Wilcoxon符号秩检验分析2种方法的结果,以P<0.05为差异有统计学意义。用GraphPad Prism 8.0软件将手动操作结果与工作站结果绘制散点图,通过Pearson相关性分析对测定结果进行相关性统计学分析,计算Pearson相关系数r值,以P<0.05为相关性有统计学意义。
1.5.3 精密性验证
1.5.3.1 试验内精密性 在同一工作日重复测定6批疫苗3个型别的D抗原含量,每批疫苗重复测定6次。将测定结果以e为底取对数,计算每批结果的几何变异系数(geometric coefficients of variation, GCV)。
1.5.3.2 试验间精密性 为考察不同实验时间对精密度的影响,分别在3个工作日重复测定6批疫苗3个型别的D抗原含量。将测定结果以e为底取对数,计算每批结果的几何变异系数。
2 结果
2.1 工作站的D抗原检测结果
用工作站分别对10批疫苗样品进行单次检测,6批疫苗样品进行6次试验内重复检测,另6批疫苗样品进行3次试验间重复检测,所有实验结果均在质量标准范围内(见图1),与手工操作结果一致。
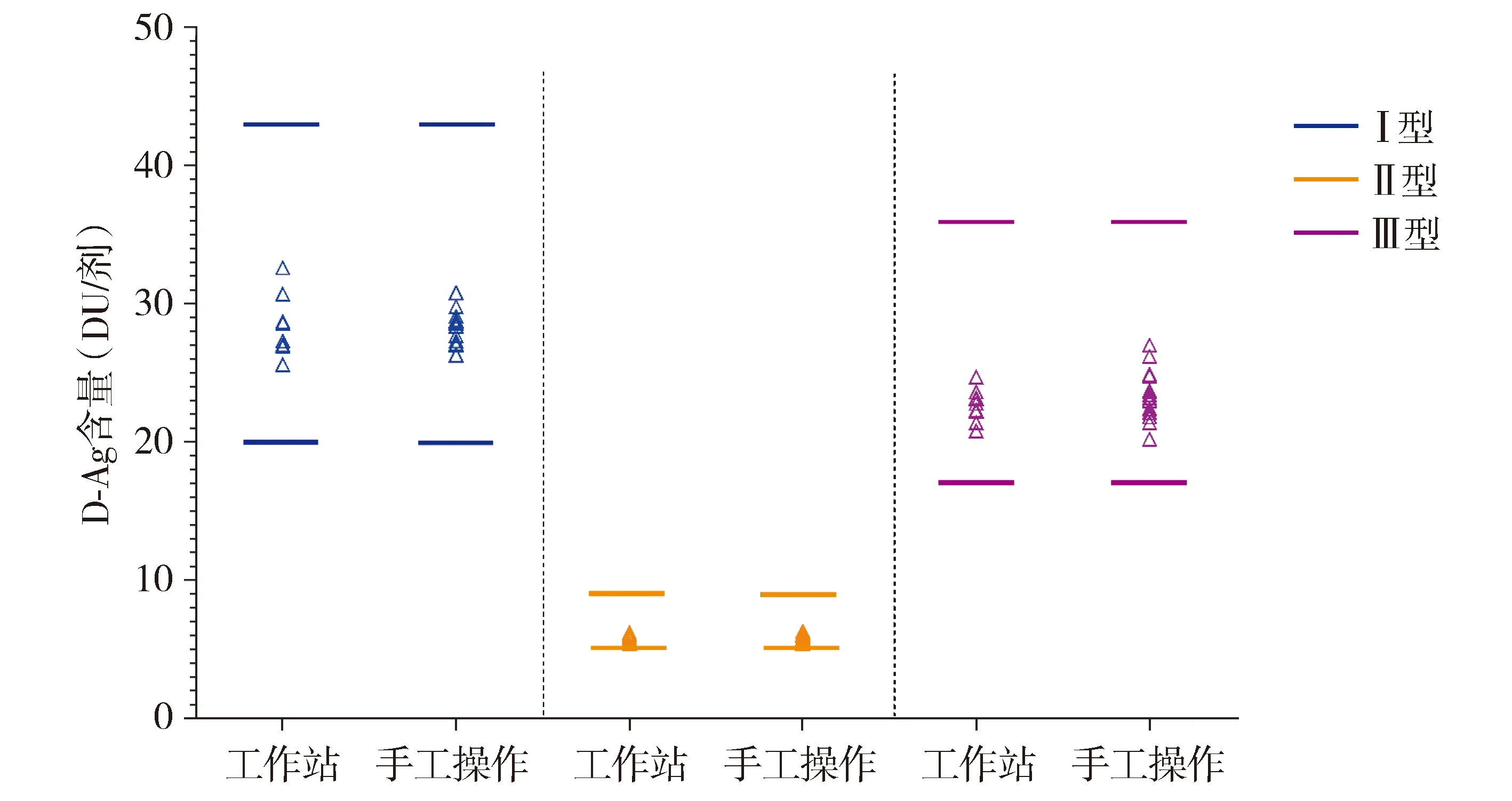
图1 工作站和手工操作的D抗原检测结果Figure 1 The determination results of D-antigen by workstation and manual operation
2.2 工作站操作与手动操作结果的相关性
对2种方法测定结果进行非参数两个相关样本的Wilcoxon符号秩检验显示,两种方法测定结果的差异无统计学意义(P>0.05,见表1)。对于3个型别的D抗原,2种方法测定结果的Pearson相关系数分别为0.7,0.7,0.9,2种方法测定结果的相关性具有统计学意义(P<0.05,见图2)。

图2 工作站与手工操作结果的相关性Figure 2 Correlation between determination results by workstation and manual operation

表1 工作站与手工操作结果的差异Table 1 Differences between the results by workstation and manual operation
2.3 工作站操作的精密性
2.3.1 试验内精密性 用工作站同时对疫苗样品的3个型别D抗原进行6次平行检测,每批疫苗的检测结果均在均值的2倍标准差范围内,且GCV为1.48%~7.19%(见表2)。
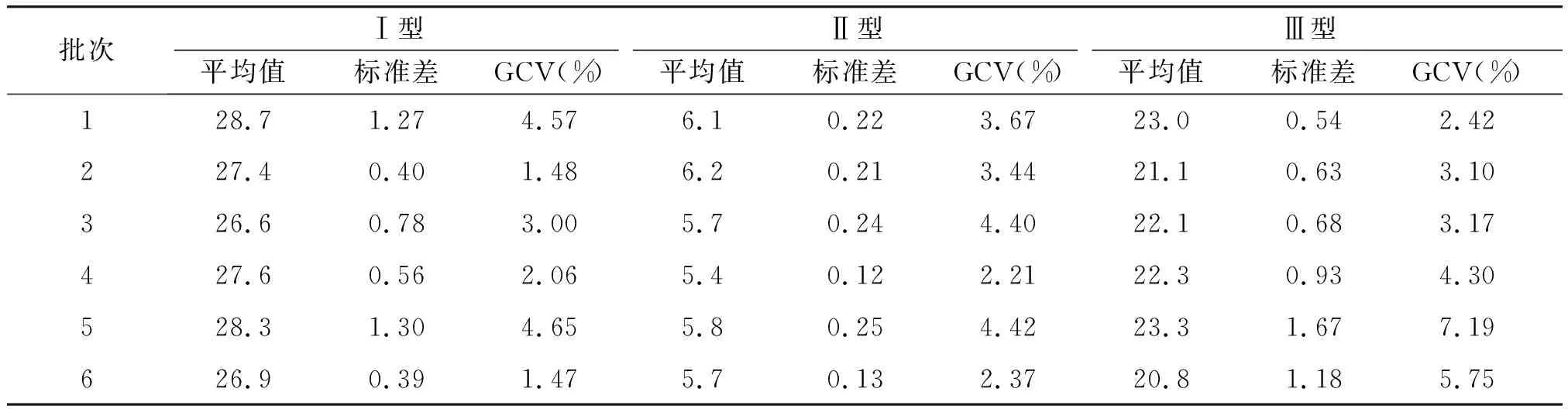
表2 工作站的试验内精密性结果Table 2 The results of intra-assay precision by workstation
2.3.2 试验间精密性 用工作站在不同时间对6批疫苗样品的3个型别D抗原进行3次重复检测,每批疫苗的检测结果均在均值的2倍标准差范围内,且GCV为0.72%~8.55%(见表3)。
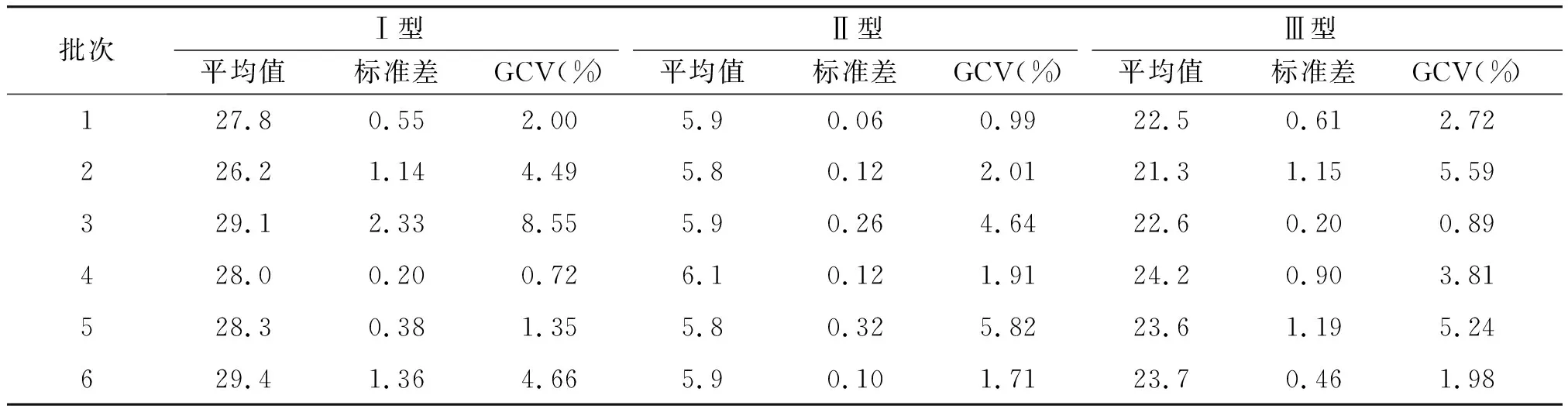
表3 工作站的试验间精密性结果Table 3 The results of inter-assay precision by workstation
3 讨论
D抗原含量ELISA测定是一种公认的评价含脊髓灰质炎病毒疫苗效力的方法,该方法的使用贯穿疫苗生产从原液到成品的各个阶段,是IPV配制时投料比例的主要依据,也确保在整个生产过程中的一致性。目前我国已有2家企业生产脊髓灰质炎灭活疫苗通过世界卫生组织(World Health Organization, WHO)预认证[11],意味着我国的国产疫苗不仅用于国内预防接种,还需满足联合国的采购需求,大大增加了疫苗生产和质量控制需要。为了减少在疫苗效力评价过程中实验人员大量的重复性操作,并降低人为因素产生的误差对后续生产和质量控制的影响,本研究探索将自动化液体处理工作站应用于D抗原含量测定。
本研究使用的全自动移液工作站包括LIHA和MCA两种机械臂,其中LIHA为8通道处理液体,每个通道能够独立操作,机械臂从左往右移动;MCA为96通道处理液体,工作时从里向外移动。根据两机械臂自身的特点,本研究设计LIHA主要进行取样、分配封闭液、稀释液、抗体、底物等液体,MCA主要进行样品稀释和整板转移的操作。由于MCA的最大量程为200 μl,使用工作站进行样品稀释时,将稀释的体积由手工操作的250 μl调整到200 μl。后续的操作步骤为将稀释好的样品通过MCA机械臂整板转移至3个型别的包被板,50 μl/孔,即在稀释板中每孔至少需要150 μl,机械臂能够一次性吸取样品,分液至3块板中,减少了反复吸液造成的液体损失,因此稀释板中200 μl/孔的终体积能够满足后续的50 μl/孔分液操作。对于参考波长,工作站自带的酶标仪缺少630 nm滤光片,在最终读取酶标板吸光值时由手工操作的630 nm调整为620 nm。620~690 nm测量的吸光度是非特异的,主要来自于酶标板孔上灰尘、脏物等所致的吸收,在实验中引入参考波长主要是排除这些非特异性吸收。另外,每块检测板中均包括系列稀释的标准品,因此参考波长的微调整对结果的影响较小。10批样品的手工操作和工作站操作的差异无统计学意义,且具有较高的相关性,也表明以上参数的调整不影响实验结果。
工作站根据设计程序计算各板的进样顺序和时间。本研究中选取D抗原含量测定实验的整体操作时间较长,在同时进行多批检测的情况下,使用的酶标板较多,因此各板的孵育时间可能在允许的范围内不完全相同,存在细微误差,因此本研究进行试验内和试验间的精密性验证,结果均在均值的2倍标准差范围内,且GCV低于10%,满足《中国药典》对生物方法的精密性GCV低于20%的要求[12]。
通过本研究的实验设计和方法验证,表明工作站能够完成脊髓灰质炎疫苗中D抗原含量的测定,替代了部分人工。本研究选取了操作较为复杂,用时较长的ELISA实验,验证自动化液体处理工作站能够满足实际使用需求,说明该工作站不仅仅适用于脊灰疫苗的D抗原检测,还可以扩展到其他项目的ELISA测定工作中。
