lncRNA NEAT1在乳腺癌肿瘤相关巨噬细胞中的表达及作用机制
2023-01-15钟国南钱丽华
司 刚,司 贞,钟国南,钱丽华
(1海口市妇幼保健院药学部,海口 570102;2琼海市中医院药学部;3海南医学院基础医学与生命科学学院)
乳腺癌(breast cancer)是女性最常见的恶性肿瘤之一。近年来,随着环境与生活方式的改变,乳腺癌的发病率急剧上升,严重威胁女性生命健康[1-3]。目前临床应用的多数治疗策略仅针对乳腺细胞,而忽视了对肿瘤微环境的改善,但研究表明,肿瘤微环境在乳腺癌的发生发展中起着重要作用[4,5]。肿瘤微环境是肿瘤细胞生存的复杂环境,主要由肿瘤细胞、免疫细胞、基质细胞和细胞外基质组成[5]。其中巨噬细胞作为肿瘤间质中的重要细胞群,能通过呈现特殊的表型特征参与调控肿瘤的发生与进展[6-8]。有数据表明肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)能促进乳腺癌细胞增殖、侵袭、转移和免疫逃逸,并促使肿瘤细胞对多种药物产生耐药性等[7-9]。因此,积极探究调控乳腺癌微环境中TAMs分化及功能的相关机制具有重要意义。
长链非编码RNA(long non-coding RNA, lncRNA)是一类长度超过200个核苷酸的非编码RNA,其在生物体的生命运动、基因表达、细胞周期和个体发育以及免疫细胞分化等方面发挥重要作用[10,11]。既往研究报道,lncRNA NEAT1在乳腺癌组织与细胞中的表达呈异常升高现象,且与较高的组织学分级和患者不良预后密切相关[12-16]。近年来进一步的研究证实,lncRNA NEAT1可在体内外通过多种途径促进乳腺癌细胞的增殖、侵袭与迁移[13-16]。而在其他疾病中,lncRNA NEAT1还能通过调控巨噬细胞的分化,从而参与调控疾病的进展[17,18],但在乳腺癌微环境中高表达lncRNA NEAT1是否同样能够参与调控TAMs的形成与维持尚不清楚。因此,本研究通过体内外实验探究lncRNA NEAT1在乳腺癌中TAMs的作用,以期进一步阐明乳腺癌的发生与发展的相关机制。
1 材料与方法
1.1 临床样本来源
选取自2019年10月至2021年1月海口市妇幼保健院确诊的30例乳腺癌患者的肿瘤组织和30例健康体检患者的外周血作为临床样本。乳腺癌患者的年龄在33~77岁之间,平均年龄为(55.4±9.2)岁。临床病理学分析显示,Ⅰ~Ⅱ期患者21例、Ⅲ期患者9例,淋巴结转移患者10例。对照组年龄在37~79岁之间,平均年龄为(58.6±8.4)岁,两组受试者的年龄差异无统计学意义(P>0.05)。
纳入标准:①两组受试者均为女性患者;②乳腺癌患者术后诊断诊断为原发性乳腺癌,且术前均未接受放疗、化疗或免疫抑制剂等相关治疗;③两组受试者均未合并其他组织或脏器的原发性恶性肿瘤、免疫系统及内分泌等相关疾病;④两组受试者的临床资料完整,且患者及家属知情同意。使用葡聚糖-泛影葡胺密度梯度离心法分离乳腺癌组织中的TAMs(TAMs组)和健康体检患者外周血中的外周血单个核细胞(peripheral blood mononuclear cell,PBMC)(PBMC组),并使用RT-PCR实验检测巨噬细胞在TAMs组与PBMC组中的极化水平及lncRNA NEAT1的表达。本研究获得我院医学伦理委员会批准,所有受试者均签署知情同意书。
1.2 主要材料与试剂
乳腺癌细胞系MCF-7购自美国ATCC菌株保藏中心;人单核巨噬细胞THP-1与小鼠巨噬细胞系Raw264.7均购自武汉普诺赛生命科技有限公司;30只6周龄的雌性BALB/c裸鼠购自海南药物研究所有限责任公司;靶向沉默lncRNA NEAT1基因表达和阴性对照的慢病毒载体(LV-shNEAT1与LV-NC,病毒滴度为4×108TU/ml)由江苏金斯瑞生物科技有限公司构建与合成;MTT试剂,RNA提取试剂盒、反转录试剂盒(美国Thermo公司);SYBR Premix Ex TaqTM试剂盒(日本TaKaRa公司);Transwell小室(0.4 μm与8 μm孔径)(美国Millipore公司);Matrigel基质胶(美国BD公司);RPMI-1640培养基(美国Hyclone公司);胎牛血清(fetal bovine serum, FBS)(购自美国Gibco公司);Ficoll淋巴细胞分离液、Ⅳ型胶原酶、DNase Ⅰ酶、佛波酯(PMA)、青霉素(100 U/ml)与链霉素(100 μg/ml)混合溶液、干扰素-γ(interferon γ, IFN-γ),白细胞介素-4(interlukin-1, IL-4),脂多糖(lipopolysaccharide, LPS)(美国Sigma公司);兔抗小鼠TNF-α,人类白细胞抗原DR(human leukocyte antigen-DR,HLA-DR),精氨酸酶-1(Arginase-1,Arg-1)抗体(美国Abcam公司);兔抗小鼠CD163、CD206、E-钙黏蛋白(E-cadherin)、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(美国Jackson Immuno-Research公司);兔抗小鼠E-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)和锌指转录因子Snail抗体(美国Cell Signaling Technology公司);NanoDrop分光光度计(Thermo Fisher Science公司);光学倒置显微镜(日本Olympus公司);RT-PCR仪(iQ型,美国Bio-Rad公司);RT-PCR引物由广州锐博生物科技公司合成。
1.3 方法
1.3.1 乳腺癌组织中TAMs与外周血中巨噬细胞的分离 参考文献方法[19]从乳腺癌患者新鲜肿瘤组织中分离TAMs,简述如下:灭菌外科剪剪碎分散乳腺癌组织块,0.3%的Ⅳ胶原酶、DNase Ⅰ与透明质酸混合液于37 ℃水浴锅中消化溶解2 h,加入红细胞裂解液以去除红细胞,0.125%的胰蛋白酶继续搅拌消化45 min后,70目滤网过滤后,取过滤液,2 200 r/min离心10 min,取下层沉淀,PBS溶液重悬后,使用等体积的Ficoll淋巴细胞分离液利用葡聚糖-泛影葡胺(Ficoll-Hypaque)密度梯度离心法在室温下分离上述乳腺癌组织消化液中的巨噬细胞,离心纯化后收集细胞。外周血中单个核细胞的分离:使用含EDTA抗凝管收集健康对照组的肘静脉血8 ml,2 200 r/min离心5 min,取底层细胞沉淀,同样利用Ficoll-Hypaque密度梯度离心法于室温下分离PBMC,离心纯化后收集PBMC进行后续实验。
1.3.2 细胞的培养与巨噬细胞的诱导 MCF-7、THP-1和Raw264.7细胞均培养于含10%FBS与1%青霉素与链霉素双抗溶液的RPMI-1640完全培养基中,并置于37 ℃、5%CO2恒温恒湿培养箱中进行培养。取处于对数生长期的THP-1,使用50 ng/ml的PMA刺激THP-1细胞48 h使其活化为M0型贴壁细胞。参考文献方法[20]联合使用300 ng/ml LPS与30 ng/ml IFN-γ处理贴壁后的THP-1与Raw264.7细胞进行M1型巨噬细胞的诱导,使用20 ng/ml的IL-4处理上述细胞进行M2型的诱导分化。24 h后使用RT-PCR实验检测诱导后的巨噬细胞中M2型标记分子Arg-1、CD206和CD163与M1型标记分子TNF-α和HLA-DR的mRNA表达水平进行鉴定M1与M2型巨噬细胞的极化。
1.3.3 慢病感染与细胞分组 取生长状态良好的Raw264.7细胞,细胞计数后,按5×105个/孔接种至6孔板中,待细胞生长融合至70%时,按加入含LV-shNEAT1或LV-NC的慢病毒颗粒转染液,感染指数(multiplicity of infection, MOI)为25。将慢病毒转染液与细胞缓慢充分混匀后,置于37 ℃、5%CO2恒温恒湿培养箱中进行培养,8 h更换为含10%的RPMI-1640培养液,感染48 h后,收集细胞进行RT-PCR检测感染效率。继续培养3 d后,使用含10%FBS与2 mg/L的嘌呤霉素的RPMI-1640培养液进行筛选以建立稳定感染LV-shNEAT1或LV-NC的细胞系。将Raw264.7细胞与乳腺癌细胞MCF-7在Transwell(0.4 μm)共培养体系进行培养,并将共培养体系分为3组:LV-NC组、LV-shNEAT1组和control组。其中LV-NC组的Transwell共培养体系中上室为感染LV-NC的Raw264.7细胞,下室为MCF-7细胞;LV-shNEAT1组上室为感染LV-shNEAT1的Raw264.7细胞,下室为MCF-7细胞;control组上室为未转染的Raw264.7细胞,下室为MCF-7细胞;各组共培养体系置于37 ℃、5%CO2恒温恒湿培养箱中培养24 h后分别用于EdU实验、Transwell实验和RT-PCR及Western blot实验检测。
1.4 EdU法检测细胞增殖
取1.3中的各组Transwell共培养体系中MCF-7细胞,弃原培养液,每孔加入150 μl终浓度为50 μmol/L的EdU试剂,37 ℃下孵育2 h后,将各组MCF-7细胞于4%多聚甲醛溶液中固定20 min,然后加入2 mg/ml甘氨酸5 min,PBS充分洗涤后,0.5% TritonX-100透化细胞10 min。再次用PBS洗涤后,加入终浓度为1 mg/ml的DAPI试剂在室温下孵育30 min进行染核。最后荧光显微镜观察拍照,其中EdU阳性(红色)细胞表示正在进行DNA复制的增殖期细胞。实验单独重复3次。
1.5 Transwell实验检测细胞侵袭
取生长状态良好的MCF-7细胞,按5×105个/孔接种至预先包被BD基质胶的Transwell(8 μm)上室中,下室为接种等密度的感染LV-NC或LV-shNEAT1或未转染的Raw264.7细胞,并按1.3方法继续分为LV-NC组、LV-shNEAT1组和control组,培养24 h后取出小室,棉签擦拭上室未穿出的细胞,95%酒精于室温下固定15 min,自然风干后,0.1%的结晶紫染色,PBS冲洗细胞3次,最后使用倒置显微镜进行观察拍照。实验单独重复3次。
1.6 RT-PCR实验检测lncRNA NEAT1和Arg-1、CD206、CD163、TNF-α及HLA-DR的mRNA表达水平
取待测细胞,使用RNA提取试剂盒收集细胞中的总RNA,NanoDrop分光光度计进行定量后,反转录试剂盒进行逆转录合成cDNA,并以此为模板按照SYBR PreMix Ex TaqTM试剂盒说明书方法进行RT-PCR。反应条件:95 ℃预热10 min,95 ℃变性10 s,60 ℃退火/延伸20 s,40个循环周期。使用阈值周期(Ct)测定目标基因的表达水平,以GAPDH为内参,利用2-ΔΔCt法计算相对表达水平。RT-PCR引物序列见表1。

表1 RT-PCR引物序列Table 1 Primer sequences of RT-PCR
1.7 Western blot实验检测Arg-1、CD206、CD163、TNF-α、HLA-DR及E-cadherin、N-cadherin、Vimentin和Snail的蛋白表达水平
使用RIPA裂解液与蛋白酶抑制剂提取待测细胞中的总蛋白,BCA法进行定量,经加热变性后,取约35 μg蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳进行分离蛋白质,随后转移到PVDF膜,5%脱脂奶粉于室温下封闭抗体1 h,加入一抗:TNF-α(1 ∶1 000),HLA-DR(1 ∶1 000),Arg-1(1 ∶1 000),CD163(1 ∶1 000),CD206(1 ∶1 000),N-cadherin(1 ∶800),N-cadherin(1 ∶800)、Vimentin(1 ∶500)和Snail(1 ∶500)和GAPDH(1 ∶1 000),4 ℃孵育过夜,随后加入辣根过氧化物酶标记的山羊抗兔IgG(1 ∶5 000)二抗,最后加入化学发光液于凝胶成像系统中曝光拍照,Image J软件分析蛋白条带灰度值,以GAPDH为内参。实验单独重复3次。
1.8 裸鼠皮下移植瘤实验
将30只饲养在SPF级环境下的雌性BALB/c裸鼠随机分为3组:control组、LV-NC组和LV-shNEAT1组。其中control组向裸鼠注射含MCF-7细胞的PBS悬液;LV-NC组向裸鼠注射联合注射感染LV-shNC的Raw264.7与MCF-7细胞;LV-shNEAT1组向裸鼠注射联合注射感染LV-shNEAT1的Raw264.7细胞与MCF-7细胞。其中LV-NC组与LV-shNEAT1组小鼠于右侧前肢腋下经皮注射约含1×105/ml个感染LV-shNC或LV-shNEAT1慢病毒的Raw264.7细胞与1×106/ml MCF-7的细胞悬液。control组仅注射同体积约含1×106/ml MCF-7细胞悬液。每2 d测量肿瘤的长度与宽度,并监测肿瘤体积[=(长度×宽度2)/2]生长情况,持续28 d。28 d后脱颈处死各组小鼠,手术剥离肿瘤组织,拍照后,4%的多聚甲醛固定,石蜡包埋,制成2 μm厚的连续切片进行苏木精-伊红(HE)染色与Ki-67的免疫组织化学染色以观察肿瘤细胞的生长与增殖情况。
1.9 HE染色检测移植瘤组织的病理学改变与免疫组织化学染色检测Ki-67的表达
HE染色:取固定于4%多聚甲醛溶液中的肿瘤组织,常规使用梯度酒精与二甲苯脱水透化,石蜡包埋,并切片(厚约4 μm)后,二甲苯脱蜡,梯度酒精水化,苏木精与伊红染色,随后再次使用梯度酒精与二甲苯脱水,封片后,倒置显微镜下观察拍照。
免疫组织化学染色:将肿瘤组织切片于二甲苯中脱蜡,梯度酒精水化,微波加热已修复抗原后,使用3%的过氧化氢溶液浸泡以阻断内源性过氧化物酶,PBS充分洗涤后,加入兔抗小鼠Ki-67,4 ℃下孵育过夜,随后加入二抗,DAB试剂盒染色,苏木素复染,最后使用Image J软件分析,以累积吸光度值作为指标进行比较分析。其中细胞核为蓝色,棕黄色为阳性表达。
1.10 统计学分析

2 结果
2.1 lncRNA NEAT1在TAMs中的表达
RT-PCR检测结果显示,与健康对照人群的PBMC相比,乳腺癌患者的TAMs中M2型巨噬细胞标记分子Arg-1、CD206和CD163的mRNA表达水平均显著升高(P<0.05),而M1型巨噬细胞标记分子TNF-α、HLA-DR的mRNA表达水平明显降低(P<0.05);lncRNA NEAT1的检测结果显示,与健康对照人群的PBMC相比,乳腺癌患者的TAMs中lncRNA NEAT1的表达水平明显升高(P<0.01,见图1)。

与PBMC相比,*P<0.05,**P<0.01图1 RT-PCR检测M1与M2型巨噬细胞标记分子和lncRNA NEAT1的表达水平Figure 1 Expression of M1 and M2 macrophage marker molecules and the expression levels of lncRNA NEAT1 by RT-PCR
2.2 lncRNA NEAT1在体外诱导的M2型巨噬细胞中高表达
RT-PCR检测结果显示,在THP-1来源的巨噬细胞中,与M0型相比,M1型中lncRNA NEAT1的表达水平显著降低(P<0.05),但M2型巨噬细胞中的表达水平明显升高(P<0.05),且与M1型巨噬细胞相比,lncRNA NEAT1在M2型中的表达水平显著升高(P<0.01)。与RAW264.7来源的M0型巨噬细胞相比,M1型中lncRNA NEAT1的表达水平显著降低(P<0.05),但在M2型中的表达水平明显升高(P<0.05),且与M1型细胞相比,lncRNA NEAT1在M2型中的表达水平显著升高(P<0.01,见图2)。这提示无论在人源性或小鼠源性巨噬细胞中,lncRNA NEAT1在M2型中的表达均显著升高,在M1型中的表达明显降低。

与同来源M0型相比,*P<0.05;与同来源M1型相比,##P<0.01图2 RT-PCR检测lncRNA NEAT1在体外诱导的M1与M2型巨噬细胞中的表达水平Figure 2 Expression level of lncRNA NEAT1 in M1 and M2 macrophages induced in vitro by RT-PCR
2.3 沉默lncRNA NEAT1表达对巨噬细胞极化的影响
RT-PCR检测结果显示,与未转染的RAW264.7细胞相比,转染LV-shNEAT1的细胞中lncRNANEAT1表达水平显著降低(P<0.05),感染LV-NC的细胞无明显差异(P>0.05,见图3A)。RT-PCR和Western blot检测共培养体系中RAW264.7细胞中M1型和M2型分子标记物的mRNA和蛋白表达水平的结果显示,与control组相比,LV-NC组和LV-shNEAT1组RAW264.7细胞中Arg-1、CD206、CD163的mRNA和蛋白表达水平均显著增加(P<0.05),而TNF-α、HLA-DR的mRNA和蛋白表达水平表达均明显降低(P<0.05);但与LV-NC组相比,LV-shNEAT1组RAW264.7细胞中TNF-α、HLA-DR的mRNA和蛋白表达水平均显著升高(P<0.05),而Arg-1、CD206、CD163的mRNA和蛋白表达水平均明显降低(P<0.05,见图3B、C)。这提示乳腺癌细胞能诱导RAW264.7细胞向M2型巨噬细胞分化,而沉默RAW264.7中lncRNA NEAT1表达可显著抑制其向M2型巨噬细胞的分化能力,并促进其向M1型巨噬细胞分化。

C.Western blot检测沉默lncRNA NEAT1的表达对各组RAW264.7细胞分化的影响与RAW264.7巨噬细胞相比,&P<0.05;与control组相比,*P<0.05;与LV-NC组相比,#P<0.05图3 RT-PCR与Western blot检测沉默lncRNA NEAT1后对RAW264.7细胞极化的影响Figure 3 Effect of silencing lncRNA NEAT1 on the polarization of RAW264.7 cells by RT-PCR and Western blot
2.4 沉默巨噬细胞中lncRNA NEAT1表达对乳腺癌细胞增殖能力的影响
EdU检测结果显示,与control组相比,LV-NC组和LV-shNEAT1组中MCF-7的EdU阳性率均显著升高(P<0.05),而与LV-NC组相比,LV-shNEAT1组中EdU阳性率却明显降低(P<0.05,见图4)。

红色为EdU阳性,细胞核为蓝色图4 EdU染色检测各组乳腺癌细胞的增殖能力Figure 4 The proliferation ability of breast cancer cells in various groups by EdU staining
2.5 沉默巨噬细胞中lncRNA NEAT1表达对乳腺癌细胞上皮细胞-间充质转化(EMT)能力的影响
Western blot实验检测结果显示,与control组相比,LV-NC组和LV-shNEAT1组MCF-7细胞中E-cadherin蛋白表达水平明显降低(P<0.05),N-cadherin、Vimentin和Snail蛋白表达水平均显著升高(P<0.05);而与LV-NC组相比,LV-shNEAT1组MCF-7细胞中E-cadherin蛋白表达水平明显升高(P<0.05),N-cadherin、Vimentin和Snail蛋白表达水平均显著降低(P<0.05,见图5)。

与control组相比,*P<0.05;与LV-NC组相比,#P<0.05图5 Western blot检测各组乳腺癌细胞EMT相关蛋白E-cadherin、N-cadherin、Vimentin和Snail的表达Figure 5 Expression of EMT-associated proteins E-cadherin, N-cadherin, Vimentin and Snail in breast cancer cells detected by Western blot
2.6 沉默巨噬细胞中lncRNA NEAT1表达对乳腺癌细胞侵袭能力的影响
Transwell侵袭实验检测结果显示,与control组相比,LV-NC组和LV-shNEAT1组MCF-7细胞侵袭能力均显著升高(P<0.05),而与LV-NC组相比,LV-shNEAT1组中乳腺癌细胞侵袭能力明显降低(P<0.05,见图6)。

与control组相比,*P<0.05;与LV-NC组相比,#P<0.05图6 Transwell检测各组乳腺癌细胞的侵袭能力 (×200)Figure 6 The invasion ability of breast cancer cells detected by Transwell method (×200)
2.7 沉默巨噬细胞中lncRNA NEAT1表达对乳腺癌移植瘤生长的影响
裸鼠皮下移植瘤实验结果显示,与control组相比,LV-NC组和LV-shNEAT1组乳腺癌移植瘤的生长速度和肿瘤质量均显著升高(P<0.05),而与LV-NC组相比,LV-shNEAT1组乳腺癌移植瘤的生长速度和肿瘤质量均明显降低(P<0.05,见图7A)。移植瘤组织的HE染色结果表明,与control组相比,LV-NC组和LV-shNEAT1组肿瘤细胞核增大,染色加深,而LV-NC组又较LV-shNEAT1组的变化更为显著;移植瘤组织中Ki-67染色结果显示,与control组相比,LV-NC组和LV-shNEAT1组Ki-67阳性率明显升高(P<0.05),而与LV-NC组相比,LV-shNEAT1组Ki-67阳性率显著降低(P<0.05,见图7B)。
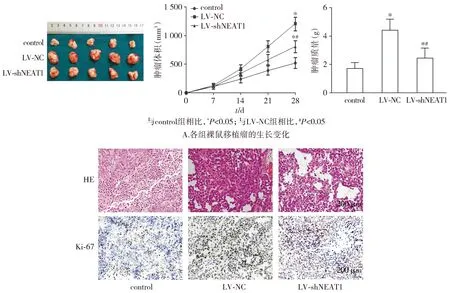
B.各组裸鼠移植瘤组织的HE染色与Ki-67阳性表达率图7 沉默巨噬细胞中lncRNA NEAT1表达乳腺癌移植瘤生长的影响Figure 7 Effect of silencing lncRNA NEAT1 expression in macrophages on the growth of breast cancer xenografts
3 讨论
最近的研究证实lncRNA在肿瘤的发展中起着关键作用,这对未来新治疗靶点的研发具有重要启示意义[10]。尽管国内外学者已报道,lncRNA NEAT1参与乳腺癌的增殖与侵袭,但其在TAMs的极化与维持中的作用尚不清楚。本研究通过体内外水平,系统探究了lncRNA NEAT1在调控乳腺癌TAMs极化和功能中的作用,进一步解析了lncRNA NEAT1在乳腺癌发生发展中的机制,为临床的应用研究提供了一定的实验室依据。如前所述,巨噬细胞是肿瘤基质中的一个重要群体,其能通过经典激活的M1型和交替激活的M2型来改变其功能,以参与肿瘤的发生与进展[6-8]。M1巨噬细胞通过表达促炎因子(如TNF-α)参与炎症反应,而在实体肿瘤微环境中,外周血单核细胞通过血管渗入肿瘤组织主要分化为M2型,即TAMs,并分泌相关细胞因子如白介素-4(interlukin-4,IL-4)或IL-10,以促进血管生成、基质合成和免疫逃逸[6,7]。研究表明,在肿瘤发展的初级阶段,外周血单核细胞通过血管渗入肿瘤组织并极化为M1型巨噬细胞,并通过产生TNF-α、活性氧等发挥吞噬与促炎作用,从而抑制肿瘤细胞的生长。但在肿瘤发展的中晚期,肿瘤微环境培养的巨噬细胞分泌IL-10和TGF-β,通过抑制细胞毒性T淋巴细胞和自然杀伤细胞的激活,来促进肿瘤的进展[6-9]。在本研究中,课题组通过检测M1型标志分子TNF-α、HLA-DR和M2型标志分子Arg-1、CD206、CD163来评估乳腺癌患者肿瘤组织中的M2型巨噬细胞比例,结果证实,与正常对照人群的PBMC相比,乳腺癌组织中的M2型巨噬细胞表达水平显著升高。这与既往研究结果一致,均提示乳腺癌微环境能够诱导外周血M0型单核巨噬细胞向M2型极化,即TAMs主要以M2型巨噬细胞为主。同时,本实验结果还显示,在TAMs中,lncRNA NEAT1表达水平明显升高。结合之前国内外学者报道的lncRNA NEAT1在乳腺癌组织中存在异常高表达的现象[12-16],上述结果并不意外。同时,为进一步研究lncRNA NEAT1在人源性与小鼠源性的M2型巨噬细胞中的高表达水平,课题组在体外诱导人单核巨噬细胞系THP-1与小鼠巨噬细胞系RAW264.7的M1与M2型分化,结果再次表明,lncRNA NEAT1在M2型巨噬细胞中的表达水平显著增加,而M1型中的表达水平明显降低。这进一步说明lncRNA NEAT1参与调控巨噬细胞的M1与M2型极化。
M2型巨噬细胞,也称为交替激活的巨噬细胞,可通过IL-4、IL-13或TGF-β诱导单核细胞分化形成[20]。M2巨噬细胞可通过释放抗炎因子(如IL-10和TGF-β)、免疫抑制因子(如前列腺素E2、Arg-1、生长抑素)等来促进肿瘤细胞的增殖、EMT与侵袭能力[21,22]。最新研究报道,lncRNA NEAT1可在多种疾病中调控巨噬细胞的M2型分化,如Zhang等[23]在脉络膜新生血管中发现,lncRNA NEAT1可通过发挥竞争性RNA的功能来抑制miRNA-148a-3p的作用,从而靶向调控人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(PTEN)的表达,诱导M2巨噬细胞极化,从而参与脉络膜新生血管的形成,而下调lncRNA NEAT1则可抑制M2巨噬细胞的体内外活动改善疾病的进展。在胶质细胞的活化中,Liu等[18]学者报道,lncRNA NEAT1在小鼠骨髓单核细胞诱导的M2型巨噬细胞中显著高表达,而敲除该基因的表达能通过削弱其对miR-224-5p/IL-33轴的抑制,上调M2型巨噬细胞标志物Arg-1、CD206、CD163与细胞因子IL-4、IL-10、TGF-β的表达水平。而Gao等[24]在多发性骨髓瘤中发现高表达lncRNA NEAT1可通过抑制miR-214的表达,从而解除后者对CD276的负向调控作用,促进M2型巨噬细胞的极化。上述文献提示lncRNA NEAT1可正向促进或诱导M2型巨噬细胞的分化。但在脓毒症诱导的急性肾损伤中,Wang等[17]则报道敲除lncRNA NEAT1基因可通过miR-125a-5p/肿瘤坏死因子受体6(TRAF6)/转化生长因子活化激酶1(TAK1)轴促进巨噬细胞M2极化,从而改善LPS诱导的炎症。这说明,lncRNA NEAT1对巨噬细胞极化的影响可能在不同疾病中的作用存在差异。本实验在小鼠源性巨噬细胞RAW264.7中,利用慢病毒沉默lncRNA NEAT1表达探究其对乳腺癌微环境中巨噬细胞分化的影响,结果表明,与乳腺癌细胞共培养可诱导RAW264.7向M2型分化,但沉默lncRNA NEAT1表达能显著抑制这一现象。同时,为进一步探究沉默巨噬细胞中lncRNA NEAT1表达对乳腺癌细胞的恶性生物学行为的影响,课题组在体外进行实验,结果表明,共培养体系中的巨噬细胞能显著促进乳腺癌细胞的增殖与侵袭能力,并降低上皮细胞标志物E-cadherin,而上调间质细胞标志物N-cadherin、Vimentin和Snail的表达,即促进细胞的EMT能力。在裸鼠体内同样证实,将沉默lncRNA NEAT1表达的巨噬细胞过继转移可显著缓解乳腺癌的增殖与侵袭能力。
综上所述,本研究表明,lncRNA NEAT1参与调控乳腺癌微环境中巨噬细胞的极化,而沉默其表达可通过抑制M2型细胞的极化,改善乳腺癌细胞的体内外增殖与侵袭。然而,关于lncRNA NEAT1发挥上述作用具体调控机制与信号通路仍有待进一步阐释,本课题组后期将从该方面着手进行深入探究。
