低能量激光对衰老牙周膜干细胞增殖和成骨分化功能的影响
2023-01-15郭小梅夜文敏孔荣荣王丽颖
邵 馨,王 爽,郭小梅,夜文敏,孔荣荣,宋 扬,吴 凡,王丽颖*
(1西安交通大学口腔医院,陕西省颅颌面精准医学研究重点实验室,西安 710004;2西安交通大学口腔医院正畸科;3西安交通大学口腔医院病理科;4空军第九八六医院口腔科;5空军第九八六医院心脏外科;*通讯作者,E-mail:710808434@qq.com)
牙周炎是一种高患病率的口腔疾病,会持续破坏牙周组织并导致牙齿脱落,所以牙周治疗的目标是牙周组织的再生[1]。牙周膜干细胞(periodontal ligament stem cells,PDLSCs)来源于牙周膜组织,是可高度增殖的细胞,具有向牙周组织分化的潜能[2],被认为是牙周组织再生的种子细胞。已有研究表明,使用自体PDLSCs治疗牙槽骨缺损是安全的,不会产生明显的不良反应[3,4]。
在炎症、高糖等条件下PDLSCs的多能性会受到损害,成骨分化功能被抑制[5,6]。由于大部分牙周缺损的患者年龄较大,所以衰老对PDLSCs成骨分化以及牙周修复潜能的影响尤为重要。已有研究表明随着年龄的增长,PDLSCs的增殖能力和成骨分化潜能降低,这不利于衰老PDLSCs用于牙周组织再生[7],因此本研究聚焦于如何提高衰老PDLSCs的增殖和成骨分化功能。
低能量激光治疗(low-level laser therapy, LLLT)也称为红光治疗、冷激光、软激光、生物刺激和光生物调节,于20世纪60年代首次报道,从那时起就被用于减轻炎症和促进伤口愈合[8]。有研究表明,LLLT在促进间充质干细胞成骨分化方面起着关键作用[9,10],本课题组前期研究证实,LLLT可以在健康和炎症条件下调节骨髓间充质干细胞的增殖和成骨分化能力[11]。在众多激光中,掺钕钇铝石榴石(neodymium-doped:yttrium-aluminum-garnet, Nd:YAG)激光可有效去除慢性牙周炎患者牙周袋外牙龈上皮的细菌,被视为提高牙周病疗效的方法[12],本课题组前期研究证实,Nd:YAG激光能在适宜能量强度范围上调PDLSCs的增殖和成骨分化功能[13]。但LLLT对衰老PDLSCs的功能是否具有调节作用尚未可知。
因此本研究通过观察不同照射强度LLLT对衰老PDLSCs增殖和成骨分化功能的影响,旨在寻找增强衰老PDLSCs功能的最佳LLLT照射强度,以期提高衰老PDLSCs牙周缺损修复能力。
1 材料与方法
1.1 主要试剂
α-MEM培养基、胎牛血清、青链霉素(Gibco,美国),0.25%胰蛋白酶、Ⅰ型胶原酶(Sigma,美国),中性蛋白酶(Roche Diagnostics Gmbh,德国),Vario免疫磁珠分选器(MASC,德国),Stro-1抗体(Rnd,美国),激光治疗仪(Fidelis Plus Ⅲ, Fotona,德国),成骨诱导液(Cyagen,美国),甲苯胺蓝染色液(北京索莱宝科技有限公司),碱性磷酸酶(ALP)测试盒(南京建成生物工程研究所),茜素红染液(陕西中晖赫彩生物医药科技有限公司),钙比色试剂盒(BioVision,美国),Pierce蛋白质分析试剂盒(Thermo,美国),Trizol试剂盒(Invitrogen,美国),SYBR Green PCR试剂盒、逆转录试剂盒(TaKaRa,日本),抗人矮小相关转录因子2(runt-related transcription factor 2, Runx2)、ALP、骨钙素(osteocalcin, OCN)、β-肌动蛋白(β-actin)抗体(Abcam,美国),ELISA测试盒(R&D Systems,美国)。
1.2 牙周膜干细胞(PDLSCs)的分离和培养
选取西安交通大学口腔医院外科门诊因阻生齿或正畸需要拔除的第3磨牙或正畸牙,要求牙齿完整,无龋病和慢性牙周疾病,本研究经西安交通大学医学部生物医学伦理委员会批准(No.2020398),所有患者知情同意。按患者年龄将细胞分为yPDLSCs组(年轻组,15~25岁,男3例,女3例,共10颗牙)和aPDLSCs组(老年组,40~55岁,男3例,女3例,共8颗牙)。在超净台内用PBS反复冲洗牙齿直至牙根无污物,刮除牙根部的牙周膜组织,用3 mg/ml Ⅰ型胶原酶和4 mg/ml中性蛋白酶消化刮除的组织1 h,离心后弃上清,加入含20% FBS、1%青链霉素的α-MEM培养基中,在37 ℃、5% CO2环境下培养,3 d换液1次,待细胞生长至80%融合率时用胰蛋白酶消化,按照1 ∶2或1 ∶3比例传代培养,记为第1代细胞。选取第2代细胞与stro-1抗体在4 ℃环境下反应30 min,PBS漂洗后在4 ℃环境下二抗孵育30 min,PBS漂洗。将激光二级管放在Vario免疫磁珠分选器中,4 ℃条件下分离stro-1阳性细胞,即PDLSCs。
1.3 低能量激光疗法(LLLT)
待上述2组PDLSCs长至80%左右融合率时将细胞分为5组,yPDLSCs组(年轻组,不予以激光照射)、aPDLSCs对照组(老年对照组,不予以激光照射)、aPDLSCs 4 J/cm2组(4 J/cm2LLLT处理aPDLSCs细胞)、aPDLSCs 8 J/cm2组(8 J/cm2LLLT处理aPDLSCs细胞)和aPDLSCs 16 J/cm2组(16 J/cm2LLLT处理aPDLSCs细胞)。使用垂直于表面的单探针激光机头扫描细胞,接收激光(Nd:YAG,1 064 nm)照射,照射角度为90°,输出功率为0.25 W,将照射能量强度调整为约0~16 J/cm2,隔天照射1次,每次照射20 s,共照射3次。5组细胞均用于后续研究,包括克隆形成率的测定,检测细胞增殖能力;茜素红染色、ALP活性和RT-PCR,检测细胞成骨分化能力;ELISA检测细胞因子表达水平。
1.4 PDLSCs克隆形成率的测定
将处于对数生长期PDLSCs以1×103的密度接种于90 mm培养皿,用含10% FBS、1%青链霉素的α-MEM培养基培养14 d。去除原培养基,PBS漂洗后用4%多聚甲醛固定30 min,再次漂洗后用甲苯胺蓝染色液染色15 min,弃染色液,漂洗后镜下计数大于50个细胞的克隆数,计算克隆形成率(colony forming unit-fibroblastic,CFU-F)。
1.5 茜素红染色和ALP活性共同检测PDLSCs成骨分化能力
茜素红染色:将处于对数生长期PDLSCs以5×104/孔的密度接种于12孔板,待细胞生长至70%融合率时,换用成骨诱导培养基进行培养,3 d换液1次。成骨诱导21 d去原培养基,PBS漂洗后4%多聚甲醛固定30 min,PBS漂洗3次后用茜素红染液染色,漂洗后镜下观察,成骨结节红染。观察后进行茜素红染色定量,用钙比色试剂盒进行,根据已知钙浓度的稀释创建标准曲线,通过与标准曲线的比较计算钙的含量。使用Pierce蛋白质分析试剂盒通过双金鸡纳酸(BCA)法测定同一样品中的总蛋白质含量,钙活性被标准化为总蛋白质含量,以每毫克总蛋白质的钙含量的微摩尔数(μmol/mg蛋白)表示。茜素红染色定量越高,说明形成的成骨结节量越多。
ALP活性:将处于对数生长期PDLSCs以5×104/孔的密度将细胞接种到12孔板,待细胞生长至70%融合率时,弃去原培养基,用成骨诱导培养基进行培养,3 d换液1次,成骨诱导7 d根据ALP测试盒说明书进行ALP活性测定。弃去原培养基,PBS漂洗后4%多聚甲醛固定30 min,PBS漂洗3次,在碱性溶液中培养20 min。使用Pierce蛋白质分析试剂盒通过双金鸡纳酸(BCA)法测定同一样品中的总蛋白质含量,ALP活性被标准化为总蛋白质含量,用每分钟每毫克总蛋白质产生的对硝基苯酚纳摩尔数[nmol/(min·mg蛋白质)]表示。
1.6 RT-PCR检测Runx2、ALP、OCN的表达水平
用Trizol试剂盒提取PDLSCs的总RNA,对提取得到的RNA进行浓度检测,根据浓度确定逆转录所需的RNA样本量,用逆转录试剂盒将RNA反转录合成cDNA。以cDNA为模板链,采用PCR试剂盒进行扩增。反应程序如下:95 ℃ 30 s变性,95 ℃ 5 s,60 ℃ 30 s退火和延伸,共40个循环。Runx2、ALP、OCN、β-actin引物序列见表1。

表1 引物序列Table 1 Primer sequences for RT-PCR
1.7 ELISA检测细胞因子TNF-α表达水平
使用人TNF-α ELISA试剂盒测定PDLSCs中TNF-α的分泌,严格按照说明书进行操作。在铝箔袋中取出微孔板,每个孔中添加已配制好的标准品或样品,室温孵育2 h洗涤液洗4次,向每个孔中加入含过氧化氢酶(HRP)标记的检测抗体,室温培养2 h洗涤,加入显色剂室温避光培养30 min,加入终止液,在450 nm处测定各孔OD值,绘制标准曲线,计算结果,结果以pg/106细胞表示。
1.8 统计学分析

2 结果
2.1 4 J/cm2和8 J/cm2 LLLT可提高衰老PDLSCs的增殖能力
克隆形成实验结果显示:与aPDLSCs对照组比较,4 J/cm2组和8 J/cm2组aPDLSCs的克隆形成率明显升高(P<0.05),16 J/cm2组细胞的克隆形成率的变化不具有统计学意义。与yPDLSCs组相比,aPDLSCs对照组克隆形成率明显下降(P<0.01,见图1)。

与aPDLSCs对照组比较,*P<0.05,**P<0.01;与yPDLSCs组比较,##P<0.01图1 不同照射强度对PDLSCs克隆形成率的影响Figure 1 The influence of different irradiation intensities on CFU-F of PDLSCs
2.2 8 J/cm2 LLLT可增强衰老PDLSCs的成骨分化能力
茜素红染色结果显示:与aPDLSCs对照组比较,4 J/cm2组和8 J/cm2组aPDLSCs的成骨结节形成明显增多(P<0.05),16 J/cm2组aPDLSCs的成骨结节形成减少(P<0.05);与yPDLSCs组相比,aPDLSCs对照组的成骨结节形成量减少(P<0.01,见图2)。ALP活性结果显示:与aPDLSCs对照组比较,8 J/cm2组aPDLSCs中ALP活性升高(P<0.01),16 J/cm2组aPDLSCs中ALP活性降低(P<0.01);与yPDLSCs组相比,aPDLSCs对照组ALP活性降低(P<0.01,见图2)。RT-PCR结果显示:与aPDLSCs对照组比较,8 J/cm2组aPDLSCs的成骨相关基因Runx2、ALP、OCN表达水平明显升高(P<0.01),16 J/cm2组aPDLSCs的Runx2、ALP、OCN表达水平变化无统计学意义;与yPDLSCs组相比,aPDLSCs对照组成骨相关基因表达水平降低(P<0.01,见图2)。
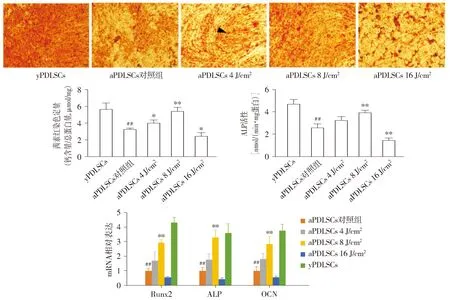
箭头表示红染的成骨结节;与aPDLSCs对照组比较,*P<0.05,**P<0.01;与yPDLSCs组比较,##P<0.01图2 不同照射强度组PDLSCs成骨分化能力Figure 2 The osteogenic differentiation ability of PDLSCs in different irradiation intensity groups
2.3 4 J/cm2和8 J/cm2LLLT可减少衰老PDLSCs TNF-α的分泌
ELISA结果显示:与aPDLSCs对照组比较,4 J/cm2和8 J/cm2组aPDLSCs中TNF-α的分泌明显减少(P<0.05),16 J/cm2组aPDLSCs中TNF-α的分泌变化无统计学意义;与yPDLSCs组相比,aPDLSCs对照组的TNF-α的分泌量明显升高(P<0.01,见图3)。

与aPDLSCs对照组细胞比较,*P<0.05,**P<0.01;与yPDLSCs组细胞比较,##P<0.01图3 不同照射强度组PDLSCs细胞因子分泌水平Figure 3 Cytokine secretion level of PDLSCs in different irradiation intensity groups
3 讨论
牙周病中骨组织和软组织的丢失是逐渐增加的,并且在很大程度上不可逆,所以缺失牙周组织的再生是利用组织工程技术治疗牙周缺损的目标[14]。干细胞是组织工程的重要组成部分,然而微环境的变化会影响干细胞对牙周再生的作用。
已有相关研究显示衰老对干细胞功能的影响。Zhang等[15]探究年龄对PDLSCs再生潜能的影响,发现衰老供体来源PDLSCs干细胞表面标记物Stro-1表达明显减少,增殖能力、迁移能力以及成骨分化能力下降。Wu等[16]研究发现,衰老来源PDLSCs细胞外基质蛋白,包括胶原蛋白Ⅰ型、纤黏蛋白、整合蛋白β1等分泌显著减少,制备的细胞膜片基质不足,成骨能力和裸鼠体内类骨质形成能力均明显下降。本研究结果显示,相对于yPDLSCs,aPDLSCs的克隆形成率降低,成骨结节减少,ALP活性和成骨相关基因水平降低,说明衰老会抑制PDLSCs的增殖能力和成骨分化能力,与上述研究结论一致。
LLLT可以调节干细胞的成骨分化功能。Yamauchi等[17]研究发现,650 nm高功率红色发光二极管照射可激活细胞外信号调节激酶1和2,从而促进PDLSCs的增殖、成骨分化和矿化。Santinoni等[18]研究证实,LLLT可刺激间充质干细胞的增殖和分化,导致骨再生增强。本课题组[13]前期研究显示LLLT在2~6 J/cm2时可促进PDLSCs的增殖和成骨分化,在8 J/cm2时,LLLT可显著抑制PDLSCs的成骨分化。本研究探讨了LLLT与衰老PDLSCs增殖和成骨分化的关系。克隆形成实验结果显示,4 J/cm2和8 J/cm2可显著增强衰老PDLSCs的增殖。茜素红染色、ALP活性、RT-PCR结果显示,8 J/cm2可显著增强衰老PDLSCs的成骨分化。前期研究对象为健康的PDLSCs,本次为衰老的PDLSCs,两者的结果差异说明,不同微环境会影响LLLT对PDLSCs作用效果。
LLLT只有在适宜剂量应用才有治疗效果,具有双相剂量反应,即相同波长条件下低剂量的LLLT往往比高剂量的更有效,对组织的刺激和修复有更好的效果[19]。在本次研究中,4 J/cm2和8 J/cm2LLLT作用PDLSCs克隆形成率升高,成骨结节增加,ALP活性和成骨相关基因水平升高,然而16 J/cm2LLLT对细胞的作用显示为相反的结果,说明LLLT对PDLSCs的作用也存在双相剂量反应。
Avci等[20]研究发现,LLLT可以通过降低炎症细胞因子的表达来抑制炎症反应。本课题组[13]前期研究显示,2~8 J/cm2LLLT刺激PDLSCs中TNF-α和IL-β1的分泌。在本研究中,ELISA结果显示,4 J/cm2和8 J/cm2的激光会使PDLSCs中炎症细胞因子TNF-α水平下降。不同的实验结果可能与细胞处于不同的微环境有关,在前期研究中,PDLSC是健康的,TNF-α和IL-β1的表达较少,而在以往研究和本次研究中,组织或细胞处于炎症或衰老状态,炎症细胞因子的表达率偏高。
综上所述,衰老会降低PDLSCs的增殖和成骨分化水平,适宜强度的LLLT可以增强衰老PDLSCs的增殖能力和成骨分化潜能,这可以为应用衰老PDLSCs修复牙周组织缺损提供参考。
